Introdução: A cicatrização é um processo de restauração da integridade física das estruturas do corpo. É um processo dinâmico, complexo, multicelular que envolve matriz extracelular, citosinas, células sanguíneas e fatores de crescimento. Os fatores de crescimento são proteínas que estimulam e ativam a proliferação celular mediante a ativação da angiogênese, mitogênese, transcrição genética, acelerando o processo de cicatrização.
Objetivo: Avaliar a influência dos fatores de crescimento no processo cicatricial de feridas realizadas no dorso de ratas em comparação com a ferida, controle através da macro e microscopia.
Método: Foram utilizadas 45 ratas Wistar, submetidas à criação de três feridas no dorso. A primeira controle a segunda com injeção de fator de crescimento epitelial e a terceira com fator misto. As avaliações macroscópicas e microscópicas foram realizadas no 3º, no 7º e no 15º dia do experimento. Para análise microscópica, utilizou-se coloração de Hematoxilina-Eosina para ava-liar o processo inflamatório; vimentina, para a avaliação dos vasos e fibroblastos, e Sirius Red, para avaliar o colágeno.
Resultados: Na avaliação macroscópica, o uso de fatores de crescimento proporcionou cicatrização mais rápida e diminuição do tecido de granulação no 7º e 15º dia (80,31% de redução na ferida controle vs. 83,24% na ferida epitelial vs. 100% na ferida mista). Na microscopia, nos três momentos do experimento, não foram encontradas diferenças significativas entre as três feridas; entretanto, quando comparados os dias de morte em relação a cada tipo de ferida, observou-se resultado favorável para as feridas epiteliais e mistas (entre 3º × 15º dia apresentou p < 0,001 e na comparação entre 7º × 15º dias; p = 0,002 e p = 0,001 para as feridas epiteliais e mistas) com maior número de fibroblasto, angiogênese e colágeno tipo 1.
Conclusão: A utilização de fatores de crescimento acelera a cicatrização, estimula maior ativi-dade angiogênica, acelera a fibroplasia e maturação do colágeno.
Introduction: Healing is a process that restores the physical integrity of body structures. It is a dynamic, complex, multicellular process that involves the extracellular matrix, cytokines, blood cells, and growth factors. Growth factors are proteins that activate and stimulate cell proliferation through the activation of angiogenesis, mitogenesis, and gene transcription, accelerating the healing process.
Objective: To assess the influence of growth factors on the healing process of wounds made on the backs of female rats compared to the control wound, through macro and microscopy.
Methods: This study used 45 female Wistar rats, in which three wounds were made on the back. The first was the control wound, the second received epithelial growth factor injection, and the third received a combination of factors. Macroscopic and microscopic assessments were performed on the third, seventh, and 15th days of the experiment. For microscopic analy-sis, hematoxylin-eosin staining was utilized to assess the inflammatory process; vimentin, for assessment of blood vessels and fibroblasts, and Sirius Red for collagen assessment.
Results: In the macroscopic assessment, the use of growth factors resulted in faster healing and decrease of granulation tissue on days seven and 15 (80.31% reduction in the control wound vs. 83.24% in the epithelial wound vs. 100% in the mixed wound). Utilizing microscopy, at the three stages of the experiment, there were no significant differences between the three wounds; however, when comparing the day of euthanization for each type of wound, there was a favorable outcome for epithelial and mixed wounds (between the third vs. 15th day, p < 0.001, and in the comparison of the seventh vs. 15th day; p = 0.002 and p = 0.001 for epithelial and mixed wounds, respectively) with a higher number of fibroblasts, angiogenesis, and collagen type I.
Conclusion: The use of growth factors accelerates healing, stimulates greater angiogenic activity, and accelerates fibroplasia and collagen maturation.
Introdução
Cicatrização é um processo de restauração da integridade física interna e (ou) externa das estruturas do corpo, e compreende complexas interações entre as células e vários outros fatores. É um processo dinâmico e complexo, composto de três fases: inflamação, proliferação e remodelação dos tecidos.1 O processo de cicatrização abrange a matriz extra-celular, as citocinas, as células sanguíneas e os fatores de crescimento. Os fatores de crescimento são proteínas que estimulam e ativam a proliferação celular mediante a ativação da angiogênese, mielogênese e transcrição genética, entre outras reações que ativam e aceleram o processo de cicatrização.1,2
Dentre os fatores de crescimento, os mais importantes para cicatrização são: fator de crescimento epitelial (FCE), fator de crescimento derivado de plaquetas (FCDP), fator de crescimento transformador (FCT-b), fator de crescimento vascular endotelial (FCVE), fator de crescimento de fibroblastos (FCF), fator de crescimento insulínico (FCI), e este estimula a proliferação celular, a remodelação tecidual e o aumento de colágeno e elastina. FCVE age na angiogênese e na granulação dos tecidos num estádio inicial da cicatrização. FCDP é crucial para inflamação, granulação, reepitelização e remodelação nas três fases da cicatrização das feridas.3,4
Devido à complexidade patológica e fisiológica do processo de cicatrização, a perfeita regeneração dos tecidos é difícil de ser alcançada.4,5 Portanto, é necessária a avaliação de novos tratamentos, bem como o uso de novas estratégias. O uso de fatores de crescimento e suas combinações têm sido sugeridos como tratamento promissor, pois promove a aceleração do processo de cicatrização. Apesar disso, um dos maiores obstáculos é que os fatores de crescimento são degradados por proteinases ou removidos por exsudatos antes de atingir o leito da ferida.5
Uma grande quantidade de fatores de crescimento e citocinas estão presentes no sítio da ferida. Suas expressões dinâmicas mostram características temporais e espaciais na regulação e mudança no padrão de expressão dos fatores de crescimento que estão associados com cicatrização de feridas debilitadas. Importantes alterações nos níveis de um fator acabam afetando a produção de outros fatores de crescimento e citocinas. Assim, tem sido evidenciado que citocinas proinflamatórias e fatores de crescimento do soro são liberados durante a fase inicial da cicatrização das feridas, sendo potentes estimuladores da expressão de outros fatores de crescimento. Um exemplo é a regulação de FCF7, um fator de crescimento produzido por fibroblastos no sítio da injúria. Outro exemplo é a regulação de FCVE, maior regulador da angiogênese, que é produzido por queratinócitos e macrófagos no sítio da ferida. Foi verificado que citocinas pró-inflamatórias podem induzir a expressão de FCVE em ambos os tipos de células. Tais exemplos realçam as complexas interações que ocorrem durante a cicatrização das feridas. Essas interações devem ser consideradas na inter-pretação de resultados obtidos pela superexpressão ou eliminação de um único fator de crescimento no sítio da ferida.6
Um estudo realizado para comparar a efetividade do plasma rico em plaquetas (PRP) na cicatrização de coelhos comparou dois grupos: um com aplicação de condrócitos + PRP, e o outro apenas com PRP. Esses componentes foram injetados no subcutâneo da região dorsal dos coelhos; como controle, foi injetado apenas o PRP em quatro coelhos. Após dois meses, foram submetidos a ressonância magnética, análise histológica e quantificação de glicosaminoglicanos. A ressonância mostrou formação de nova cartilagem, o que indica que o PRP regenera a cartilagem e mostra o potencial do uso deste método para a reconstrução dos defeitos da cartilagem.5,7
Shi8 demonstrou que a ativação de fator de crescimento conjuntivo e a formação de cicatriz em feridas corneais de coelhos marcadamente melhoram a arquitetura do estroma corneal e reduzem a formação de cicatriz. Entretanto, os autores concluíram que não há um impacto mensurável in vivo da cicatriz de ferida corneal, e deve ser considerado como alvo específico da terapia de drogas para cicatriz de córnea.
Feng et al.9 realizaram estudo em ratos diabéticos; para tanto, foram criadas feridas no dorso e injetados fatores de crescimento de queratinócitos para avaliar a cicatrização. Foram feitas duas feridas de 2 cm de diâmetro, uma de cada lado da coluna vertebral, sendo que, em um lado, foi injetado fator de crescimento, e no outro, solução salina. O tempo de estudo foi de quatro semanas, e foram feitas fotografias diárias por um período de 28 dias. Os resultados mostraram proliferação de células e um significante estímulo à cicatrização nas feridas com fator de crescimento.
Neste estudo, foram utilizados os fatores de crescimento FCE, FCVE associado a FCI e FCF, denominados fator misto (FM), para quantificar o colágeno, a elastina, os vasos e a proliferação celular na cicatrização cutânea de ratas, e a efetividade dos fatores de crescimento no processo de cictrização em relação à ferida controle, onde não foram injetados fatores de crescimento ou solução salina para mimetizar a cicatrização natural.
O objetivo deste trabalho foi avaliar a influência dos fatores de crescimento no processo cicatricial, mediante a evolução macroscópica e a microscopia do processo de cicatrização de feridas realizadas no dorso de ratas, com infiltração de FCE e FCVE combinados com FM, em comparação com a ferida controle, sem infiltração de fatores de crescimento.
Método
O manejo dos animais foi efetuado conforme o Colégio Brasileiro de Experimentação Animal (COBEA) e as exigências estabelecidas em Guide for the Care and Use of Experimental Animals (Canadian Council on Animal Care). O estudo foi aprovado pela Comissão de Ética no Uso de Animais (CEUA), portaria 787/03-BL, de 11 de junho de 2003, sob processo 23075.013736/2012-11. O estudo foi realizado no período de julho de 2012 a julho de 2015.
Foram utilizadas 45 ratas (Rattus norvegicus albinus, Rodentia mammalia) da linhagem Wistar, com idades entre 115 e 130 dias, peso de 200 a 253 gramas. Após a pesagem, os animais foram divididos aleatoriamente em três grupos de 15 animais. Em cada grupo, avaliou-se a cicatrização em diferentes fases. No Grupo 1, a avaliação se deu no terceiro dia; no Grupo 2, no sétimo dia, e no Grupo 3, no 15º dia.
Foram criadas três feridas: uma de 1 cm de diâmetro e outras duas de 0,6 cm. As feridas foram produzidas em tamanhos distintos, com vistas a medir a tensão delas. Devido a não disponibilidade de um tensiomêtro, não foi realizada a tensão das feridas e prosseguiu-se o trabalho avaliando a macroscopia e a microscopia. Em cada animal, a excisão se estendeu da pele até o plano muscular.
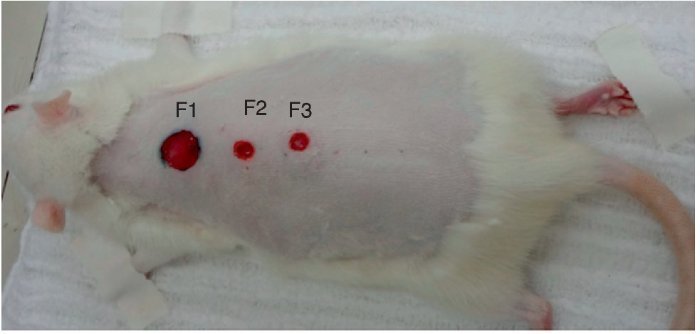
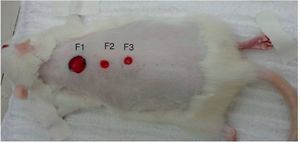
Foram denominadas Feridas 1-3 (F1, F2, F3): a F1 controle (proximal); F2 (central ou medial), sendo injetado fator de crescimento epitelial (FCE); e na F3 (distal) fator de crescimento vascular (FCVE) associado a fator de crescimento de fibroblasto (FCF) e fator de crescimento insulínico (denominado fator misto – FM).
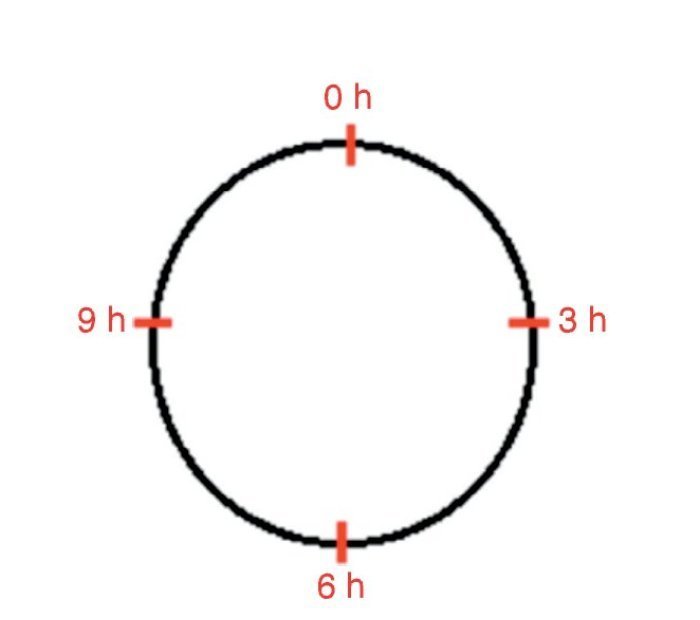
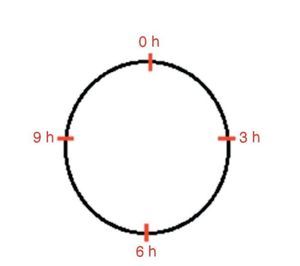
Os fatores de crescimento foram injetados somente no dia da confecção das feridas. A infiltração foi feita com 0,5 mL por ferida, em quatro pontos: 0, 3, 6 e 9 horas na derme e tecido celular subcutâneo (figs. 1 e 2). As feridas cicatrizaram espontaneamente.
Figura 1. Desenho esquemático mostrando o local de infiltração de fatores de crescimento nas feridas epitelial e mista nos quatro quandrantes 0, 3, 6 e 9 horas.
Figura 2. Denominação das feridas: ferida 1 – controle (1,0 cm de diâmetro); ferida 2 – epitelial (0,6 cm de diâmetro) e ferida 3 – mista (0,6 cm de diâmetro).
As feridas foram consideradas circulares, e foi realizada a medida do diâmetro por meio de fotos, com uma régua comum milimetrada. Os resultados foram colocados em um gráfico com as porcentagens das respectivas medidas avaliadas.
Após a morte dos animais, no terceiro, sétimo e 15º dias de experimento, foram removidos os retalhos cutâneo-aponeuróticos contendo as lesões. Na sequência, o material foi amostrado e submetido a processamento histológico auto-matizado e emblocamento em parafina. Lâminas histológicas contendo as secções foram coradas pelas técnicas da hematoxilina, eosina e Sirius Red. Secções adicionais foram confeccionadas para técnica da imuno-histoquímica, utilizando-se o anticorpo antivimentina.
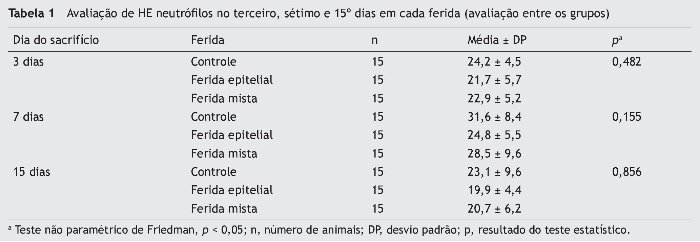
Com os cortes corados em hematoxilina e eosina, foram avaliadas a quantidade de neutrófilos polimorfonucleares, as células inflamatórias crônicas (linfócitos e plasmócitos), os capilares neoformados, os fibroblastos em proliferação e a quantidade de fibras depositadas. A regeneração epitelial foi considerada como parcial ou completa.
Cortes corados em Sirius Red foram utilizados para avaliar a presença e o tipo de colágeno (maduro ou imaturo), por meio de microscopia de luz polarizada, quantificando-se em porcentagem ambos os tipos de colágeno (colágeno jovem = verde; colágeno maduro = vermelho).
Cortes histológicos, submetidos ao estudo imuno-histoquímico e marcados com anticorpo antivimentina, foram utilizados para identificar os fibroblastos e os capilares neoformados.
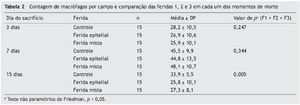
Após avaliação dos aspectos macroscópicos e microscópicos das F1, F2 e F3, foi comparada a coloração HE em relação a todas as variáveis do estudo (neutrófilos, linfócitos, macrófagos, fibroblastos e vasos), e feita a análise separada para cada momento de avaliação (3, 7 e 15 dias), sendo submetidos à análise estatística considerando o teste não paramétrico de Friedman. Os momentos de morte foram comparados usando-se o teste não paramétrico de Kruskal-Wallis. Valores de p < 0,05 indicaram significância estatística. Os dados foram analisados com o programa computacional Statistica v. 8.0.
Resultados
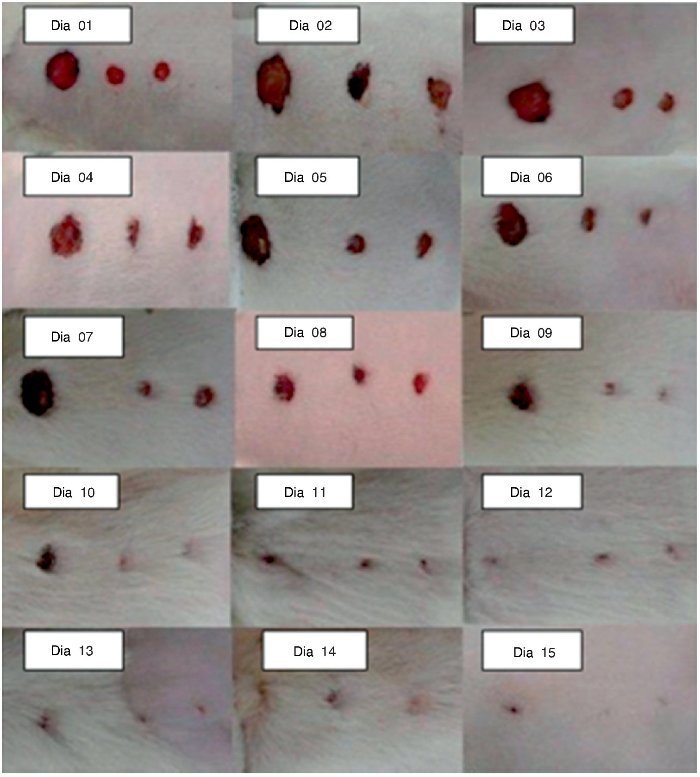
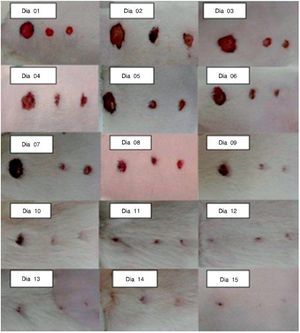
A avaliação macroscópica das feridas foi realizada diariamente, sendo registrada em fotografias. Foram medidas as F1, F2, F3 de todas as ratas, por meio de uma régua graduada em milímetros, posicionada ao nível da lesão e, após, foi feita a média entre todas as feridas, em cada dia do experimento (fig. 3).
Figura 3. Fotografia das feridas do primeiro ao 15º dia do experimento, em diferentes animais.
No terceiro dia, todas as feridas estavam abertas. Na F1 havia pouca contração de ferida e muito tecido de granulação; na F2 e F3 havia uma discreta melhora em relação à F1.
No sétimo dia, as feridas ainda estavam abertas, com ligeira contração de todas as feridas, mas F1 apresentava tecido de granulação, mostrando retardo na cicatrização.
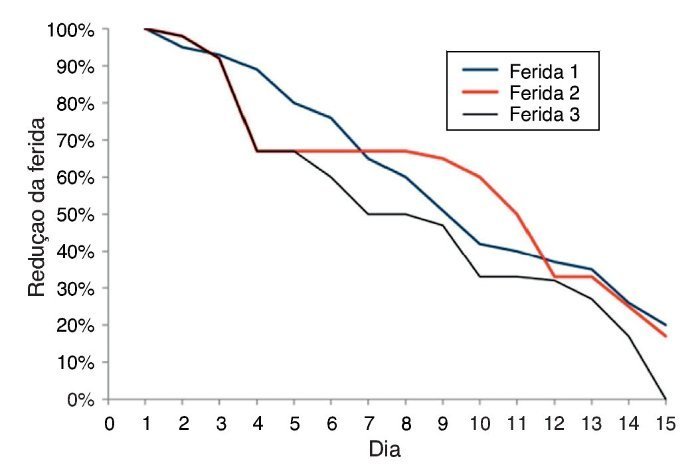
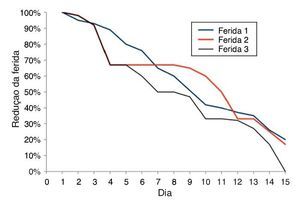
No 15º dia do experimento, as cicatrizes das feridas apresentaram-se da seguinte forma: na F1 houve redução de 80% ± 0,311% da ferida; na F2 a redução foi de 83% ± 0,201%; e na F3 foi de 100% (fig. 4).
Figura 4. Gráfico comparativo da cicatrização das feridas 1, 2 e 3 por meio da medida das feridas 1, 2 e 3, em porcentagem, nos 15 dias do experimento.
Ao comparar os três tipos de ferida em cada dia de morte, não foram encontradas diferenças significativas em relação ao número de neutrófilos (tabela 1). Entretanto, ao avaliar a evolução de cada ferida nos três dias de morte, foi encontrada diferença significativa para a F1, que apresentou maior número de neutrófilos. Para esta ferida, houve diferença entre o terceiro e o sétimo dias (p = 0,029), e entre o sétimo e o 15º dias (p = 0,007). Já entre o terceiro e o 15º dias não foi observada diferença significativa (p = 0,557). Para F2 e F3, os resultados foram menores, apresentando tendência à significância entre os três dias de avaliação (p = 0,058 e p = 0,076, respectivamente).
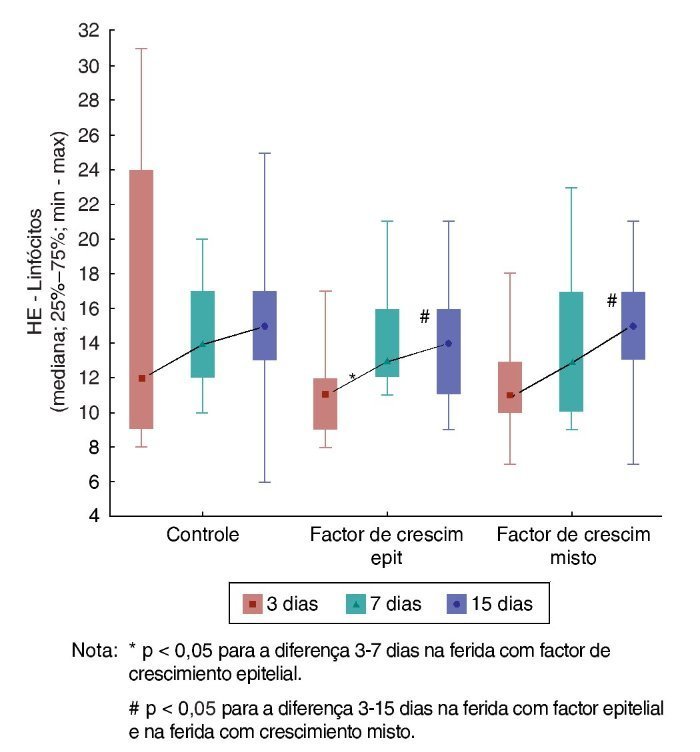
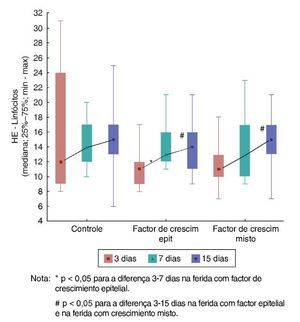
Com relação aos linfócitos, na comparação da F1, F2 e F3 em cada um dos momentos de morte, observou-se que não existe diferença significativa entre elas (p = 0,270). Para o sétimo dia, também não foi verificada diferença significativa entre as três feridas (p = 0,759). O mesmo foi obtido para o 15º dia (p = 0,451).
Na F1, os resultados foram similares em relação aos linfócitos, nos três dias de comparação (p = 0,774). Já para a F2, foi observado aumento do número de linfócitos entre o terceiro e o sétimo dias (p = 0,007), e entre o terceiro e o 15º dias (p = 0,007). Nas comparações entre os dias de avaliação para a F3, foi encontrado aumento do número de linfócitos somente na comparação entre o terceiro e o 15º dias (fig. 5).
Figura 5. Evolução de HE – linfócitos em cada ferida – avaliação.
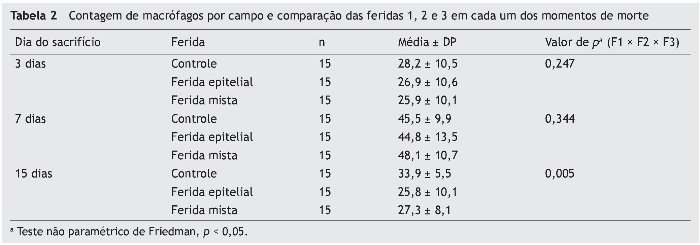
Em relação aos macrófagos, tanto para o terceiro como para o sétimo dias, os resultados foram semelhantes entre as três feridas (p = 0,247 e p = 0,344, respectivamente). Já no 15º dia, o resultado apresentou diferença significativa entre as três feridas, apresentando menor número de macrófagos na F2 e F3 (p = 0,005). Ainda para o 15º dia, ao comparar as feridas duas a duas, foi observada diferença entre a F1 e a F2 (p = 0,001), com menor número de macrófagos para a F2; e entre as F1 e F3, observou-se menor número de macrófagos para a F3 (p = 0,004). As F2 e F3 não apresentaram diferença significativa (p = 0,660) (tabela 2).
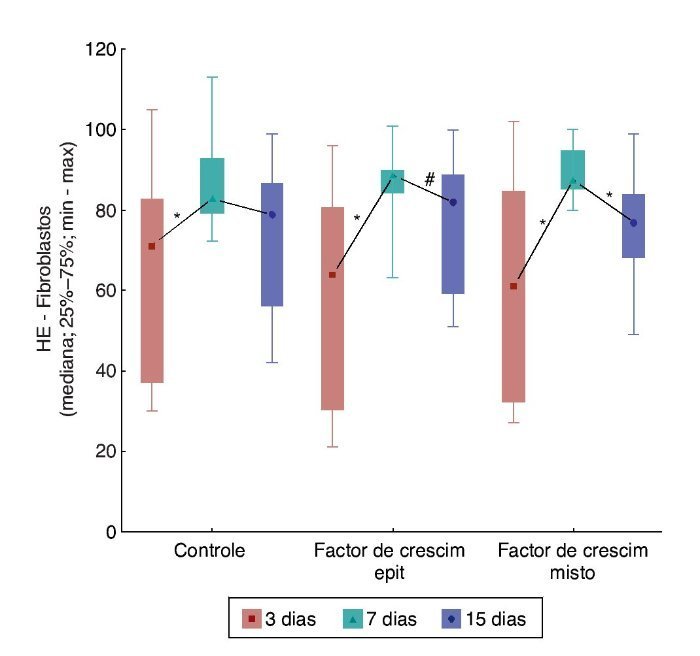
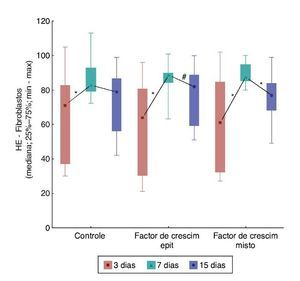
Ao comparar os dias de sacrifício em relação aos fibroblastos, foram obtidas diferenças significativas entre eles, com maior número de fibroblastos para a F2 e F3 (p = 0,018 para a F1; p = 0,003 para a F2 e p < 0,001 para a F3). Ao comparar os dias de morte dois a dois, observaram-se diferenças entre o terceiro e o sétimo dias (p = 0,004 para F1 e p < 0,001 para F2 e F3, que apresentaram maior número de fibroblastos no sétimo dia). Na comparação entre o terceiro e o 15º dias, foi registrada diferença significativa somente para F2 (p = 0,044), e na comparação entre o sétimo e o 15º dias, somente para F3 (p = 0,003) (fig. 6).
Figura 6. Evolução de HE – fibroblastos em cada ferida, entre os momentos de morte – avaliação entre grupos.
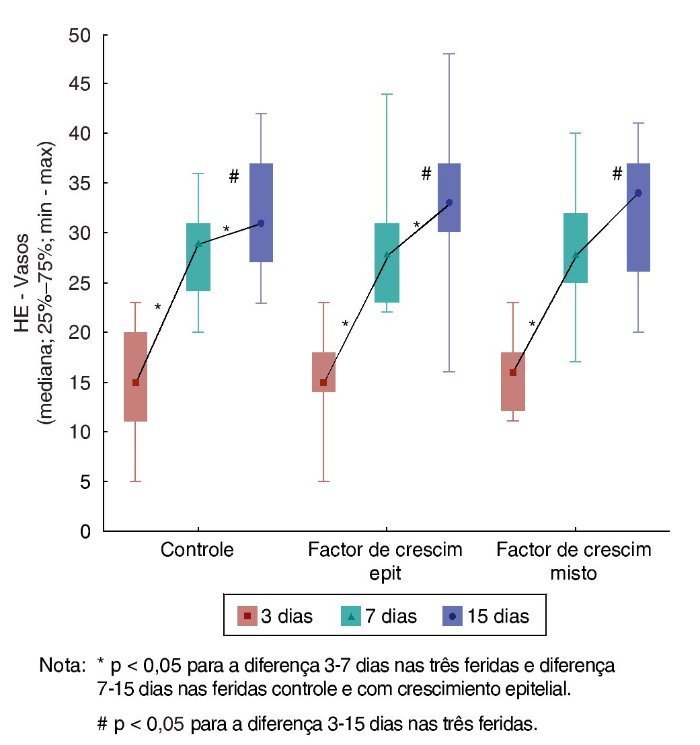
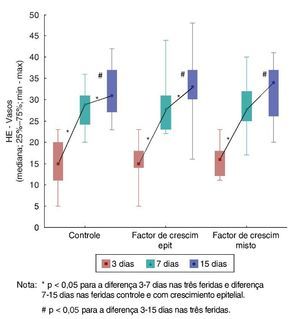
Ao avaliar a evolução de cada ferida nos três dias de morte, foram encontradas diferenças significativas quanto ao aumento do número de vasos (p < 0,001). Na comparação dos dias de morte dois a dois, houve diferença significativa entre o terceiro e o sétimo dias (p < 0,001), e houve também diferenças significativas entre o terceiro e o 15º dias (p < 0,001). Já entre o sétimo e o 15º dias, houve diferença significativa somente para F1 e F2 (p = 0,044 e p = 0,035, respectivamente) (fig. 7).
Figura 7. Evolução de HE – vasos em cada ferida, avaliação entre os momentos de morte – avaliação intragrupo.
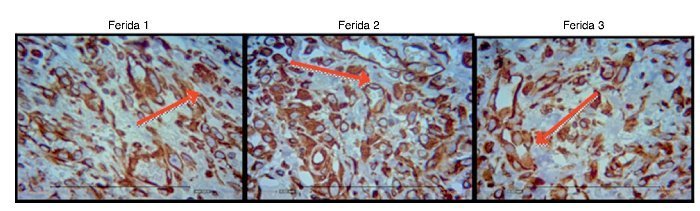
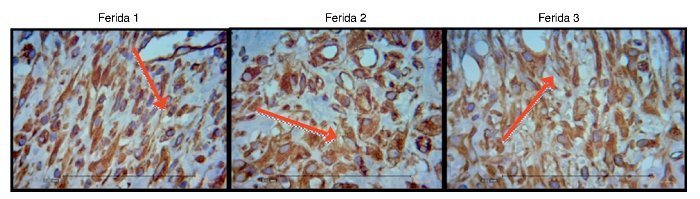
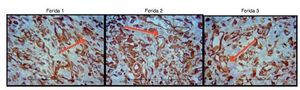
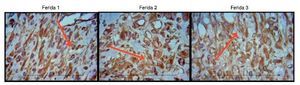
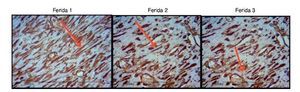
As figuras 8, 9 e 10 mostram detalhes histológicos da avaliação imuno-histoquímica das cicatrizes, nos três espaços de tempo avaliados.
Figura 8. Fotomicrografia vimentina – nas quais são avaliados macrófagos, fibroblatos e vasos no terceiro dia de evolução, nas feridas 1, 2 e 3 (VIM 200×).
Figura 9. Fotomicrografia vimentina – nas quais são avaliados macrófagos, fibroblastos e vasos no sétimo dia de evolução, nas feridas 1, 2 e 3 (VIM 200×).
Figura 10. Fotomicrografia vimentina – nas quais são avaliados macrófagos, fibroblastos e vasos no 15º dia de evolução, nas feridas 1, 2 e 3 (VIM 200×).
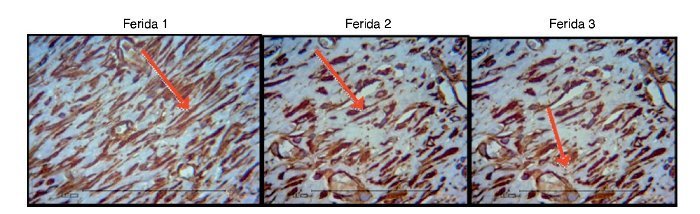
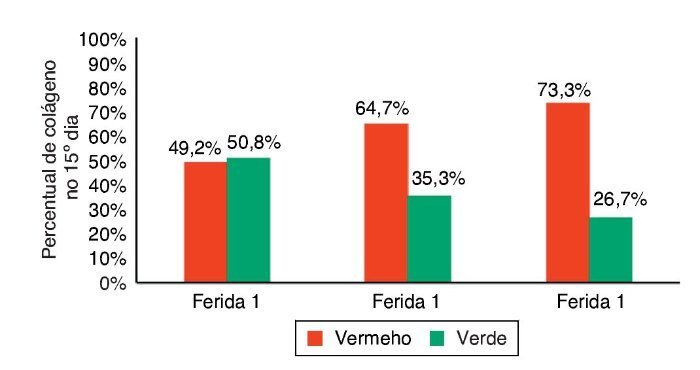
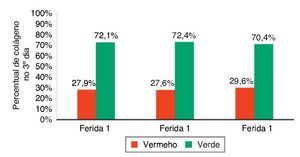
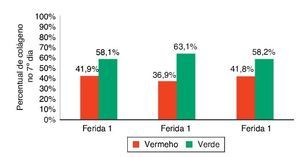
Ao avaliar o colágeno tipo I nos dias de morte, não houve significância estatística para a F1 (p = 0,240), enquanto para F2 e F3 houve maior número do colágeno tipo I (p ≤ 0,001), demonstrando diminuição da quantidade de infiltrado inflamatório, maior angiogênese e fibroplasia, com cicatrização mais rápida e organizada (figs. 11-13).
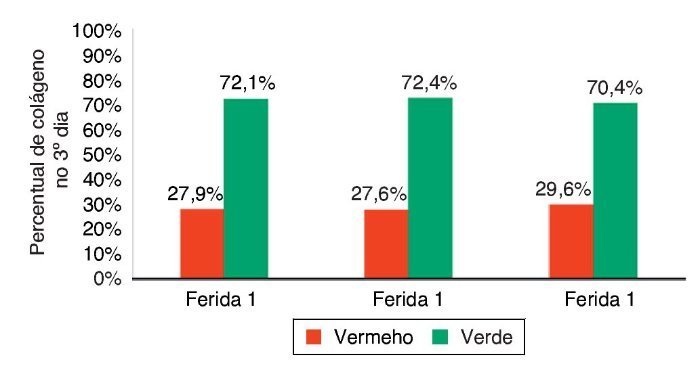
Figura 11. Demonstração da porcentagem de colágeno tipos I e II no terceiro dia do experimento, nas três feridas.
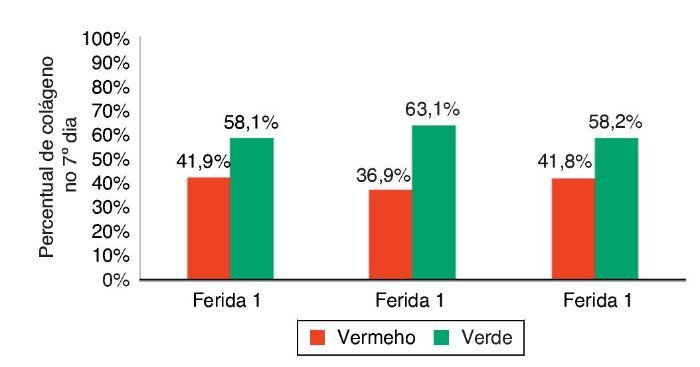
Figura 12. Demonstração da porcentagem de colágeno tipos I e II no sétimo dia do experimento, nas três feridas.
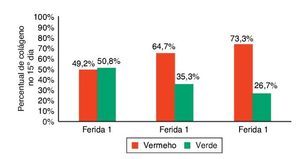
Figura 13. Demonstração da porcentagem de colágeno tipos I e II no 15° dia do experimento, nas três feridas.
Em relação ao colágeno tipo III, foram encontradas diferenças significativas na F2 e F3, com menor número de colágeno tipo III (p ≤ 0,001).
Discussão
As grandes mudanças ocorridas nas últimas décadas nos conceitos referentes à cicatrização têm mobilizado as indústrias a desenvolver e comercializar produtos cada vez mais específicos, que sejam eficazes e adequados a cada tipo de ferida, em termos de custo/benefício. Atualmente, pretende-se interferir na biologia molecular, abordando a síntese de substâncias envolvidas nos fenômenos cicatriciais.10 Diante de tantos recursos, no presente estudo, optou-se por estudar fatores de crescimento injetáveis na cicatrização de feridas, por interferirem positivamente na cicatrização.
A cicatrização das feridas é uma série complexa de reações e interações de mediadores inflamatórios e de crescimento celular.10-14 Muitos fatores intrínsecos e extrínsecos afetam a cicatrização das feridas, e existe grande variedade de opções comerciais que pretendem neutralizar inter-ferências negativas ou estimular o processo cicatricial.14 A inter-relação entre a nutrição e o processo de cicatrização da ferida age em conjunto com o sistema imune e a função imuno-moduladora.15 Neste trabalho, foi analisado o processo de cicatricização nos aspectos macroscópicos e microscópicos, e a influência de fatores de crescimento no processo cicatricial. No início do processo de cicatrização há migração de neutrófilos estimulados pelas plaquetas; após, os macrófagos contribuem para a angiogênese e para a fibroplasia, como ocorreu neste estudo, no qual as feridas com infiltração de FCE e FM apresentaram maior quantidade de neutrófilos, com p = 0,058 e p = 0,076. Para os macrófagos, foram encontradas diferenças significativas nas três feridas (p < 0,01); mas, comparando-se as feridas duas a duas, foi encontrada diferença significativa para as F2 e F3 (p < 0,001). Na avaliação de HE quanto aos vasos, houve diferença significativa entre as três feridas (p < 0,001). A imuno-histoquímica também demonstrou aumento de fibroblastos, macrófagos e vasos para as feridas F2 e F3 (p < 0,001). Para o colágeno tipo I, as F2 e F3 apresentaram maior deposição deste tipo de colágeno (p = 0,001 e p < 0,001), demonstrando resposta inflamatória maior e maior angiogênese, com cicatrização mais rápida. As porcentagens de colágeno tipo I no 15º dia do experimento foram: para F1 (49,2%), F2 (64,7%), e para a F3 (73,3%), demonstrando melhora da cicatrização das feridas onde houve infiltração de fatores de crecimento em relação à ferida controle.
Em relação aos fatores de crescimento derivado de plaquetas, Van Den Dolder et al. realizaram estudo em matriz óssea de ratos e fizeram a cultura in vitro, uma amostra de matriz óssea coberta com pele e PRP e outra apenas com matriz óssea com pele, e concluíram que o PRP estimula a matriz e a diferenciação óssea, onde foram encontradas correlações positivas entre cicatrização e fator de crescimento.16 No presente estudo, foi analisada a utilização de FCVE, FCE, FCF e FCI para acelerar a cicatrização de feridas, e foram obtidos resultados favoráveis quando comparado com a ferida controle, sem a presença de fatores de crescimento. A área das feridas foi analisada macroscopicamente e apresentou o seguinte resultado: a F1 apresentou uma área de 0,031 cm2 ao final do experimento, e em F2 e F3 a área foi, respectivamente, 0,008 e 0, demonstrando uma cicatrização mais efetiva.
A porcentagem de colágeno no presente estudo, observada através da microscopia com HE, foi maior nas feridas com fator de crescimento, além de uma menor resposta inflamatória que na ferida controle (p < 0,05 = 0,016). Na literatura, encontramos resultados semelhantes. Xie et al. usaram modelos de ratos e compararam a cicatrização em feridas tratadas com fator de crescimento tópico e ferida controle. As feridas foram acompanhadas diariamente, tendo sido medidas com caliper nos dias 1, 7, 14 e 28, quando foi realizada eutanásia e biópsia excisional. Procedeu-se à análise microscópica com HE e o colágeno foi medido por porcentagem.3 A metodologia foi semelhante à utilizada neste estudo, na confecção das feridas, nas medidas, na biópsia e na microscopia. Os resultados também foram semelhantes, por registrarem colágeno com porcentagem maior nas feridas com fator de crescimento.
Outro estudo criou feridas com 0,8 cm de diâmetro no dorso de ratos diabéticos, realizadas por punch, e aplicaram topicamente células progenitoras endoteliais, imediatamente após a cirurgia, e outra ferida foi usada como controle. Foram realizadas medidas nos dias 5, 10 e 14 após o tratamento.17 Como no presente estudo, as feridas também foram ressecadas, e foi realizada a análise histológica da vascularização, com resultado de p < 0,001, quando comparadas intragrupos entre o terceiro e o sétimo dias; e o terceiro e o 15º dias entre as três feridas; já entre o sétimo e o 15º dias houve diferença significativa para as F1 e F2; p = 0,044 e p = 0,035, respectivamente. O estudo de Asai et al. apontou que a aplicação tópica de fator de crescimento promoveu melhora da cicatrização, tal como o identificado no estudo ora apresentado.17
Em outro estudo, autores compararam por meio da expressão de fatores de crescimento um modelo de cicatrização de feridas em ratos Wistar, Grupo 1: saudável sem criação de ferida; Grupo 2: ferida excisional; Grupo 3: estimulador elétrico (TENS); Grupo 4: solução salina tópica; Grupo 5: iodo povidona; Grupe 6: óleo de lavanda. O experimento foi de cinco dias e os fatores de crescimento foram mensurados por meio de ensaio imunoenzimático e imuno-histoquímica. Os níveis dos fatores de crescimento FCDP e FCE foram significativamente maiores no grupo TENS, em comparação aos outros grupos e o grupo controle (p < 0,05).4 Esse estudo mostrou os vários tratamentos para a cicatrização de feridas, diferentemente do presente estudo, no qual foram avaliados apenas fatores de crescimento na cicatrização de feridas. Não houve estímulo externo e foram usados apenas fatores de crescimento.
Vale ressaltar que, apesar de o presente estudo ter obtido resultado favorável com uso de FCE e FM (p < 0,05) nos três dias de avaliação e maior porcentagem de colágeno maduro para as F2 e F3, com 64,7% e 73,3%, respectivamente, em comparação a F1, com apenas 49,2%, houve um estudo que avaliou os efeitos do PRP em feridas de cavalos com resultado negativo. Em seis éguas de várias raças, foram criadas três feridas na região de metacarpo de cadauma, totalizando 36 feridas; destas 36 feridas, 18 foram tratadas com PRP e bandagem e 18 eram feridas controle, tratadas apenas com bandagem, sem medicação. Estudo anatomopatológico foi realizado após uma, duas e três semanas da criação da ferida. Nas feridas tratadas com PRP, observaram-se grande quantidade de tecido de granulação e alta concentração de fator de crescimento transformador B1, quando comparadas com feridas sem tratamento com PRP. Dados histológicos, biomecânicos e expressão gênica não diferiram significativamente entre feridas tratadas e não tratadas com PRP. Os autores concluíram que a aplicação tópica de PRP autóloga não acelera ou melhora a reparação de feridas com granulação em membros de cavalos. Este tratamento pode melhorar feridas com grande perda de tecido ou, alternativamente, feridas crônicas, o que beneficiaria mediadores para acelerar o processo cicatricial.18
Os cuidados e objetivos do estudo de Pradeep (2009) consistiram em comparar a efetividade clínica de duas técnicas regenerativas no tratamento de defeitos ósseos em humanos. Foram usados PRP e PRP associados à matriz anorgânica derivada de tecido bovino e peptídio-15 (ABM/P-15). Analisando parâmetros clínicos e radiológicos em 14 pacientes, foram criados defeitos ósseos e injetados PRP e, em outro grupo, PRP associado ao AMB/P-15. Em todos os parâmetros clínicos analisados, houve grande diferença estatística p < 0,001 (índice de placas, índice de sangramento de sulco, nível de inserção e nível marginal gengival, profundidade de sondagem) para o grupo de enxerto associado a PRP. A tomografia computadorizada demonstrou que o crescimento ósseo obteve melhores resultados com a combinação de PRP + AMB/P-15, com significância estatística (p < 0,001). Concluiu-se que a combinação de PRP com AMB/P-15 foi mais efetivo que o PRP sozinho no tratamento de defeitos intraósseos.19 Resultados semelhantes foram obtidos neste estudo, pois as feridas com FM obtiveram uma cicatrização ligeiramente melhor em relação à ferida com FCE, o que leva à concusão de que a associação de fatores de crescimento resulta em uma cicatriz melhor.
Conclusões
A análise dos resultados macroscópicos associa-se a estímulo na redução da área cruenta da ferida, e os resultados microscópicos do presente estudo permitem concluir que a utilização dos fatores de crescimento tanto epitelial como misto, injetados nos bordos das feridas cutâneas de ratas, quando comparada à ferida controle, acelera o processo de cicatrização, pois desenvolve maior atividade angiogênica, acelera a fibroplasia e a deposição de colágeno tipo I, além de acelerar a maturação da cicatrização.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 27 de agosto de 2015;
aceito em 3 de setembro de 2015
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.09.011
☆ Como citar este artigo: João De Masi EC, Campos AC, João De Masi FD, Ratti MA, Ike IS, João De Masi RD. The influence of growth factors on skin wound healing in rats. Braz J Otorhinolaryngol. 2016;82:512-21.
* Autor para correspondência.
E-mails:elen.masi@ipo.com.br, ecdemasi@netuno.com.br (E.C. João De Masi).