Postural instability is one the most common disabling features in vestibular disorders.
ObjectiveThis study aimed to analyze the limit of stability and the influence of manipulation of visual, somatosensorial and visual–vestibular information on postural control in older adults with vestibular disorder, with and without a history of falls.
MethodsCross‐sectional study. Participants – 76 elderly patients with vestibular disorder (G1, without falls; G2, with falls) and 41 healthy elderly subjects (control group; CG). Using posturography, analyzed were limit of stability area, body center of pressure, and velocity of oscillation in the standing position in 10 conditions, including open/closed eyes, unstable surface with eyes closed, saccadic and optokinetic stimuli, and visual–vestibular interaction.
ResultsLimit of stability area in CG was better compared with G1‐2, and center of pressure values were worse in G1 than in CG. Center of pressure area in all conditions and velocity of oscillation in the following conditions: open/closed eyes, optokinetic stimulation, and visual–vestibular interaction showed worse values in G2 than in CG. Center of pressure area in the following conditions: open/closed eyes, saccadic and optokinetic stimuli, visual–vestibular interaction, and unstable surface with eyes closed showed worse values in G2 than in G1.
ConclusionOlder adults with vestibular disorder presented reduced limit of stability and increased postural sway in the following conditions: conflict between visual and somatosensory information and visual–vestibular interaction. Deterioration in postural control was significantly associated with history of falls.
Instabilidade postural é uma das características incapacitantes mais comuns nos distúrbios vestibulares.
ObjetivoAnalisar o limite de estabilidade e a influência da manipulação de informações visuais, somatossensoriais e visuais‐vestibulares no controle postural em idosos com disfunção vestibular, com e sem histórico de quedas.
MétodoEstudo transversal. Participantes: 76 idosos com distúrbios vestibulares (G1, sem quedas; G2, com quedas) e 41 idosos saudáveis (grupo controle; GC). Com o uso da posturografia, foram analisadas a área do limite de estabilidade, centro de pressão e velocidade de oscilação na posição ereta em 10 condições, incluindo olhos abertos/fechados, superfície instável com olhos fechados, estímulos sacádicos e optocinéticos e interação visual‐vestibular.
ResultadosA área de limite de estabilidade no GC foi melhor comparada com o G1‐2 e os valores do centro de pressão foram piores no G1 do que no GC. A área do centro de pressão em todas as condições e a velocidade de oscilação nas seguintes condições: olhos abertos/fechados, estímulo optocinético e interação visual‐vestibular mostraram valores piores no G2 do que no GC. A área do centro de pressão nas seguintes condições: olhos abertos/fechados, estímulos sacádicos e optocinéticos, interação visual‐vestibular e superfície instável com olhos fechados apresentou valores piores no G2 do que no G1.
ConclusãoIdosos com disfunção vestibular apresentaram redução de limite de estabilidade e aumento da oscilação postural nas seguintes condições: conflito entre informação visual e somatossensorial e interação visual‐vestibular. A deterioração no controle postural foi significantemente associada ao histórico de quedas.
Instabilidade postural ou diminuição do equilíbrio corporal é uma das principais causas de incapacidade entre os idosos,1,2 já que o resultado final pode ser a ocorrência de quedas.3,4 Um distúrbio vestibular pode afetar o equilíbrio corporal e a prevalência de quedas é maior nessa população (53,3%)5 do que nos idosos da comunidade geral (32,7% ‐34,8%).6,7 As causas mais prevalentes da queixa de instabilidade postural, tontura e/ou quedas são vertigem posicional paroxística benigna, doença de Ménière, hipofunção vestibular (unilateral ou bilateral), distúrbio vascular labiríntico, labirintopatia metabólica e problemas neurológicos, como doença de Parkinson, acidente vascular cerebral e esclerose múltipla.8,9
A avaliação posturográfica pode ser útil na análise da instabilidade corporal de idosos10–12 e na identificação do risco de quedas.13–15 Os resultados do exame posturográfico devem ser avaliados junto com outras informações obtidas na propedêutica de pacientes com distúrbios vestibulares, como histórico clínico, exame físico, exames laboratoriais e exames funcionais de equilíbrio corporal.16,17
Sistemas de realidade virtual integrados a uma plataforma de força têm sido usados para estimulação visual e para avaliar o efeito da percepção sensorial nas respostas posturais quando os estímulos são fornecidos. A realidade virtual é uma “interface avançada” para aplicativos computacionais, caracterizada pela visualização e movimentação em ambientes tridimensionais em tempo real, bem como pela interação com elementos desse ambiente.11,12
A identificação do desempenho posturográfico de idosos com vestibulopatia crônica em diferentes ambientes visuais que estimulam reflexos oculomotores, tais como sacádicos e optocinéticos, a perseguição visual de imagens e a interação visual‐vestibular podem ser úteis na determinação de estímulos visuais e vestibulares que resultam em maior instabilidade e na elaboração de protocolos de reabilitação de equilíbrio corporal, principalmente para aqueles com maior risco de queda.
Este estudo teve como objetivo avaliar o controle postural de idosos com vestibulopatia crônica, com ou sem histórico de quedas, utilizando posturografia integrada à realidade virtual.
MétodoSeleção dos indivíduosUm estudo transversal foi feito entre dezembro de 2007 e março de 2010, o qual foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo (Unifesp). O trabalho descrito foi feito de acordo com o Código de Ética da World Medical Association (protocolo número 1704/07). Idosos do sexo masculino e feminino com ≥ 65 anos foram avaliados e alocados no Grupo Controle (GC) e em um grupo de pacientes com distúrbio vestibular crônico subdividido em dois grupos: Grupo 1 (G1) – pacientes sem histórico de quedas nos últimos 6 meses e Grupo 2 (G2) – pacientes com histórico de quedas no mesmo período.
Os critérios de exclusão para os três grupos foram os seguintes: idosos incapazes de compreender e responder a comandos verbais simples; incapazes de permanecer de forma independente na posição ortostática e os que usavam um dispositivo auxiliar para a marcha; com deficiência visual grave sem lentes corretivas; com diabetes e recebendo insulinoterapia; com um distúrbio ortopédico que resultava em limitação de movimento e uso de prótese nos membros inferiores; com distúrbios neurológicos e/ou psiquiátricos; que haviam ingerido álcool 24 horas antes da avaliação; que recebiam medicamentos com ação sobre o sistema nervoso central ou sistema vestibular; e que haviam feito reabilitação do equilíbrio corporal nos últimos 6 meses.
O GC foi composto por idosos do Setor de Estudos do Envelhecimento da Unifesp. Os critérios de inclusão para o GC foram: ausência de sintomas vestibulares e/ou desequilíbrio, sem queixas auditivas, sem antecedentes pessoais de doença vestibular, sem sinais anormais na avaliação da função vestibular, sem histórico de quedas nos últimos 6 meses e com dificuldade em no máximo três atividades de vida diária, verificadas pela versão brasileira do Older Americans Research and Services Multidimensional Functional Assessment Questionnaire (BOMFAQ).18
Protocolo clínicoO diagnóstico de distúrbio vestibular crônico foi considerado quando a tontura vestibular estava presente havia pelo menos três meses consecutivos.19 Todos os participantes do estudo forneceram informações sobre sexo, idade, altura, atividade física regular, número de doenças e número de medicamentos e responderam ao questionário BOMFAQ;18 sua função vestibular foi avaliada e foram feitas eletronistagmografia e posturografia estática integrada à realidade virtual.9,20
A atividade física foi considerada regular quando o participante relatou fazê‐la três ou mais vezes por semana, durante seu tempo livre, por >30min nos últimos 14 dias.21
Posturografia computadorizadaA Unidade de Reabilitação do Equilíbrio (Balance Rehabilitation Unit, BRU; Medicaa, Montevidéu, Uruguai) é um sistema de posturografia computadorizada integrado a um sistema de realidade virtual que mede a oscilação postural resultante de diferentes estímulos.9,12,20 Ele usa informações sobre a posição do centro de pressão (Center of Body Pressure, COP) do indivíduo durante tarefas feitas em uma plataforma de equilíbrio (450 × 450mm). O software BRU envia um estímulo para um head‐mounted display (HMD), um dispositivo de vídeo usado na cabeça como um capacete (eMagin Z800 3D Vision, Nova York, NY, EUA), que provoca reflexos oculomotores (sacádicos, optocinéticos e vestíbulo‐oculares).
Os parâmetros analisados foram limite de estabilidade (Limit of Stability, LOS) e Intervalos de Confiança de 95% do COP. A média da velocidade de oscilação (Velocity of Sway, VOS) foi determinada pela trajetória total do COP dividida pelo tempo de teste (60s).9 A área do LOS foi quantificada pelo deslocamento total máximo e mínimo no eixo Y (anteroposterior) e eixo X (médio‐lateral), aproximou‐se do padrão de oscilação para uma elipse. O teste de LOS foi usado para avaliar a capacidade de deslocar o COP do indivíduo nos planos anteroposterior e lateral sem risco de queda. Um aumento no LOS indica boa estabilidade. O COP representa o vetor da força de reação do solo e reflete o movimento do centro de massa do corpo. Deslocamentos anteroposterior e médio‐lateral foram registrados em uma frequência de amostragem de 50Hz. Deslocamentos de COP foram usados para estimar a área de oscilação do COP.
A avaliação posturográfica foi feita com o paciente em posição ortostática na plataforma, braços pendentes ao lado do corpo e descalços, com o maléolo interno posicionado nas extremidades da linha intermaleolar.
Para determinar o LOS, foi solicitado aos participantes que deslocassem o corpo nas direções anteroposterior e médio‐lateral através da estratégia do tornozelo, ou seja, sem mover os pés ou usar estratégias de tronco, por 60s. O procedimento foi repetido até três vezes quando os participantes moviam os pés ou o tronco.
Os participantes foram avaliados na posição ortostática em 10 condições sensoriais classificadas de acordo com o estímulo visual e o reflexo oculomotor envolvido:12,20 Condição 1 (superfície firme, olhos abertos); Condição 2 (superfície firme, olhos fechados); Condição 3 (superfície de espuma instável, olhos fechados); Condição 4 (superfície firme, estimulação sacádica na frequência de 0,2 KHz); Condição 5 (superfície firme, estimulação optocinética horizontal da esquerda para a direita); Condição 6 (superfície firme, estimulação optocinética horizontal da direita para a esquerda); Condição 7 (superfície firme, estimulação optocinética vertical de cima para baixo); Condição 8 (superfície firme, estimulação optocinética vertical de baixo para cima); Condição 9 (superfície firme, estimulação optocinética horizontal associada a movimentos lentos e uniformes da rotação da cabeça com ombros e tronco firmes) e Condição 10 (superfície firme, estimulação optocinética vertical associada a movimentos lentos e uniformes de flexão‐extensão da cabeça com ombros e tronco firmes). Nas condições 5 a 8, a velocidade angular da estimulação optocinética foi de 60°/s. Óculos de realidade virtual (eMagin Z800 3D Vision, eMagin, Nova York) forneceram estímulos visuais para desencadear reflexos oculomotores (sacádicos e optocinéticos), perseguição visual de imagens e interação visual‐vestibular, ou seja, estimulação optocinética associada ao Reflexo Vestíbulo‐Ocular (Vestibulo‐Ocular Reflex, VOR) através de movimentos da cabeça verticais e horizontais. Os óculos de realidade virtual foram usados da 4ª à 10ª condição sensorial. Na Condição 4, o indivíduo foi instruído a seguir alvos visuais randomizados com cores e letras diferentes para estimular o sistema sacádico.
O estímulo visual exibido no campo visual do indivíduo nas Condições 5 a 8 tinha barras pretas individuais em movimento. O indivíduo era instruído a olhar para o centro do campo visual para induzir o nistagmo optocinético.
Para a avaliação de cada uma das dez condições, foi solicitado aos participantes que permanecessem na posição ortostática (estática e silenciosa e o mais calma possível) por 60s.
Uma espuma de poliuretano de alta densidade de 14cm foi usada na 3ª condição; um sistema de suporte de proteção com arreios e um cinto de segurança foram usados para evitar quedas. A incapacidade de manter o equilíbrio corporal foi descrita como o uso da estratégia do passo ou movimento dos membros superiores, calcâneo ou pés para compensar a instabilidade do corpo após a terceira repetição do procedimento em cada condição.
Análise estatísticaAnálises estatísticas simples descritivas e bivariadas foram feitas por meio do teste do qui‐quadrado ou teste de Fisher e Anova (seguido pelo teste de Bonferroni para comparação múltipla, quando p < 0,05). O nível de significância foi estabelecido em 5% (α = 0,05). O softwareStatistical Package for Social Sciences (SPSS, versão 10.0, 1999) para Windows foi usado para a análise estatística. O tamanho da amostra estimado foi baseado em dados de posturografia previamente coletados com a seguinte hipótese: α = 0,05 e análise de potência = 0,80.
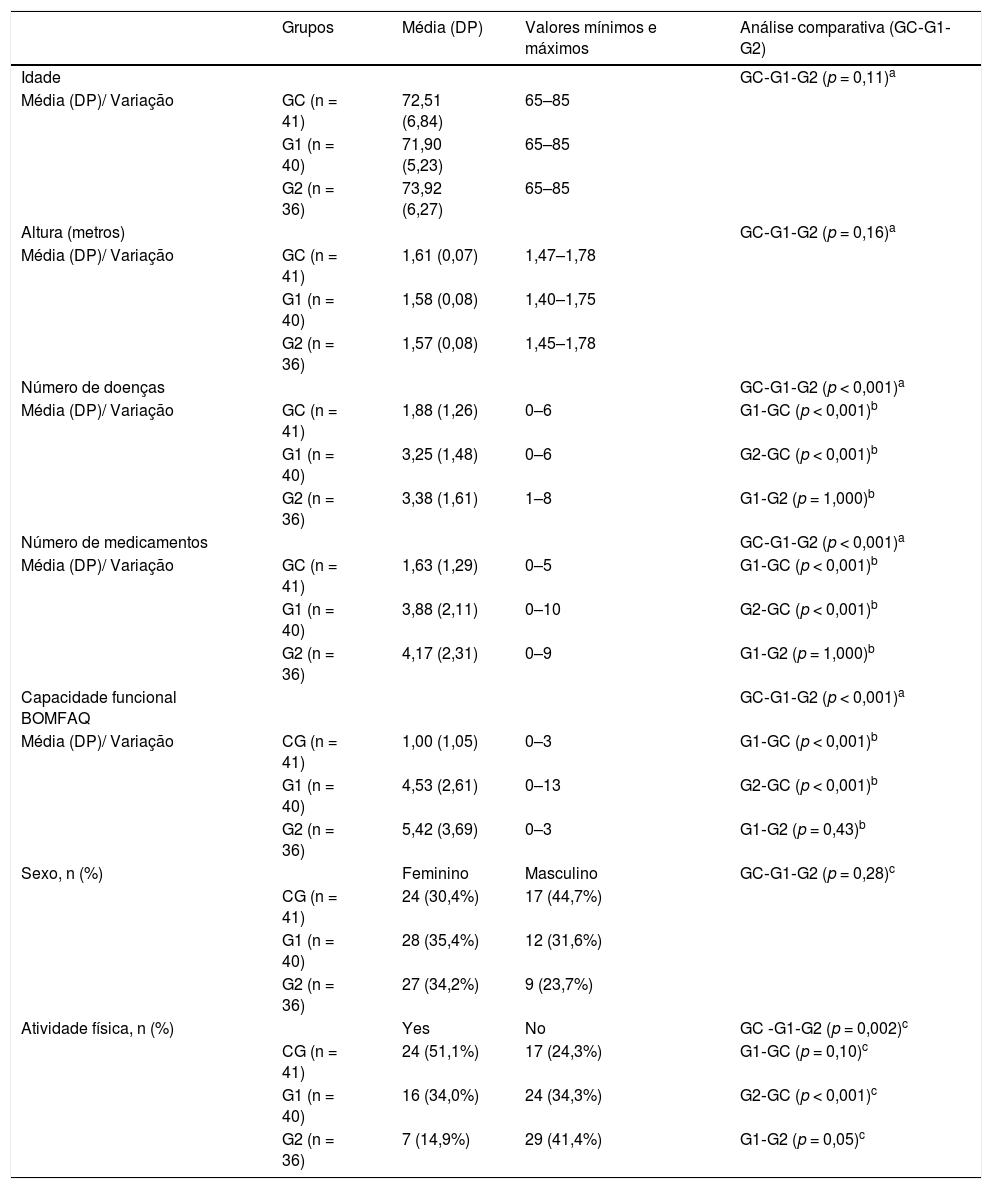
ResultadosCaracterísticas clínicasParticiparam deste estudo 117 idosos (76 com distúrbio vestibular crônico; 41saudáveis). Os idosos do G2 apresentaram pelo menos um episódio de queda: 23 (19,7%) caíram apenas uma vez e 13 (11,3%) relataram episódios recorrentes de quedas nos últimos 6 meses. A análise descritiva da idade, altura, número de doenças, número de medicamentos e capacidade funcional de cada grupo e a análise comparativa entre o GC e G1, G1 e G2, GC e G2 são apresentadas na tabela 1.
Análise descritiva e comparativa de idade, sexo, altura, número de doenças, número de medicamentos, capacidade funcional e prática de atividade física entre idosos do grupo controle e idosos com distúrbio vestibular crônico com e sem histórico de quedas
| Grupos | Média (DP) | Valores mínimos e máximos | Análise comparativa (GC‐G1‐G2) | |
|---|---|---|---|---|
| Idade | GC‐G1‐G2 (p = 0,11)a | |||
| Média (DP)/ Variação | GC (n = 41) | 72,51 (6,84) | 65–85 | |
| G1 (n = 40) | 71,90 (5,23) | 65–85 | ||
| G2 (n = 36) | 73,92 (6,27) | 65–85 | ||
| Altura (metros) | GC‐G1‐G2 (p = 0,16)a | |||
| Média (DP)/ Variação | GC (n = 41) | 1,61 (0,07) | 1,47–1,78 | |
| G1 (n = 40) | 1,58 (0,08) | 1,40–1,75 | ||
| G2 (n = 36) | 1,57 (0,08) | 1,45–1,78 | ||
| Número de doenças | GC‐G1‐G2 (p < 0,001)a | |||
| Média (DP)/ Variação | GC (n = 41) | 1,88 (1,26) | 0–6 | G1‐GC (p < 0,001)b |
| G1 (n = 40) | 3,25 (1,48) | 0–6 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 3,38 (1,61) | 1–8 | G1‐G2 (p = 1,000)b | |
| Número de medicamentos | GC‐G1‐G2 (p < 0,001)a | |||
| Média (DP)/ Variação | GC (n = 41) | 1,63 (1,29) | 0–5 | G1‐GC (p < 0,001)b |
| G1 (n = 40) | 3,88 (2,11) | 0–10 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 4,17 (2,31) | 0–9 | G1‐G2 (p = 1,000)b | |
| Capacidade funcional BOMFAQ | GC‐G1‐G2 (p < 0,001)a | |||
| Média (DP)/ Variação | CG (n = 41) | 1,00 (1,05) | 0–3 | G1‐GC (p < 0,001)b |
| G1 (n = 40) | 4,53 (2,61) | 0–13 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 5,42 (3,69) | 0–3 | G1‐G2 (p = 0,43)b | |
| Sexo, n (%) | Feminino | Masculino | GC‐G1‐G2 (p = 0,28)c | |
| CG (n = 41) | 24 (30,4%) | 17 (44,7%) | ||
| G1 (n = 40) | 28 (35,4%) | 12 (31,6%) | ||
| G2 (n = 36) | 27 (34,2%) | 9 (23,7%) | ||
| Atividade física, n (%) | Yes | No | GC ‐G1‐G2 (p = 0,002)c | |
| CG (n = 41) | 24 (51,1%) | 17 (24,3%) | G1‐GC (p = 0,10)c | |
| G1 (n = 40) | 16 (34,0%) | 24 (34,3%) | G2‐GC (p < 0,001)c | |
| G2 (n = 36) | 7 (14,9%) | 29 (41,4%) | G1‐G2 (p = 0,05)c |
BOMFAQ, Brazilian OARS (Older Americans Research and Services) Multidimensional Functional Assessment Questionnaire;16 DP, desvio‐padrão; G1, grupo sem quedas; G2, grupo com quedas; GC, grupo controle.
Nível de significância α = 0,05.
Dos 76 idosos com distúrbio vestibular crônico, quatro mulheres entre 72 e 83 anos no G2 não cumpriram todas as condições: três não completaram a condição 3 e uma não completou as condições 2 e 3.
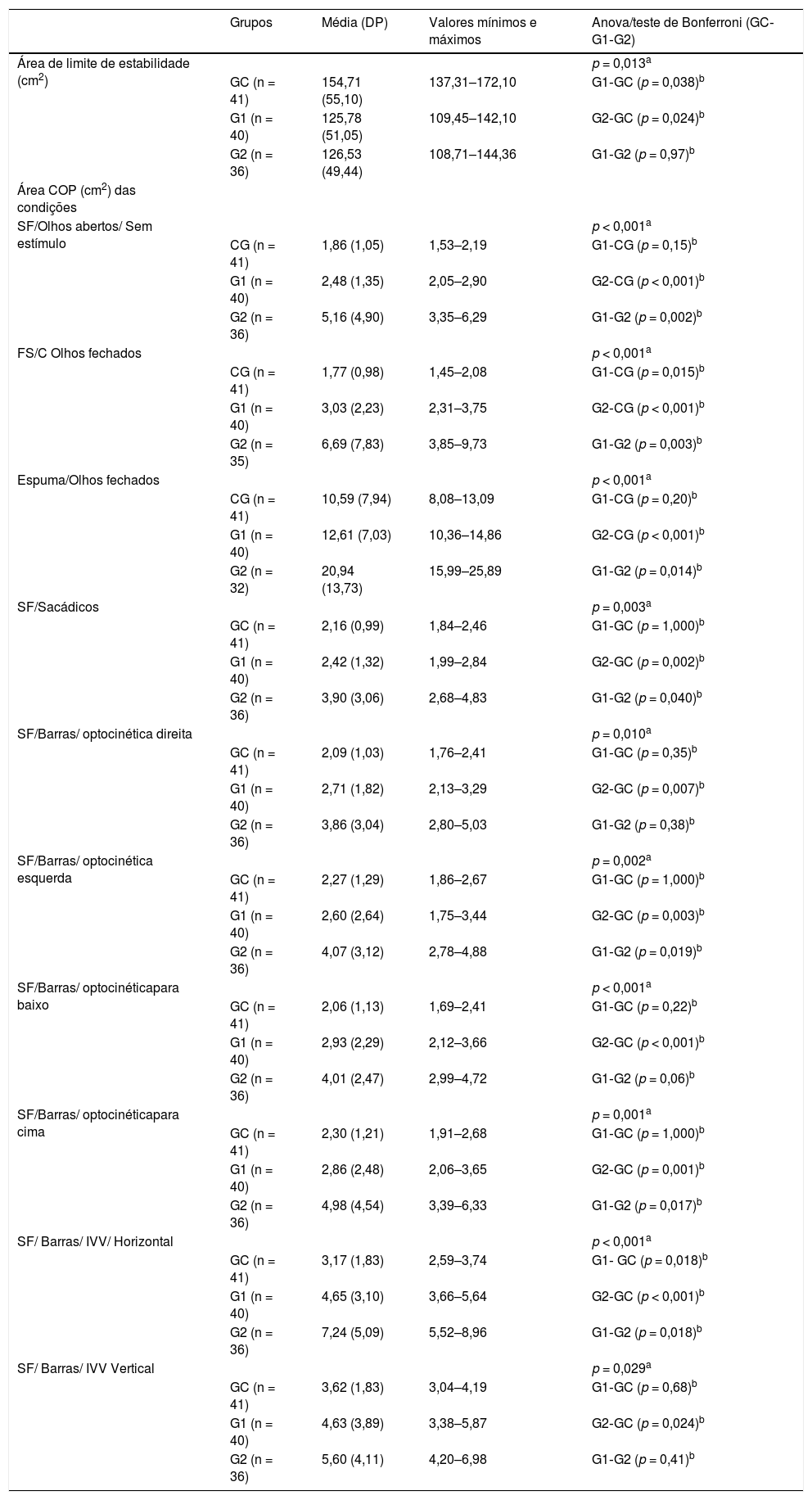
O valor do LOS foi significantemente maior no GC do que no G1 e não houve diferença significante entre o G1 e o G2 (tabela 2).
Análises descritiva e comparativa da área de limite de estabilidade (cm2) e da área COP (cm2) nas condições testadas entre idosos do grupo controle e idosos com distúrbio vestibular crônico com e sem histórico de quedas
| Grupos | Média (DP) | Valores mínimos e máximos | Anova/teste de Bonferroni (GC‐G1‐G2) | |
|---|---|---|---|---|
| Área de limite de estabilidade (cm2) | p = 0,013a | |||
| GC (n = 41) | 154,71 (55,10) | 137,31–172,10 | G1‐GC (p = 0,038)b | |
| G1 (n = 40) | 125,78 (51,05) | 109,45–142,10 | G2‐GC (p = 0,024)b | |
| G2 (n = 36) | 126,53 (49,44) | 108,71–144,36 | G1‐G2 (p = 0,97)b | |
| Área COP (cm2) das condições | ||||
| SF/Olhos abertos/ Sem estímulo | p < 0,001a | |||
| CG (n = 41) | 1,86 (1,05) | 1,53–2,19 | G1‐CG (p = 0,15)b | |
| G1 (n = 40) | 2,48 (1,35) | 2,05–2,90 | G2‐CG (p < 0,001)b | |
| G2 (n = 36) | 5,16 (4,90) | 3,35–6,29 | G1‐G2 (p = 0,002)b | |
| FS/C Olhos fechados | p < 0,001a | |||
| CG (n = 41) | 1,77 (0,98) | 1,45–2,08 | G1‐CG (p = 0,015)b | |
| G1 (n = 40) | 3,03 (2,23) | 2,31–3,75 | G2‐CG (p < 0,001)b | |
| G2 (n = 35) | 6,69 (7,83) | 3,85–9,73 | G1‐G2 (p = 0,003)b | |
| Espuma/Olhos fechados | p < 0,001a | |||
| CG (n = 41) | 10,59 (7,94) | 8,08–13,09 | G1‐CG (p = 0,20)b | |
| G1 (n = 40) | 12,61 (7,03) | 10,36–14,86 | G2‐CG (p < 0,001)b | |
| G2 (n = 32) | 20,94 (13,73) | 15,99–25,89 | G1‐G2 (p = 0,014)b | |
| SF/Sacádicos | p = 0,003a | |||
| GC (n = 41) | 2,16 (0,99) | 1,84–2,46 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 2,42 (1,32) | 1,99–2,84 | G2‐GC (p = 0,002)b | |
| G2 (n = 36) | 3,90 (3,06) | 2,68–4,83 | G1‐G2 (p = 0,040)b | |
| SF/Barras/ optocinética direita | p = 0,010a | |||
| GC (n = 41) | 2,09 (1,03) | 1,76–2,41 | G1‐GC (p = 0,35)b | |
| G1 (n = 40) | 2,71 (1,82) | 2,13–3,29 | G2‐GC (p = 0,007)b | |
| G2 (n = 36) | 3,86 (3,04) | 2,80–5,03 | G1‐G2 (p = 0,38)b | |
| SF/Barras/ optocinética esquerda | p = 0,002a | |||
| GC (n = 41) | 2,27 (1,29) | 1,86–2,67 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 2,60 (2,64) | 1,75–3,44 | G2‐GC (p = 0,003)b | |
| G2 (n = 36) | 4,07 (3,12) | 2,78–4,88 | G1‐G2 (p = 0,019)b | |
| SF/Barras/ optocinéticapara baixo | p < 0,001a | |||
| GC (n = 41) | 2,06 (1,13) | 1,69–2,41 | G1‐GC (p = 0,22)b | |
| G1 (n = 40) | 2,93 (2,29) | 2,12–3,66 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 4,01 (2,47) | 2,99–4,72 | G1‐G2 (p = 0,06)b | |
| SF/Barras/ optocinéticapara cima | p = 0,001a | |||
| GC (n = 41) | 2,30 (1,21) | 1,91–2,68 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 2,86 (2,48) | 2,06–3,65 | G2‐GC (p = 0,001)b | |
| G2 (n = 36) | 4,98 (4,54) | 3,39–6,33 | G1‐G2 (p = 0,017)b | |
| SF/ Barras/ IVV/ Horizontal | p < 0,001a | |||
| GC (n = 41) | 3,17 (1,83) | 2,59–3,74 | G1‐ GC (p = 0,018)b | |
| G1 (n = 40) | 4,65 (3,10) | 3,66–5,64 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 7,24 (5,09) | 5,52–8,96 | G1‐G2 (p = 0,018)b | |
| SF/ Barras/ IVV Vertical | p = 0,029a | |||
| GC (n = 41) | 3,62 (1,83) | 3,04–4,19 | G1‐GC (p = 0,68)b | |
| G1 (n = 40) | 4,63 (3,89) | 3,38–5,87 | G2‐GC (p = 0,024)b | |
| G2 (n = 36) | 5,60 (4,11) | 4,20–6,98 | G1‐G2 (p = 0,41)b |
DP, desvio‐padrão; G1, grupo sem quedas; G2, grupo com quedas; GC, grupo controle; IVV, Interação Visual‐Vestibular; SF, superfície firme.
Nível de significância α = 0,05.
Os valores da área do COP foram significantemente diferentes entre os grupos em todas as condições e os valores foram maiores no G2 do que no GC. Os valores da área do COP no G1 foram maiores que os do GC nas condições 2 e 9. Diferenças significantes também foram encontradas entre G1 e G2 nas condições 1–4, 6, 8 e 9.
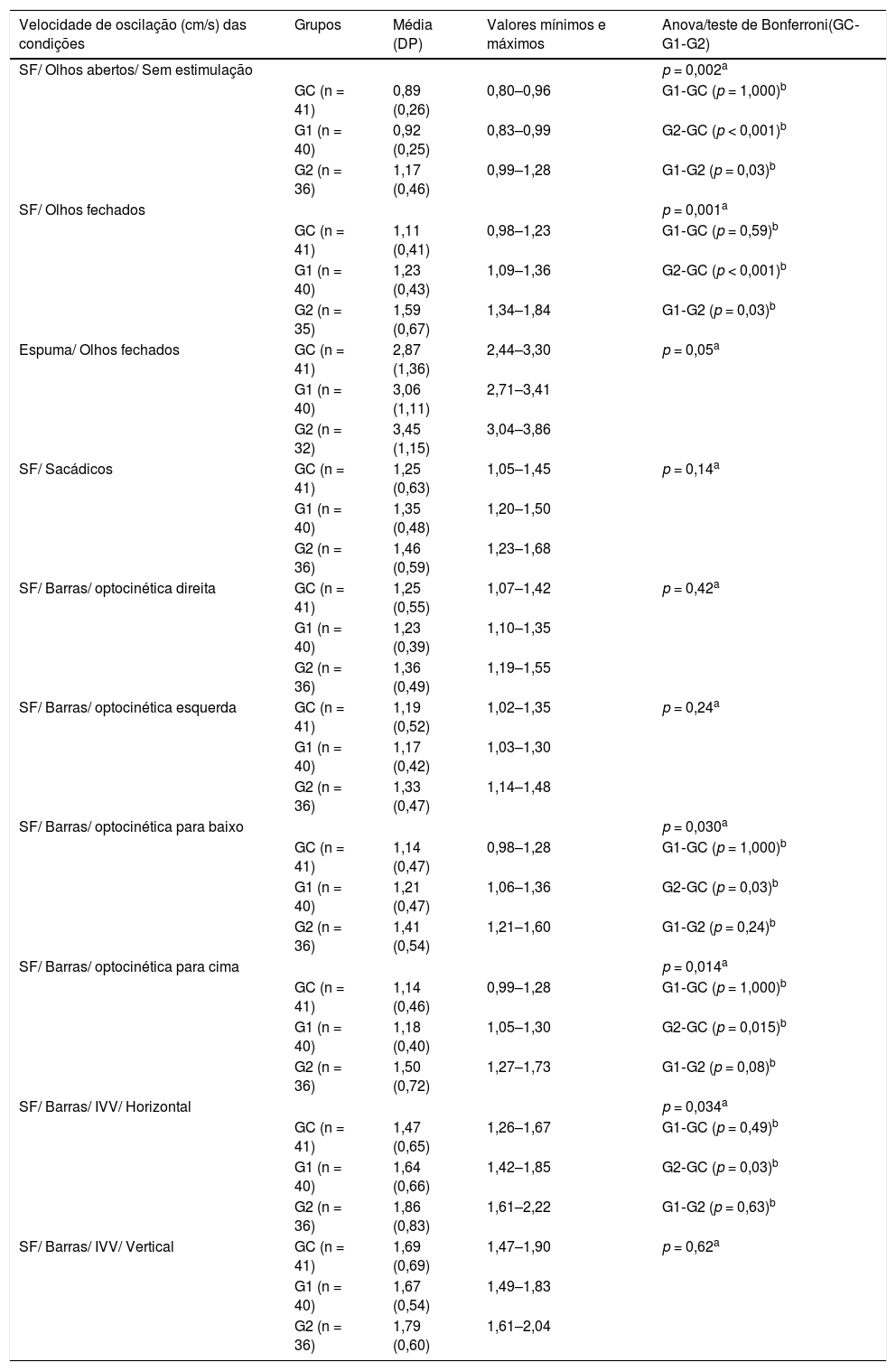
Os valores da VOS foram significantemente diferentes entre os grupos nas condições 1, 2, 7, 8 e 9, com valores maiores no G2 do que no GC. Além disso, diferenças significantes foram encontradas entre G1 e G2 nas condições 1 e 2 (tabela 3).
Análise descritiva e comparativa da velocidade de oscilação (cm/s) nas condições testadas entre idosos do grupo controle e idosos com distúrbio vestibular crônico com e sem histórico de quedas
| Velocidade de oscilação (cm/s) das condições | Grupos | Média (DP) | Valores mínimos e máximos | Anova/teste de Bonferroni(GC‐G1‐G2) |
|---|---|---|---|---|
| SF/ Olhos abertos/ Sem estimulação | p = 0,002a | |||
| GC (n = 41) | 0,89 (0,26) | 0,80–0,96 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 0,92 (0,25) | 0,83–0,99 | G2‐GC (p < 0,001)b | |
| G2 (n = 36) | 1,17 (0,46) | 0,99–1,28 | G1‐G2 (p = 0,03)b | |
| SF/ Olhos fechados | p = 0,001a | |||
| GC (n = 41) | 1,11 (0,41) | 0,98–1,23 | G1‐GC (p = 0,59)b | |
| G1 (n = 40) | 1,23 (0,43) | 1,09–1,36 | G2‐GC (p < 0,001)b | |
| G2 (n = 35) | 1,59 (0,67) | 1,34–1,84 | G1‐G2 (p = 0,03)b | |
| Espuma/ Olhos fechados | GC (n = 41) | 2,87 (1,36) | 2,44–3,30 | p = 0,05a |
| G1 (n = 40) | 3,06 (1,11) | 2,71–3,41 | ||
| G2 (n = 32) | 3,45 (1,15) | 3,04–3,86 | ||
| SF/ Sacádicos | GC (n = 41) | 1,25 (0,63) | 1,05–1,45 | p = 0,14a |
| G1 (n = 40) | 1,35 (0,48) | 1,20–1,50 | ||
| G2 (n = 36) | 1,46 (0,59) | 1,23–1,68 | ||
| SF/ Barras/ optocinética direita | GC (n = 41) | 1,25 (0,55) | 1,07–1,42 | p = 0,42a |
| G1 (n = 40) | 1,23 (0,39) | 1,10–1,35 | ||
| G2 (n = 36) | 1,36 (0,49) | 1,19–1,55 | ||
| SF/ Barras/ optocinética esquerda | GC (n = 41) | 1,19 (0,52) | 1,02–1,35 | p = 0,24a |
| G1 (n = 40) | 1,17 (0,42) | 1,03–1,30 | ||
| G2 (n = 36) | 1,33 (0,47) | 1,14–1,48 | ||
| SF/ Barras/ optocinética para baixo | p = 0,030a | |||
| GC (n = 41) | 1,14 (0,47) | 0,98–1,28 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 1,21 (0,47) | 1,06–1,36 | G2‐GC (p = 0,03)b | |
| G2 (n = 36) | 1,41 (0,54) | 1,21–1,60 | G1‐G2 (p = 0,24)b | |
| SF/ Barras/ optocinética para cima | p = 0,014a | |||
| GC (n = 41) | 1,14 (0,46) | 0,99–1,28 | G1‐GC (p = 1,000)b | |
| G1 (n = 40) | 1,18 (0,40) | 1,05–1,30 | G2‐GC (p = 0,015)b | |
| G2 (n = 36) | 1,50 (0,72) | 1,27–1,73 | G1‐G2 (p = 0,08)b | |
| SF/ Barras/ IVV/ Horizontal | p = 0,034a | |||
| GC (n = 41) | 1,47 (0,65) | 1,26–1,67 | G1‐GC (p = 0,49)b | |
| G1 (n = 40) | 1,64 (0,66) | 1,42–1,85 | G2‐GC (p = 0,03)b | |
| G2 (n = 36) | 1,86 (0,83) | 1,61–2,22 | G1‐G2 (p = 0,63)b | |
| SF/ Barras/ IVV/ Vertical | GC (n = 41) | 1,69 (0,69) | 1,47–1,90 | p = 0,62a |
| G1 (n = 40) | 1,67 (0,54) | 1,49–1,83 | ||
| G2 (n = 36) | 1,79 (0,60) | 1,61–2,04 |
DP, desvio‐padrão; G1, grupo sem quedas; G2, grupo com quedas; GC, grupo controle; IVV, Interação Visual‐Vestibular; SF, superfície firme.
Nível de significância α = 0,05.
A média de idade dos idosos deste estudo foi de 72 anos, semelhante à média de idade de outros estudos que avaliaram idosos com tontura e/ou desequilíbrio corporal. 5,10,11,22,23 A prevalência de distúrbios do sistema vestibular em mulheres também foi documentada, 5,24 corroborou os achados de nosso estudo.
O diagnóstico de distúrbio vestibular, o número de afecções vestibulares associadas, o início, a duração e a periodicidade da tontura, a capacidade funcional e medo de cair foram semelhantes entre os grupos com e sem quedas; portanto, esses grupos são clinicamente semelhantes e a ocorrência de quedas é a principal diferença. Entretanto, a associação entre tontura rotatória (vertigem) e não rotatória foi prevalente no G2; assim, esse grupo possivelmente tem mais de uma doença24 ou um dano concomitante em outros sistemas envolvidos no equilíbrio corporal, sugere um distúrbio sensorial multifatorial.
Quatro casos no G2 apresentaram dificuldade de completar a avaliação posturográfica nas condições 2 (superfície firme e olhos fechados) e/ou 3 (superfície de espuma e olhos fechados), devido à incapacidade de manter a posição ortostática. No entanto, idosos com quedas recorrentes apresentaram uma perda significantemente maior de equilíbrio corporal na terceira tentativa do teste que aqueles sem quedas e aqueles que caíram apenas uma vez, sugeriu que a perda de equilíbrio corporal durante a posturografia poderia estar associada ao risco de quedas durante as atividades da vida diária.25
O LOS foi significantemente maior no GC do que no G1 e no G2, o que é semelhante a outros estudos que usaram o mesmo equipamento de posturografia.11 O LOS é a área onde a oscilação do paciente é mais segura; uma redução significante nessa área pode resultar em aumento do risco de queda, já que a oscilação sutil do COP supera o LOS.9,11,20 Esses conceitos podem justificar o porquê de idosos com distúrbios do equilíbrio corporal, devido ao medo de cair, não atingirem seus limites reais durante o teste e apresentarem redução no LOS em relação aos indivíduos saudáveis. O pior desempenho do G1 e do G2 em relação ao LOS pode ser justificado por uma disfunção do sistema vestibular e outros sistemas envolvidos no equilíbrio corporal.
Na Condição 1 (superfície firme e olhos abertos), foram observadas diferenças na área de COP e na VOS entre G2 e GC e entre G1 e G2, revelaram‐se valores mais altos no G2, no qual o equilíbrio corporal foi pior. Esse achado também foi relatado por outros estudos.11,22,26 Entretanto, não houve diferença significante nesses parâmetros entre o GC e o G1, o que é consistente com o achado de que o uso de pistas visuais e somatossensoriais poderia compensar a informação imprecisa do sistema vestibular para a manutenção do equilíbrio corporal em pacientes com distúrbio vestibular.10
Na Condição 2 (superfície firme e olhos fechados), foram encontradas diferenças na área de COP entre os três grupos e diferenças na VOS entre G2 e GC e entre G1 e G2, enfatizou‐se que o input visual tem um papel significativo no equilíbrio corporal, especialmente em indivíduos idosos com distúrbios somatossensoriais devido ao processo de envelhecimento27 e/ou um histórico de quedas.4,28 Achados semelhantes foram relatados entre os seguintes grupos de idosos saudáveis e funcionalmente ativos: nunca caíram, histórico de uma queda e histórico de duas ou mais quedas, com base no escore de equilíbrio da Condição 2 no Teste de Organização Sensorial (superfície firme e olhos fechados)15,25,28 e na condição de Romberg com os olhos fechados.22 A VOS não diferiu entre G1 e GC, corroborou os achados de outros estudos.22,26
Na Condição 3 (superfície de espuma e olhos fechados), na qual a informação somatossensorial é imprecisa com uma superfície de espuma e a informação visual está ausente, o sistema vestibular atua como a principal fonte de informação sensorial para o controle postural. Diferenças na área de COP entre G2 e GC e entre G1 e G2 foram observadas, demonstraram um pior desempenho de idosos com disfunção vestibular com histórico de quedas. A VOS não diferiu entre os grupos nessa condição. Estudos anteriores relataram que, na Condição 3, não foram observadas diferenças significantes na VOS entre os idosos com distúrbios do equilíbrio e/ou tontura e aqueles no GC ou entre os idosos que relataram quedas e aqueles que não o fizeram.26,28 Esses achados podem ser atribuídos à fixação postural e ao medo de cair durante o teste.29 A terceira condição é claramente a mais desafiadora para o controle postural; os valores da área de COP e da VOS foram maiores nessa condição do que em outras. A diminuição da informação somatossensorial, especialmente com os olhos fechados, aumenta a dependência da função vestibular, o que, por sua vez, eleva o risco de queda em pacientes com distúrbios vestibulares.
Na Condição 4 (superfície firme e estímulo sacádico), foram observadas algumas diferenças na área de COP entre G2 e GC e entre G1 e G2, com valores maiores no G2. Esse achado também foi relatado em um estudo anterior.11 A VOS não diferiu entre os grupos na condição 4, o que é consistente com os achados de um estudo anterior,30 mas não com os de outro estudo.11
Na Condição 5 (superfície firme e estimulação optocinética à direita) foi encontrada uma diferença significante na área de COP apenas entre o G2 e o GC. Na Condição 6 (superfície firme e estimulação optocinética à esquerda), observou‐se diferença significante na área de COP entre G2 e GC e entre G2 e G1. Nas condições 7 e 8 (superfície firme e estimulação optocinética vertical de cima para baixo; de baixo para cima), a área de COP e a VOS foram significantemente diferentes entre G2 e GC. Esses achados sugerem que a estimulação optocinética vertical é mais estimulante do que as barras horizontais. Os valores da área de COP e VOS na barra horizontal e os estímulos optocinéticos verticais do BRU foram maiores em idosos com histórico de instabilidade e quedas no último ano do que em indivíduos saudáveis.11
No caso de informações visuais imprecisas (ou seja, estímulos optocinéticos), o sistema de controle postural deve decidir qual input sensorial é o mais adequado para manter a orientação e a estabilidade postural.4 Nas condições de teste 6 a 8 (estímulos optocinéticos), observou‐se maior aumento da oscilação corporal em idosos com disfunção vestibular crônica, o que poderia ser explicado pela aparente preferência dos pacientes em aceitar qualquer informação visual, mesmo que inadequada, como correta. Nessas condições, pacientes idosos com distúrbios vestibulares podem ter dificuldade de selecionar os inputs sensoriais mais precisos, como a informação somestésica.
Na Condição 9 (interação visual‐vestibular horizontal), a área de COP foi diferente nos três grupos e a VOS diferiu apenas no G2 e GC, o que é consistente com os achados de outros estudos.11,30 Na Condição 10 (interação visual‐vestibular vertical), apenas o G2 apresentou valores significantemente maiores da área de COP do que o GC. Portanto, o movimento horizontal da cabeça pode ser mais estimulante ou fornecer maior conflito visual em relação ao movimento de flexão‐extensão da cabeça.
As limitações do nosso estudo incluíram o seguinte: 1) O software usado não permite a randomização das condições, o que pode impedir a influência do aprendizado; todos os participantes foram avaliados de acordo com uma sequência padronizada pelo sistema BRU (ou seja, da primeira à 10ª condição); 2) Permanecer na posição ortostática da 4ª à 10ª condição, sem intervalo de descanso, devido à dificuldade de posicionamento na plataforma (os participantes foram orientados a solicitar descanso quando necessário); 3) Os parâmetros disponíveis da posturografia estática do sistema BRU forneceram apenas valores médios da área de COP e da VOS, que foram medidos em 60s para cada condição; no entanto, a direção (ou seja, médio‐lateral e anteroposterior) que apresentou maior oscilação corporal não foi verificada.
ConclusãoPacientes com distúrbio vestibular crônico com ou sem histórico de quedas têm uma área de LOS reduzida. Entretanto, pacientes com distúrbio vestibular sem quedas apresentaram oscilação corporal semelhante à de idosos saudáveis. O controle postural de idosos com distúrbio vestibular crônico com quedas é pior do que o observado em indivíduos saudáveis e em indivíduos com distúrbio vestibular crônico sem quedas.
Esses achados também demonstram que a posturografia pode quantificar e identificar pacientes com risco de queda, considerando‐se que a incidência de quedas aumenta com o aumento da oscilação corporal em idosos.
Aprovação éticaEste estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo (UNIFESP), protocolo número 1704/07.
FinanciamentoCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Gazzola JM, Caovilla HH, Doná F, Ganança MM, Ganança FF. A quantitative analysis of postural control in elderly patients with vestibular disorders using visual stimulation by virtual reality. Braz J Otorhinolaryngol. 2020;86:593–601.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.