Introdução: A ocorrência de apoptose e a expressão de marcadores proliferativos são ferramentas poderosas no estabelecimento do prognóstico do câncer.
Objetivo: Avaliar a fração de crescimento de papilomas e carcinomas laríngeos de células escamosas, com três graus de diferenciação, através da apoptose e expressão de regiões organizadoras de nucléolo.
Método: Estudo retrospectivo, cujo material em blocado em parafina foi submetido à microtomia e coloração em hematoxilina-eosina, e pela prata. As lâminas coradas foram utilizadas para quantificar o índice apoptótico e o número de regiões organizadoras de nucléolo (NORs) através da morfometria.
Resultados: A apoptose foi significativamente mais frequente em carcinomas bem diferenciados e em papilomas; enquanto que uma maior fração de crescimento, de NORs expressos e de células que expressaram maior número de NORs, foram mais frequentes nos carcinomas indiferenciados.
Conclusões: Foi possível verificar que o índice apoptótico elevado indica menores chances de diferenciação tumoral nos carcinomas, enquanto que um maior número de NORs totais e células expressando NORs acima da média, e uma maior fração de crescimento, determinam maiores chances de proliferação celular anormal e maior diferenciação tumoral.
Introduction: Occurrence of apoptosis and expression of proliferative markers are powerful tools to establish a prognosis in the follow-up of cancer.
Objective: To evaluate the growth fraction in papillomas and laryngeal squamous cell carcinomas with three degrees of differentiation through apoptosis and the expression of nucleolus organizer regions.
Methods: Retrospective study from which paraffin material was submitted to microtomy and hematoxylin-eosin and silver staining. Stained slides were used to quantify the apoptotic index and the number of nucleolus organizer regions by morphometry.
Results: Apoptosis was significantly more frequent in well differentiated carcinomas and in papillomas, and a higher growth fraction of expressed nucleolus organizer regions and cells that expressed a greater than average number of nucleolus organizer regions were more frequently noted in undifferentiated carcinomas.
Conclusions: Thus, it was possible to verify that a high apoptotic index was associated with a lower chance of tumor differentiation in carcinomas, while a greater number of total nucleolus organizer regions, cells expressing nucleolus organizer regions above average and a higher growth fraction were associated with greater likelihood of abnormal cell proliferation and increased tumor differentiation.
Introdução
Em todo o mundo, os carcinomas de cabeça e pescoço são o quinto em incidência, acometendo principalmente homens, tabagistas e etilistas, e as regiões da laringe e cavidade oral.1 Estima-se que o Brasil apresentou mais de 6.000 novos casos de carcinoma de laringe em 2012, sendo considerado o segundo tumor de maior ocorrência do trato respiratório no mundo e o mais comum entre os diversos tipos de câncer de cabeça e pescoço, representando 2% do total de neoplasias malignas.2
Vários estudos demonstraram que o número de regiões organizadoras de nucléolo coradas pela prata (AgNORs) em células neoplásicas malignas é frequentemente maior do que em células neoplásicas benignas ou, ainda, em células normais.3,4
Rüschoff et al.5 concluíram que a avaliação orientada do padrão das AgNORs facilita a compreensão da biologia celular, visto que o número e a área de pontos dissociados das AgNORs estão principalmente relacionados à taxa de proliferação e diferem acentuadamente entre as linhagens celulares, nos vários graus de diferenciação, independentemente do tipo e do tamanho dos agregados das AgNORs na célula. Com isso, a relação entre a quantificação das AgNORs na interfase e a proliferação celular tem sido largamente investigada em tumores humanos, pela comparação de parâmetros relativos de AgNORs na interface com os marcadores de proliferação celular comumente usados em patologia tumoral.4
Antonangelo et al.6 verificaram a relação entre a expressão das regiões organizadoras de nucléolo coradas pela prata (AgNORs) e o tempo de sobrevivência em pacientes com carcinoma de células escamosas de pulmão, e concluíram que a expressão das AgNORs era menor em tumores em estágio inicial, assim como aqueles que expressavam alto grau histológico apresentavam maior quantidade de AgNORs e menor taxa de sobrevida. Esses resultados encorajaram o uso da técnica de AgNORs no prognóstico de câncer pulmonar.
Rüschoff et al.,5 trabalhando com células normais e neoplásicas do sistema urinário, mostraram que o tamanho dos agregados de AgNORs está relacionado à diferenciação das células, sendo que os maiores agregados de AgNORs foram observados em tumores mais diferenciados.
Lorand-Metze & Metze,7 procurando estabelecer uma correlação entre o padrão de coloração das AgNORs em leucemia linfocítica crônica (LLC) e a cinética tumoral, concluíram que a porcentagem de linfócitos circulantes com aglomerado de AgNORs poderia ser utilizada como parâmetro da cinética deste tumor, ajudando a diferenciar pacientes com a enfermidade nas fases estável e progressiva e classificando corretamente 94% dos pacientes. Para propósitos práticos, um valor de mais de 13% de células com aglomerados de AgNORs é sugestivo de enfermidade progressiva.
Casos de carcinoma de células escamosas da cavidade oral tiveram prognóstico estabelecido utilizando-se a quantificação do número de AgNORs, apesar da sobreposição entre os valores individuais. A média de AgNORs foi maior para as lesões com um prognóstico desfavorável e com característica mais agressiva.8
A partir disso, as AgNORs têm sido amplamente utilizadas como marcadores de proliferação celular, apresentando bom valor diagnóstico e prognóstico em patologia tumoral.9-11
Estudos recentes têm descrito a ocorrência de apoptose em vários tipos de carcinomas humanos, sendo as neoplasias mais indiferenciadas as que usualmente apresentam o menor índice apoptótico.12,13 Assim, o processo de apoptose parece guardar uma relação de proximidade com um bom prognóstico para o paciente com neoplasias epiteliais na laringe.
Neste contexto, os objetivos do presente estudo foram: (a) determinar o índice apoptótico; (b) determinar o número de AgNORs; e (c) avaliar a fração de crescimento de neoplasias epiteliais malignas e benignas da região da laringe.
Método
Para a realização desta pesquisa, foi conduzido um estudo de coorte histórica com corte transversal. As amostras foram obtidas de pacientes submetidos a tratamento cirúrgico de tumores laríngeos durante o período compreendido entre os anos de 1989 a 2002. Todo o material utilizado foi prima-riamente colhido no hospital por médicos, com finalidades diagnósticas e terapêuticas, não se aventando, na época, a possibilidade desta pesquisa. A mesma foi realizada durante o período compreendido entre os anos de 2002 a 2004, não havendo, nesta época, uma resolução que estabelecesse diretrizes para o uso de material biológico em pesquisas. Foi a partir de 2005, com a resolução 347/05, que foram estabelecidas normas para regulamentar o armazenamento e a utilização de material biológico humano no âmbito de projetos de pesquisa. A resolução 441/11 é uma versão atualizada da resolução 347/05, onde o artigo 15º mantém praticamente as mesmas disposições da versão anterior; portanto, como este estudo foi realizado anteriormente a esta resolução, não foram necessárias estas determinações, segundo o próprio Comitê de Ética em Pesquisa.
Inicialmente, foi realizado um levantamento de dados do arquivo hospitalar, com o objetivo de listar indivíduos com neoplasias laríngeas benignas e malignas. Foram encontrados 142 pacientes, entre os quais foram selecionados 40, cujo material emblocado em parafina encontrava-se em melhor estado de conservação. O restante foi desconsiderado devido à alta incidência de carcinomas moderadamente diferenciados, não se justificando excessos na amostragem já obtida como representativa.
Não foram considerados como critérios de seleção sexo, raça ou idade. Assim, com base apenas no diagnóstico histopatológico, os pacientes foram divididos em grupos, sendo os carcinomas caracterizados, conforme o grau de ceratinização, como: bem diferenciados (grau I – quatro casos), mode-radamente diferenciados (grau II – 16 casos) e indiferenciados (grau III – 14 casos). Os tumores benignos (seis casos) foram caracterizados como papilomas. Lesões bem diferenciadas são aquelas em que se observa a ceratinização individual das células e a formação de numerosas pérolas córneas ou de ceratina, de tamanho variável; quando há grupos de células invadindo ativamente o tecido conjuntivo. Lesões moderadamente diferenciadas preservam, em parte, as características do epitélio normal, com as células já apresentando formas alteradas. Lesões pouco diferenciadas são aquelas em que a semelhança com o epitélio pavimentoso é menos acentuada. A forma característica das células pode estar alterada, bem como a disposição típica entre as mesmas. As células apresentam variação no tamanho, na capacidade tintorial e na capacidade de executar a função de uma célula pavimentosa, que é a formação de ceratina. São diferentes, pleomórficas, com perda de coesão e apresentam figuras mitóticas numerosas e atípicas.
Para analisar o grau histológico e o índice apoptótico, as amostras incluídas em parafina foram seccionadas a 4 μm e coradas em Hematoxilina-Eosina (HE). Outros cortes foram submetidos à impregnação pela prata para posterior quantificação do índice de proliferação celular pela contagem das NORs. Os cortes foram desparafinados, reidratados em ál-cool absoluto, 70% e 50% e lavados em água deionizada. Os cortes foram corados pela técnica de Ploton et al.,14 modificada por Aubele et al.15 A impregnação pela prata foi feita por duas soluções previamente preparadas: solução A (solução aquosa de nitrato de prata a 50%) e solução B (ácido fórmico a 1% contendo 2 g de gelatina incolor). As soluções A e B foram misturadas na proporção de 2:1, no momento da incubação dos cortes. A incubação foi realizada em câmara úmida e escura a 37 ºC, durante 20 minutos. Posteriormente, os cortes foram lavados com água deionizada por 15 minutos e desidratados em álcool 70% e álcool absoluto, diafanizados em xilol e montados com Entelan.16
Uma lâmina de cada grupo (papilomas; carcinomas de grau I, II e III) foi selecionada para a determinação do número mínimo de campos para o cálculo do índice apoptótico. Em cada lâmina, foi analisado o maior número de campos possíveis (em objetiva de 403) e registrados os índices apoptóticos, isto é, o número de células em apoptose no campo dividido pelo número total de células no mesmo campo. As imagens foram geradas por um microscópio conectado a uma câmera e transferidas para uma placa digitalizadora no computador, onde se fazia a morfometria utilizando um programa específico (Kontron KS 300 versão 2.0). O número mínimo representativo de campos microscópicos, para quantificar a apoptose nessas lesões, foi obtido pela análise de instabilidade do coeficiente de variação.17 Dos campos avaliados, foram obtidos valores médios para amostras múltiplas de cinco campos aleatórios até se atingir o número total de campos por lâmina. Esses valores médios foram considerados como unidades experimentais e usados na análise estatística dos dados. Os desvios-padrão (DPs) e coeficientes de variação de cada tamanho amostral foram diminuindo à medida que o número de campos considerados aumentou, até ocorrer uma estabilização. Esta estabilização ocorreu quando foram atingidos 10 campos por lâmina para os papilomas e 30 para os carcinomas de todos os graus.
Em seguida, foi selecionada uma lâmina de cada grupo (papilomas; carcinomas de grau I, II e III), sendo analisado o maior número de campos possíveis (em objetiva de 1003) e registrados os números de NORs totais, isto é, o número de grumos por núcleo no campo dividido pelo número total de núcleos no mesmo campo, utilizando-se o mesmo método e equipamento citados anteriormente. A estabilização ocorreu quando foram atingidos 10 campos por lâmina para os papilomas e 15 para todos os graus de carcinomas.
Para a análise do índice apoptótico (n.º de células apoptóticas/n.º total de células 3 100), as células foram observadas por um único pesquisador, tendo sido contadas apenas aquelas que apresentavam pelo menos três das seguintes características morfológicas peculiares ao processo: (1) anoiquia (presença de halo claro pericelular); (2) condensação do cito-plasma; (3) condensação nuclear (crescentes); (4) fragmentação nuclear; (5) fragmentação celular (corpos apoptóticos); (6) fagocitose dos corpos apoptóticos (“canibalismo celular”). As áreas de necrose foram excluídas. Foram contadas, em uma área total correspondente a 53.333,4 μm2, as células em processo de apoptose e, posteriormente, todas as células do epitélio, em um total de 10 campos para os papilomas e 30 campos para todos os graus de carcinoma.
Para a análise do índice de proliferação celular (n.º de NORs/n.º total de núcleos 3 100), foram contadas, em uma área total correspondente a 8.533,37 μm2, as NORs presentes em cada núcleo e, paralelamente, o número total de núcleos do epitélio, num total de 10 campos para os papilomas e 15 para todos os graus de carcinoma. A razão entre o número de células expressando AgNORs acima da média e o índice apoptótico foi considerado como a fração de crescimento para cada tipo de tumor.
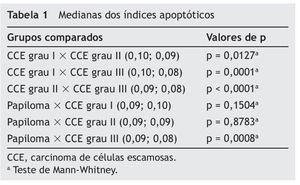
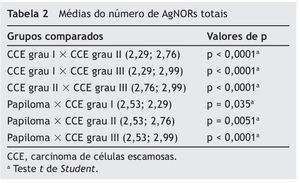
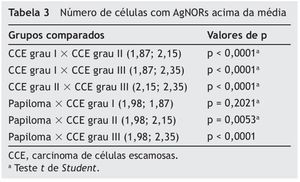
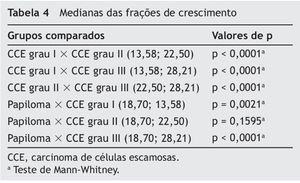
Médias ou medianas foram obtidas para os parâmetros morfométricos estudados a fim de caracterizar os grupos. Num primeiro momento, verificou-se a normalidade dos dados por meio do teste Kolmogorov-Smimov. Quando a distribuição foi normal, utilizou-se o teste paramétrico t de Student para comparar as médias das diferentes lesões. Quando a distribuição dos dados não demonstrou normalidade, utilizou-se o teste não paramétrico de Mann-Whitney para comparar as medianas das diferentes lesões. Todos os dados foram analisados com o nível de significância de 0,05 por meio do programa GraphPad Prism 3.0.
Resultados
Das 40 amostras selecionadas, 34 eram de pacientes com carcinoma laríngeo, sendo que 28 eram homens (82,35%) e seis eram mulheres (17,65%), e a média de idade foi de 59,5 anos. O restante das amostras era composto de pacientes com papiloma laríngeo, sendo quatro homens (66,66%) e duas mulheres (33,34%), e a média de idade correspondia a 36 anos.
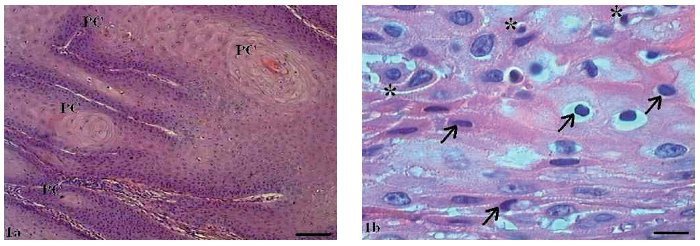
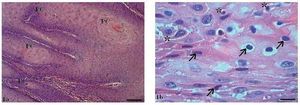
Histologicamente, no carcinoma de células escamosas (CCE) grau I, observou-se um número variado de pérolas de ceratina espalhadas pelo tecido (fig. 1A), além de ceratinizações intracelulares isoladas.
Figura 1 Carcinoma de células escamosas grau I. (1A) Micrografia de carcinoma de células escamosas grau I, com presença de pérolas córneas (PC) difusas (HE, barra = 100 μm). (1B) Micrografia de carcinoma de células escamosas grau I, com várias células em apoptose com condensação do citoplasma (setas) e anoiquia (*) (HE, barra = 10 μm).
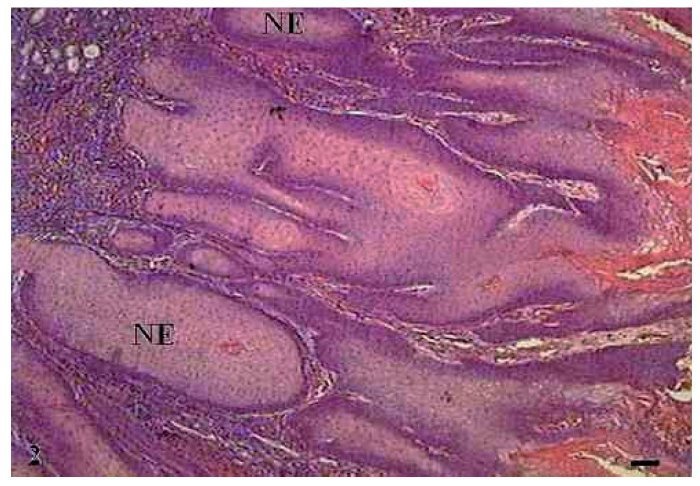
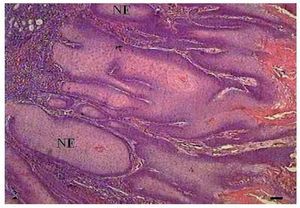
Notou-se a presença de várias células em apoptose dispersas no tumor com condensação do citoplasma e anoiquia (fig. 1B). O pleomorfismo celular variou entre discreto e moderado e o tamanho dos núcleos apresentou pequena alteração. Embora houvesse invasão do tecido conjuntivo adjacente pelas células tumorais, as bordas dos cordões e ninhos epiteliais eram bem delimitadas (fig. 2).
Figura 2 Carcinoma de células escamosas grau I. Micrografia de carcinoma de células escamosas grau I, com invasão do tecido conjuntivo pelas células tumorais sob a forma de ninhos epiteliais (NE) bem delimitados (HE, barra = 100 μm).
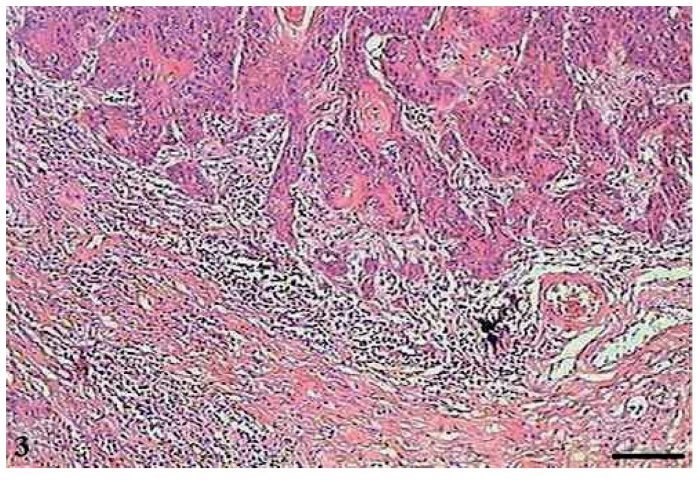
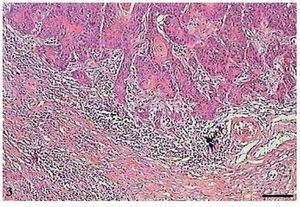
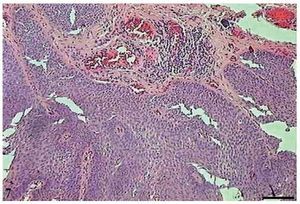
No CCE grau II, observou-se menor número de pérolas córneas e maior invasão do tecido conjuntivo pelas células tumorais (fig. 3). As mitoses eram frequentes, muitas das quais atípicas. Células apoptóticas com condensação do citoplasma e anoiquia (fig. 4) encontravam-se dispersas no tecido tumoral, no entanto, em menor quantidade do que no CCE grau I.
Figura 3 Carcinoma de células escamosas grau II. Micrografia de carcinoma de células escamosas grau II, com infiltração do tecido conjuntivo pelas células tumorais (HE, barra = 100 μm).
Figura 4 Carcinoma de células escamosas grau II. Micrografia de carcinoma de células escamosas grau II com presença de células apoptóticas com condensação do citoplasma (setas) e anoiquia (*) (HE, barra = 10 μm).
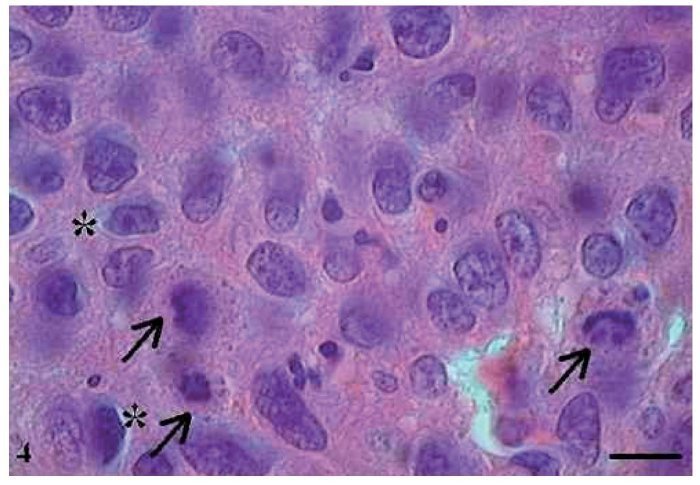
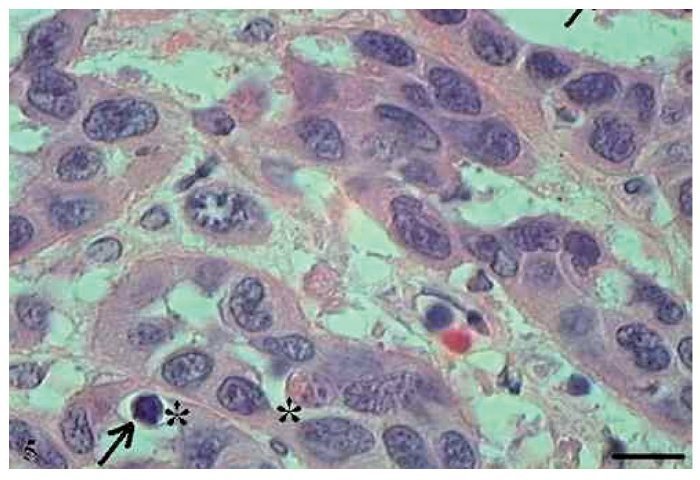
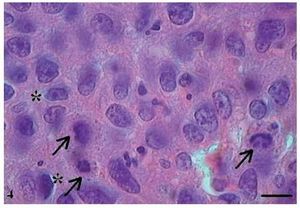
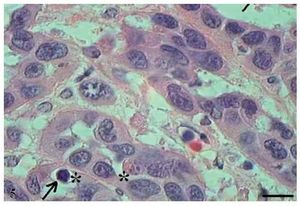
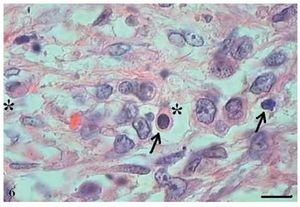
No CCE grau III, o pleomorfismo e atipias celulares eram intensos, os núcleos apresentaram-se aumentados de tamanho, observou-se hipercromasia nuclear e aumento da relação núcleo/citoplasma (fig. 5). As células apresentaram perda de coesão e invadiram o tecido conjuntivo e áreas mais profundas, como os tecidos muscular e glandular. Praticamente não foram observadas células com ceratinização intracelular, e a formação de pérolas de ceratina foi inexistente. Poucas células estavam em apoptose, com condensação do citoplasma e anoiquia (fig. 6), ocorrendo sem um padrão definido de localização e também em células epiteliais isoladas que se encontravam no estroma.
Figura 5 Carcinoma de células escamosas grau III. Micrografia de carcinoma de células escamosas grau III com células apoptóticas com hipercromasia nuclear (setas) (HE, barra = 10 μm).
Figura 6 Carcinoma de células escamosas grau III. Micrografia de carcinoma de células escamosas grau III com presença de poucas células apoptóticas com condensação do citoplasma (setas) e anoiquia (*) (HE, barra = 10μm).
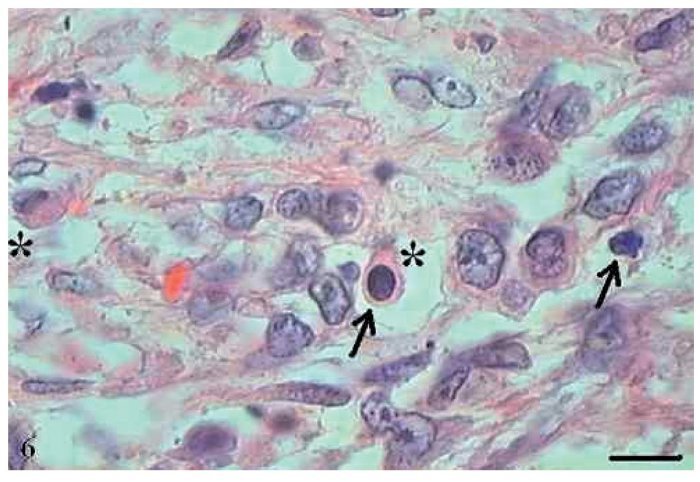
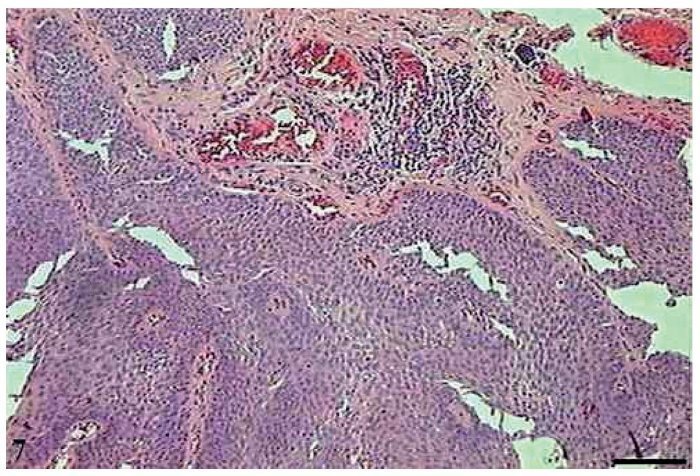
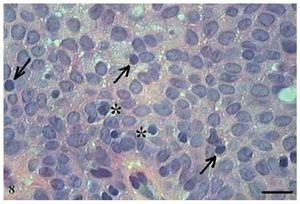
O papiloma apresentou projeções exofíticas (fig. 7). Cada projeção apresentou-se revestida por epitélio estratificado pavimentoso ceratinizado, com hiperceratose e células sustentadas por uma parte central de tecido conjuntivo com vasos sanguíneos. Além disso, observou-se, nas projeções digitiformes do papiloma, a presença de células em apoptose com condensação do citoplasma e anoiquia (fig. 8). As células em apoptose distribuíam-se mais frequentemente na camada basal e espinhosa.
Figura 7 Papiloma. Micrografia de papiloma com projeções exofíticas estendendo-se abaixo da superfície da mucosa (HE, barra = 100 μm).
Figura 8 Papiloma. Micrografia de papiloma com células em apoptose com condensação do citoplasma (setas) e anoiquia (*) (HE, barra = 10 μm).
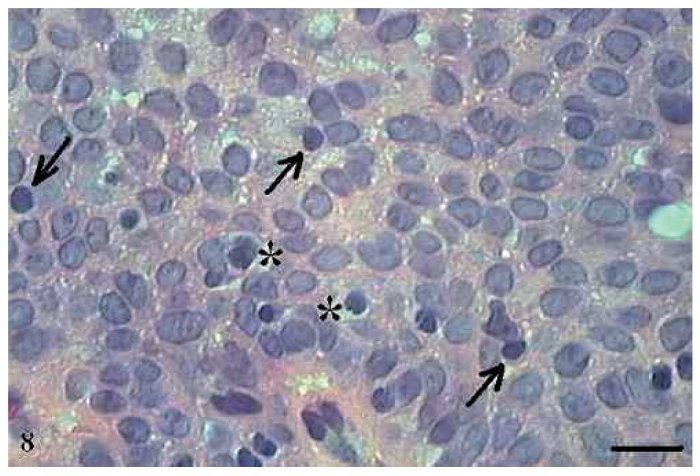
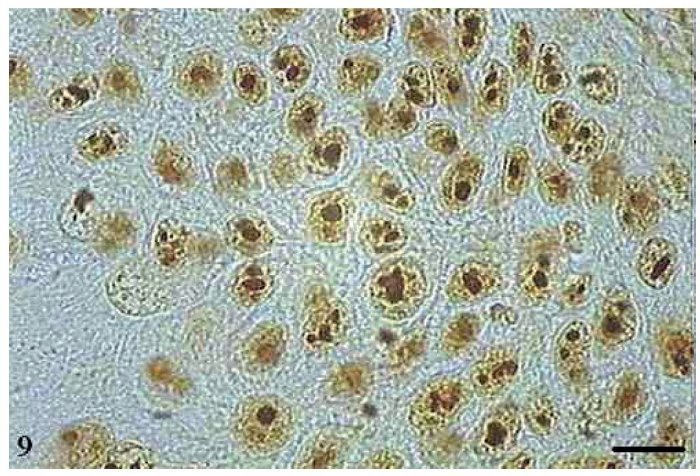
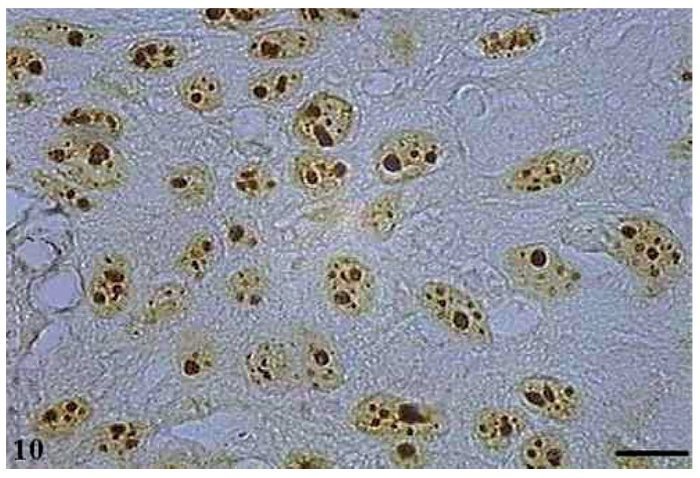
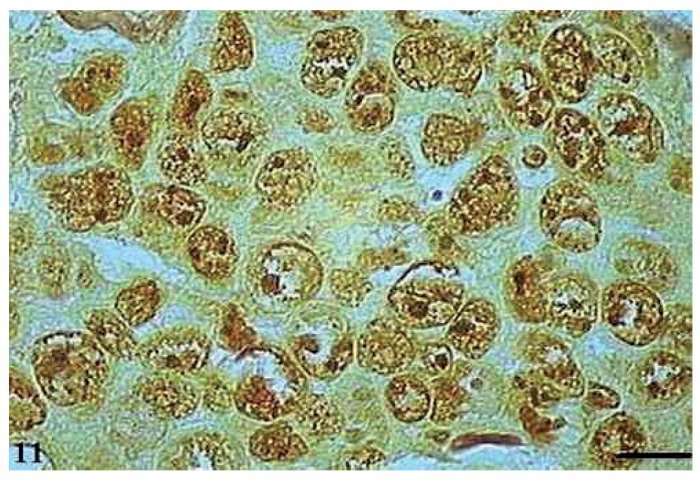
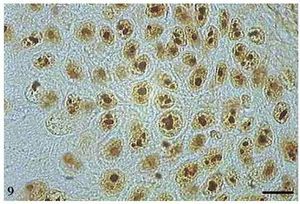
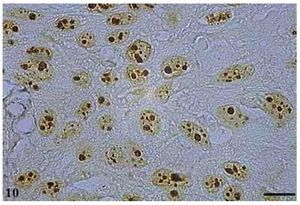
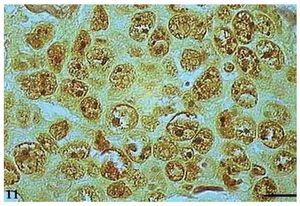
As AgNORs foram identificadas nos diversos tipos de tumor como grumos amarronzados ou pretos, com forma, tamanho e distribuição variados. No CCE grau I, as AgNORs apresentavam-se como grumos isolados ou constituindo agregados, com formas arredondadas ou irregulares, preenchendo todo o nucléolo ou dispersas no núcleo como satélites (fig. 9). No CCE grau II, observou-se a presença de AgNORs constituindo grumos arredondados, preenchendo todo o nucléolo ou como pequenos satélites espalhados por todo o núcleo (fig. 10). Já no CCE grau III, as AgNORs apresentavam-se formando grumos escuros, unidos e irregulares, ocupando praticamente todo o nucléolo ou isolados como satélites nos grandes núcleos (fig. 11).
Figura 9 Carcinoma de células escamosas grau I com AgNORs. Micrografia de carcinoma de células escamosas grau I com AgNORs sob a forma de grumos isolados ou constituindo grandes agregados, com formas arredondadas ou irregulares preenchendo todo o nucléolo ou presentes no núcleo como satélites (AgNOR, barra = 10 μm).
Figura 10 Carcinoma de células escamosas grau II com AgNOR. Micrografia de carcinoma de células escamosas grau II contendo AgNORs constituindo grumos arredondados preenchendo todo o nucléolo ou como pequenos satélites espalhados pelo núcleo (AgNOR, barra = 10 μm).
Figura 11 Carcinoma de células escamosas grau III com AgNORs. Micrografia de carcinoma de células escamosas grau III com AgNORs formando grumos escuros e unidos ocupando todo o nucléolo ou isolados como pequenos satélites nos grandes núcleos (AgNOR, barra = 10 μm).
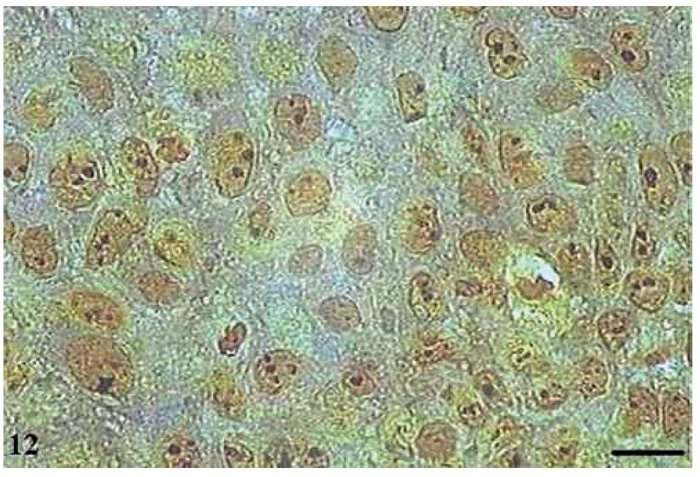
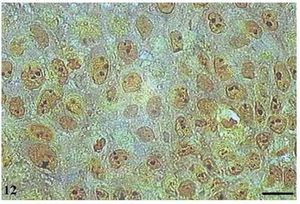
No papiloma, as AgNORs apresentaram-se de forma semelhante às encontradas no CCE grau I, formando pequenos grumos isolados ou como agregados, presentes como satélites no núcleo ou ocupando todo o nucléolo (fig. 12).
Figura 12 Papiloma com AgNORs. Micrografia de papiloma com AgNORs formando pequenos grumos presentes como satélites no núcleo ou ocupando todo o nucléolo (AgNOR, barra = 10 μm).
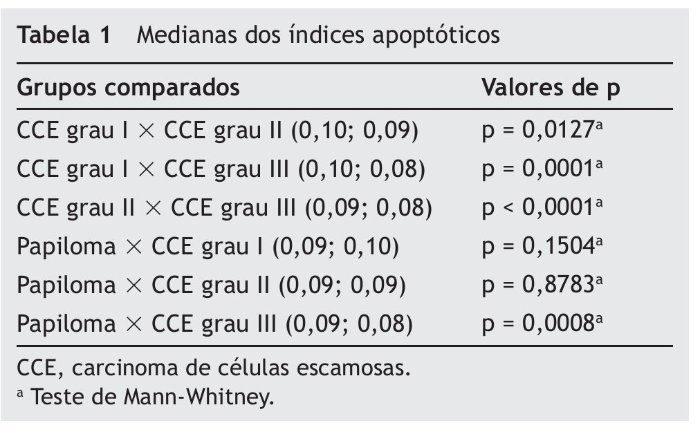
Em relação ao índice apoptótico, o CCE grau I apresentou maior índice quando comparado com o CCE grau II (p = 0,0127) e III (p < 0,0001), mas não com o papiloma (p = 0,1504). O CCE grau II apresentou maior índice apoptótico quando comparado com o de grau III (p < 0,0001), mas não houve diferença significativa em relação ao papiloma (p = 0,8783). Finalmente, o CCE grau III, quando comparado com o papiloma, apresentou menor índice apoptótico (p = 0,0008) (tabela 1).
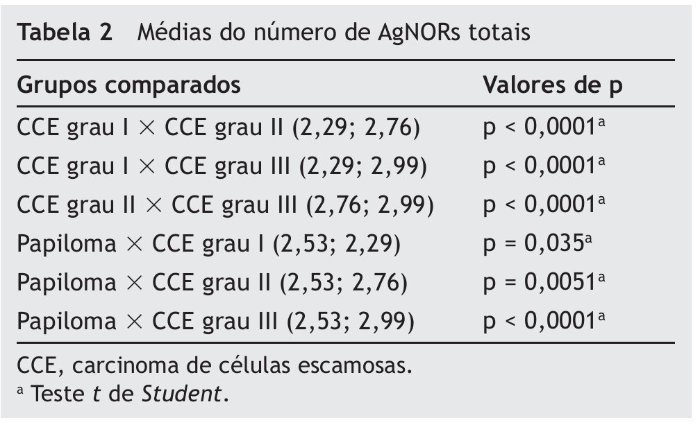
O número de AgNORs totais por campo no papiloma foi significativamente maior em comparação ao CCE grau I (p = 0,035) e significativamente menor em comparação ao CCE grau II (p = 0,0051) e III (p < 0,0001). O CCE grau I apresentou menor número de AgNORs totais por campo, quando comparado com o CCE grau II (p < 0,0001) e com o CCE grau III (p < 0,0001). Da mesma forma, o CCE grau II apresentou menor média de AgNORs totais por campo em relação ao CCE grau III (p < 0,0001) (tabela 2).
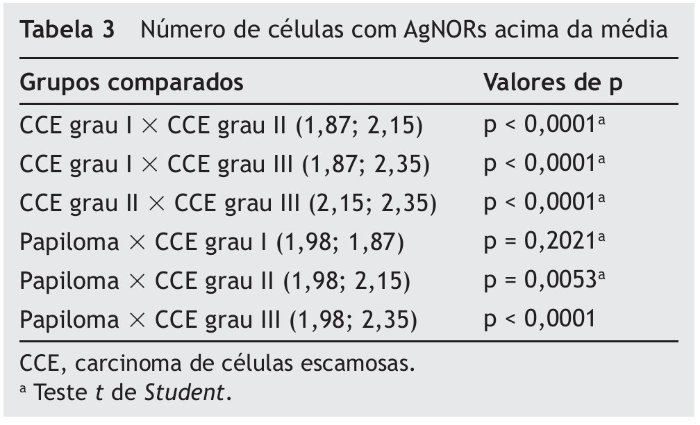
A tabela 3 mostra as comparações do número de células que expressam AgNORs acima da média por campo entre os diferentes grupos de tumores. Não houve diferença significativa entre os grupos papiloma e CCE grau I (p = 0,2021). O número de células que expressam AgNORs acima da média no papiloma foi menor que no CCE grau II (p = 0,0053) e III (p < 0,0001). O CCE grau I apresentou um número menor de células expressando AgNORs acima da média que o CCE grau II (p < 0,0001) e o CCE grau III (p < 0,0001). Da mesma forma, o CCE grau II apresentou um número menor de células expressando AgNORs acima da média em relação ao CCE grau III (p < 0,0001).
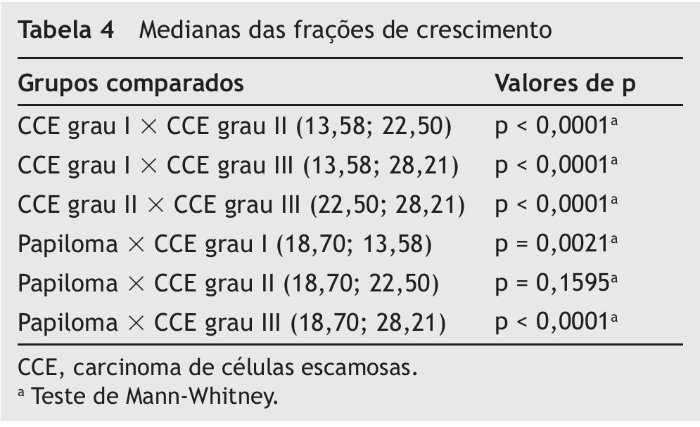
As comparações da fração de crescimento (número de células expressando AgNORs acima da média por campo/índices apoptóticos) entre os diferentes tipos de tumores estão apresentadas na tabela 4. O CCE grau III apresentou maior fração de crescimento quando comparado com os demais tipos de tumores (p < 0,0001). O CCE grau II apresentou maior fração de crescimento que o CCE grau I (p < 0,0001), mas não houve diferença significativa com o papiloma (p = 0,1595). O papiloma apresentou maior fração de crescimento quando comparado com CCE grau I (p = 0,0021).
Discussão
Em neoplasias malignas, a massa celular pode ser reduzida através da apoptose e da necrose, portanto, uma desregulação ou interrupção na via apoptótica permitirá o desenvolvimento desses tumores.18 A apoptose é a única forma de morte celular encontrada em todos os estágios do crescimento do tumor, o que poderia explicar, satisfatoriamente, a grande taxa de perda celular que ocorre nas neoplasias.19 Em tumores de crescimento rápido, observa-se que a apoptose e a mitose estão numericamente aumentadas. Cotter et al.20 observaram que a proporção de células apoptóticas para as células mitóticas, em tumores não tratados, é próxima de 1:1. No presente estudo, o índice apoptótico do CCE grau I atingiu o valor mais elevado. Esse fato poderia explicar o comportamento menos agressivo e a menor taxa de crescimento desse tumor. Apesar do papiloma numericamente apresentar um valor menor que o CCE grau I, não houve diferença significativa entre grupos. Portanto, os grupos CCE grau I e papiloma apresentaram índices apoptóticos similares. A literatura reporta que muitos tumores benignos apresentam índice apoptótico baixo.21 Tal resultado foi evidenciado em nosso estudo para o papiloma. Por outro lado, no CCE grau III, este índice também se apresentou baixo. Pode-se inferir que isso seria um fator a contribuir para a maior malignidade, tendência a metástases e maiores chances de crescimento tumoral observadas nesse tipo de tumor. Nossos resultados compartilham similaridades com os do estudo conduzido por Hamada et al.,22 que encontraram, em CCEs de esôfago, que os graus bem diferenciados e moderadamente diferenciados apresentaram altos índices apoptóticos quando comparados aos pouco diferenciados, sugerindo que a apoptose contribui para um bom prognóstico. Por outro lado, outros autores observaram, em graus avançados de tumor localizado na região supraglótica, que o alto índice apoptótico estava significativamente associado com baixa sobrevida e sugeriram que, no futuro, um alto grau de apoptose fosse utilizado para identificar pacientes com prognóstico ruim em câncer de laringe.23 Da mesma forma, Alcaide et al.24 relataram alto número de células apoptóticas em carcinomas colorretais quando comparados a adenomas e epitélio normal; o índice apoptótico também foi mais alto na doença metastática (estágio 4) do que em outros estágios. Tal assertiva não é respaldada pelos achados deste estudo, pois aqui o alto índice apoptótico relacionou-se a um grau histológico menor e a um prognóstico melhor.
Com relação ao número de AgNORs totais por campo, o CCE grau I apresentou o valor mais baixo, seguido pelo papiloma, CCE grau II e CCE grau III. O mesmo pôde ser observado com relação ao número de células expressando AgNORs acima da média por campo. Alguns estudos têm demonstrado que o número de AgNORs em células neoplásicas malignas é frequentemente maior do que em células neoplásicas benignas ou, ainda, em células normais.10,25-27 Em muitos tumores, a quantificação e a distribuição das AgNORs no núcleo e no nucléolo têm apresentado valor prognóstico significativo.28 Alguns autores encontraram que tumores com alto grau de malignidade apresentam maior número de AgNORs quando comparados aos tumores de baixo grau, o que corrobora com os achados do presente estudo.28-30
Evidências prévias reportam que a média de AgNORs em CCEs da cavidade oral e laríngea é maior nos tumores com um prognóstico desfavorável e com características mais agressivas, ou seja, menos diferenciados.28,31 Hanemann, Miyazawa & Souza28 declararam que o método de contagem de AgNORs é uma ferramenta diagnóstica útil para identificar diferentes tipos de neoplasias malignas escamosas orais e, também, um marcador prognóstico desses carcinomas, bem como permite diferenciar entre lesões pré-cancerosas, benignas e malignas. Para Underwood & Giri,32 as AgNORs dispersam-se pelo núcleo, em extensões variadas, facilitando a tarefa de mensuração. A quantificação das AgNORs é, dessa forma, dependente do grau de dispersão ou desagregação de um grande número relativo de NORs no núcleo. Logo, a chamada contagem histológica de NORs, em lesões benignas e malignas, demonstra não um número absoluto, mas sim um índice numérico de sua dispersão. Isto não impede e, necessariamente, não invalida a utilidade da contagem como fator discriminante para malignidade ou atividade transcricional.
Com relação à fração de crescimento, o CCE grau I apresentou o menor valor, sendo seguido pelo papiloma, CCE grau II e CCE grau III. Uma vez que o CCE grau I apresentou o maior índice apoptótico e o menor número de AgNORs acima da média, sua fração de crescimento foi a menor dos tumores malignos. O papiloma apresentou uma fração de crescimento ligeiramente maior do que o CCE grau I e ligeiramente menor do que o CCE grau II. No entanto, a diferença entre papiloma e CCE grau II não foi estatisticamente significativa. Já o CCE grau III apresentou uma fração de crescimento extremamente elevada, visto que seu índice apoptótico foi baixo e seu número de AgNORs acima da média foi elevado. Liu et al.33 respaldaram nossos achados ao afirmar que o grau de diferenciação em cânceres humanos geralmente reflete o grau de malignidade, onde o mais indiferenciado é considerado o mais agressivo, a partir da análise de carcinoma ovariano. Eles sugerem que microRNAs encontram-se desregulados e, portanto, superexpressos nestes tumores, provocando um aumento na taxa de proliferação celular.
Karki, Jha & Sayami34 encontraram AgNORs de formato irregular em células malignas de derrames pleurais e peritoniais, e AgNORs grandes e individuais em células benignas dos mesmos derrames. Arora et al.35 mostraram que o número de AgNORs por núcleo em CCEs de laringe parece aumentar à medida em que aumenta o grau de indiferenciação tumoral. Além disso, com o aumento do grau histológico, as NORs diminuem de tamanho e tornam-se mais irregulares. Em nosso estudo, observamos a presença de agregados maiores, arredondados, regulares e menos dispersos nos núcleos no CCE grau I e agregados menores e irregulares no CCE grau III. Portanto, nossos achados são similares aos descritos para neoplasias de laringe35 e células de derrames pleurais e peritoniais.34
Conclusões
O índice apoptótico elevado indica menores chances de diferenciação tumoral nos casos de carcinomas de células escamosas de laringe.
Quanto maior o número de AgNORs totais e de células expressando AgNORs acima da média, maiores são as chances de proliferação celular anormal, e menos diferenciado tende a ser o tumor.
Quanto maior a fração de crescimento definida como a razão entre o número de células expressando AgNORs acima da média e os índices apoptóticos, maiores são as chances de tratar-se de um tumor menos diferenciado.
Financiamento
Este estudo foi financiado por FAPEMIQ com suporte financeiro oferecido pela realização do projeto.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 14 de novembro de 2013;
aceito em 22 de julho de 2014
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2014.12.003
☆ Como citar este artigo: Ribeiro CV, Vasconcelos AC, Andrade Filho JS. Apoptosis and expression of argyrophilic nucleolus organizer regions in epithelial neoplasms of the larynx. Braz J Otorhinolaryngol. 2015;81:158-66.
☆☆ Instituição: O projeto foi desenvolvido no Instituto de Ciências Biológicas (ICB), Universidade Federal de Minas Gerais (UFMG); e na Escola de Medicina, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
☆☆☆ Caso clínico: Estudo retrospectivo de 40 casos de neoplasias epiteliais de laringe, com três graus de diferenciação tumoral.
* Autor para correspondência.
E-mail:christianavargas@yahoo.com.br (C.V. Ribeiro).