A proteína do grupo Box‐1 de alta mobilidade participa da patogênese da rinite alérgica. A ativação do inflamassoma pode mediar a liberação de proteína do grupo Box‐1 de alta mobilidade. O papel do inflamassoma ausente no melanoma 2 na rinite alérgica permanece incerto.
ObjetivoInvestigar a função do inflamassoma ausente no melanoma 2 em um modelo murino de rinite alérgica e a interação entre a proteína do grupo Box‐1 de alta mobilidade e o inflamassoma ausente no melanoma 2.
MétodoUm modelo murino de rinite alérgica foi estabelecido com 20 camundongos Balb/c. A expressão dos componentes do inflamassoma ausente no melanoma 2, da proteína speck‐like associada à apoptose com CARD (Asc), da caspase‐1 p20 e do domínio de pirina da família NLR adicional com 3 (Nlrp3) foi detectada por western blotting durante a rinite alérgica. Alterações de inflamassoma ausente no melanoma 2, na caspase‐1 e na proteína do grupo Box‐1 de alta mobilidade após o teste de provocação com ovalbumina foram demonstradas por imuno‐histoquímica. O ensaio dUTP Nick‐End Labeling mediado por TdT, TUNEL e clivagem de caspase‐3 e PARP‐1 foram usados para a observação de piroptose.
ResultadosEosinofilia e infiltração de células caliciformes foram observadas na mucosa nasal de camundongos do grupo rinite alérgica. Inflamassoma ausente no melanoma 2, Asc e caspase‐1 p20 aumentou após a exposição à ovalbumina, enquanto Nlrp3 não aumentou. A proteína do grupo Box‐1 de alta mobilidade foi liberada na mucosa nasal de camundongos com rinite alérgica. As células TUNEL‐positivas aumentaram no epitélio e na lâmina própria, enquanto a clivagem da caspase‐3 e a PARP‐1 não foram observadas.
ConclusãoO inflamassoma ausente no melanoma 2 foi ativado e pode ocorrer piroptose na mucosa nasal após o tratamento com ovalbumina. Esses fatores podem contribuir para a translocação de proteína do grupo Box‐1 de alta mobilidade e o desenvolvimento de rinite alérgica.
A rinite alérgica (RA) é definida como um tipo de inflamação da mucosa nasal associada a uma resposta imune mediada por IgE contra alérgenos.1 Pacientes com RA geralmente apresentam sintomas de obstrução nasal, rinorreia, espirrros e prurido nasal.2 O distúrbio compromete consideravelmente os pacientes, na sua qualidade de vida, função cognitiva e autopercepção.3 Atualmente, a RA tornou‐se um importante problema de saúde pública mundial, afeta 10% a 20% da população adulta.4 Compreender a natureza da RA melhorará o atendimento aos pacientes que apresentam essa condição clínica.
É amplamente aceito que a proteína do grupo Box‐1 de alta mobilidade (HMGB1, do inglês High Mobility Group Box 1), uma proteína expressa de maneira onipresente, desempenha vários papéis em processos fisiológicos e patológicos.5 A HMGB1 foi originalmente descrita como uma importante proteína da cromatina,6 mas agora é conhecida por ter diferentes funções com base na expressão específica do compartimento.7 Quando a HMGB1 é liberada em um local extracelular, faz a mediação da ativação da resposta imune inata como um fator pró‐inflamatório.8 Nosso estudo anterior demonstrou que a HMGB1 aumentou na mucosa nasal e foi translocada após a exposição à ovalbumina (OVA) em um modelo de RA murino. A inibição da HMGB1 pelo piruvato de etila exerceu um efeito terapêutico na RA.9 Entretanto, o mecanismo de liberação da HMGB1 na RA permanece incerto.
A HMGB1 pode ser liberada passivamente de células que estão morrendo,10 bem como ser ativamente secretada por células inflamatórias, como macrófagos, monócitos, células dendríticas e células natural‐killer.11 Foi demonstrado que várias vias estão relacionadas à liberação de HMGB1, como a ativação do inflamassoma mediada pela proteína quinase ativada por RNA de fita dupla (PKR)12 e a translocação nuclear mediada pela manutenção da região cromossômica 1.13 Recentemente, uma série de estudos revelou que a caspase‐1 poderia agir como um potencial alvo terapêutico na RA com o uso de vários agentes protetores,14–16 sugeriu que o inflamassoma pode ser ativado após exposição ao alérgeno. A ativação do inflamassoma leva à piroptose e resulta em morte celular,17 que então faz a mediação da liberação de HMGB1.18 Entretanto, há falta de estudos sobre qual subfamília do inflamassoma é ativada na RA. A montagem de um complexo de inflamassoma é iniciada pelo domínio de ligação de nucleotídeos, receptor do tipo Nod (NLR, do inglês Nod‐like receptor) ou ausente no melanoma 2 (AIM2) após o reconhecimento de padrões moleculares associados a patógenos (PAMPs) ou padrões moleculares associados a danos (DAMPs).19 Os NLRs ou AIM2 ativados podem recrutar a proteína speck‐like associada à apoptose que contém um domínio de recrutamento de caspase (ASC) para fazer a ativação da caspase‐1.20 Demonstrou‐se que Nlrp3 e AIM2 são up‐reguladas na patogênese de doenças das vias aéreas superiores, como rinossinusite aguda e crônica.21,22
Nossa hipótese é que o inflamassoma é ativado na mucosa nasal de camundongos por meio da exposição à OVA e que a piroptose pode ocorrer após a ativação do inflamassoma. Para testar essa hipótese, estabelecemos um modelo murino de RA e investigamos a ativação do inflamassoma na RA.
MétodoAnimaisVinte camundongos BALB/c machos do tipo selvagem entre 6 e 8 semanas foram usados no estudo. Os camundongos foram alojados em instalações específicas para animais, livres de patógenos e divididos aleatoriamente em dois grupos – controle e RA – com 10 ratos em cada. Seis camundongos de cada grupo foram usados para análise da expressão da proteína e os camundongos remanescentes foram usados para análise histológica e imuno‐histoquímica. Os experimentos foram conduzidos de acordo com as diretrizes dos institutos nacionais de saúde para o cuidado e uso de animais de laboratório e foram aprovados pelo comitê institucional de uso e cuidado de animais (número IACUC: S2372).
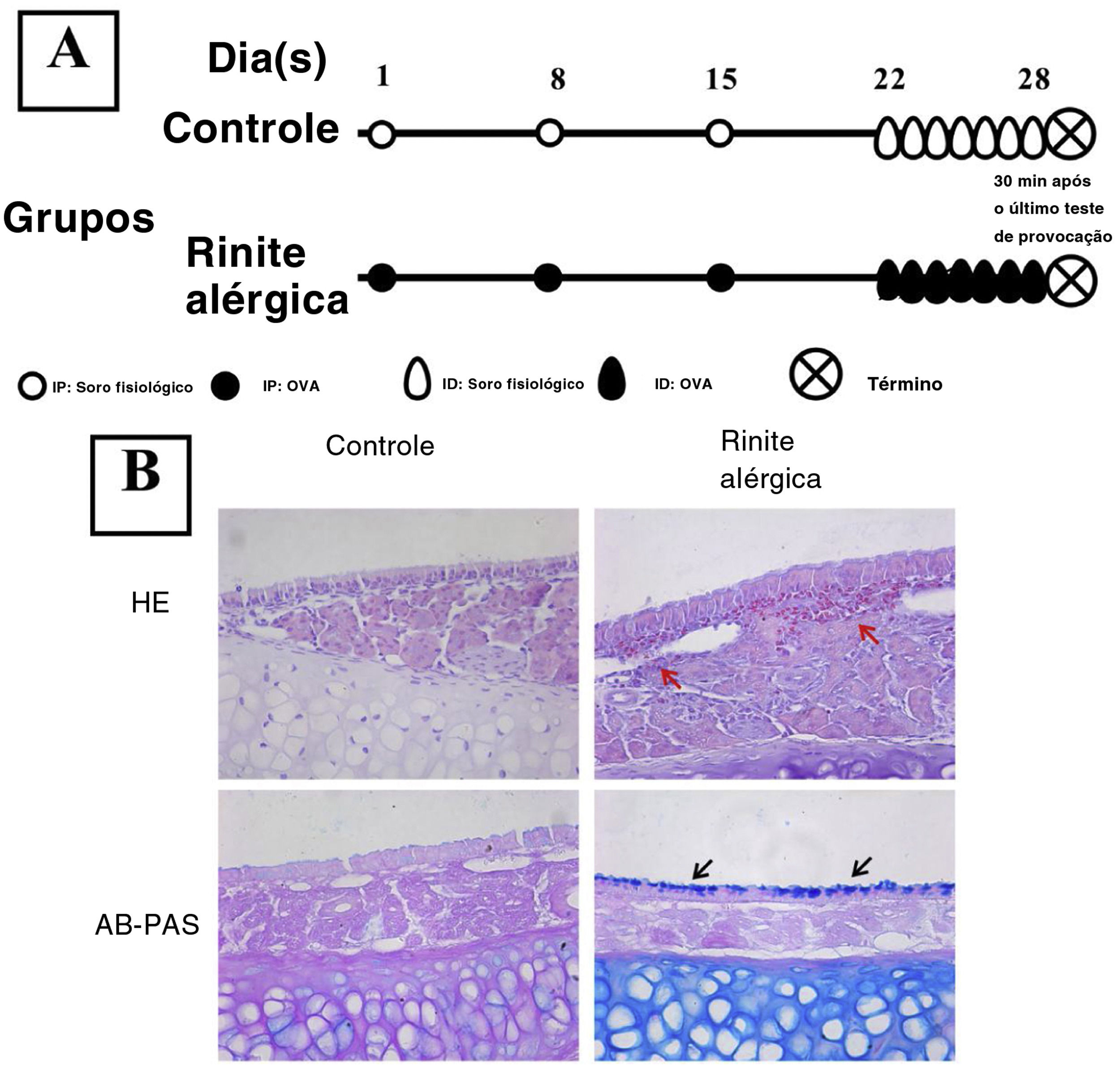
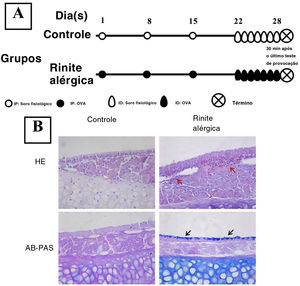
Estabelecimento de um modelo murino de rinite alérgicaO estabelecimento do modelo murino de RA foi feito como descrito anteriormente.9 O grupo experimental recebeu uma injeção intraperitoneal no 1°, 8° e 15° dias do estudo com 200μL de solução de PBS que continha 40μg de OVA (grau V; Sigma‐Aldrich; St. Louis, MO, EUA) e 2mL de hidróxido de alumínio, enquanto o grupo controle recebeu a mesma quantidade de solução de PBS. A partir do 22° dia, 500μg de OVA em 20μL de PBS foram inalados pelas cavidades nasais bilateralmente através de respiração normal diariamente durante uma semana (fig. 1) no grupo de RA, enquanto o grupo controle recebeu apenas solução salina.
Estabelecimento de um modelo murino de rinite alérgica (RA). Os camundongos do grupo RA foram sensibilizados através de injeção intraperitoneal (IP) de 40μg de OVA e 2μg de alumínio nos dias experimentais 1, 8 e 15 e foram submetidos a teste de provocação com OVA por inalação diária (ID) do dia 22 a 28 (A). A coloração H&E e a coloração AB‐PAS foram usadas para observar a infiltração eosinofílica e hiperplasia das células caliciformes. Infiltração evidente de eosinófilos (setas vermelhas) e aumento do número de células caliciformes (setas pretas) foram observados no grupo RA (B) em comparação com o grupo controle.
Quatro camundongos de cada grupo foram usados para a análise de ativação do inflamassoma e localização da HMGB1. Os camundongos foram submetidos à eutanásia com método humanitário após a anestesia e imediatamente decapitados. Os focinhos foram fixados com formaldeído a 4% por uma noite, descalcificados com ácido etilenodiaminotetracético‐2 Na a 10% em PBS por um mês, desidratados em uma série graduada de etanol e então incluídos em parafina. Finalmente, as amostras foram seccionadas em cortes de 5 um e coletadas.
Para a análise de expressão das proteínas, a análise imuno‐histoquímica foi feita com um REAL™ Envision™ Detection Kit (Dako, Glostrup, Dinamarca). Todos os procedimentos foram feitos de acordo com as instruções do fabricante. Após desparafinização e desidratação, as seções de tecido foram submetidas à recuperação do epítopo induzida pelo calor. Os tecidos foram incubados com H2O2 a 4% para bloquear as peroxidases endógenas após lavados por três vezes com PBS. Albumina de soro bovino foi usada para saturar qualquer excesso de sítios de ligação de proteína. As seções bloqueadas foram então incubadas com anticorpos anti‐AIM2 (diluição de 1: 200), caspase‐1 (diluição 1:50) ou HMGB1 (diluição 1: 250), a 4°C, por uma noite. No dia seguinte, um anticorpo secundário foi aplicado aos cortes por 1h em temperatura ambiente e as lâminas foram novamente lavadas três vezes com PBS após a incubação. Por fim, as lâminas foram contrastadas com hematoxilina e, em seguida, observadas em um microscópio ótico. Para observar a infiltração eosinofílica e a hiperplasia das células caliciformes, os cortes foram corados com hematoxilina e eosina (H&E) e coloração de Alcian blue e ácido periódico de Schiff (AB‐PAS), como descrito anteriormente.9
Ensaio dUTP Nick‐End Labeling mediado por TdT (TUNEL)O ensaio TUNEL foi feito com base nas instruções do fabricante. Após a desparafinização e desidratação, os cortes foram lavados três vezes com PBS e, em seguida, incubados com proteinase K dissolvida em solução de Tris‐HCl (20μg/mL, Ph 7,4) por 30min a 37°C. Depois de serem lavados mais três vezes com PBS, um volume de 50μL da mistura de reação do ensaio TUNEL que consistia em 48μL de solução de marcação e 2μL de solução de TdT foi adicionado às lâminas, que foram incubadas por 90min a 37°C, e os cortes foram novamente lavados três vezes com PBS. Finalmente, os cortes foram contrastados com DAPI e observados em um microscópio de fluorescência (Leica Microsystems Ltd., Wetzlar, Alemanha).
Análise de Western blotAs expressões proteicas de HMGB1 e os componentes dos inflamassomas foram analisados através de western blotting. A proteína total foi extraída das amostras da mucosa nasal com tampão de lise RIPA e as concentrações das proteína foram medidas pelo ensaio BCA. Os lisados de proteína foram separados em gel de poliacrilamida‐dodecil sulfato de sódio (SDS‐PAGE) a 12% e transferidos para membranas de difluoreto de polivinilideno (PVDF). As membranas foram bloqueadas por 1h com leite desnatado a 5% em solução salina tamponada com Tris que continha Tween (TBST) e incubadas durante a noite a 4°C com a diluição adequada de anticorpos primários: anti‐Nlrp3 (R&D Systems, Minneapolis, MN, EUA, diluído a 1:300), anti‐AIM2 (Abcam, Cambridge, MA, EUA, diluído a 1:1.000), anti‐Asc (Abcam, diluído a 1:1.000), anti‐caspase‐1 (Biovision, Milpitas, CA, EUA, 1:200) e anti‐β‐actina (Millipore, Billerica, MA, EUA, diluído a 1:3.000). Após a lavagem, as membranas foram incubadas por 1h à temperatura ambiente com o anticorpo secundário conjugado com HRP apropriado (diluído a 1:3.000). As bandas de proteína foram visualizadas com BeyoECL Plus (Beyotime, Haimen, Jiangsu, China) e o software Gel‐Pro analyzer 4.0 (Media Cybernetics, Inc., Rockville, MD, EUA) foi usado para quantificação relativa, com a β‐actina como controle interno.
Análise estatísticaTodos os resultados são expressos como média±DP. A análise estatística foi feita com o programa Statistical Package for the Social Sciences (SPSS, versão 18.0; SPSS Inc., Chicago, IL, EUA). O teste t de Student foi usado para analisar a expressão dos componentes do inflamassoma. Um valor de p <0,05 foi considerado estatisticamente significativo.
ResultadosEstabelecimento de um modelo de AR murinoA coloração H&E mostrou que numerosos eosinófilos infiltraram a mucosa nasal de camundongos RA, enquanto nenhuma célula inflamatória evidente foi observada em camundongos do grupo controle (fig. 1). Além disso, hiperplasia de células caliciformes também foi observada em camundongos RA.
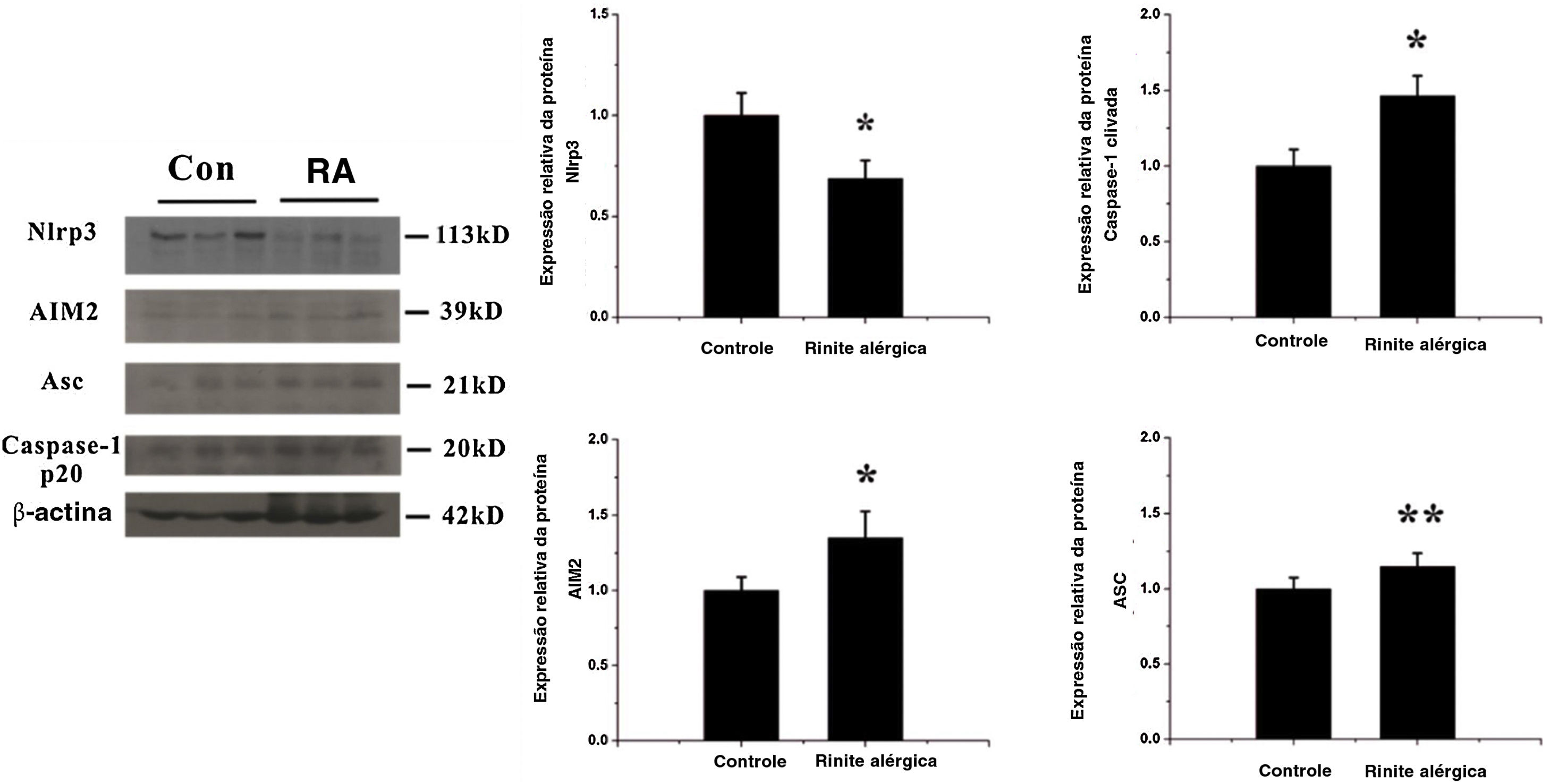
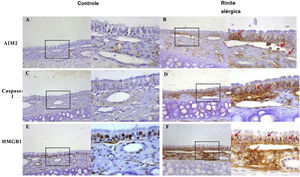
Ativação do inflamassoma AIM2Para detectar alterações na expressão dos componentes do inflamassoma na resposta das vias aéreas induzida por OVA, observamos a localização e a expressão dos componentes do inflamassoma com imuno‐histoquímica e western blotting. As expressões de AIM2, asc e caspase‐1 clivada aumentaram significativamente após a exposição à OVA (figs. 2 e 3).
Expressão de componentes do inflamassoma após estímulo com OVA. As expressões de dois receptores, Nlrp3 e AIM2, foram analisadas por western blotting. A expressão de Nlrp3 diminuiu enquanto a do AIM2 aumentou na mucosa nasal após a exposição a OVA, p <0,01. Enquanto isso, a expressão de outro componente do complexo do inflamassoma, Asc e os níveis de caspase‐1 clivada aumentaram, p <0,05 e 0,01, respectivamente (* p <0,01, ** p <0,05).
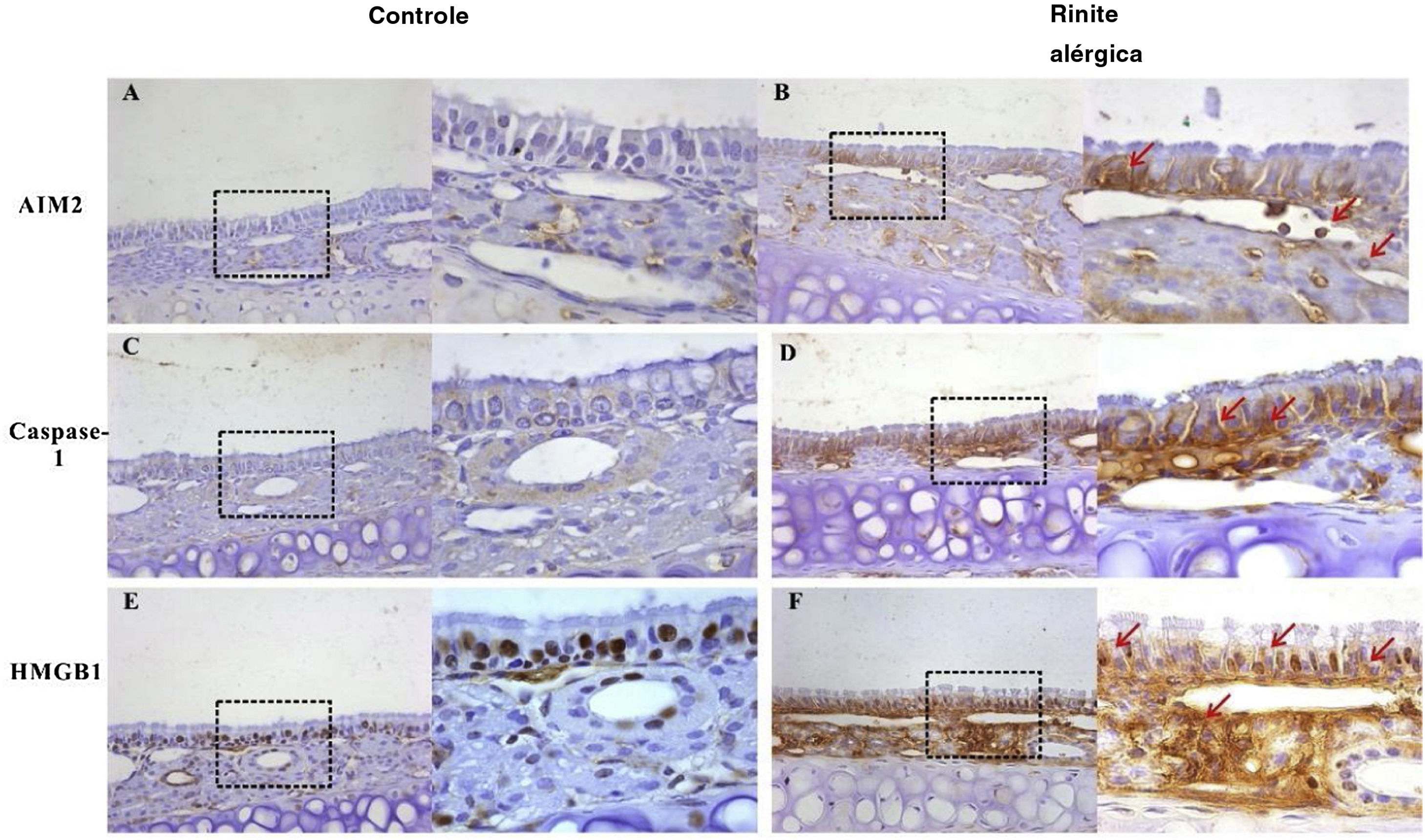
Expressão de AIM2, caspase‐1 e HMGB1 na mucosa nasal de camundongos. AIM2 e caspase‐1 foram raramente expressas na mucosa nasal do grupo controle (A, C). No entanto, após o estímulo com OVA, a expressão de ambas as proteínas foi up‐regulada no epitélio, lâmina própria e células inflamatórias infiltradas (B, D). A HMGB1 foi abundantemente expressa no epitélio e lâmina própria e localizada principalmente no núcleo da mucosa de camundongos controle (E). A expressão de HMGB1 aumentou significativamente na mucosa nasal de camundongos do grupo RA e a translocação da HMGB1 do núcleo para o citoplasma foi observada (F, setas vermelhas).
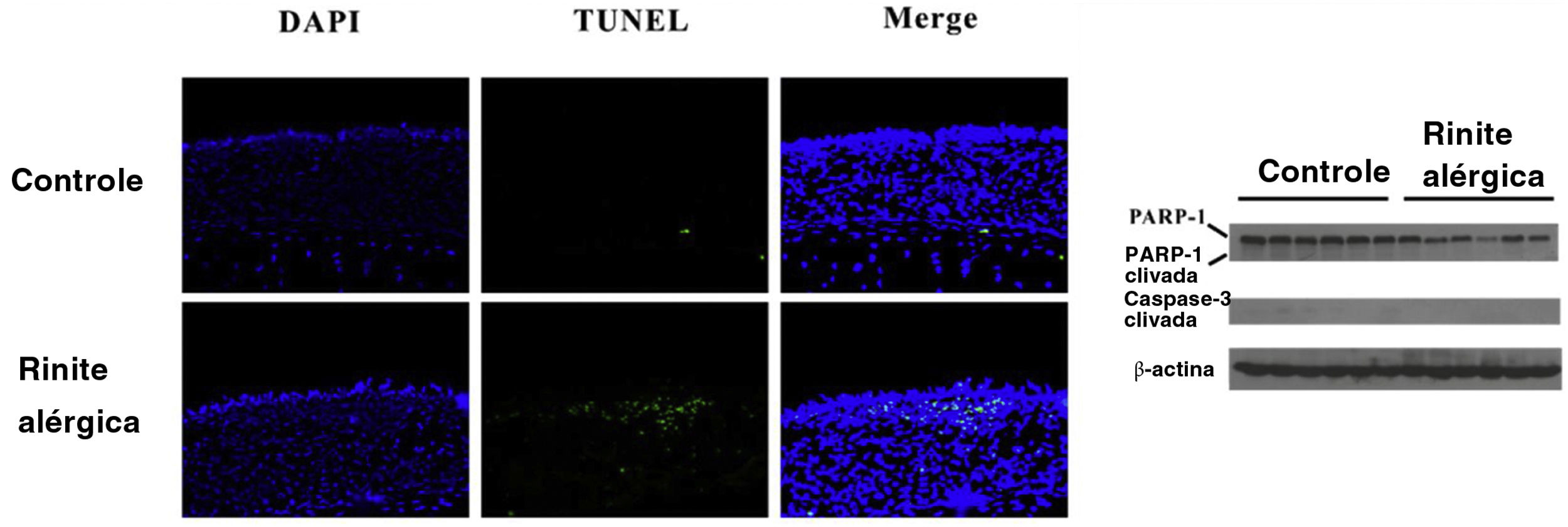
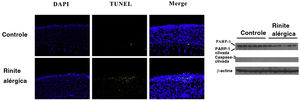
A HMGB1 pode ser liberada passivamente como resultado da piroptose celular. Fragmentos de DNA foram detectados com o ensaio TUNEL e confirmamos a clivagem de caspase‐3 e PARP‐1. Números aumentados de células TUNEL‐positivas foram encontrados no grupo RA, enquanto nenhuma diferença na clivagem da caspase‐3 ou PARP‐1 foi observada entre os dois grupos. A translocação de HMGB1 foi observada no grupo RA como resultado da ativação do inflamassoma (fig. 4).
Piroptose, mas não apoptose, pode ocorrer na rinite alérgica (RA) murina. O ensaio TUNEL mostrou que a fragmentação do DNA aumentou significativamente na mucosa nasal de camundongos do grupo RA. No entanto, não houve clivagem evidente da caspase‐3 e PARP‐1 foi encontrada no grupo RA.
Um modelo murino de RA induzida por OVA foi estabelecido com sucesso, caracterizado por inflamação das vias aéreas dominada por Th2. A eosinofilia e a hiperplasia de células caliciformes foram encontradas na mucosa nasal de camundongos RA. Além disso, a ativação significativamente aumentada de inflamassomas AIM2 foi encontrada nos camundongos RA, nos quais a transferência citoplasmática e a up‐regulação de HMGB1 também foram observadas.
Neste estudo, demonstramos a ativação do inflamassoma AIM2 na mucosa nasal na RA. Observou‐se que o AIM2 agiu como um sensor de DNA na imunidade inata. Ao detectar DNA citosólico, inclusive bacteriano, viral23 e do hospedeiro,24 a proteína AIM2 recruta a proteína adaptadora ASC através do domínio PYRIN‐PAAD‐DAPIN (PYD) e a proteína ASC recruta a procaspase‐1 através da ativação de caspase e domínio de recrutamento (CARD, do inglês caspase activation and recruitment domain) para formar um inflamassoma AIM2 ativo. Nossos resultados mostraram que os componentes do inflamassoma AIM2, inclusive AIM2, asc e caspase‐1 clivada, estavam up‐regulados após exposição à OVA na mucosa nasal, sugeriu que o inflamassoma AIM2 foi ativado em modelo murino de RA. Recentemente, um estudo interessante feito nas armadilhas extracelulares de eosinófilos mostrou que as concentrações de DNA extracelular na lavado broncoalveolar de camundongos tratados com OVA estavam significantemente aumentadas em comparação com os controles.25 Esse resultado sugere que os eosinófilos podem contribuir para a ativação do inflamassoma AIM2 na RA. Além disso, a morte celular foi analisada com o ensaio TUNEL na mucosa nasal e foi demonstrado um aumento na morte celular nos cortes nasais de animais tratados com OVA versus solução salina. Observamos também clivagem da caspase‐3 e PARP‐1, que são características de apoptose, na mucosa nasal após exposição à OVA. Entretanto, não há evidências de que a clivagem da caspase‐3 e PARP‐1 ocorreu na mucosa nasal após a estimulação com OVA. Durante a piroptose, as células sofrem clivagem de DNA cromossômico e condensação nuclear e se tornam positivas no ensaio TUNEL,26 mas sem a clivagem de substratos típicos da caspase, como caspase‐3 e PARP, que são característicos de apoptose.27 Portanto, concluímos que a piroptose ocorreu na mucosa nasal do nosso modelo murino de RA. A liberação de HMGB1 pode ocorrer downstream da formação do inflamassoma e ativação da caspase‐1. Consistente com nosso achado anterior, a HMGB1 foi liberada no citosol e no espaço extracelular após a exposição à OVA. A liberação da HMGB1 pode induzir e amplificar a RA. Assim, a ativação do inflamassoma AIM2 pode induzir a translocação da HMGB1 na RA.
Nlrp3 é o subconjunto estrutural mais estudado do inflamassoma e desempenha um papel importante na patogênese de várias doenças das vias aéreas, como asma e lesão pulmonar aguda.28 No presente estudo, observou‐se que Nlrp3 estava down‐regulada na mucosa nasal do grupo RA em comparação com o grupo controle. Um estudo interessante comparou a expressão de NLRs em biópsias nasais de indivíduos saudáveis e pacientes que sofriam de RA intermitente e mostrou que a Nlrp3 era significativamente mais baixa no grupo alérgico, especialmente durante a estação do pólen, do que no grupo saudável.29 Em outro estudo que usou um modelo murino de asma, a diminuição da expressão de Nlrp3 também foi encontrada durante a inflamação das vias aéreas.30 Esses resultados indicam que a Nlrp3 pode ser down‐regulada após a exposição ao alérgeno como mecanismo de defesa. Além disso, os efeitos das citocinas Th2, como IL‐4 e IL‐13 na expressão de Nlrp3, foram estudados em queratinócitos humanos, células THP‐1 e macrófagos derivados da medula óssea de camundongo.31,32 A pesquisa demonstrou que a expressão de Nlrp3 foi suprimida pelo tratamento com citocinas Th2. A inflamação das vias aéreas dominada por Th2 é uma característica da RA e as citocinas Th2, como IL‐4, IL‐5 e IL‐13, são liberadas após a estimulação por alérgeno.33 Portanto, a expressão de Nlrp3 pode ser suprimida por citocinas Th2 na RA.
Em nosso estudo, demonstramos que o inflamassoma AIM2 foi ativado na RA e pode contribuir para a liberação de HMGB1. Durante a inflamação das vias aéreas, vários tipos de células participaram do desenvolvimento de RA, como as células Th2. Recentemente, um estudo sobre o papel da Nlrp3 na diferenciação de Th2 revelou que ela é expressa por células T CD4+e atua como um fator‐chave de transcrição.34 Assim, a Nlrp3 pode estar implicada na patogênese de doenças dominadas por Th2, como RA e asma. No entanto, uma das principais limitações de nosso estudo é que a mucosa é um órgão complexo que compreende vários tecidos. É difícil demonstrar mudanças na expressão da proteína Nlrp3 no nível de um único tipo de célula na mucosa nasal. O papel da Nlrp3 na RA, portanto, justifica um estudo mais aprofundado.
ConclusãoDemonstramos que o inflamassoma AIM2 foi ativado e pode ocorrer piroptose na mucosa nasal após o tratamento com OVA. A liberação de HMGB1 também foi observada. A ativação do inflamassoma pode contribuir para a translocação da HMGB1 e o desenvolvimento de RA. A caspase‐1 pode, portanto, atuar como um potencial alvo terapêutico para a RA.
FinanciamentoWu Jieping Medical Foundation (n° LC1345) e The Natural Science Foundation of Hubei Province, China (n° 2014CFB359).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Wang Y, Chen S, Yang P‐L, Chen J‐J, Kong W‐J, Wang Y‐J. AIM2 inflammasome activation may mediate high mobility group box 1 release in murine allergic rhinitis. Braz J Otorhinolaryngol. 2022;88:925–31.