Estudos comprovam os efeitos ototóxicos dos antimaláricos em pessoas que fazem uso destes medicamentos, porém pouco se sabe sobre a toxicidade destes fármacos no sistema auditivo de neonatos quando ingeridos pelas mães no período gestacional.
ObjetivoVerificar a incidência de perda auditiva em neonatos de mães tratadas para malária durante a gestação sem outros indicadores de risco associados.
MétodoEstudo quantitativo, de coorte retrospectivo, desenvolvido no Hospital de Base Dr. Ary Pinheiro e na Clínica Limiar, ambos em Porto Velho (Rondônia). Compuseram a amostra 527 recém-nascidos divididos em dois grupos: grupo exposto (n = 32) e grupo não exposto (n = 495). A coleta de dados ocorreu de setembro de 2014 a dezembro de 2015, através de entrevista com as genitoras e/ou responsáveis pelo recém-nascido, investigação nos prontuários dos neonatos e das genitoras e no banco de dados da triagem auditiva neonatal das instituições supracitadas.
ResultadosTodos os neonatos do grupo exposto, avaliados através do registro das emissões otoacústicas transientes associado a realização do potencial evocado auditivo de tronco encefálico automático passaram na triagem auditiva neonatal no primeiro exame. Já, entre os recém-nascidos do grupo não exposto, 30 apresentaram falha e foram retestados. Destes, um continuou falhando e foi encaminhado para diagnóstico, no qual foram evidenciados resultados dentro da normalidade. Nos neonatos do grupo exposto, a infecção pelo Plasmodium vivax foi a mais frequente, mostrando distribuição semelhante entre os trimestres gestacionais, sendo a cloroquina o antimalárico mais utilizado e o tratamento medicamentoso realizado mais frequentemente no terceiro trimestre, porém tais achados não mostraram influência sobre os achados audiológicos dos neonatos estudados.
ConclusãoO presente estudo não identificou casos de perda auditiva nos neonatos de mães que utilizaram antimaláricos na gestação.
A malária é a doença infecciosa endêmica mais importante da Amazônia brasileira, pela sua ampla difusão na região, a alta incidência, os impactos na morbimortalidade e o difícil controle.1
Entre os nove estados que compõem a Amazônia Legal (Acre, Amapá, Amazonas, Maranhão, Mato Grosso, Pará, Rondônia, Roraima e Tocantins), Rondônia ocupa a segunda e a terceira colocação em casos registrados de malária, entre 2002 e 2011.2
Em 2006 os municípios de Cruzeiro do Sul (AC), Manaus (AM) e Porto Velho (RO) foram responsáveis por 22,59% do total de casos de malária na Amazônia.2
O quadro clínico da malária pode ser classificado como leve, moderado ou grave, de acordo com a espécie do parasito, da quantidade de parasitos circulantes, do tempo de doença e do nível de imunidade adquirida pelo paciente.3 Na malária grave e complicada algumas características clínicas e laboratoriais devem ser evidenciadas. Entre elas podem-se listar: alteração da consciência, hemorragias, icterícia, anemia grave, hipoglicemia, insuficiência renal,3,4 dispneia ou hiperventilação, convulsões, hipotensão arterial ou choque, edema pulmonar.3
Assim como as crianças e os primoinfectados, as gestantes estão sujeitas à maior gravidade, principalmente se infectadas pelo Plasmodium falciparum, o diagnóstico precoce e o tratamento correto e oportuno são os meios mais adequados para reduzir a gravidade e a letalidade por malária.3
Entre as complicações da malária materna nos conceptos, estudos registram casos de abortos,5,6 natimortalidade,6 prematuridade5,7–9 e baixo peso ao nascer.5,7–11
O número de lâminas positivas em grávidas no município de Porto Velho, em 2010, evidenciou 331 casos, entre área rural e urbana. Foram 48 casos de P. falciparum, 280 casos de P. vivax e três casos de malária mista (P. falciparum+P. vivax).12
Estudos comprovam os efeitos ototóxicos dos antimaláricos em pessoas que fazem uso desses fármacos,13–18 porém pouco se sabe da sua toxicidade no sistema auditivo de neonatos quando ingeridos pelas mães ainda na gestação.
Estudos relatam que a cloroquina, por atravessar a placenta, pode ser ototóxica para os fetos.14,19 Pesquisa feita no hospital público referência da capital de Rondônia, em 2014, com o objetivo de caracterizar os resultados da Triagem Auditiva Neonatal (TAN) quanto ao tipo de infecção com risco de transmissão vertical apresentada pela mãe evidenciou que a malária é a infecção mais frequente (35,4%) nas mães cujos filhos foram atendidos pelo programa e a falha na TAN foi de 1,5%.20
Estudo feito em 2004 confirmou 12 casos de perda auditiva em crianças de mães que haviam sido tratadas com antimaláricos durante a gestação. Todas as crianças foram diagnosticadas com perda auditiva neurossensorial, foram sete de grau profundo e cinco entre os graus moderado e grave.21
Em Porto Velho (RO) foram constatados 11,8% (n = 2) de casos de perda auditiva em crianças de até três meses cujas mães fizeram uso de antimalárico durante a gestação. As duas crianças foram diagnosticadas com perda auditiva do tipo neurossensorial de grau leve unilateral.22
Pesquisa feita no programa de TAN do hospital público referência do Estado de Rondônia evidenciou que os neonatos de mães tratadas para a malária na gravidez apresentam percentual de falha na TAN de 6,7% e 5,64 vezes maior do que os recém-nascidos (RN) de mães não tratadas.23 Foram constatados em outro estudo, feito no mesmo programa, 3% de perda auditiva em RN de mães tratadas para malária gestacional.24 Porém, as poucas publicações existentes22–25 não isolam o fator uso de antimalárico no período gestacional dos demais Indicadores de Risco para Audição na Infância (IRDA).
A necessidade de avaliar o efeito do uso de antimaláricos no período gestacional na audição do neonato sem a possibilidade da influência de outros IRDA justifica o presente estudo. A partir do exposto, objetivou-se verificar a frequência de perda auditiva em neonatos de mães tratadas para malária durante a gestação, sem outros IRDA associados, bem como caracterizar o Grupo Exposto (GE) e o Não Exposto (GNE) ao antimalárico no período gestacional quanto às variáveis: idade, procedência e escolaridade materna, assim como Idade Gestacional (IG) e peso do neonato ao nascimento; caracterizar o GE quanto ao tipo e trimestre da infecção por malária e quanto ao tipo de antimalárico usado e o trimestre gestacional da medicação administrada.
MétodoEstudo epidemiológico, observacional, analítico, do tipo coorte histórica, avaliado e aprovado pelo comitê de ética em pesquisa (CEP) com seres humanos sob o número 314.929. A presente pesquisa foi feita no Hospital de Base Dr. Ary Pinheiro (HBAP) e na clínica de avaliação e reabilitação da audição – Limiar, ambos na cidade de Porto Velho (RO).
Todos os RN do presente estudo cujas mães não fizeram tratamento com antimalárico no período gestacional foram triados com emissões otoacústicas transientes (EOAT), os neonatos que apresentaram falha foram retestados dentro de 15 dias. Já os RN submetidos aos referidos fármacos, bem como os que não foram submetidos, falharam na avaliação com EOAT, foram triados com uso da técnica combinada (EOAT + potencial evocado auditivo de tronco encefálico - PEATE-A). A coleta de dados deste estudo ocorreu entre setembro de 2014 e dezembro de 2015.
Para a escolha dos casos foram estabelecidos os seguintes critérios de elegibilidade: RN filhos de mães brasileiras, internados no alojamento conjunto (Alcon) do HBAP, sem IRDA, ou somente com o fator antimalárico na gestação, que fizeram a TAN no período da coleta de dados e que tivessem feito todas as etapas preconizadas para programas de triagem auditiva neonatal,26 cujas mães tivessem feito o pré-natal adequadamente e concordado com sua participação no estudo, com a assinatura do termo de consentimento livre e esclarecido (TCLE).
A amostra foi estimada a partir do número médio de RN triados no Alcon do HBAP, no período destinado a coleta de dados, que é de 3600. Adotando-se um erro de 5% e um nível de significância de 95% chegou-se a um tamanho amostral mínimo de 348 RN.
Foram abordadas, antes da alta hospitalar, 734 mães ou responsáveis dos RN internados no Alcon do HBAP no período da coleta de dados, os quais consentiram em participar do estudo e autorizaram o acesso aos prontuários da puérpera e do RN. Desses, 173 foram excluídos por terem IRDA, 25 por não terem feito todas as etapas preconizadas para programas de TAN (sete RN falharam na TAN, foram encaminhados para diagnóstico e não compareceram) e nove devido às mães não terem feito o pré-natal.
A partir do exposto, 527 RN compuseram a amostra, que foi dividida em dois grupos, a saber: Grupo Exposto (GE) e Grupo Não Exposto (GNE). O primeiro grupo é composto por 32 RN de mães que fizeram uso de antimalárico no período gestacional e o segundo, por 495 RN sem qualquer indicador de risco para a deficiência auditiva na infância.
Com intuito de tentar isolar a variável “uso do antimalárico no período gestacional” e evitar a presença de variáveis confundidoras, foram incluídos no GNE somente RN que não tinham qualquer IRDA e no GE foram incluídos RN filhos de mães que fizeram uso de antimaláricos no período gestacional, sem qualquer outro IRDA associado.
Dos 32 neonatos que compõem o GE, 17 são do sexo feminino (53,1%) e 15 do masculino (46,9%) e dos 495 RN do GNE, 251 são do sexo feminino (50,7%) e 244 (49,3%) do masculino.
Os RN do GE apresentaram Idade Gestacional (IG) média de 38,4 semanas e peso médio ao nascer de 3.131g, enquanto os RN do GNE apresentaram IG média de 38,6 semanas e média de peso ao nascimento de 3.229g.
A coleta de dados teve início por meio de entrevista com as genitoras ou responsáveis pelos neonatos com intuito de obter informações socioeconômicas e demográficas, o histórico familiar de deficiência auditiva na infância, confirmar as informações que logo após foram obtidas nos prontuários como ocorrência de infecções congênitas e feitura do pré-natal e, nos casos das mães que tiveram malária gestacional, obtiveram-se informações do tipo da infecção, o período de ocorrência, o tratamento medicamentoso, bem como o período em que a medicação foi administrada (primeiro, segundo e/ou terceiro trimestre gestacional).
Além da entrevista, usaram-se para a coleta dos dados os prontuários dos RN e das genitoras, o banco de dados da TAN do HBAP, o banco de dados da clínica Limiar, o equipamento modelo MADSEN AccuScreen® portátil, da marca GN Otometrics, cartão de vacina do RN, cartão de gestante e formulário de coleta de dados.
Todos os dados compilados foram registrados no formulário de coleta de dados, a fim de garantir a organização e a qualidade da coleta, tabulados em planilhas do Excel e submetidos a testes estatísticos com nível de significância de 5% (p = 0,05).
A fim de caracterizar a amostra quanto às variáveis quantitativas (idade materna, peso ao nascer e IG), bem como comparar essas variáveis entre os grupos, usou-se o teste estatístico Anova. Para analisar a distribuição das variáveis qualitativas (escolaridade e procedência materna e sexo do RN), bem como comparar tais variáveis entre os grupos, foi usado o teste estatístico de igualdade de duas proporções. Esse teste estatístico foi usado ainda com intuito de caracterizar os sujeitos do GE, quanto ao tipo e trimestre gestacional de infecção por malária, além de verificar os diferentes antimaláricos usados no período gestacional, bem como o período gestacional de sua administração, além de comparar os resultados das EOAT, de acordo com a orelha, entre os grupos e comparar os resultados da TAN entre os grupos.
Além dessas análises, foi possível calcular o risco relativo de os RN de ambos os grupos falharem nas EOAT da orelha esquerda. Não foi possível fazer a mesma análise referente às EOAT da orelha direita e referente ao resultado final da TAN, visto que não se obtiveram falhas nas EOAT da orelha direita e no resultado final da TAN no GE.
Descreveram-se ainda, a ocorrência da infecção nas cinco genitoras infectadas em mais de um período gestacional, o período gestacional de ocorrência da malária nas genitoras tratadas com Coartem® (artemeter+lumefantrina) e quinina+clindamicina, o número de genitoras tratadas para malária após o período de infecção e a feitura do tratamento de acordo com o trimestre gestacional (um ou mais trimestres).
Por fim, foram descritos os resultados da avaliação audiológica do RN encaminhado para avaliação diagnóstica.
ResultadosA idade das mães que tiveram malária durante a gestação variou de 14 a 39 anos, com média de 23,3, e das mães que não foram acometidas pela doença variou de 14 a 43 anos, com média de 25,1. Tais valores, quando comparados, não apresentaram diferença com significância estatística (p = 0,140).
Foi evidenciado, em ambos os grupos, que a maioria significativa das mães é proveniente de Porto Velho (RO) (p < 0,001). Entre as mães dos RN do GE, 24 são provenientes da capital de Rondônia, seis do interior do estado e duas do interior de estado vizinho (Amazonas). Entre as mães dos RN do GNE, 336 são oriundas de Porto Velho, 154 do interior do estado e 5 do interior de estado vizinho (Amazonas).
Com relação à escolaridade, a maior parte das mães do GE (56,3%; n = 18) referiu não ter concluído o ensino fundamental, achado significativo quando comparado com os demais graus de instrução: ensino fundamental completo - EFC, ensino médio incompleto - EMI, ensino superior incompleto - ESI e ensino superior completo - ESC (p < 0,0001); ensino médio completo - EMC (p = 0,044). Entre as mães do GNE a maioria referiu ter concluído o ensino médio (34,6%; n = 171), achado que não diferiu estatisticamente somente do número de mães que mencionaram não ter concluído o ensino fundamental (31,2%; n = 154; p = 0,250), apontou-se diferença significativa quando comparado aos demais graus de instrução (EFC, EMI, ESI e ESC; p < 0,001).
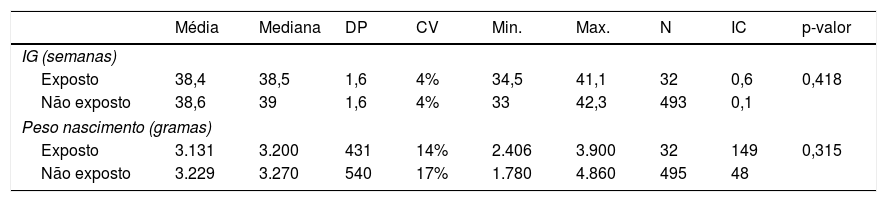
Ao comparar as variáveis IG e peso do neonato ao nascimento entre os grupos, não foi observada diferença significante (tabela 1).
Comparação das variáveis idade gestacional e peso ao nascimento entre os grupos
| Média | Mediana | DP | CV | Min. | Max. | N | IC | p-valor | |
|---|---|---|---|---|---|---|---|---|---|
| IG (semanas) | |||||||||
| Exposto | 38,4 | 38,5 | 1,6 | 4% | 34,5 | 41,1 | 32 | 0,6 | 0,418 |
| Não exposto | 38,6 | 39 | 1,6 | 4% | 33 | 42,3 | 493 | 0,1 | |
| Peso nascimento (gramas) | |||||||||
| Exposto | 3.131 | 3.200 | 431 | 14% | 2.406 | 3.900 | 32 | 149 | 0,315 |
| Não exposto | 3.229 | 3.270 | 540 | 17% | 1.780 | 4.860 | 495 | 48 | |
Teste estatístico: Anova (p = 0,05)
IG, idade gestacional; DP, desvio-padrão; CV, coeficiente de variação; Min., mínimo; Max., máximo; IC, intervalo de confiança; N, número; %, porcentagem; p-valor, nível de significância estatística.
A infecção pelo P. vivax foi a mais frequente na população estudada, mostrou diferença estatisticamente significante quando comparada com a ocorrência de infecção por P. falciparum (tabela 2).
Distribuição dos RN do GE quanto ao tipo e período de infecção por malária
| Tipo de infecção | N | % | p-valor | Período de infecção | N | % | p-valor |
|---|---|---|---|---|---|---|---|
| P. vivax | 25 | 78,1 | < 0,001a | 1° trimestre | 14 | 43,8 | Ref. |
| P. falciparum | 7 | 21,9 | 2° trimestre | 13 | 40,6 | 0,800 | |
| 3° trimestre | 12 | 37,5 | 0,611 |
Teste estatístico: Igualdade de Duas Proporções (p = 0,05).
RN, recém-nascido; GE, grupo exposto; N, número amostral; %, porcentagem; 1°, primeiro; 2°, segundo; 3°, terceiro; Ref., referência; p-valor, nível de significância estatística.
A distribuição da infecção entre os trimestres gestacionais foi bastante homogênea, o primeiro trimestre foi o mais recorrente, porém sem diferença estatística quando comparado aos demais (tabela 2). Vale ressaltar que cinco mães foram infectadas em mais de um período gestacional, uma delas foi infectada no primeiro e no segundo trimestres gestacionais, duas no primeiro e no terceiro trimestres e duas referiram a infecção durante todo o período gestacional (três trimestres). As cinco foram infectadas pelo P. vivax.
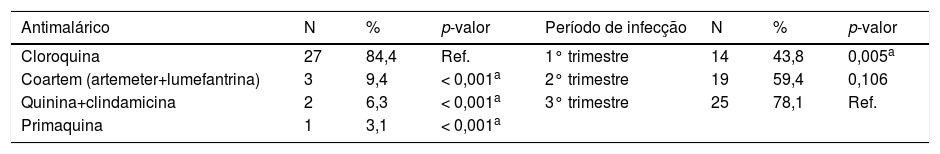
O antimalárico mais usado pelas mães dos RN que compõem o GE foi a cloroquina, achado estatisticamente significante quando comparado com o uso de Coartem® (artemeter+lumefantrina), o tratamento foi feito com quinina associada a clindamicina e com a primaquina (tabela 3).
Distribuição dos RN do GE quanto ao tipo de antimalárico usado e o período de administração
| Antimalárico | N | % | p-valor | Período de infecção | N | % | p-valor |
|---|---|---|---|---|---|---|---|
| Cloroquina | 27 | 84,4 | Ref. | 1° trimestre | 14 | 43,8 | 0,005a |
| Coartem (artemeter+lumefantrina) | 3 | 9,4 | < 0,001a | 2° trimestre | 19 | 59,4 | 0,106 |
| Quinina+clindamicina | 2 | 6,3 | < 0,001a | 3° trimestre | 25 | 78,1 | Ref. |
| Primaquina | 1 | 3,1 | < 0,001a |
Teste estatístico: Igualdade de Duas Proporções (p = 0,05).
RN, recém-nascido; GE, grupo exposto; N, número amostral; %, porcentagem; 1°, primeiro; 2°, segundo; 3°, terceiro; Ref., referência; p-valor, nível de significância estatística.
As três mães tratadas com Coartem® (artemeter+lumefantrina) foram infectadas pelo P.falciparum, duas delas foram infectadas no segundo trimestre e uma no terceiro trimestre gestacional. Das duas mulheres tratadas com quinina associada à clindamicina, ambas foram infectadas no primeiro trimestre gestacional, porém uma foi infectada pelo P. vivax e a outra pelo P.falciparum.
Além disso, três mães infectadas por P. falciparum referiram ter feito tratamento com cloroquina, uma usou esse antimalárico associado à primaquina.
O tratamento medicamentoso com antimalárico foi mais frequente no terceiro trimestre gestacional, esse resultado é significante quando comparado com a administração do antimalárico no primeiro trimestre gestacional (tabela 3). Quatorze mães (43,75%) referiram ter feito o tratamento além do(s) período(s) de ocorrência da doença, segundo orientação médica.
Três mães (9,38%) fizeram o tratamento somente no primeiro trimestre, outras três mães (9,38%) fizeram o tratamento somente no segundo trimestre, enquanto oito mães (25%) fizeram o tratamento somente no terceiro trimestre. Uma mãe (3,12%) referiu ter usado antimalárico no primeiro e segundo trimestre gestacional, duas (6,25%) referiram tratamento no primeiro e terceiro trimestre, sete (21,87%) mencionaram tratamento no segundo e terceiro trimestre e oito (25%) foram tratadas para malária durante os três trimestres gestacionais.
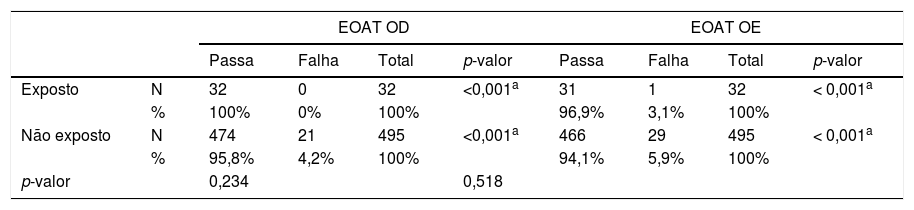
Quando analisados os resultados isolados das EOAT de acordo com a orelha testada, verificou-se, no primeiro teste, que nenhum RN do GE apresentou falha durante a avaliação da orelha direita, enquanto um RN falhou no exame da orelha esquerda. Já entre os RN do GNE, 21 apresentaram falha nas EOAT da orelha direita e 29 na orelha esquerda. Tais achados mostraram significância estatística quando feita a comparação intragrupos, porém não se observou diferença estatisticamente significante quando comparados os achados entre os grupos (tabela 4). Verificou-se que não há associação entre falha nas EOAT da orelha esquerda e a exposição ao antimalárico durante a gestação (tabela 5).
Comparação entre os resultados das EOAT de acordo com a orelha testada, no primeiro teste
| EOAT OD | EOAT OE | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Passa | Falha | Total | p-valor | Passa | Falha | Total | p-valor | ||
| Exposto | N | 32 | 0 | 32 | <0,001a | 31 | 1 | 32 | < 0,001a |
| % | 100% | 0% | 100% | 96,9% | 3,1% | 100% | |||
| Não exposto | N | 474 | 21 | 495 | <0,001a | 466 | 29 | 495 | < 0,001a |
| % | 95,8% | 4,2% | 100% | 94,1% | 5,9% | 100% | |||
| p-valor | 0,234 | 0,518 | |||||||
Teste estatístico: Igualdade de Duas Proporções (p = 0,05).
EOAT, emissões otoacústicas evocadas transientes; OD, orelha direita; OE, orelha esquerda; N, número amostral; %, porcentagem; p-valor, nível de significância estatística.
Risco relativo de falha nas EOAT da orelha esquerda em neonatos expostos ao antimalárico no período gestacional
| EOAT OE | Falhou | Passou | Total | RR |
|---|---|---|---|---|
| Exposto | 1 | 31 | 32 | 0,53(0,08a 3,58) |
| Não exposto | 29 | 466 | 495 | |
| Total | 30 | 497 | 527 |
EOAT, emissões otoacústicas evocadas transientes; OE, orelha esquerda; RR, risco relativo.
a Significância estatística.
Verificou-se maior incidência de falha nas EOAT da OE nos RN do grupo não exposto, indicou que o uso de antimaláricos no período gestacional pode proteger a audição dos neonatos (tabela 5). Porém, esse resultado não foi estatisticamente significativo.
O RN do GE que apresentou falha na EOAT da orelha esquerda não fez reteste, visto que apresentou resposta satisfatória no PEATE-A, resultou em “passa” na TAN.
Assim, somente os RN que apresentaram “falha” no primeiro teste e compõem o GNE, os quais foram avaliados apenas com o uso de EOAT, fizeram reteste. Dos 30 RN que fizeram reteste das EOAT, apenas um continuou a apresentar “falha” (bilateral), foi então encaminhado para avaliação diagnóstica.
Todos os RN do GE, avaliados com a técnica combinada (EAOT+PEATE-A), passaram na TAN logo no primeiro exame. Já dos 495 RN que compõem o GNE, avaliados somente com EOAT, por serem considerados de baixo risco para a deficiência auditiva, 33 apresentaram “falha” no primeiro teste. Desses, três RN fizeram PEATE-A e passaram, não foi necessário fazer reteste.
Dos 30 RN retestados, 53,3% (n = 16) foram retestados antes da alta hospitalar e 46,6% (n = 14) foram reavaliados 15 dias após o primeiro teste, ou seja, após a alta hospitalar. Após reteste, apenas um RN continuou a apresentar “falha”, essa bilateral.
Assim, dos 32 RN do GE todos passaram na TAN (100%) e dos 495 do GNE, 494 passaram na TAN (99,8%), o RN que falhou foi encaminhado para avaliação diagnóstica.
Esse neonato compareceu para avaliação diagnóstica com 22 dias de vida e apresentou ausência de EOAT diagnóstico em ambas as orelhas; presença das ondas I, III e V no PEATE diagnóstico, com latências absolutas e interpicos dentro da normalidade, evidenciou integridade da via auditiva até o tronco encefálico alto; limiar eletrofisiológico na frequência de 2000 Hz dentro da normalidade (30 dB) e mobilidade normal do sistema tímpano ossicular (curva timpanométrica tipo A), bilateralmente. Com tais resultados, e tendo em vista que esse RN não tem IRDA, ele recebeu alta do programa de TAN e a mãe foi orientada quanto ao desenvolvimento auditivo e linguístico do filho.
Assim, dos 527 RN que participaram do presente estudo (GE = 32; GNE = 495) nenhum foi diagnosticado com perda auditiva.
DiscussãoO presente estudo não evidenciou casos de perda auditiva em neonatos de mães que fizeram uso de antimalárico (cloroquina, Coartem®, quinina e primaquina) durante a gestação. Esse achado corrobora o encontrado por Silva (2014), que caracterizou o programa de TAN do hospital onde este estudo foi desenvolvido, o qual verificou que apesar de a ocorrência da malária no período gestacional ser a infecção com risco de transmissão vertical mais frequente na população estudada, nenhum dos RN diagnosticados com deficiência auditiva tinha histórico de malária gestacional.27
A malária na gestação também foi um indicador de risco com ocorrência significativa em neonatos advindos do alojamento conjunto, em estudo feito com RN provenientes de unidades privadas de saúde da cidade de Porto Velho (RO), porém os neonatos expostos à malária gestacional não apresentaram perda auditiva.28
Outra pesquisa, feita no mesmo município, diagnosticou 15 neonatos com deficiência auditiva (2/1000 RN triados), porém não foi detectado caso de uso de antimalárico no período gestacional entre os neonatos diagnosticados.29
Em contrapartida, outros estudos constataram perda auditiva em crianças expostas a antimaláricos no período gestacional,21,24,25 porém nenhum deles isolou o uso de antimaláricos na gestação dos demais IRDA, visto que as crianças diagnosticadas apresentaram outros indicadores de risco associados ao tratamento para malária durante a gestação, os quais podem ser os responsáveis pelas alterações encontradas.
Assim, ainda não há evidências do fator de risco “antimalárico na gestação” causar perda auditiva em neonatos.
Ainda, o presente estudo não constatou diferença significante na IG e no peso dos neonatos de ambos os grupos (exposto e não exposto ao antimalárico no período gestacional), esses achados foram bastante semelhantes aos encontrados por outros pesquisadores.24
Acredita-se que as mães do presente estudo que tiveram malária durante a gravidez fizeram diagnóstico precoce e tratamento oportuno e não apresentaram alterações no curso da gestação, bem como na IG e no peso dos neonatos ao nascer.
Esse resultado confirma, também, o verificado em pesquisa desenvolvida na Tailândia com 300 gestantes, total de 376 episódios de malária, dos quais 246 foram infecção por P.falciparum, tratados com quinina, e 130 de infecção por P. vivax, tratamento com cloroquina. Constatou-se que não houve aumento das taxas de anormalidade congênita, morte fetal ou baixo peso ao nascer. Segundo os pesquisadores, esses resultados sugerem que as doses terapêuticas de cloroquina e quinina são seguras.30 Em contrapartida, outras pesquisas registraram casos de prematuridade5,7,9 e baixo peso ao nascer.5,7,9–11
Outra hipótese que pode justificar a ausência de alterações no curso da gestação e, consequentemente, na IG e no peso dos RN do presente estudo é o fato de os episódios maláricos evidenciados não serem classificados como graves ou complicados.
Em contrapartida, estudo feito em Ibadan, no sudoeste da Nigéria, constatou associação entre malária materna durante a gravidez e peso do neonato ao nascer (p = 0,007); mostrou peso ao nascer significativamente menor nos RN do grupo exposto à malária durante a gestação.31
No que se refere aos dados maternos, verificou-se que a média de idade das mães dos RN que compõem o GE corrobora o encontrado em estudo feito com neonatos de mulheres que fizeram uso de antimaláricos no período gestacional, que verificou média de idade materna de 23,1 anos,24 e em pesquisa desenvolvida com 417 gestantes que tiveram malária durante a gestação e fizeram tratamento medicamentoso.32 A idade média das mulheres que não tiveram malária durante a gestação, logo, não fizeram tratamento medicamentoso, mostrou-se maior (25 anos), compatível com o verificado em estudos feitos em programas de TAN de Recife (PE).33,34
Grande parte das mães que participaram da presente pesquisa são advindas da capital de Rondônia, bem como verificado em estudos recentes desenvolvidos no mesmo hospital.24,27
Quanto à escolaridade, a maior parte das mães do GE não concluiu o Ensino Fundamental, enquanto as mães do GNE tinham, em sua maioria, o Ensino Médio Completo, achado que ratifica o verificado em outros estudos feitos na região amazônica,24,27,32 e que evidencia que quanto maior a escolaridade menor foi a infecção por malária. Em contrapartida, Dræbel et al. (2013) sugerem que o nível de escolaridade não precisa ser elevado para as pessoas fazerem prevenção e tratamento da malária, porém encontraram associação da frequência escolar com diagnóstico e tratamento da malária.35
Na presente pesquisa a infecção pelo P. vivax foi a mais prevalente, bem como verificado em outros estudos5,9,10,20,23–25,32,36 feitos no mesmo município ou em regiões próximas, a maioria parte da Amazônia legal. Porém, em estudos feitos na Índia,6 Nigéria37,38 e Tailândia,30 a infecção por P. falciparum mostrou-se mais frequente.
Quanto ao período gestacional de infecção, não foi encontrada diferença na distribuição entre os três trimestres gestacionais, achado que corrobora o encontrado em outros estudos desenvolvidos no mesmo programa,23,25 porém vai de encontro ao observado em pesquisa feita no mesmo hospital, a qual constatou maior frequência da infecção no primeiro trimestre gestacional,24 e em pesquisas feitas no Hospital da Mulher Mãe Luzia, na cidade de Macapá (AP),36 e em uma clínica de pré-natal de Benin City (Nigéria), os quais evidenciaram maior ocorrência de malária no terceiro trimestre gestacional.8
Em consonância com o preconizado pelo Ministério da Saúde, o antimalárico mais usado no tratamento da infecção por P. vivax, no presente estudo, foi a cloroquina.3,4,39 Outras pesquisas também evidenciaram o uso da cloroquina para tratamento da malária por P. vivax,20,22–25,30,32,36 esse fármaco foi o mais usado no tratamento da malária falciparum em estudo feito na Nigéria, com 199 gestantes.8
Dos sete casos de infecção por P. falciparum evidenciados neste estudo, três mães foram tratadas com Coartem® (artemeter + lumefantrina), tratamento recomendado para gestantes com malária falciparum no segundo e terceiro trimestre gestacionais,4,39 períodos nos quais se encontravam as três gestantes referidas. Outros autores também constataram o uso do Coartem® como tratamento de preferência para malária falciparum, no segundo e terceiro trimestres gestacionais.36
Somente duas mães foram tratadas com quinina associada à clindamicina, uma infectada pelo P. vivax e a outra pelo P. falciparum, ambas no primeiro trimestre gestacional, esse é o tratamento indicado pelo Ministério da Saúde para os casos de malária grave e complicada causada tanto pelo P. falciparum quanto pelo P. vivax, no primeiro trimestre gestacional.4 Esse achado corrobora o encontrado em estudo feito na Tailândia com mulheres tratadas para malária no primeiro trimestre de gestação.30
Contatou-se ainda que três mães foram tratadas para infecção por P. falciparum com uso de cloroquina, medicação contraindicada por ser esse parasito resistente ao fármaco referido.39 A associação de cloroquina e primaquina foi usada no tratamento de uma mãe infectada pelo P. falciparum no primeiro trimestre gestacional, a primaquina foi contraindicada por causar hemólise fetal.3 Estudo publicado em 2010 aponta a primaquina como um dos antimaláricos mais usados no tratamento da malária gestacional. Além disso, refere que a primaquina tem ação gametocida contra o P. falciparum, porém é contraindicada durante a gestação devido efeitos indesejáveis no feto, como meta-hemoglobinemia.40
Apesar de a maior parte dos tratamentos feitos estar de acordo com o preconizado pelo Ministério da Saúde,3,4,39 não houve consenso quanto à terapêutica usada de acordo com o trimestre gestacional, como verificado também em estudo feito em Macapá (AP).36 Além disso, não houve concordância quanto ao tratamento da malária de acordo com o tipo de infecção, visto que três mães infectadas pelo P. falciparum foram tratadas com cloroquina, medicamento que não é eficaz para combater este Plasmodium devido à resistência que esse tem ao referido fármaco.
No presente estudo, o tratamento medicamentoso com antimalárico foi mais frequente no terceiro trimestre gestacional, resultado que corrobora o encontrado em outros estudos,8,22 porém discorda do verificado em pesquisa que constatou que o tratamento para malária foi mais frequente no segundo trimestre, porém não verificou diferença significante quando comparado com o tratamento nos demais períodos gestacionais.24 Acredita-se que, no presente estudo, o tratamento para malária foi mais frequente no terceiro trimestre gestacional, pois, além das mulheres infectadas no referido trimestre (n = 12; 37,5%), muitas das infectadas no primeiro e segundo trimestres referiram ter sido orientadas a fazer o tratamento até o sexto mês de vida do neonato.
Quanto à avaliação auditiva dos neonatos, pôde-se verificar, no primeiro teste, maior número de falhas na orelha esquerda, como já evidenciado em outros estudos feitos com neonatos,41,42 resultado que pode ser justificado pelo fato de a amplitude das EOA ser menor nessa orelha.43–45
Todos os RN expostos ao antimalárico no período gestacional foram triados com uso das EOAT associada ao PEATE-A, como recomendado para neonatos de alto risco para a deficiência auditiva.46 Devido ao conhecimento do fator ototóxico dos antimaláricos e por falta de evidências da ação ototóxica dos antimaláricos usados pela mãe durante a gestação no neonato, o programa feito no HBAP classifica os RN expostos a antimaláricos no período gestacional como de risco para o desenvolvimento de deficiência auditiva. Apesar disso, todos os 32 RN do GE apresentaram resultados normais no PEATE-A, em 35 dBNA, e, portanto, passaram na TAN, evidenciaram a ausência de comprometimento auditivo nos neonatos expostos a antimaláricos (cloroquina, quinina, Coartem® - artemeter+lumefantrina - e primaquina) no período gestacional, no momento da avaliação auditiva nos participantes deste estudo.
Divergindo do obtido na presente pesquisa, que não registrou casos de falhas na TAN no grupo de RN expostos a antimaláricos durante a gestação, Silva et al. (2015) demonstraram 6,7% de falha na TAN de RN cujas mães fizeram tratamento para malária durante a gestação, apresentam 5,64 vezes mais chance de falhar na TAN do que os RN de mães não tratadas para malária gestacional.23 Na mesma vertente, Aurélio et al. (2014) evidenciaram 11,4% (n = 4) de casos de falhas na TAN de neonatos cujas mães fizeram uso de antimaláricos no período gestacional.24 Vale ressaltar que, em ambos os estudos mencionados, a TAN dos RN expostos a antimaláricos durante a gestação foi feita com uso da técnica combinada (EOA e PEATE-A), bem como no presente estudo. Acredita-se que essa divergência se deve ao fato de os estudos referidos23,24 não terem isolado o uso do antimalárico no período gestacional dos demais IRDA, os quais podem ter contribuído ou potencializado os resultados encontrados.
Sugere-se o desenvolvimento de outros estudos com um número maior de sujeitos, situação que se mostrou inviável nesta pesquisa em virtude das modificações ocorridas no programa de TAN do HBAP na época da coleta de dados, o qual atualmente tria todos os RN somente com EOA.
Além disso, a feitura de um estudo tipo caso-controle poderia ser também apropriada em virtude de a perda auditiva, bem como a infecção por malária, não ser frequente. Porém, estudos de caso-controle, nesse caso, poderão apresentar o viés de os neonatos do grupo caso (com perda auditiva) apresentarem outros IRDA associados ao tratamento para malária na gestação e dificultar a relação entre perda auditiva e uso de antimaláricos na gravidez. As alterações apresentadas por esse grupo poderão ser em virtude dos outros IRDA apresentados pelos neonatos, o que se julga ter ocorrido em outras pesquisas já desenvolvidas.22,24,25
Acredita-se que os achados do presente estudo, referentes à IG, peso dos neonatos ao nascimento, bem como a ausência de alterações auditivas nos neonatos expostos a antimaláricos no período gestacional, justificam-se pela feitura do tratamento adequado e oportuno, conforme proposto pelo Ministério da Saúde.4
Sugere-se, ainda, que a audição desses RN seja monitorada e estudos com crianças e adolescentes expostos ao antimalárico no período gestacional sejam desenvolvidos a fim de investigar a ocorrência de perdas auditivas progressivas nessa população. Pesquisa feita com 725 crianças e adolescentes de Moçambique, que fizeram uso de antimaláricos, dos quais 12 com idade média de 3,2 anos e que haviam sido também expostos ao antimalárico no período gestacional, constatou que todas as crianças cujas mães foram tratadas para malária durante a gestação apresentaram perda auditiva do tipo neurossensorial, sete de grau profundo e cinco entre moderado e grave.21 Vale salientar que as mães dessas crianças diagnosticadas com perda auditiva fizeram tratamento, em sua maioria, com cloroquina e cloroquina associada à quinina,21 antimaláricos também usados pelas mães do presente estudo.
ConclusãoO presente estudo não identificou casos de perda auditiva nos neonatos de mães que fizeram uso de antimaláricos (cloroquina, Coartem®, quinina e primaquina) na gestação, sem outros IRDA associados, todos os neonatos do GE passaram na TAN, com uso de EOAT e PEATE-A desde o primeiro teste.
A partir disso, salienta-se a necessidade do desenvolvimento de estudos que objetivem acompanhar a audição de crianças expostas a antimalárico no período gestacional, preferencialmente sem outros IRDA, a fim de investigar a ocorrência de perdas auditivas progressivas nessa população.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Patatt FS, Sampaio AL, Tauil PL, Oliveira CA. Hearing of neonates without risk indicators for hearing loss and use of antimalarial drugs during pregnancy: a historical cohort study in the Northern Region of Brazil. Braz J Otorhinolaryngol. 2021;87:19–27.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico-Facial.