Rinossinusite crônica é um quadro de inflamação da cavidade nasal e dos seios paranasais que necessita de tratamento multifatorial. O xilitol pode ser associado às irrigações nasais e pode prover melhor controle da doença.
ObjetivoAvaliar a relação entre os efeitos da lavagem nasal com solução fisiológica em comparação à lavagem nasal com solução de xilitol.
MétodoDivididos em dois grupos (n=26 no grupo Xilitol e n=26 no grupo Soro), 52 pacientes responderam à questionários validados em língua portuguesa (NOSE e SNOT‐22) sobre seus sintomas nasais e sintomas gerais, antes e depois de cirurgia endoscópica endonasal e após um período de 30 dias de irrigação nasal.
ResultadosO grupo Xilitol apresentou melhoria significativa dos sintomas de dor e sintomas nasais após a cirurgia e a irrigação nasal com solução de xilitol (p <0,001). O grupo Soro também apresentou melhoria dos sintomas, porém em menor escala.
ConclusãoEste estudo sugere que a solução de xilitol pode ser usada no período pós‐operatório de cirurgia endoscópica endonasal por levar a uma maior redução nos sintomas nasais.
Rinossinusite crônica (RSC) é uma condição de inflamação da mucosa da cavidade nasal e dos seios paranasais com sintomatologia maior do que 12 semanas.1 Pode ser dividida em rinossinusite crônica primária ou secundária (pode ou não apresentar polipose nasal). Pólipos são o estágio final do crescimento hiperplástico da mucosa nasal devido à intensa atividade de linfócitos T‐helper tipo2 (Th2), eosinófilos e imunoglobulina E (IgE).1
Apesar de diversas teorias, a presença bacteriana interfere no clearance mucociliar, imunidade inata e imunidade celular.2 A relação entre RSC e biofilmes foi descrita em 2004 e diversas terapias foram propostas para erradicação dessas entidades na busca do adequado controle de sintomas e redução da gravidade da doença.3 Entre os diversos tratamentos com recomendação atual, citamos: corticoide nasal, implantes com corticoide intranasal, corticoide sistêmico, lavagem nasal com solução salina e imunoterapia.1
O xilitol (1,2,3,4,5‐pentaidroxipentano) é um poliálcool de estrutura aberta e com cinco grupos hidroxila, atóxico e seguro, segundo a Food and Drug Administration.4 Tem um poder adoçante semelhante à sacarose – com 40% menos calorias – e é metabolizado pelo fígado em glicose e glicogênio ou piruvato e lactato.5 É bem tolerado, apesar de não existirem doses máximas estabelecidas. A irrigação nasal é comumente orientada, tanto no pré quanto no pós‐operatório, por melhorar o clearance mucociliar, diminuir o edema, reduzir a concentração dos mediadores inflamatórios e reduzir a quantidade de muco acumulado nas cavidades, além de prevenir a formação de crostas.6 Estudos recentes demonstraram a efetividade do xilitol associado a irrigação nasal, durante o pós‐operatório,6 devido a suas características antibacterianas, bactericidas e anti‐adesivas demonstradas in vitro.7
O xilitol é usado com vários objetivos terapêuticos e os mais estabelecidos são a prevenção de cáries8 e estabilização dos níveis glicêmicos, por não depender da insulina para sua metabolização.9 No sistema respiratório, o xilitol pode apresentar os seguintes efeitos terapêuticos:
- a)
Toxicidade bacteriana: A molécula de xilitol não é metabolizada pela bactéria, tendo de ser eliminada da célula. Isso promove um ciclo de gasto de energia sem ganho nutricional que, aliado ao acúmulo tóxico de fosfato de xilitol no interior celular, desencadeia a morte bacteriana;10
Adesão bacteriana: O xilitol extracelular age como um receptor análogo para a célula hospedeira, interfere no processo de adesão;11,12
- b)
Aumento das defesas inatas da superfície das vias aéreas: A atividade antibacteriana de vários desses agentes é sal‐dependente, ou seja, um aumento na sua concentração inibirá sua atuação tanto isolada como sinergicamente. Alguns autores acreditam que essa alteração na concentração seja uma das razões pelas quais os pacientes com fibrose cística são mais propensos à colonização e à infecção bacteriana;13
- c)
Óxido nítrico: O óxido nítrico produzido por macrófagos ativados tem importância na resposta imune antimicrobiana.14 Foi demonstrado que o xilitol a 5% estimula a produção de óxido nítrico por macrófagos infectados por Leishmania amazonenses, diminui a infecção após 72 horas;15
- d)
Biofilme: O xilitol demonstrou ser efetivo em inibir a formação de biofilme bacteriano em cavidade oral, principalmente em estudos relacionados à formação de placa bacteriana e formação de cáries.16
Estudos clínicos prévios demonstraram a eficácia do xilitol na redução dos sintomas nasais, sem cirurgia associada (por escala visual analógica e pelo questionário SNOT‐22).17,18 No entanto, quanto de sua concentração e volume é necessário para reduzir sintomas nasais em pós‐operatório de cirurgia endoscópica endonasal (FESS) e a comparação da eficácia desse tipo de lavagem nasal e a lavagem com solução salina ainda não estão bem estabelecidos.
Assim, questionamos se existe superioridade no uso da solução de xilitol, quando comparada à tradicional solução salina fisiológica 0,9%, para a irrigação nasal no pós‐operatório de pacientes submetidos a cirurgia endoscópica dos seios paranasais. Para tentar obter respostas a essa pergunta, o presente estudo tem o objetivo de analisar através de parâmetros clínicos, de forma comparativa, a efetividade da irrigação nasal de grande volume com solução de xilitol e a solução salina a 0,9% no pós‐operatório de pacientes submetidos a cirurgia endoscópica dos seios paranasais.
MétodoPopulação estudadaForam incluídos 52 pacientes com diagnóstico de RSC (primária ou secundária, com ou sem polipose nasal), que preenchiam critérios de RSC de difícil tratamento, ou seja, não apresentavam controle clínico adequado após uso de corticosteroides tópicos nasais em spray e até dois ciclos de antibióticos e/ou corticosteroides orais no último ano, acompanhados em um ambulatório especializado, e que foram submetidos a cirurgia endoscópica endonasal, feita pelo mesmo cirurgião, com a mesma técnica de abertura de todos os seios paranasais.
O diagnóstico de RSC foi definido de acordo com os critérios de pesquisa sugeridos pelo EPOS 2020.1 Foram excluídos pacientes menores de 18 anos, ou que não desejassem participar do estudo. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Instituição sob número 266/2019.
Delineamento do estudoEstudo prospectivo de intervenção não controlado em pacientes com RSC de difícil tratamento. A intervenção em estudo foi a terapia tópica com irrigação nasal em alto volume com solução de xilitol. Os pacientes foram orientados a iniciar a irrigação nasal (com xilitol ou solução salina) a partir do segundo dia de pós‐operatório.
Os pacientes do grupo Xilitol foram orientados a usar a solução da seguinte forma: cada sachê de 6 gramas de xilitol diluído em 360 mL de água filtrada ou fervida. Os pacientes foram orientados a usar esse volume de 360 mL por dia, irrigar cada narina com o auxílio de uma seringa de 60 mL, com jato contínuo da solução a cada oito horas, durante 30 dias.
Já os pacientes do grupo Soro foram orientados a usar 360 mL de solução fisiológica a 0,9% por dia, irrigar as fossas nasais com auxílio de seringa de 60 mL, com a solução em cada narina de oito em oito horas, durante 30 dias. A tabela 1 apresenta os valores do orçamento para o presente estudo.
Os pacientes foram avaliados antes e após 30 dias de terapia tópica de irrigação. Os desfechos subjetivos avaliados foram: melhoria subjetiva e grau de satisfação pós‐terapia tópica de irrigação. Os pacientes foram perguntados, no fim da terapia tópica de irrigação, se houve melhoria do seu quadro clínico (melhoria total, melhoria parcial, sem melhoria, pioria) e se estavam satisfeitos com o grau dessa melhoria subjetiva (satisfeitos ou insatisfeitos).
Foi considerado sucesso terapêutico quando o paciente apresentava melhoria subjetiva satisfatória.
Os desfechos objetivos avaliados foram: escores da Escala Visual Analógica (EVA) para sensação de dor (antes e depois da cirurgia), escores dos questionários NOSE19 e SNOT‐22,20 ambos validados para a língua portuguesa. Esses desfechos foram avaliados quantitativa e qualitativamente. A avaliação quantitativa dos desfechos objetivos envolveu cálculos estatísticos que compararamo pré e pós‐terapia tópica de irrigação.
Análise estatísticaOs resultados dos escores obtidos da aplicação dos questionários de Escala Visual Analógica (EVA), NOSE e SNOT‐22 foram descritos por médias, medianas e valores mínimos e máximos. Para cada uma das perguntas dos questionários, foram apresentados frequências e percentuais. A comparação dos grupos definidos pelo tratamento (Xilitol ou Soro), em relação aos escores, foi feito com o teste não paramétrico de Mann‐Whitney. Para a comparação dos momentos de avaliação (antes e depois), dentro de cada grupo, foi considerado o teste não paramétrico de Wilcoxon. Valores de p <0,05 indicaram significância estatística. Os dados foram analisados com o programa computacional Stata/SE v.14.1 (StataCorpLP, USA).
ResultadosA análise apresentada a seguir foi feita com base nas respostas obtidas de 52 pacientes: 26 usaram solução de xilitol (grupo Xilitol) e 26 usaram solução fisiológica (grupo Soro) após o procedimento cirúrgico.
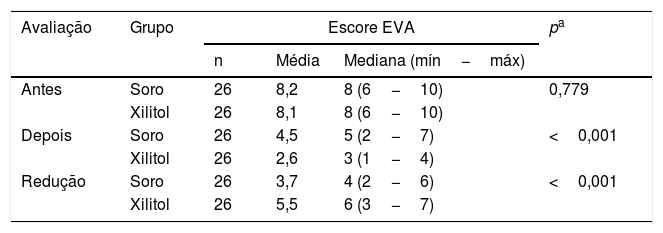
Comparação dos grupos em relação a escala de dor (EVA)Na tabela 2 são apresentadas estatísticas descritivas do escore EVA e os valores de p dos testes estatísticos.
Comparação dos grupos em relação aos resultados de avaliação de dor
| Avaliação | Grupo | Escore EVA | pa | ||
|---|---|---|---|---|---|
| n | Média | Mediana (mín−máx) | |||
| Antes | Soro | 26 | 8,2 | 8 (6−10) | 0,779 |
| Xilitol | 26 | 8,1 | 8 (6−10) | ||
| Depois | Soro | 26 | 4,5 | 5 (2−7) | <0,001 |
| Xilitol | 26 | 2,6 | 3 (1−4) | ||
| Redução | Soro | 26 | 3,7 | 4 (2−6) | <0,001 |
| Xilitol | 26 | 5,5 | 6 (3−7) | ||
EVA, Escala Visual Analógica; Máx, Máximo; Mín, Mínimo.
Foram obtidos resultados semelhantes quanto à avaliação de dor antes da cirurgia (p=0,779). Após o procedimento cirúrgico, encontramos diferença significativa entre os dois grupos quanto aos valores da escala de dor (p <0,001). Da mesma forma, ao comparar os grupos quanto à redução no escore EVA, foi encontrada diferença significativa entre eles (p <0,001).
O grupo Xilitol apresentou uma redução média de 5,5 pontos, maior do que essa redução para o grupo Soro (média de 3,7 pontos). Em seguida, dentro de cada grupo, foram comparados os escores EVA de antes da cirurgia com aqueles depois da cirurgia. Para ambos os grupos foi encontrada diferença significativa entre as duas avaliações de EVA (grupo Soro: p <0,001 e grupo Xilitol: p <0,001).
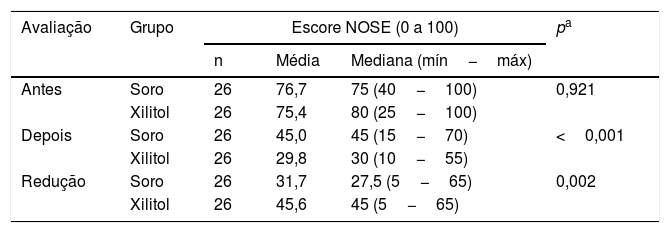
Comparação dos grupos em relação aos sintomas de obstrução nasal (NOSE)Após o procedimento cirúrgico, foi encontrada diferença significativa entre os dois grupos (p <0,001); (tabela 3). Foram agrupadas as classificações “normal” e “leve” e as classificações “acentuadas” e “severas”. Da mesma forma, ao comparar os grupos quanto à redução no escore NOSE, foi encontrada diferença significativa entre eles (p=0,002). O grupo Xilitol apresentou uma redução média de 45,6 pontos, maior do que essa redução para o grupo Soro (média de 31,7 pontos); (tabela 4). Em seguida, dentro de cada grupo, foram comparados os escores NOSE de antes da cirurgia com aqueles depois da cirurgia. Para tanto, testou‐se a hipótese nula de que os resultados são iguais nas duas avaliações versus a hipótese opcional de resultados diferentes. Para ambos os grupos foi encontrada diferença significativa entre as duas avaliações de NOSE (grupo Soro: p <0,001 e grupo Xilitol: p <0,001).
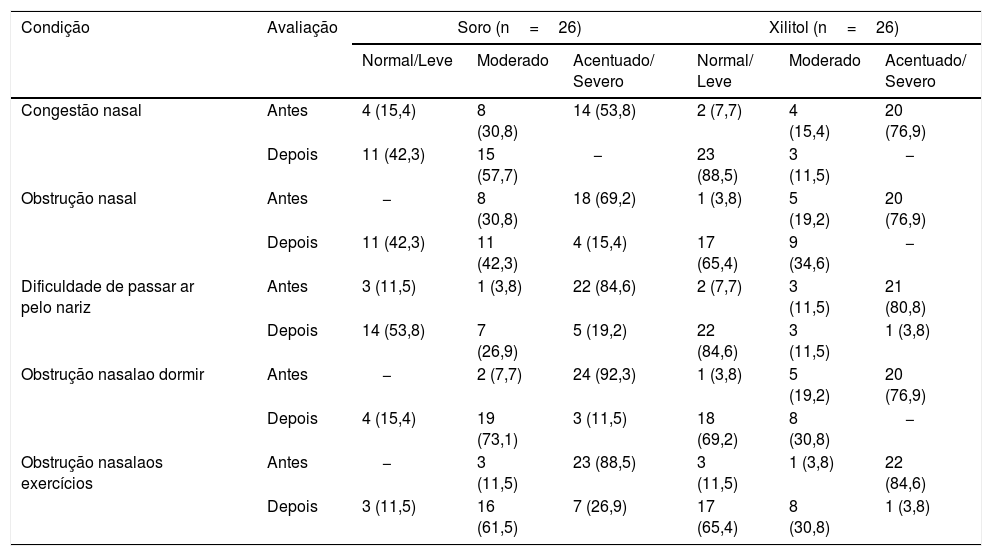
Resultados descritivos de cada uma das perguntas do NOSE
| Condição | Avaliação | Soro (n=26) | Xilitol (n=26) | ||||
|---|---|---|---|---|---|---|---|
| Normal/Leve | Moderado | Acentuado/ Severo | Normal/ Leve | Moderado | Acentuado/ Severo | ||
| Congestão nasal | Antes | 4 (15,4) | 8 (30,8) | 14 (53,8) | 2 (7,7) | 4 (15,4) | 20 (76,9) |
| Depois | 11 (42,3) | 15 (57,7) | − | 23 (88,5) | 3 (11,5) | − | |
| Obstrução nasal | Antes | − | 8 (30,8) | 18 (69,2) | 1 (3,8) | 5 (19,2) | 20 (76,9) |
| Depois | 11 (42,3) | 11 (42,3) | 4 (15,4) | 17 (65,4) | 9 (34,6) | − | |
| Dificuldade de passar ar pelo nariz | Antes | 3 (11,5) | 1 (3,8) | 22 (84,6) | 2 (7,7) | 3 (11,5) | 21 (80,8) |
| Depois | 14 (53,8) | 7 (26,9) | 5 (19,2) | 22 (84,6) | 3 (11,5) | 1 (3,8) | |
| Obstrução nasalao dormir | Antes | − | 2 (7,7) | 24 (92,3) | 1 (3,8) | 5 (19,2) | 20 (76,9) |
| Depois | 4 (15,4) | 19 (73,1) | 3 (11,5) | 18 (69,2) | 8 (30,8) | − | |
| Obstrução nasalaos exercícios | Antes | − | 3 (11,5) | 23 (88,5) | 3 (11,5) | 1 (3,8) | 22 (84,6) |
| Depois | 3 (11,5) | 16 (61,5) | 7 (26,9) | 17 (65,4) | 8 (30,8) | 1 (3,8) | |
Análise comparativa dos escores NOSE
| Avaliação | Grupo | Escore NOSE (0 a 100) | pa | ||
|---|---|---|---|---|---|
| n | Média | Mediana (mín−máx) | |||
| Antes | Soro | 26 | 76,7 | 75 (40−100) | 0,921 |
| Xilitol | 26 | 75,4 | 80 (25−100) | ||
| Depois | Soro | 26 | 45,0 | 45 (15−70) | <0,001 |
| Xilitol | 26 | 29,8 | 30 (10−55) | ||
| Redução | Soro | 26 | 31,7 | 27,5 (5−65) | 0,002 |
| Xilitol | 26 | 45,6 | 45 (5−65) | ||
Máx, Máximo; Mín, Mínimo.
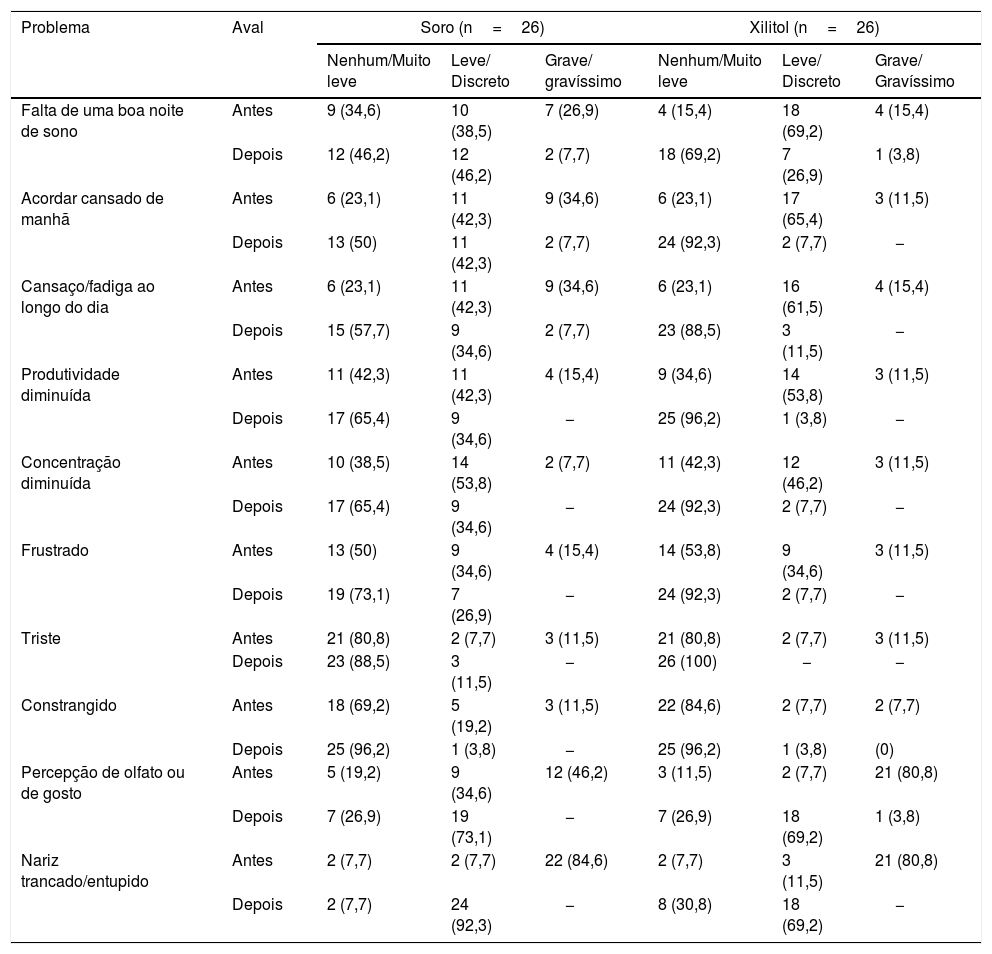
Nas tabelas 5 e 6, para cada problema ou condição avaliados, são apresentados frequências e percentuais de pacientes de acordo como tratamento (Soro ou Xilitol), para as avaliações antes e depois da cirurgia.
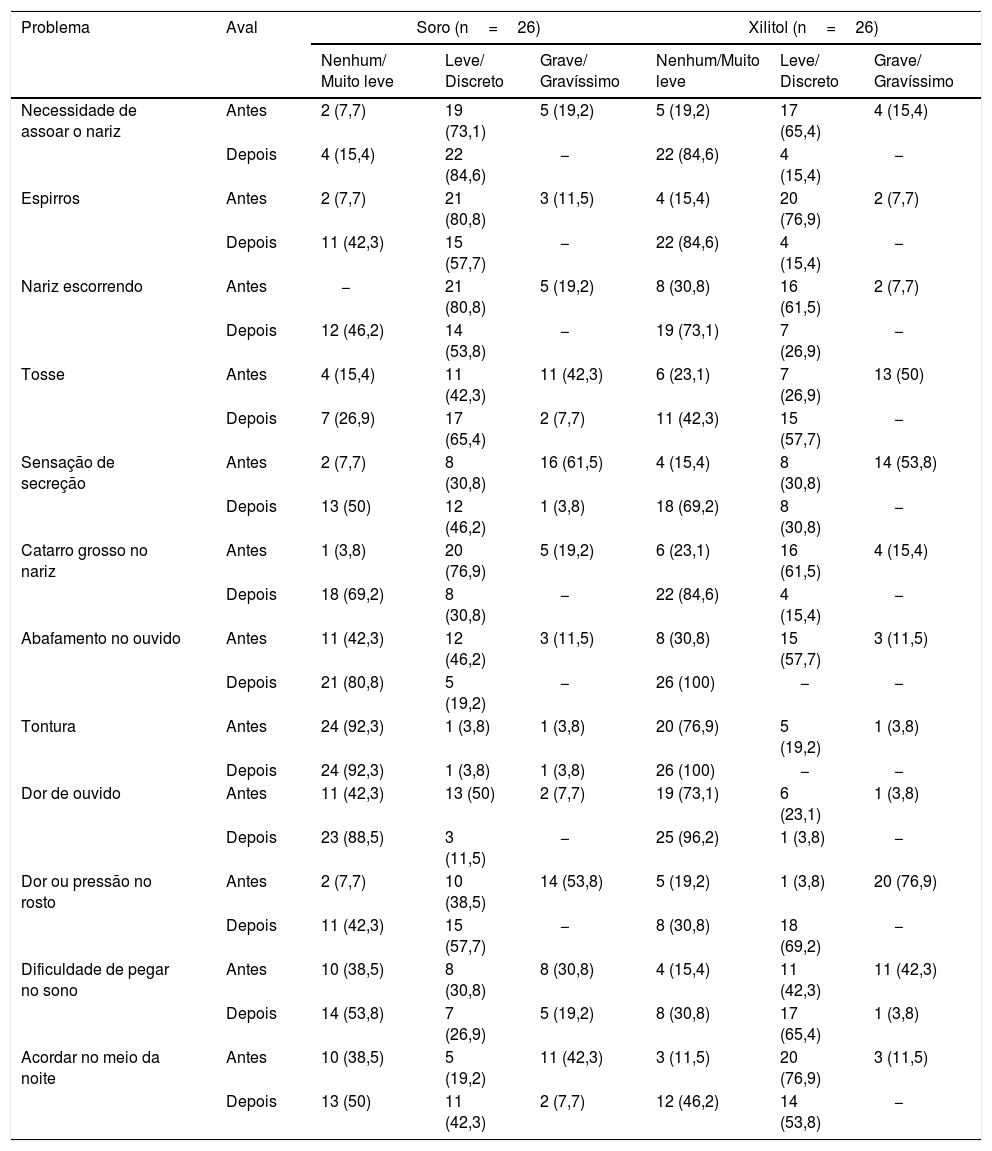
Resultados descritivos de cada uma das perguntas do SNOT‐22 (problema)
| Problema | Aval | Soro (n=26) | Xilitol (n=26) | ||||
|---|---|---|---|---|---|---|---|
| Nenhum/ Muito leve | Leve/ Discreto | Grave/ Gravíssimo | Nenhum/Muito leve | Leve/ Discreto | Grave/ Gravíssimo | ||
| Necessidade de assoar o nariz | Antes | 2 (7,7) | 19 (73,1) | 5 (19,2) | 5 (19,2) | 17 (65,4) | 4 (15,4) |
| Depois | 4 (15,4) | 22 (84,6) | − | 22 (84,6) | 4 (15,4) | − | |
| Espirros | Antes | 2 (7,7) | 21 (80,8) | 3 (11,5) | 4 (15,4) | 20 (76,9) | 2 (7,7) |
| Depois | 11 (42,3) | 15 (57,7) | − | 22 (84,6) | 4 (15,4) | − | |
| Nariz escorrendo | Antes | − | 21 (80,8) | 5 (19,2) | 8 (30,8) | 16 (61,5) | 2 (7,7) |
| Depois | 12 (46,2) | 14 (53,8) | − | 19 (73,1) | 7 (26,9) | − | |
| Tosse | Antes | 4 (15,4) | 11 (42,3) | 11 (42,3) | 6 (23,1) | 7 (26,9) | 13 (50) |
| Depois | 7 (26,9) | 17 (65,4) | 2 (7,7) | 11 (42,3) | 15 (57,7) | − | |
| Sensação de secreção | Antes | 2 (7,7) | 8 (30,8) | 16 (61,5) | 4 (15,4) | 8 (30,8) | 14 (53,8) |
| Depois | 13 (50) | 12 (46,2) | 1 (3,8) | 18 (69,2) | 8 (30,8) | − | |
| Catarro grosso no nariz | Antes | 1 (3,8) | 20 (76,9) | 5 (19,2) | 6 (23,1) | 16 (61,5) | 4 (15,4) |
| Depois | 18 (69,2) | 8 (30,8) | − | 22 (84,6) | 4 (15,4) | − | |
| Abafamento no ouvido | Antes | 11 (42,3) | 12 (46,2) | 3 (11,5) | 8 (30,8) | 15 (57,7) | 3 (11,5) |
| Depois | 21 (80,8) | 5 (19,2) | − | 26 (100) | − | − | |
| Tontura | Antes | 24 (92,3) | 1 (3,8) | 1 (3,8) | 20 (76,9) | 5 (19,2) | 1 (3,8) |
| Depois | 24 (92,3) | 1 (3,8) | 1 (3,8) | 26 (100) | − | − | |
| Dor de ouvido | Antes | 11 (42,3) | 13 (50) | 2 (7,7) | 19 (73,1) | 6 (23,1) | 1 (3,8) |
| Depois | 23 (88,5) | 3 (11,5) | − | 25 (96,2) | 1 (3,8) | − | |
| Dor ou pressão no rosto | Antes | 2 (7,7) | 10 (38,5) | 14 (53,8) | 5 (19,2) | 1 (3,8) | 20 (76,9) |
| Depois | 11 (42,3) | 15 (57,7) | − | 8 (30,8) | 18 (69,2) | − | |
| Dificuldade de pegar no sono | Antes | 10 (38,5) | 8 (30,8) | 8 (30,8) | 4 (15,4) | 11 (42,3) | 11 (42,3) |
| Depois | 14 (53,8) | 7 (26,9) | 5 (19,2) | 8 (30,8) | 17 (65,4) | 1 (3,8) | |
| Acordar no meio da noite | Antes | 10 (38,5) | 5 (19,2) | 11 (42,3) | 3 (11,5) | 20 (76,9) | 3 (11,5) |
| Depois | 13 (50) | 11 (42,3) | 2 (7,7) | 12 (46,2) | 14 (53,8) | − | |
Resultados descritivos de cada uma das perguntas do SNOT‐22
| Problema | Aval | Soro (n=26) | Xilitol (n=26) | ||||
|---|---|---|---|---|---|---|---|
| Nenhum/Muito leve | Leve/ Discreto | Grave/ gravíssimo | Nenhum/Muito leve | Leve/ Discreto | Grave/ Gravíssimo | ||
| Falta de uma boa noite de sono | Antes | 9 (34,6) | 10 (38,5) | 7 (26,9) | 4 (15,4) | 18 (69,2) | 4 (15,4) |
| Depois | 12 (46,2) | 12 (46,2) | 2 (7,7) | 18 (69,2) | 7 (26,9) | 1 (3,8) | |
| Acordar cansado de manhã | Antes | 6 (23,1) | 11 (42,3) | 9 (34,6) | 6 (23,1) | 17 (65,4) | 3 (11,5) |
| Depois | 13 (50) | 11 (42,3) | 2 (7,7) | 24 (92,3) | 2 (7,7) | − | |
| Cansaço/fadiga ao longo do dia | Antes | 6 (23,1) | 11 (42,3) | 9 (34,6) | 6 (23,1) | 16 (61,5) | 4 (15,4) |
| Depois | 15 (57,7) | 9 (34,6) | 2 (7,7) | 23 (88,5) | 3 (11,5) | − | |
| Produtividade diminuída | Antes | 11 (42,3) | 11 (42,3) | 4 (15,4) | 9 (34,6) | 14 (53,8) | 3 (11,5) |
| Depois | 17 (65,4) | 9 (34,6) | − | 25 (96,2) | 1 (3,8) | − | |
| Concentração diminuída | Antes | 10 (38,5) | 14 (53,8) | 2 (7,7) | 11 (42,3) | 12 (46,2) | 3 (11,5) |
| Depois | 17 (65,4) | 9 (34,6) | − | 24 (92,3) | 2 (7,7) | − | |
| Frustrado | Antes | 13 (50) | 9 (34,6) | 4 (15,4) | 14 (53,8) | 9 (34,6) | 3 (11,5) |
| Depois | 19 (73,1) | 7 (26,9) | − | 24 (92,3) | 2 (7,7) | − | |
| Triste | Antes | 21 (80,8) | 2 (7,7) | 3 (11,5) | 21 (80,8) | 2 (7,7) | 3 (11,5) |
| Depois | 23 (88,5) | 3 (11,5) | − | 26 (100) | − | − | |
| Constrangido | Antes | 18 (69,2) | 5 (19,2) | 3 (11,5) | 22 (84,6) | 2 (7,7) | 2 (7,7) |
| Depois | 25 (96,2) | 1 (3,8) | − | 25 (96,2) | 1 (3,8) | (0) | |
| Percepção de olfato ou de gosto | Antes | 5 (19,2) | 9 (34,6) | 12 (46,2) | 3 (11,5) | 2 (7,7) | 21 (80,8) |
| Depois | 7 (26,9) | 19 (73,1) | − | 7 (26,9) | 18 (69,2) | 1 (3,8) | |
| Nariz trancado/entupido | Antes | 2 (7,7) | 2 (7,7) | 22 (84,6) | 2 (7,7) | 3 (11,5) | 21 (80,8) |
| Depois | 2 (7,7) | 24 (92,3) | − | 8 (30,8) | 18 (69,2) | − | |
Foram agrupadas as classificações “nenhum problema” e “problema muito leve”, as classificações “problema leve ou discrete” e “problema moderado” e as classificações “problema grave” e “problema gravíssimo”.
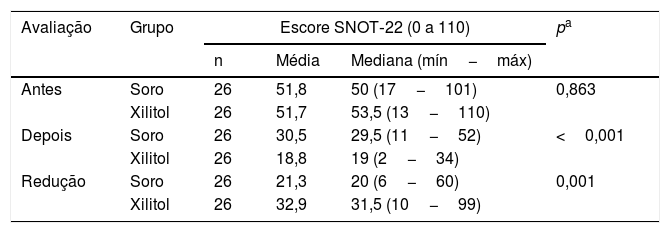
Os resultados indicam grupos homogêneos na avaliação de qualidade de vida pelo SNOT‐22 antes da cirurgia (p=0,863). Após, foi encontrada diferença significativa entre eles (p <0,001). Da mesma forma, ao comparar os grupos quanto à redução no escore SNOT‐22, foi encontrada diferença significativa entre eles (p=0,001). O grupo Xilitol apresentou uma redução média de 32,9 pontos, maior do que a redução para o grupo Soro (média de 21,3 pontos).
Em seguida, dentro de cada grupo, foram comparados os escores SNOT‐22 de antes da cirurgia com aqueles depois da cirurgia. Para ambos os grupos foi encontrada diferença significativa entre as duas avaliações de SINOT‐22 (grupo Soro: p <0,001 e grupo Xilitol: p <0,001); (tabela 7).
Análise comparativa dos escores SNOT‐22
| Avaliação | Grupo | Escore SNOT‐22 (0 a 110) | pa | ||
|---|---|---|---|---|---|
| n | Média | Mediana (mín−máx) | |||
| Antes | Soro | 26 | 51,8 | 50 (17−101) | 0,863 |
| Xilitol | 26 | 51,7 | 53,5 (13−110) | ||
| Depois | Soro | 26 | 30,5 | 29,5 (11−52) | <0,001 |
| Xilitol | 26 | 18,8 | 19 (2−34) | ||
| Redução | Soro | 26 | 21,3 | 20 (6−60) | 0,001 |
| Xilitol | 26 | 32,9 | 31,5 (10−99) | ||
Máx, Máximo; Mín, Mínimo.
O presente estudo prospectivo demonstrou que o grupo de pacientes que fez uso de solução de xilitol no período pós‐operatório de cirurgia endoscópica endonasal apresentou melhoria significativa dos sintomas de dor (através da escala analógica visual) e de sintomas nasais (através dos questionários NOSE e SNOT‐22). Weissman et al. (2011) demonstraram a eficácia da irrigação de xilitol na melhoria dos sintomas nasais em pacientes com RSC.17 Porém, o tratamento foi feito por somente 10 dias. Lin et al. (2017) também demonstraram a superioridade da irrigação nasal com solução de xilitol em relação a solução salina entre pacientes com RSC. A solução de xilitol foi preparada com uma concentração de 5% e ambos os grupos usaram suas respectivas soluções por um período de 30 dias.18
O xilitol é uma substância atóxica e bem tolerada com doses diárias seguras sem apresentar efeitos adversos já estabelecidas.5,21 O xilitol apresenta diversos efeitos terapêuticos, interfere no crescimento da Streptococcus pneumoniae e Haemophilus influenzae7,22 e adesão bacterianos,10,22–24 aumento da imunidade inata,13 aumento da produção de óxido nítrico15,25 e inibição da formação do biofilme.16,26 Ammons et al.26,27 (em 2009 e 2011) fizeram uma série de estudos em que demonstraram a capacidade do xilitol de dissolver a estrutura do biofilme de Pseudomonas aeruginosa. O biofilme dessa bactéria tem alta relevância clínica no ser humano (altamente prevalente nos casos de RSC) e é um dos que apresentam mais resistência aos antimicrobianos comuns.26 Em estudo anterior, Katsuyama et al. (2005) já haviam demonstrado a eficácia do xilitol (em concentração de 5%) em inibir a formação do biofilme de Staphylococcus aureus, principalmente pela inibição da formação do glicocálix.28
Diversos estudos experimentais evidenciaram o potencial benéfico do xilitol, redução da aderência da S. pneumoniae in vitro,29 redução na formação de biofilme pelo pneumococo30 e redução na concentração de P. aeruginosa em seios maxilares de coelhos inoculados.2 Os efeitos terapêuticos do xilitol na via aérea podem ser identificados em períodos curtos. Zabner et al. (2000) demonstraram aumento da atividade do sistema imune na mucosa nasal de 21 sujeitos saudáveis que fizeram uso de solução com xilitol por apenas quatro dias.15 De forma análoga, Weissman et al. e Lin et al. observaram resultados satisfatórios com curtos períodos de uso da solução nasal de xilitol.17,18 Essa característica nos faz pensar que o uso da solução de xilitol pode ser orientado e prescrito por um curto intervalo, aumenta a adesão e a qualidade de vida dos pacientes. No presente estudo, a escolha do intervalo de tempo para uso da solução de xilitol (30 dias) foi feita de forma aleatória. Acreditamos, porém, que novos estudos para avaliar o intervalo de tempo mínimo ideal para obtenção do maior grau de satisfação dos pacientes ainda são necessários.
Diversas outras formas de irrigação nasal já foram propostas para a mesma finalidade. Giotakis et al. (2016) randomizaram o uso de solução fisiológica entre 174 sujeitos submetidos a FESS e observaram melhoria importante dos sintomas nasais entre os sujeitos do grupo que fez uso sistemático da irrigação nasal (somente solução fisiológica a 0,9%).31 Mais interessante, observaram que após 3 meses de irrigação nasal os efeitos benéficos já não eram diferentes entre os dois grupos.31 Kosugi et al. (2016) obtiveram melhoria significativa entre 16 sujeitos orientados a fazer irrigação nasal com budesonida em alto volume (1mg de budesonida diluído em 500 mL de soro fisiológico a cada dois dias) nos escores do questionário SNOT‐22 e classificação endoscópica Lund‐Kennedy, após 3 meses de terapia.32 Já o estudo de Low et al. (2014) avaliou os sintomas e o clearance mucociliar de 74 sujeitos adultos submetidos a FESS e orientados a fazer irrigação nasal com solução fisiológica (a 0,9%), Ringer lactato ou solução salina hipertônica (a 2,7%). Observaram que todos os grupos apresentaram melhoria dos scores clínicos (SNOT‐20 e EVA) e aspecto endoscópico da mucosa nasal após a sexta semana de pós‐operatório com irrigação nasal, porém sem impactar em melhoria do clearance mucociliar. Observaram, ainda, melhoria significativa dos sintomas com o uso de Ringer lactato.33 O xilitol, usado no presente estudo, mostrou‐se efetivo em reduzir os sintomas nasais (como observado pelos escores NOSE e SNOT‐22) de forma significante.
Baseado em estudos prévios, podemos especular que a melhoria dos sintomas dos pacientes estaria relacionada à melhoria dos mecanismos associados à fisiopatologia da RSC em si (por melhorar o clearance mucociliar e reduzir a formação do biofilme) e também à melhoria da cicatrização pós‐operatória. A cicatrização da mucosa nasal, após um trauma cirúrgico, envolve um complexo processo para reestabelecer a integridade anatômica e funcional das cavidades nasais e paranasais.34 Diversas soluções tópicas já foram testadas in vitro e in vivo (em modelos animais) com o objetivo de acelerar o processo cicatricial, bem como no tratamento clínico da RSC.34 A irrigação nasal tem seu uso no tratamento da rinossinusite e em pós‐operatórios de cirurgias nasais, por remover as secreções e debris, minimizar a formação de crostas e sinéquias e melhorar o transporte mucociliar.35,36 A lavagem nasal habitualmente feita é como solução salina isotônica a 0,9%. Entretanto, estudos feitos com soluções salinas hipertônicas relatam que essas substâncias alteram a pressão osmótica e dessa forma reduzem o edema e melhoram o clearance mucociliar.37
LimitaçõesO presente estudo apresentou algumas limitações. Primeiro, a amostra obtida foi pequena. Apesar de incluirmos 52 pacientes, outros estudos disponíveis na literatura contavam com quase 200 participantes. Segundo, o período em que os sujeitos incluídos no presente estudo apresentavam sintomas de RSC pode ter exercido alguma influência nos resultados apresentados. Ou seja, um sujeito com diagnóstico de RSC havia mais tempo pode ter tido menos sucesso terapêutico com a irrigação nasal com xilitol. Terceiro, fatores externos à pesquisa poderiam ter exercido efeitos sobre os resultados. Por exemplo, a ocupação, o local de residência, o tipo de residência, as comorbidades associadas, outras medicações em uso, entre outros. Outra limitação é que o efeito do xilitol nos sintomas nasais foi avaliado dentro de 30 dias após a cirurgia endoscópica endonasal. Outras suposições sobre o efeito do xilitol em longo prazo nos sintomas nasais não podem ser feitas. Por fim, o presente estudo se valeu de avaliações subjetivas dos sintomas (respondidas pelos sujeitos incluídos no estudo). A falta de parâmetros objetivos (comparações tomográficas antes e depois da cirurgia e das irrigações nasais, por exemplo) poderia ser considerada um viés do presente estudo. Porém, ressalta‐se que a feitura de imagens pós‐operatórias não tem cobertura dos planos de saúde no Brasil. Como seria uma infração ética onerar financeiramente os sujeitos incluídos no estudo, decidimos não fazer o procedimento radiológico após o período analisado.
ConclusãoO presente estudo mostrou que o uso de xilitol nas irrigações nasais no período pós‐operatório de FESS foi capaz de reduzir significativamente os sintomas nasais dos sujeitos envolvidos. O xilitol pode ser usado no período pós‐operatório de FESS sem causar efeitos colaterais, por levar a uma maior redução nos sintomas nasais. Estudos futuros, com maior número de sujeitos incluídos, randomizados quanto ao tipo de irrigação nasal e com medidas objetivas por meio de exames de imagem, devem ser feitos para adequado controle da RSC.
FinanciamentoNada a declarar.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Silva CF, Silva FE, Pauna HF, Hurtado JM, Santos MC. Symptom assessment after nasal irrigation with xylitol in the postoperative period of endonasal endoscopic surgery. Braz J Otorhinolaryngol. 2022;88:243–50.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.