Os efeitos anti‐inflamatórios dos macrolídeos são reconhecidos, principalmente da claritromicina para os pacientes com rinossinusite crônica sem pólipos e outras doenças inflamatórias crônicas das vias aéreas em outras populações. Não existe consenso na literatura quanto a sua prescrição para os pacientes de rinossinusite crônica com polipose nasossinusal e a literatura nacional não dispõe de estudos prospectivos sobre a eficácia da claritromicina na rinossinusite crônica em nossa população.
ObjetivoAvaliar o efeito da claritromicina no tratamento adjuvante da rinossinusite crônica recorrente com polipose nasossinusal refratária ao tratamento clínico e cirúrgico.
MétodoEstudo prospectivo aberto, com 52 pacientes, portadores de rinossinusite crônica com polipose nasossinusal recorrente. Todos os indivíduos receberam lavagem nasal com SF 0,9% 20 mL e fluticasona spray nasal, 200 mcg/dia, 12/12 horas por 12 semanas; e claritromicina 250 mg, de 8/8 horas, por 2 semanas e posteriormente 12/12 horas, por 10 semanas. Os pacientes foram avaliados através do SNOT 20, do NOSE e Lund‐Kennedy antes, pós‐tratamento imediato e 12 semanas após o tratamento. Os pacientes também foram avaliados antes do tratamento por tomografia computadorizada das cavidades paranasais (Lund‐Mackay) e dosagem sérica de IgG, IgM, IgA, IgE e eosinófilos. Os desfechos avaliados foram: SNOT‐20, NOSE e Lund‐Kennedy.
ResultadosA maioria dos pacientes era mulher, idade de 47 (15) anos (mediana/intervalo interquartílico) e 61,5% (32/52) portadores de asma. Todos os pacientes completaram o seguimento após 12 semanas e 42,3% (22/52) após 24 semanas. O tratamento resultou em uma diminuição quantitativa do SNOT‐20 [2,3 (1,6) vs. 1,4 (1,6); Δ=‐0,9 (1,1); p <0,01]; do NOSE [65 (64) vs. 20 (63); Δ=‐28 (38), p <0,01] e do Lund‐Kennedy [11 (05) vs. 07 (05); Δ=‐2 (05); p <0,01]. O SNOT‐20 mostrou uma melhoria qualitativa (> 0,8) em 54% (28/52, p <0,04) dos pacientes, grupo que evidenciou menor nível de IgE [108 (147) vs. 289 (355), p <0,01]. O grupo de pacientes que completou o seguimento 12 semanas após o término do tratamento (n=22) não mostrou uma pioria dos desfechos.
ConclusãoO uso prolongado adjuvante da claritromicina em baixas doses para pacientes com rinossinusite crônica com polipose nasossinusal recorrente refratária ao tratamento clínico e cirúrgico resultou em melhoria na qualidade de vida e endoscopia nasal, principalmente em pacientes com níveis de IgE normal. Essa melhoria se sustentou no grupo de pacientes avaliado 12 semanas após o término do tratamento.
A rinossinusite (RS) é uma das causas mais frequentes de queixas apresentadas em todas as visitas médicas nos Estados Unidos e uma das principais razões para prescrição de antibióticos e perda de produtividade laboral. Em cada 1.000 americanos são afetados 135 ou 31 milhões de pessoas são afetadas nos Estados Unidos a cada ano, com um custo total de seis bilhões de dólares ao ano.1–3 As RS são divididas em aguda (bacteriana), crônica com pólipos, crônica sem pólipos e fúngica alérgica.4 A rinossinusite crônica (RSC) com polipose nasossinusal (RSCcPN) é definida por critérios clínicos e endoscópicos. O paciente deverá relatar dois ou mais dos seguintes sintomas por um período superior a 12 semanas e um desses deverá ser um dos dois primeiros: a) Bloqueio ou congestão nasal; b) Secreção nasal anterior ou gotejamento nasal posterior; c) Dor ou pressão na face; d) Redução ou ausência de olfato.5 A endoscopia nasal deverá evidenciar polipose nasal bilateral.5,6 Um grupo desses pacientes apresenta RSCcPN recorrente, definida pela ausência de remissão após sinusectomia feita há mais de 6 meses e tratamento medicamentoso pós‐operatório contínuo com corticoides tópicos nasais, em spray, associados à solução salina nasal isotônica.5 Existem algumas opções de tratamentos para esse grupo de pacientes, porém nenhuma é efetiva para todos os casos.
Os macrolídeos (MAC) são uma opção com ação anti‐inflamatória para o tratamento da RSC. Embora a primeira publicação sobre a prescrição dessa classe de drogas como antibiótico por Kataura et al. tenha sido em 1965, a primeira publicação do seu uso como anti‐inflamatório nas doenças crônicas das vias aéreas superiores foi em 1993.7 Nenhum efeito bactericida estaria associado com a ação nessas doenças crônicas, visto que os níveis séricos máximos durante a terapia estariam abaixo da concentração inibitória mínima das bactérias isoladas clinicamente8 e o tratamento é efetivo em pacientes infectados com cepas de bactérias resistentes a MAC, como Pseudomonas aeruginosa.9 Zeng et al. mostraram que a claritromicina (CLA) exerceria efeito anti‐inflamatório semelhante à dexametasona nos pacientes com RSC: aumento de mediadores anti‐inflamatórios e diminuição da produção de resposta Th1 e Th2da mucosa nasossinusal.10 Enquanto o uso da claritromicina pelos pacientes com RSCcPN é controverso, estudos recentes mostraram um resultado muito superior no uso prolongado dessa droga para os pacientes com RSCsPN. Contudo, estudos recentes mostraram a diversidade de endótipos nas populações de pacientes com RSCcPN e não temos conhecimento da distribuição desses endótipos no Brasil.11
Estudos abertos com grupo controle mostraram recentemente o efeito do uso prolongado de claritromicina em pacientes com RSCcPN para prevenir recorrência logo após sinusectomia.12 Não há na literatura estudos que analisem o efeito da CLA na qualidade de vida de pacientes com RSCcPN no Brasil.
ObjetivoAvaliar o efeito da claritromicina em baixas doses por 12 semanas na qualidade de vida em pacientes com rinossinusite crônica recorrente com polipose nasossinusal refratária ao tratamento clínico e cirúrgico.
MétodoEstudo prospectivo aberto, autopareado, feito em hospital terciário da cidade de São Paulo, de 2011 a 2012 após aprovação do Comitê de Ética em Pesquisa (0523/08). Incluímos pacientes a partir de 18 anos portadores de RSCcPN recorrente, definida pela ausência de remissão da RSC após sinusectomia feita há mais de seis meses e tratamento medicamentoso pós‐operatório contínuo com corticoides tópicos nasais, em spray, associados à solução salina nasal isotônica.
A medicação em uso durante o ano após a cirurgia foi irrigação nasal com 20 mL de soro fisiológico 0,9% em cada narina, 2 vezes ao dia, e propionato de fluticasona, spray nasal, 100 mcg em cada narina 2 vezes ao dia. A partir de 3 meses antes do início e durante o período do estudo o paciente foi orientado a não usar corticoides sistêmicos, antibiótico local ou antibiótico sistêmico.
Os critérios de exclusão foram: causas secundárias de RSC; perfuração septal; antecedentes de trauma ou fraturas nasais; imunodeficiências primárias ou secundárias; síndrome craniofacial; gestantes; doença granulomatosa nasal; tumores malignos; pós‐radioterapia de cabeça e pescoço.
Protocolo de estudoForam incluídos 52 pacientes consecutivos atendidos no período do estudo. Todos adicionaram ao esquema terapêutico e doses descritas acima para irrigação nasal com soro fisiológico e fluticasona spray nasal o uso da CLA. Ela foi prescrita na dose de 250 mg, via oral, de 8 em 8 horas, por 2 semanas e posteriormente 250 mg, via oral, de 12 em 12 horas, por 10 semanas. As avaliações iniciais incluíram anamnese completa, avaliação de qualidade de vida, com o SNOT‐20 e NOSE, endoscopia nasal (classificado de acordo com os critérios de Lund‐Kennedy), tomografia computadorizada das cavidades paranasais (classificada de acordo com os critérios de Lund‐Mackay) e dosagem sérica de IgG, IgM, IgA, IgE e eosinófilos. Em caso de dúvida no preenchimento dos questionários de qualidade de vida, como, por exemplo, no uso da escala ou nos termos relacionados ao sintoma, médico assistente sem conhecimento do exame endoscópico prévio e antes do novo exame endoscópico auxiliou informativamente no entendimento dos formulários, sem influenciar nos resultados. Os pacientes também foram investigados para diagnósticos concomitantes de rinite, segundo teste cutâneo e IgE específico; asma, segundo critérios da Sociedade Americana de Tórax; e DREA, segundo história clínica.
Todos os pacientes concluíram a avaliação após 3 meses de tratamento (12 semanas) e 43,4% (22/52) completaram o seguimento 3 meses após o término do tratamento (24 semanas). Os desfechos avaliados após o tratamento (12 semanas) e 12 semanas após o término do tratamento (24 semanas) foram a melhoria qualitativa e quantitativa do SNOT‐20 e a melhoria quantitativa do NOSE, do Lund‐Kennedy e a magnitude do efeito. A melhoria qualitativa do SNOT‐20 foi definida por uma redução> 0,8da pontuação total do SNOT‐20.
Os pacientes também foram avaliados de forma exploratória quanto à associação entre o desfecho e a avaliação pré‐operatória. Os efeitos colaterais foram explicados no termo de consentimento esclarecido e a cada avaliação, durante o estudo, os pacientes eram interrogados sobre o aparecimento dos mesmos.
Análise estatísticaO teste t de Wilcoxon foi usado para comparar os valores. Dados dicotômicos foram analisados pelo qui‐quadrado ou teste exato de Fisher. O teste binomial foi usado para avaliar a melhoria qualitativa no SNOT‐20. O p <0,05 foi considerado estatisticamente significativo. A magnitude de efeito 12 semanas após o início do tratamento foi comparada com as padronizações previamente publicadas: 0,2; 0,5; 0,8 representaram, respectivamente, uma melhoria leve, moderada e alta.
ResultadosOs pacientes apresentaram idade de 47 (15) anos (mediana/intervalo interquartil), eram em sua maioria mulheres (27/25) e 61,5% (32/52) portadores de asma (tabela 1). Todos os pacientes completaram o seguimento após 12 semanas e 22 pacientes após 24 semanas.
Dados dos pacientes avaliados no estudo
| Variáveis | n=52 |
|---|---|
| Idade | 47 (15)a |
| Gênero (H/M) | 0,93 (25/27) |
| Asma | 61,5% (32/52) |
| DREA | 36,5% (20/52) |
| Rinite | 30,8% (16/52) |
H, Homem; M, Mulher; DREA, Doença Respiratória Exacerbada por Aspirina.
O tratamento com CLA resultou em uma diminuição quantitativa na pontuação do SNOT‐20 [2,3 (1,6) vs. 1,4 (1,6); p <0,01]; do NOSE [65 (64) vs. 20 (63); p <0,01] e do Lund‐Kennedy [11 (05) vs. 07 (05); p <0,01], após 12 semanas de tratamento. Evidenciou‐se também que 53,8% (28/52) dos pacientes apresentaram uma melhoria qualitativa do SNOT‐20 (p <0,04).
No grupo de pacientes que completou o seguimento 12 semanas após o término do tratamento (n=22) não se evidenciou após 12 semanas do término do medicamento uma alteração estatisticamente significativa no SNOT‐20 e NOSE, mas se evidenciou uma diminuição no Lund‐Kennedy [7 (5) vs. 5 (8); p <0,01]. A magnitude de efeito no SNOT‐20 foi 0,81 e no NOSE foi 0,83 (tabelas 2 e 3).
Desfechos após tratamento clínico com claritromicina – mediana (intervalo interquartil)
| Pré‐tratamento | Pós‐tratamento | Melhoria após tratamento | |
|---|---|---|---|
| SNOT‐20 | 2,3 (1,6) | 1,4 (1,6) | ‐0,9 (1,1) |
| Melhoria clinicamente significativa no SNOT‐20 | 53,8% (28/52) | ||
| NOSE | 65 (64) | 20 (63) | ‐28 (38) |
| Lund‐Kennedy | 11 (05) | 07 (05) | ‐2 (05) |
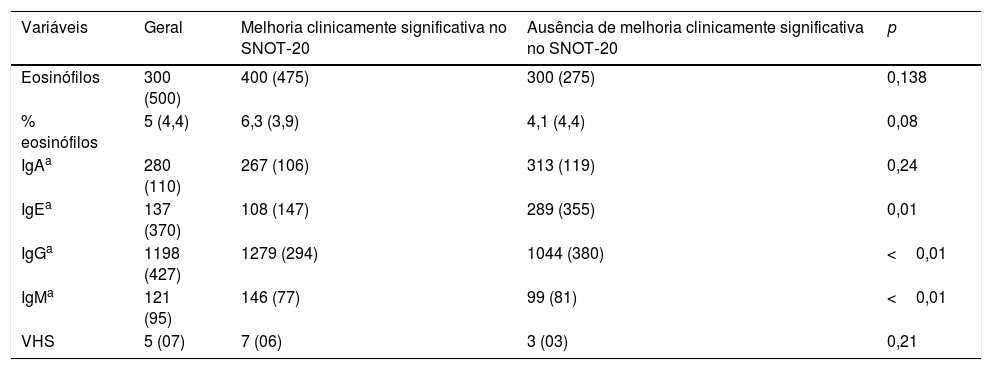
Ao avaliar os dados pré‐tratamento mais associados à melhoria clínica após uso da CLA, observou‐se um menor nível de IgE [108 (147) vs. 289 (355); p <0,01) quando comparado aos pacientes sem resposta a CLA. Evidenciou‐se também nos pacientes que apresentaram uma melhoria clinicamente significativa uma maior dosagem sérica de IgG [1279 (294) vs. 1044 (380); p <0,01)] e IgM [146 (77) vs. 99 (81); p <0,01)] (tabela 4).
Resultados dos exames laboratoriais pré‐operatórios conforme a melhoria clinicamente significativa no SNOT‐20 (diminuição na pontuação maior que 0,8)
| Variáveis | Geral | Melhoria clinicamente significativa no SNOT‐20 | Ausência de melhoria clinicamente significativa no SNOT‐20 | p |
|---|---|---|---|---|
| Eosinófilos | 300 (500) | 400 (475) | 300 (275) | 0,138 |
| % eosinófilos | 5 (4,4) | 6,3 (3,9) | 4,1 (4,4) | 0,08 |
| IgAa | 280 (110) | 267 (106) | 313 (119) | 0,24 |
| IgEa | 137 (370) | 108 (147) | 289 (355) | 0,01 |
| IgGa | 1198 (427) | 1279 (294) | 1044 (380) | <0,01 |
| IgMa | 121 (95) | 146 (77) | 99 (81) | <0,01 |
| VHS | 5 (07) | 7 (06) | 3 (03) | 0,21 |
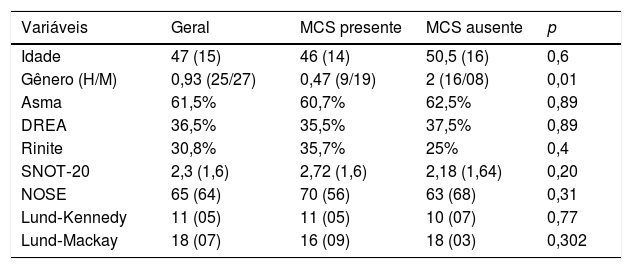
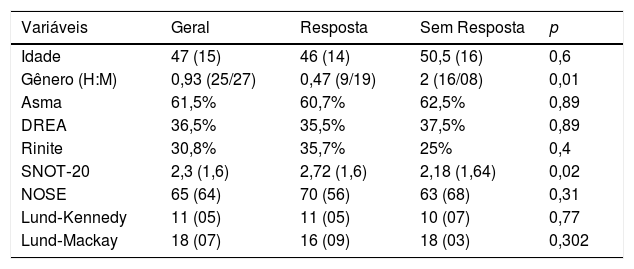
Não se evidenciou uma diferença na avaliação pré‐tratamento, entre os grupos, quanto à presença de asma, DREA, rinite, pontuação de SNOT‐20, NOSE, Lund‐Kennedy ou de Lund‐Mackay (tabelas 5 e 6).
Variáveis pré‐operatórias conforme a Melhoia Clinicamente Significativa (MCS) no SNOT‐20 (diminuição na pontuação maior que 0,8)
| Variáveis | Geral | MCS presente | MCS ausente | p |
|---|---|---|---|---|
| Idade | 47 (15) | 46 (14) | 50,5 (16) | 0,6 |
| Gênero (H/M) | 0,93 (25/27) | 0,47 (9/19) | 2 (16/08) | 0,01 |
| Asma | 61,5% | 60,7% | 62,5% | 0,89 |
| DREA | 36,5% | 35,5% | 37,5% | 0,89 |
| Rinite | 30,8% | 35,7% | 25% | 0,4 |
| SNOT‐20 | 2,3 (1,6) | 2,72 (1,6) | 2,18 (1,64) | 0,20 |
| NOSE | 65 (64) | 70 (56) | 63 (68) | 0,31 |
| Lund‐Kennedy | 11 (05) | 11 (05) | 10 (07) | 0,77 |
| Lund‐Mackay | 18 (07) | 16 (09) | 18 (03) | 0,302 |
Avaliação pré‐tratamento conforme a resposta clínica quanto a presença de asma, DREA, rinite, pontuação de SNOT‐20, NOSE, Lund‐Kennedy ou de Lund‐Mackay
| Variáveis | Geral | Resposta | Sem Resposta | p |
|---|---|---|---|---|
| Idade | 47 (15) | 46 (14) | 50,5 (16) | 0,6 |
| Gênero (H:M) | 0,93 (25/27) | 0,47 (9/19) | 2 (16/08) | 0,01 |
| Asma | 61,5% | 60,7% | 62,5% | 0,89 |
| DREA | 36,5% | 35,5% | 37,5% | 0,89 |
| Rinite | 30,8% | 35,7% | 25% | 0,4 |
| SNOT‐20 | 2,3 (1,6) | 2,72 (1,6) | 2,18 (1,64) | 0,02 |
| NOSE | 65 (64) | 70 (56) | 63 (68) | 0,31 |
| Lund‐Kennedy | 11 (05) | 11 (05) | 10 (07) | 0,77 |
| Lund‐Mackay | 18 (07) | 16 (09) | 18 (03) | 0,302 |
O uso da CLA em baixas doses por longo prazo resultou em uma melhoria da qualidade de vida na doença específica relacionada à rinossinusite (SNOT‐20), à obstrução nasal (NOSE) e à endoscopia nasal (Lund‐Kennedy). Não houve pioria dos sintomas no grupo de pacientes que completou o seguimento após 3 meses do término do tratamento (n=22).
Corticoides tópicos nasais em spray são a primeira opção de tratamento para os pacientes com RSCcPN, apoiados por níveis elevados de evidências. Entretanto, um número significativo de pacientes não apresenta resposta satisfatória a essa droga. O EPOS define os pacientes como RSCcPN de difícil controle quando não apresentam resolução dos sintomas após cirurgia seguida de corticoide spray nasal, são necessários pelo menos dois cursos curtos de antibióticos ou corticoides sistêmicos no último ano.5
Esses pacientes podem precisar de tratamento opcional, de preferência não cirúrgico. Nosso estudo evidencia que nos pacientes com RSCcPN e baixos níveis de IgE, a CLA é uma opção associada a um bom resultado, proporciona resposta satisfatória em mais da metade dos pacientes.
O mecanismo de ação da terapia prolongada com MAC permanece uma questão aberta. Investigações prévias têm focado nas suas várias propriedades anti‐inflamatórias, como suprimir a exsudação dos neutrófilos no tecido13 e a proliferação dos fibroblastos nos pólipos nasais;14 inibir a resposta proliferativa dos linfócitos T CD4+de forma similar à apresentada na presença da prednisolona; e suprimir a resposta imune antígeno‐específica das células dendríticas.14,15 Nas citocinas do local da inflamação, provoca uma redução de IL‐8,16 de RANKL, de GM‐CSF,17 de AP‐1,18 de IFN‐γ, de ICAM‐1 e de IgE.15,19,20 Também reduz a síntese de DNA no epitélio nasal exposto a endotoxinas,21 diminui a secreção de água e muco pela mucosa nasal,22 melhora o clearence mucociliar em pacientes com síndrome sino‐bronquial e as propriedades reológicas do muco nasal,23 além de inibir a formação de biofilme por Pseudomonas aeruginosa e a transcrição de MUC5AC induzida por TNF‐α.24
Um macrolídeo já estudado para a RSC, a azitromicina, tem uso controverso. Videler et al. mostraram em um ensaio clínico a ausência de benefício significativo no uso da azitromicina para pacientes com RSC sem diferenciar quanto à presença de pólipos.25 Contudo, outro ensaio clínico evidenciou um melhor resultado com o uso dessa medicação durante o período pós‐operatório.26 Oliveira et al. publicaram recentemente no Brasil um estudo autopareado que evidenciou uma melhoria clínica significativa para os pacientes com RSCcPN eosinofílica com azitromicina. Contudo, esse grupo é diverso do que apresentou melhor resultado no presente estudo e na literatura, com perfil menos eosinofílico.11 A definição futura dos perfis endotípicos mais prevalentes em cada região geográfica do Brasil provavelmente nos auxiliará a entender melhor essa diferença de resultados.
Evidenciamos um melhor resultado para os pacientes com RSCcPN e IgE baixo, que confirmam dados previamente publicados. Haruna et al. também mostraram que havia um pior resultado após o uso de macrolídeo para os pacientes com polipose nasal extensa e eosinofilia.27 Isso pode ser justificado, em parte, pelo fato de que os MACs exercem um efeito inibitório nos promotores de inflamação neutrofílica, como a Interleucina‐8. Suzuki et al., em um estudo com 16 pacientes com RSC, também mostraram melhoria da sintomatologia associada a baixos níveis de IgE e baixa contagem de eosinófilos no sangue periférico, secreção nasal, e na mucosa nasal.27
Não encontramos uma frequência menor de pacientes com asma, rinite ou DREA no grupo que apresentou resposta ao tratamento. Apesar disso, os adultos com RSCcPN devem ser inquiridos sobre sintomas da via aérea inferior e de hipersensibilidade ao ácido acetilsalicílico (AAS) e outros AINEs.
O subgrupo com melhoria clínica também apresentava, pré‐tratamento, comparativamente ao outro subgrupo, níveis de IgG e IgM elevados (ambos p <0,01). Esses dados são secundários e estudos posteriores poderão avaliar a relevância disso para esse grupo de pacientes, talvez esteja relacionado a uma possível maior população Th1 e menor Th2 nesses pacientes com IgE normal.
Moriyama et al. mostraram melhores resultados subjetivos e endoscópicos com a associação de eritromicina em baixas doses por longo prazo durante o pós‐operatório da sinusectomia.28 Em 2002, Cervin et al. publicaram pela primeira vez em uma revista de língua inglesa o uso de um MAC para RSCR, a eritromicina. A dose de 500 mg/dia por 12 meses foi administrada a pacientes com RSCR e os resultados assemelharam‐se aos publicados na literatura japonesa.14 Esses estudos envolviam um pequeno número de pacientes ou não tinham um grupo controle com placebo.14,27–29 Ragab et al. publicaram o primeiro estudo prospectivo, randomizado e controlado sem placebo que comparou o tratamento clínico com eritromicina (1000 mg/dia por 15 dias seguido de 500 mg/dia por 75 dias) com o tratamento cirúrgico para pacientes com RSC com e sem polipose. Ambos os grupos apresentaram melhoria nos sintomas clínicos, na dosagem de óxido nítrico nasal, na rinometria acústica, no tempo de clearence nasal da sacarina e na endoscopia nasal. Todas essas foram estatisticamente significativas e semelhantes, exceto pelo maior volume nasal total apresentado nos pacientes do tratamento cirúrgico.29
Wallwork et al. publicaram o primeiro estudo duplo‐cego, randomizado, controlado com placebo do uso de um macrolídeo, a roxitromicina, em pacientes com RSC sem polipose. Administrou‐se na dose de 150 mg/dia por 3 meses e os pacientes apresentaram melhoria dos sintomas clínicos, da avaliação endoscópica, do tempo de clearence nasal da sacarina e dos níveis de IL‐8 nasal. Da mesma forma que em estudos anteriores, os resultados foram melhores nos pacientes com baixos níveis de IgE.30
A chave para efetivamente implantar um tratamento bem‐sucedido com macrolídeo na RSC é a seleção dos pacientes com características reconhecidamente associadas a uma boa resposta ao tratamento. A esse grupo de pacientes, o tratamento com CLA poderia ser oferecido como uma opção à cirurgia. Outra possibilidade seria o uso pós‐operatório para os pacientes sem uso de corticoide pré‐operatório em que a análise tissular evidencia baixa eosinofilia, como mostraram Oakley et al.31 Contudo, em nosso estudo não encontramos uma associação entre eosinofilia e melhoria clínica, diversamente do encontrado em relação ao baixo nível de IgE.
Não evidenciamos neste estudo reações adversas ou efeitos colaterais que resultaram na suspensão da medicação. Os efeitos colaterais associados ao uso da eritromicina e da roxitromicina são mais presentes, como os gastrointestinais, e têm uma tendência maior a hepatotoxicidade, devido à maior concentração nesse órgão, fato inverso ao verificado com a CLA, com maior concentração presente no trato respiratório.32,33 Dessa forma, a CLA seria uma opção mais adequada dentro da classe dos MACs.
Entre as limitações do estudo estão a ausência de um grupo controle com placebo, para possibilitar maiores conclusões a respeito dos efeitos da CLA. Além disso, as medidas de resultado foram baseadas em questionários e pontuações subjetivas validados, dependeram exclusivamente da avaliação do paciente. Entretanto, como a maioria dos pacientes estava em espera para novo procedimento cirúrgico, se algum deles estivesse motivado para responder o questionário de qualidade de vida incorretamente seu viés seria, provavelmente, para mostrar menos melhoria. Outra limitação é sobre as perdas no grupo que completou o seguimento até 3 meses do término do tratamento. Não conhecemos o motivo da evasão, eles perderam seguimento. Em geral, o paciente que mantém o acompanhamento tende a ser o que apresentou melhor resposta ao tratamento, tende a formar uma amostra com viés.
ConclusãoO uso da claritromicina por 3 meses em baixas doses para pacientes com RSCcPN recorrente e níveis de IgE reduzidos apresentou melhoria da qualidade de vida e da avaliação endoscópica, neste estudo não controlado.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Otolaringologia Fundamental pelo suporte no estudo.
Como citar este artigo: Bezerra TF, Pezato R, Barros PM, Coutinho LL, Costa LF, Pinna F, et al. Prospective evaluation of clarithromycin in recurrent chronic rhinosinusitis with nasal polyps. Braz J Otorhinolaryngol. 2021;87:298–304.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.