A biópsia do epitélio olfatório tem sido útil para estudar diversas doenças otorrinolaringológicas e neurológicas, incluindo seu potencial para melhor compreender a fisiopatologia por trás das manifestações olfatórias na COVID‐19. No entanto, a segurança e eficácia da técnica de obtenção de epitélio olfatório humano ainda não estão totalmente estabelecidas.
ObjetivosEste estudo teve como objetivo determinar a segurança e eficácia da coleta de células do epitélio olfatório, feixes nervosos e epitélio olfatório adequados para análise morfológica, no septo nasal superior.
MétodoDurante a cirurgia nasal, 22 indivíduos sem queixas olfatórias foram submetidos a biópsias de epitélio olfatório do septo nasal superior. A eficácia da obtenção de epitélio olfatório, a verificação de epitélio olfatório íntegro e a presença de feixes nervosos nas biópsias foram avaliadas por imunofluorescência. A segurança da função olfatória foi testada psicofisicamente usando testes unilaterais e bilaterais antes e um mês após o procedimento cirúrgico.
ResultadosEpitélio olfatório foi encontrado em 59,1% dos sujeitos. Das amostras, 50% apresentaram a qualidade necessária para a caracterização morfológica e 90,9% continham feixes nervosos. Não houve diferença nos escores psicofísicos obtidos no teste olfatório bilateral (University of Pennsylvania Smell Identification Test [UPSIT®]) entre as médias antes da biópsia: 32,3 vs. pós‐operatório: 32,5, p=0,81. Além disso, nenhuma diminuição significante ocorreu no teste unilateral (escore médio do teste unilateral 6 vs. 6,2, p=0,46). Não houve redução significante na identificação de nenhum dos 56 odorantes diferentes (p> 0,05).
ConclusãoA técnica descrita para biópsia de epitélio olfatório é altamente eficaz na obtenção de tecido olfatório neuronal, mas tem eficácia moderada na obtenção de amostras adequadas para análise morfológica. A capacidade olfativa permaneceu intacta.
As biópsias da mucosa nasal desempenham um papel importante na investigação da fisiopatologia e no potencial tratamento de uma série de doenças. Por exemplo, estudos de biópsia do epitélio olfatório (EO) podem elucidar mecanismos de perda olfatória na rinossinusite crônica e na perda olfatória pós‐infecciosa,1,2 incluindo a de vírus como o SARS‐CoV‐2,3–5 auxiliar no diagnóstico e compreensão de doenças neurológicas, como o Alzheimer,6,7 e possibilitar tratamentos inovadores com células‐tronco.8
As taxas de sucesso na obtenção de EO em biópsias realizadas em septo nasal variam entre 40% a 89%.9–15 No entanto, essas taxas não revelam a quantidade coletada de EO intacto, uma questão crítica para análises morfológicas, nem fornecem informações sobre a porcentagem de amostras que contêm os feixes de nervos necessários, por exemplo, para a cultura de neurônios.
A identificação de odores envolve uma via aferente complexa com quase 400 receptores olfativos, cada um específico para certas moléculas odoríferas isoladamente ou em combinação.16,17 Em primatas, a distribuição desses receptores não é homogênea em todo o EO nasal. 18 Portanto, mesmo uma biópsia medindo alguns milímetros pode gerar distúrbios na função olfatória. Por esse motivo, é importante avaliar se os procedimentos de biópsia comprometem a capacidade de sentir o cheiro de qualquer um dos vários odorantes. Em estudo anterior,19 observou‐se que biópsias de EO da concha nasal superior não comprometeu a capacidade olfativa dos indivíduos para identificar quaisquer dos odorantes específicos. Como essa região está perto da placa cribriforme e tem a maior concentração de neurônios olfatórios,20 presumivelmente, tem redundância significativa, de modo a esperar que quaisquer influências de um procedimento de biópsia sejam mínimas ou inexistentes. Embora a segurança e a eficácia das biópsias de regiões nasais com epitélios menos densos, como o septo nasal, tenham sido amplamente avaliadas,11,21 nenhum estudo procurou determinar especificamente se ocorrem alterações na capacidade olfativa a odorantes específicos nessas regiões a partir desse procedimento.
O presente estudo avaliou as taxas de eficácia de obtenção de EO total, EO adequado para análise morfológica e feixes de nervos do EO em biópsias de septo nasal superior. Buscou‐se também avaliar a segurança desse procedimento quanto à preservação da função olfatória unilateral, bilateral e específica por meio de testes olfatórios padronizados e validados, testando 56 odores diferentes.
MétodoPacientes do estudoEste estudo de coorte prospectivo envolveu 22 indivíduos que aguardavam cirurgia nasal devido à obstrução nasal. Os indivíduos não eram fumantes e não tinham queixas olfativas ou história de traumatismo cranioencefálico, doenças neurodegenerativas e rinossinusite crônica. Durante a cirurgia, foi realizada biópsia da mucosa olfatória do septo nasal superior de forma unilateral e confirmada a presença de EO por imunofluorescência. A segurança foi avaliada bilateralmente, testando os pacientes com o validado teste de identificação do olfato da Universidade da Pensilvânia (University of Pennsylvania Smell Identification Test – UPSIT).22,23 Os dezesseis odores da parte de identificação do teste Sniffin’Sticks® foram utilizados para o teste unilateral, oito odores para a fossa nasal direita e oito para a esquerda, ocluindo a narina contralateral com Microcopore®.24 Os voluntários tiveram seu olfato testado no pré‐operatório e um mês após a cirurgia. O estudo foi aprovado pelo comitê de ética em pesquisa local (CAAE: 41491014.1.0000.5231). Cada participante ou responsável assinou o termo de consentimento após conhecer os métodos e objetivos do estudo.
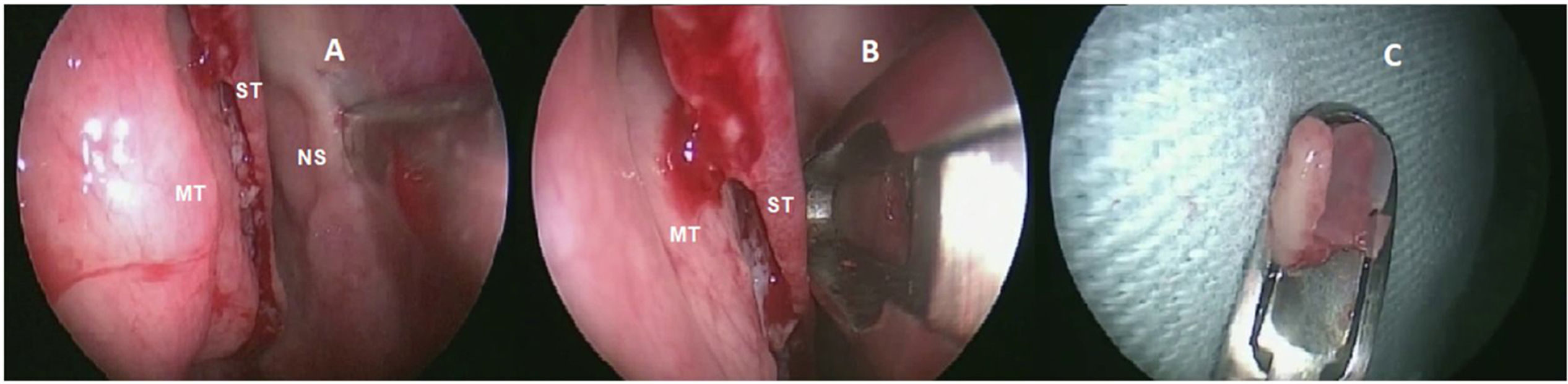
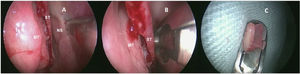
Coleta de epitélio olfatórioO mesmo otorrinolaringologista coletou as biópsias de EO sob anestesia geral. Sem o uso de compressas para evitar danos ao epitélio, apenas três gotas de oximetazolina foram aplicadas dentro das narinas para vasoconstrição local. Após o descolamento da mucosa do septo nasal superior, uma amostra de 3 a 5 milímetros de diâmetro foi colhida com um instrumento cortante (fig. 1) do septo nasal lateral, medial à concha superior. Apenas uma biópsia foi realizada por paciente. Os pacientes não precisaram de cauterização local e o sangramento local cessou espontaneamente.
ImunofluorescênciaA análise da presença e integridade do EO e dos feixes neuronais foi realizada por imunofluorescência. Primeiramente, as amostras foram fixadas em paraformaldeído (PFA) 4% por 24 horas, depois submersas em solução de sacarose 30% pelo mesmo período e, em seguida, em uma mistura de solução de sacarose 30% com composto Tissue‐Tek O.C.T. (Sakura) por mais 24 horas. Depois disso, as peças foram congeladas em composto Tissue‐Tek O.C.T. a ‐80°C até à análise.
Os tecidos foram criosseccionados a 15 micrômetros (Leica CM 1520) e montados em lâminas silanizadas (Jiangsu Huida Medical Instruments, China). As amostras foram enxaguadas em 1×PBS (tampão fosfato‐salino) em três lavagens de 5 minutos em câmara úmida. Em seguida, a recuperação do antígeno foi realizada em tubos com 2,16mL de tampão acetato, 9,84mL de tampão citrato, 108mL de água destilada e 60mL de Tween 20, em banho‐maria a 90°C. Para choque térmico, as lâminas foram colocadas em gelo até atingirem 25°C. Depois disso, as lâminas foram depositadas em câmara úmida e submetidas a três lavagens com PBS 1× por 5 minutos cada e o bloqueio antigênico foi realizado com solução de PBSt 0,1% e BSA 3% (albumina de soro bovino). Subsequentemente, mais três lavagens de 5 minutos com PBS foram feitas, e as lâminas foram incubadas durante a noite com anti‐OMP primário (anti‐Olfactory Marker Protein polyclonal antibody, Biorbyt) ou anti‐βIII (anticorpo monoclonal anti‐beta tubulina III, Thermo Fisher), diluído na proporção de 1:100 em solução PBSt 0,1% (tampão fosfato‐salino com triton) e BSA 2%.As biópsias foram então lavadas três vezes com PBS 1× durante 5 minutos e incubadas com anticorpo secundário (anti‐coelho conjugado com DyLight® 650‐GtxRb‐003‐D650NHSX 1:100 ou anti‐rato conjugado com FITC ‐ F2761 1:200) por 2 horas. As lâminas foram montadas usando Fluoreguard Mounting Medium (SCYTEK). Os cortes foram avaliados usando um microscópio confocal Leica Microsystems CMS TCS SP8 (Wetzlar, Alemanha). Os controles negativos foram feitos a partir de lâminas com tecido sem aplicação do anticorpo primário. A presença de EO foi confirmada quando o epitélio foi marcado por anti‐OMP ou anti‐βIII. O espécime foi considerado adequado para caracterização morfológica quando no mínimo 200‐μm de EO estava presente em todas as camadas celulares. A presença de feixes nervosos foi avaliada na lâmina própria da mucosa.
Análise estatísticaAs taxas de eficácia para obter EO foram expressas em porcentagens. As variáveis contínuas, como idade e escores UPSIT, foram expressas em médias e desvios‐padrão. Antes e depois da biópsia, os escores dos testes olfativos foram comparados pelo teste‐t de Student, após verificação da normalidade pelo teste de Shapiro‐Wilk. Fizemos essa comparação apenas nos pacientes que apresentaram epitélio olfatório ou feixes de nervos nas amostras coletadas (20 de 22). Teoricamente, os pacientes sem neurônios olfatórios não teriam razão para exibir capacidade olfatória diminuída. O nível de significância foi estabelecido em 0,05. A avaliação da perda da capacidade de identificar odorantes específicos foi realizada com intervalos de confiança de 95%; se os intervalos antes e depois da biópsia se cruzassem, considerou‐se que o aumento ou diminuição da capacidade olfativa não ocorreu. Um tamanho amostral de oito participantes pré e pós‐biópsia forneceria poder adequado para rejeitar a hipótese nula. Aumentamos nossa amostra em caso de perda de seguimento. A determinação do tamanho da amostra foi baseada em uma diferença clinicamente significante de quatro pontos na média dos escores UPSIT, poder de 90%, desvio padrão de seis pontos e nível alfa de 5%.
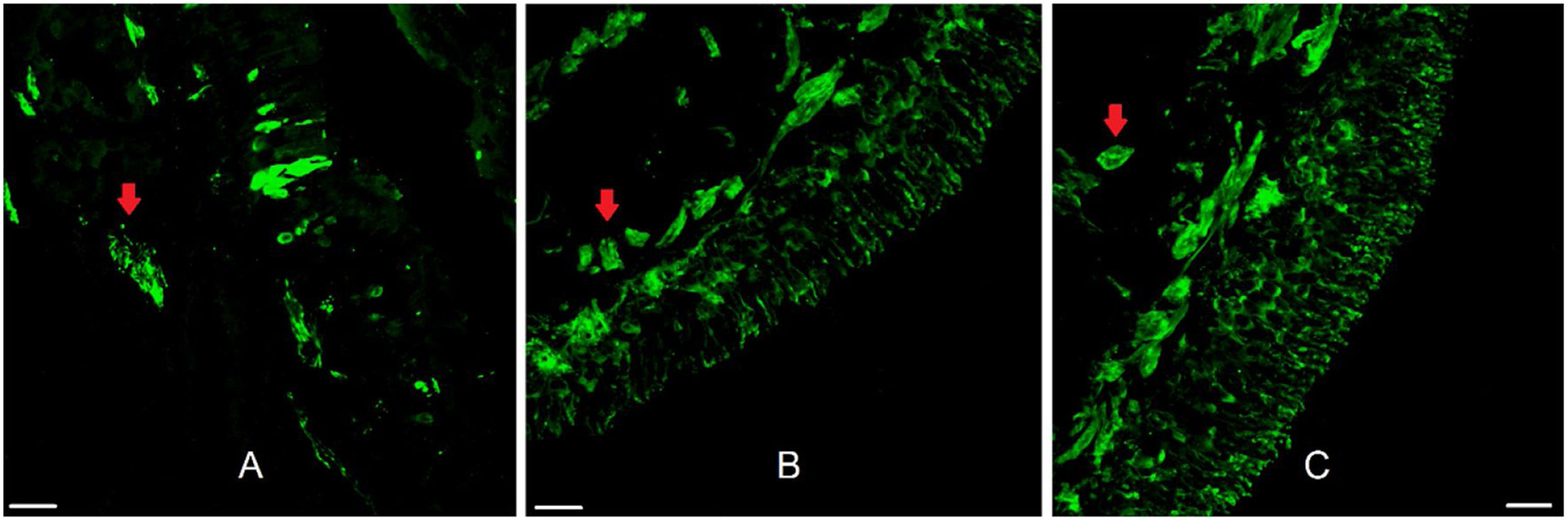
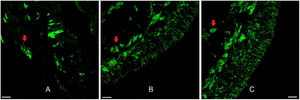
ResultadosOs vinte e dois pacientes tinham idades entre 14 e 58 anos (média=31,1, DP=12,5); quinze homens e sete mulheres. EO foi obtido em 59,1% das amostras. Mucosa olfatória sem lesão tecidual e própria para análise morfológica foi encontrada em 50% e feixes nervosos em 90,9% das amostras (fig. 2).
Epitélio olfatório humano. Imunofluorescência do epitélio olfatório humano adequado para análise morfológica em biópsia do septo nasal superior com marcação neuronal. Na figura A, vemos a marcação de anticorpo anti‐proteína marcadora olfatória (OMP 1:100, para neurônios olfatórios maduros). Nas figuras B e C usou‐se o marcador anti‐beta tubulina III (β3 1:100, total, para neurônios maduros e imaturos). As setas vermelhas indicam a presença de feixes nervosos. Barra de escala com 25μm.
Não houve diferença na função olfatória bilateral antes e depois da biópsia (escore médio UPSIT antes: 32,3 de 40, DP: 1 vs. depois: 32,5, DP=1, p=0,81). Seis dos 22 pacientes apresentaram piora do escore UPSIT após a biópsia, um deles por um ponto, três por dois pontos, os outros dois por três, um por cinco pontos e o último por oito pontos. Da mesma forma, não foram detectadas diferenças significante s entre as médias do teste olfatório unilateral do lado em que a biópsia foi realizada (média antes: 6 de 8, DP=0,3 vs. depois: 6,2, DP=0,3; p=0,46) e na cavidade nasal contralateral (média antes: 5,7, DP=0,4 vs. depois: 6,2, DP=0,3; p=0,19). Ao comparar a variação dos escores pré e pós‐biópsia nos lados biopsiados e não biopsiados, não houve diferença estatisticamente significante (média do lado biopsiado: 0,2, DP=0,2 vs. lado não biopsiado: 0,5, DP=0,4, p=0,44).
A capacidade de identificar cada odor permaneceu intacta nos testes bilateral (tabela 1) e unilateral de ambas as fossas nasais (tabelas 2 e 3). Os pacientes não apresentaram complicações pós‐operatórias, tais como sangramento nasal, dor, infecção ou fístula liquórica (FL).
Comparação da porcentagem de acertos por odor na prova olfatória bilateral antes e um mês depois da coleta de epitélio olfatório
| Odor | Antes(% de respostas corretas, IC 95%) | Depois(% de respostas corretas, IC 95%) |
|---|---|---|
| Pizza | 64,7 (37,7 – 84,7) | 64,7 (37,7 – 84,8) |
| Chiclete | 76,5 (48,2 – 91,9) | 70,6 (42,9 – 88,5) |
| Mentol | 82,4 (53,7 – 94,9) | 88,2 (59,2 – 97,5) |
| Cereja | 82,4 (53,7 – 94,9) | 88,2 (59,2 – 97,5) |
| Óleo para motor | 70,6 (42,9 – 88,5) | 52,9 (28,0 – 76,5) |
| Hortelã | 94,1 (62,7 – 99,3) | 94,1 (62,7 – 99,5) |
| Banana | 82,4 (53,8 – 94,9) | 58,8 (32,7 – 80,7) |
| Cravo‐da‐índia | 94,1 (62,7 – 99,4) | 88,2 (59,2 – 97,5) |
| Couro | 100 | 100 |
| Coco | 82,4 (53,5 – 94,9) | 88,2 (59,2 – 97,5) |
| Cebola | 94,1 (62,7 – 99,4) | 100 |
| Suco de fruta | 88,2 (59,1 – 97,5) | 94,1 (62,7 – 99,4) |
| Talco | 94,1 (62,7 – 99,4) | 100 |
| Jasmim | 64,7 (37,7 – 84,7) | 70,6 (42,9 – 88,5) |
| Canela | 88,2 (59,1 – 97,5) | 70,6 (42,9 – 88,5) |
| Gasolina | 17,6 (5,1 – 46,3) | 17,7 (5,1 – 46,3) |
| Morango | 100 | 100 |
| Café | 64,7 (37,7 – 84,7) | 47,1 (23,5 – 71,9) |
| Gengibre | 94,1 (62,7 – 99,3) | 100 |
| Maçã | 76,5 (48,2 – 91,9) | 100 |
| Perfume | 94,1 (62,7 – 99,4) | 82,4 (53,7 – 94,9) |
| Flor | 76,5 (48,2 – 91,9) | 88,2 (59,2 – 97,5) |
| Pêssego | 82,4 (53,7 – 94,9) | 100 |
| Pneu | 94,1 (62,7 – 99,4) | 88,2 (59,2 – 97,5) |
| Picles | 47,1 (23,5 – 71,9) | 47,1 (23,5 – 71,9) |
| Abacaxi | 82,4 (53,7 – 94,3) | 94,1 (62,7 – 99,4) |
| Framboesa | 88,2 (59,2 – 97,5) | 100 |
| Laranja | 82,4 (53,7 – 94,9) | 88,2 (59,2 – 97,5) |
| Nozes | 58,8 (32,7 – 80,7) | 58,8 (32,7 – 80,7) |
| Melancia | 100 | 94,1 (62,7 – 99,4) |
| Solvente | 82,4 (53,8 – 94,9) | 76,5 (48,2 – 91,9) |
| Grama | 70,6 (42,9 – 88,5) | 64,7 (37,7 – 84,8) |
| Fumaça | 88,2 (59,1 – 97,5) | 88,2 (59,2 – 97,5) |
| Madeira | 64,7 (37,7 – 84,8) | 70,6 (42,3 – 88,5) |
| Uva | 82,4 (53,7 – 94,9) | 88,2 (59,2 – 97,5) |
| Alho | 94,1 (62,7 – 99,4) | 88,2 (59,2 – 97,5) |
| Sabão | 94,1 (62,7 – 99,4) | 88,2 (59,2 – 97,5) |
| Gás natural | 94,1 (62,7 – 99,4) | 94,1 (62,7 – 99,4) |
| Rosa | 58,8 (32,8 – 80,8) | 52,9 (28,0 – 76,5) |
| Amendoim | 70,6 (42,9 – 88,5) | 88,2 (59,1 – 97,5) |
Comparação da porcentagem de acertos por odor na prova olfatória unilateral antes e um mês depois da biópsia na mesma fossa nasal da biópsia
| Odor | Antes(% de respostas corretas, IC 95%) | Depois(% de respostas corretas, IC 95%) |
|---|---|---|
| Laranja | 88,9 (37,4 – 99,1) | 100 |
| Couro | 55,6 (19,5 – 86,6) | 55,6 (19,5 – 86,6) |
| Canela | 44,5 (13,4 – 80,5) | 66,7 (26,2 – 91,9) |
| Hortelã | 100 | 100 |
| Banana | 88,9 (37,4 – 99,1) | 88,9 (37,4 – 99,1) |
| Limão galego | 66,7 (26,2 – 91,9) | 44,5 (13,4 – 80,5) |
| Alcaçuz | 44,5 (13,4 – 80,5) | 55,6 (19,5 – 86,6) |
| Solvente de tinta | 33,4 (8,1 – 73,8) | 55,6 (19,5 – 86,6) |
| Alho | 100 | 87,5 (31,9 – 99,1) |
| Café | 71,4 (21,5 – 95,8) | 87,5 (31,9 – 99,1) |
| Maçã | 42,9 (9,1 – 84,9) | 37,5 (8,7 – 79,2) |
| Cravo‐da‐índia | 100 | 100 |
| Abacaxi | 85,7 (25,7 – 99,1) | 75,0 (27,3 – 95,9) |
| Rosa | 100 | 87,5 (31,9 – 99,1) |
| Funcho | 100 | 100 |
| Peixe | 100 | 100 |
Comparação da porcentagem de acertos por odor na prova olfatória unilateral antes e um mês depois da biópsia em fossa nasal contralateral
| Odor | Before(% of correct answers, 95% CI) | After(% of correct answers, 95% CI) |
|---|---|---|
| Laranja | 71,4 (21,5 – 95,8) | 100 |
| Couro | 85,7 (25,7 – 99,1) | 100 |
| Canela | 85,7 (25,7 – 99,1) | 50,0 (14,4 – 85,7) |
| Hortelã | 100 | 100 |
| Banana | 100 | 100 |
| Limão galego | 57,1 (15,1 – 90,9) | 62,5 (20,8 – 91,4) |
| Alcaçuz | 71,4 (21,5 – 95,8) | 75,0 (27,6 – 95,9) |
| Solvente de tinta | 42,9 (9,1 – 84,9) | 25,0 (4,1 – 72,4) |
| Alho | 88,9 (37,4 – 99,1) | 88,9 (37,4 – 99,1) |
| Café | 33,4 (8,1 – 73,8) | 55,6 (19,5 – 86,6) |
| Maçã | 33,4 (8,1 – 73,8) | 11,1 (0,9 – 62,6) |
| Cravo‐da‐índia | 55,6 (19,5 – 86,6) | 88,9 (37,4 – 99,1) |
| Abacaxi | 77,8 (32,9 – 96,1) | 88,9 (37,4 – 99,1) |
| Rosa | 66,7 (26,2 – 91,9) | 100 |
| Funcho | 88,9 (37,4 – 99,1) | 88,9 (37,4 – 99,1) |
| Peixe | 88,9 (37,4 – 99,1) | 100 |
Este estudo mostrou que biópsias de septo nasal superior não afetaram significativamente a capacidade olfatória dos pacientes. A função unilateral, bilateral e a capacidade de identificar cada um dos 56 odores testados não foram comprometidas, confirmando a segurança da técnica. É importante ressaltar que a técnica foi altamente eficaz na obtenção de amostras com feixes de nervos, apresentando excelente capacidade de coleta de tecido neuronal olfatório. Também foi obtida quantidade significativa de mucosa adequada para análise morfológica.
A segurança da biópsia de EO do septo superior foi compatível com nosso estudo anterior realizado com espécimes da concha nasal superior.19 Nossos achados também foram análogos a outros estudos que mediram a capacidade olfativa bilateral e unilateral após biópsias de septo nasal para obter EO.11,21 É importante ressaltar que nossa pesquisa foi a primeira a demonstrar a manutenção das capacidades olfativas individuais de cada cavidade nasal.
Pode‐se considerar que a preservação do olfato em nossa amostra pode ser decorrente da melhora da função nasal após a cirurgia, compensando uma perda associada à biópsia. No entanto, ainda há controvérsia se as cirurgias nasais realmente melhoram a capacidade olfatória. Usando testes bilaterais, um aumento nos escores dos testes olfativos foi observado após esse tipo de procedimento cirúrgico,25 especialmente em pacientes com olfato menos apurado. No entanto, outros autores descreveram uma diminuição em pacientes com escores pré‐operatórios mais elevados.26 Curiosamente, em nossos pacientes, quando as capacidades de identificação foram testadas na cavidade nasal contralateral à biópsia, nenhuma diferença foi encontrada na função olfatória. Logo, esses dados corroboram que a cirurgia nasal per se não interfere nesse sentido e confirma a segurança da coleta de EO da forma que descrevemos.
Levando em consideração que confirmamos a presença de EO por imunofluorescência, obtivemos 59,1% de eficiência na obtenção de EO de nossas biópsias, sendo 50% dos espécimes com a qualidade necessária para análise morfológica detalhada. Estudos anteriores que coletaram EO do septo superior obtiveram sucesso em 40% a 76% das biópsias.9,12,21 Quando utilizada apenas a imunoistoquímica, a taxa de obtenção do epitélio olfatório parece ser cerca de 20% maior.11,19 É provável que as etapas adicionais necessárias para o processamento da imunofluorescência resultem em mais comprometimento da quantidade relativamente pequena do tecido coletado. Essa ideia é apoiada por nossa descoberta de feixes de nervos na maioria das amostras (90,9%), independentemente da presença de EO em muitos casos. Portanto, acreditamos que a técnica de recuperação antigênica, que visa expor melhor os epítopos e obter uma marcação mais definida,15,27,28 pode ter contribuído para a perda do epitélio durante o procedimento. Embora essa desvantagem da técnica de imunofluorescência permita múltiplos marcadores ao mesmo tempo, uma imunohistoquímica característica não pode ser obtida. Por fim, a grande quantidade de feixes nervosos indica que a biópsia dessa região é eficiente para obter nervos olfatórios, o que é muito útil para a obtenção de células‐tronco olfatórias. Uma alternativa para a obtenção de uma melhor caracterização morfológica do EO seria coletar uma quantidade maior de mucosa nasal, mas isso potencialmente prejudicaria mais essa função quimiossensorial. Outra possibilidade é realizar a biópsia na parte superior da concha superior. Uma coleta anterior de EO nessa região mostrou que o EO adequado para análise morfológica estava presente em 62% dos espécimes.19
Quanto às limitações, destacamos a não inclusão neste estudo de indivíduos em idades extremas (crianças ou idosos) e o pequeno tamanho do espécime. Por exemplo, sabe‐se que os idosos possuem menos EO que os jovens,29 tornando esse tipo de procedimento potencialmente mais prejudicial para a função olfativa nessas populações. Assim, a segurança dos procedimentos aqui descritos ainda precisa ser avaliada nesses grupos.
ConclusõesA coleta do epitélio olfatório do septo superior não causou nenhum distúrbio olfatório ao sentir o cheiro com uma ou ambas as narinas. Também não afetou a capacidade de identificar os 56 odorantes individuais testados. A técnica retratada obteve de modo efetivo tecido olfatório neuronal utilizado para células‐tronco e apresentou eficácia moderada em fornecer amostras sem danos, adequadas para análise morfológica.
FinanciamentoFundação Araucária de Apoio ao Desenvolvimento Científico e Tecnológico do Estado do Paraná (FA) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) (bolsa de doutorado, CHAMADA PÚBLICA 20/2015) Brasil.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Fundação Araucária de Apoio ao Desenvolvimento Científico e Tecnológico do Estado do Paraná (FA) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) (bolsa de doutorado, Chamada Pública 20/2015).
Como citar este artigo: Garcia EC, Luz LA, Anzolin LK, Barbosa da Silva JL, Doty RL, Pinna FR, et al. Biopsy of the olfactory epithelium from the superior nasal septum: is it possible to obtain neurons without damaging olfaction? Braz J Otorhinolaryngol. 2022;88:786–92.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.