O carcinoma papilífero de tireoide é a neoplasia endócrina mais frequente e sua incidência triplicou nos últimos 35 anos. Embora o carcinoma papilífero de tireoide tenha um bom prognóstico, 1% a 30% dos pacientes desenvolvem recorrência e metástase. Algumas características clínicas e genéticas estão associadas a um pior prognóstico. A mutação mais frequente é a BRAF p.V600E, a qual tem sido associada a muitas características clínicas de pior prognóstico. No entanto, muitos estudos apresentam resultados controversos, sem qualquer associação entre a mutação em BRAF e características clinicopatológicas de pior prognóstico.
ObjetivoUma vez que o valor prognóstico das mutações em BRAF permanece controverso, investigar a importância dessa mutação em decisões terapêuticas para o carcinoma papilífero de tireoide.
MétodoFoi avaliada a associação da mutação em BRAF com características de pior prognóstico em 85 pacientes com carcinoma papilífero de tireoide acima de 45 anos tratados no A.C. Camargo Cancer Center, de 1980 a 2007. A mutação em BRAF foi avaliada por pirossequenciamento. A análise estatística foi feita com o software SPSS.
ResultadosA média de idade dos pacientes foi de 54 anos (variação de 45−77), 73 eram mulheres (85,8%) e 12 eram homens (14,2%). Entre eles, 39 casos (45,9%) apresentaram extensão extratireoidiana e 11, doença recorrente. A mutação em BRAF foi detectada em 57 (67%) pacientes. Não foi observada associação significante entre mutação em BRAF e sexo (p=0,743), idade (p=0,236), estágio N (p=0,423), infiltração vascular e perineural (p=0,085) ou multifocalidade (p=1,0). Apesar de não apresentar associação estatística, a maioria dos pacientes com doença recorrente foi positiva para BRAF (9 em 11) (p=0,325). Os pacientes afetados pela mutação em BRAF estão associados a tumores maiores do que 1 cm (p=0,034) e com extensão extratireoidiana (p=0,033).
ConclusãoEmbora a mutação em BRAF seja amplamente avaliada, não há dados consistentes que demonstrem uma melhor sobrevida ou benefício clínico ao incorporá‐la à decisão terapêutica para o câncer de tireoide.
O carcinoma bem diferenciado da tireoide (CDT) é a lesão maligna endócrina mais comum e sua incidência triplicou nos últimos 35 anos, afetou mais de 50.000 indivíduos nos EUA em 2018.1 A maioria dos carcinomas da tireoide é derivada de células foliculares da tireoide que dão origem aos subtipos de carcinoma papilar (CPT) e carcinoma folicular (CFT) da tireoide.2 O CPT representa 80%‐85% de todos os carcinomas da tireoide e alguns fatores de risco foram associados ao desenvolvimento da doença, inclusive exposição à radiação, baixo consumo de iodo e histórico familiar de carcinoma da tireoide.2,3
Em geral, o CPT tem um bom prognóstico, com taxa de sobrevida de 5 anos acima de 90%; no entanto, alguns pacientes não respondem ao tratamento e marcadores prognósticos mais precisos não estão bem estabelecidos na rotina clínica.4 Há um risco de recorrência que varia de 5% a 30%, depende do estágio da doença ao diagnóstico.5 Atualmente, os fatores críticos no desfecho de pacientes com CPT são a idade ao diagnóstico (> 55 anos) e a presença de extensão extratireoidiana. Fatores adicionais incluem tamanho do tumor, tipo histológico, presença de metástases e ressecção tumoral incompleta.4,5 Além de fatores clínicos e patológicos, alterações genéticas também foram avaliadas no CPT. A variante molecular mais importante é a mutação em BRAF p.V600E.6
A frequência das mutações BRAF varia de 29%‐87% na população (média de 45%).7,8 Embora mais de 40 mutações tenham sido identificadas no BRAF, a área hot spot mais frequente, responsável por mais de 90% de todas as mutações BRAF, é a transversão de nucleotídeo T1799A BRAF, que origina uma proteína mutante V600E com ativação constitutiva da quinase BRAF.9,10 O BRAF é um ativador potente da via da proteína quinase ativada por mitogênio (MAPK), que tem um papel importante na regulação do crescimento e divisão celular por meio do bloqueio da apoptose e regulação da proliferação e invasão.11,12
Vários estudos relataram uma correlação da mutação em BRAF V600E com características clínicas e patológicas do CPT mais agressivo, como metástases distantes ou nodais, tamanho tumoral maior e estágio avançado.11,12 A presença da mutação em BRAF p.V600E foi incluída nas últimas recomendações da American Thyroid Association (ATA)13 como um fator a ser considerado na estratificação de risco de um curso clínico pior no CPT.
No entanto, uma série de estudos não observou associação entre a mutação em BRAF e marcadores clinicopatológicos de mau prognóstico.14,15 Uma visão geral da literatura indica que os dados clínicos que ligam a mutação em BRAF aos desfechos de CDT não são muito consistentes, com muitos resultados controversos.14,16,17 Visto que o significado prognóstico das mutações BRAF permanece um tópico de debate com relatos conflitantes, neste estudo pretendemos avaliar se a presença da mutação em BRAF é um fator prognóstico em pacientes com mais de 45 anos e carcinoma papilífero de tireoide.
MétodoPacientesEstudo retrospectivo com revisão de pacientes submetidos à tireoidectomia total entre janeiro de 1980 e dezembro de 2007 no Serviço de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do A.C. Camargo Cancer Center (Brasil). Incluímos neste estudo 85 amostras de CPT disponíveis para extração de DNA de pacientes com ≥ 45 anos. O estudo foi aprovado pelo comitê de ética em pesquisa em seres humanos (protocolo n° 1541/11).
Caracterização clínica e histopatológicaOs dados clínicos foram coletados para cada paciente, inclusive idade, sexo, fatores de risco para câncer de tireoide e seguimento (cintilografia pós‐operatória, ultrassonografia com tireoglobulina sérica ou tomografia computadorizada). A detecção de doença persistente e recorrente foi feita por ultrassom, dosagem sérica de tireoglobulina em pacientes sem anticorpos anti‐Tg (com ou sem estimulação com rhTSH), varredura com 131I e PAAF de acordo com as diretrizes da ATA para seguimento (ou seja, com o ponto de corte de 6 meses).13 A classificação histológica das amostras foi revisada por um patologista experiente que usou interpretação cega e as características patológicas foram avaliadas, como variante histológica, invasão vascular, multifocalidade e estadiamento TNM.18
Processamento de tecidos e extração de DNAAs amostras cirúrgicas foram coletadas e armazenadas de maneira adequada no Banco de Tumores do A.C. Camargo Cancer Center, obedeceram a todas as exigências legais e éticas. Amostras frescas congeladas de carcinomas papilares da tireoide foram obtidas de 85 pacientes submetidos à ressecção cirúrgica. As amostras foram microdissecadas manualmente para atingir pelo menos 70% de representação maligna e o DNA foi extraído com um método padrão à base de fenol/clorofórmio. A integridade e concentração do DNA foram verificadas em gel de agarose e NanoDrop (ND‐1000 Spectrophotometer v. 3.0.1, Labtrade).
Detecção da mutação em BRAF V600E por pirossequenciamentoInicialmente, a região de interesse foi amplificada por PCR (códon 600 do gene BRAF) com 20 ng de DNA e 0,2μM de primers marcados (Epigendx, Worcester MA, Inglaterra, ensaio ADS871, e PCR MasterMix [Qiagen]). Controles sem molde (no template), um positivo (linhagem de células de câncer de cólon WiDr), e controles negativos (DNA humano não metilado da Epitech, Qiagen) foram incluídos em todos os testes feitos. A fim de confirmar as amplificações bem‐sucedidas, os produtos de PCR foram submetidos à eletroforese em gel de agarose a 1%. O pirossequenciamento foi feito de acordo com as recomendações dos fabricantes no sistema PyroMark Q96 ID (Qiagen, Valencia, EUA). A troca de nucleotídeo T por A no códon 600 em mais de 10% dos alelos foi considerada positiva para mutação em BRAF.
Análise estatísticaA associação entre a mutação em BRAF e variáveis categóricas foi testada com o teste X2 ou teste exato de Fisher, conforme apropriado. O teste t de Student foi usado para avaliar a associação com variáveis contínuas com distribuição normal, enquanto o teste U de Mann‐Whitney foi usado para variáveis contínuas com distribuição anormal. As curvas de sobrevida livre de doença foram analisadas pelo método de Kaplan‐Meier, que avaliou a significância da diferença estatística entre pacientes BRAF‐positivos e BRAF‐negativos com o teste de log‐rank. Finalmente, a análise de regressão de Cox do tempo de sobrevida livre de recorrência foi feita, inclusive o status do BRAF e todas as variáveis associadas à recorrência na análise univariada. Significância estatística foi considerada com p<0,05 e os intervalos de confiança foram fixados em 95%. A análise estatística foi feita com os softwares SPSS (v. 21.0; SPSS, Chicago, IL, EUA) e o Graphpad Prism (v. 5.0; GraphPad Software Inc., La Jolla, CA, EUA).
ResultadosDados clínicosEntre os 85 pacientes incluídos neste estudo, 73 eram mulheres (85,8%) e 12 eram homens (14,2%). A média da idade foi de 54 anos (variação, 45‐77) e 29 (34%) pacientes tinham mais de 55 anos. Todos os tumores avaliados eram carcinomas papilíferos de tireoide, os tipos de variantes histológicas foram revisados pelo patologista e 59 amostras foram classificadas como clássicas (69,4%), 19 como foliculares (22,3%) e 6 como subtipos de variantes raras (8,3%). A extensão extratireoidiana estava presente em 39 casos (45,9%) e a infiltração vascular e perineural em sete pacientes (8,2%). A maioria dos casos apresentava nódulos únicos (53 de 85, 62,4%) e 42 (49,4%) pacientes apresentavam nódulos tireoidianos menores do que 1cm. O período médio de seguimento foi de 92 meses.
Mutação em BRAF e associação com dados clínicosA mutação em BRAF foi detectada em 57 (67%) de 85 pacientes. Os pacientes foram classificados em dois grupos de acordo com o status da mutação em BRAF V600E (BRAF positivo vs. negativo) (tabela 1). O sexo não estava associado ao status do BRAF (p=0,743), nem à idade ao diagnóstico (p=0,236). Nenhuma associação significativa foi observada entre a mutação em BRAF e a variante histológica (p=0,075), estágio N (p=0,423), infiltração vascular e perineural (p=0,085), multifocalidade (p=1,0) e metástase linfonodal (p=0,423))
Dados clínicos e histopatológicos de 85 pacientes e associação com a mutação BrafV600E
| Variável | Categoria | Mutação BRAFV600E (%) | p‐valor | |
|---|---|---|---|---|
| Negativa | Positiva | |||
| Sexo | Masculino | 3 (25) | 9 (75) | 0,743 |
| Feminino | 25 (34.2) | 48 (65.8) | ||
| Idade (anos) | ≤ 55 | 21 (37.5) | 35 (62.5) | 0,236 |
| >55 | 7 (24.1) | 22 (75.9) | ||
| Tamanho do tumor | ≤ 1 cm | 9 (21,4) | 33 (78,6) | 0,037 |
| >1 cm | 19 (44,2) | 24 (55,8) | ||
| Status dos linfonodos | pN0 | 23 (35,9) | 41 (64,1) | 0,423 |
| pN1 | 5 (23,8) | 16 (76,2) | ||
| Variante histológica | Carcinoma Papilar | 15 (25,4) | 44 (74,6) | 0,075 |
| Carcinoma Folicular | 10 (52,6) | 9 (47,4) | ||
| Rara | 3 (42,9) | 4 (57,1) | ||
| Multifocalidade | Não | 18 (34) | 35 (66) | 1,0 |
| Sim | 10 (32,3) | 21 (67,7) | ||
| Extensão extratireoidiana | Não | 19 (44,2) | 24 (55,8) | 0,033 |
| Sim | 8 (20,5) | 31 (79,5) | ||
| Infiltração Vascular/ Perineural | Não | 28 (36,4) | 49 (63,6) | 0,089 |
| Sim | 0 (0) | 7 (100) | ||
| Recorrência | Não | 26 (35,1) | 48 (64,9) | 0,325 |
| Sim | 2 (18,2) | 9 (81,8) | ||
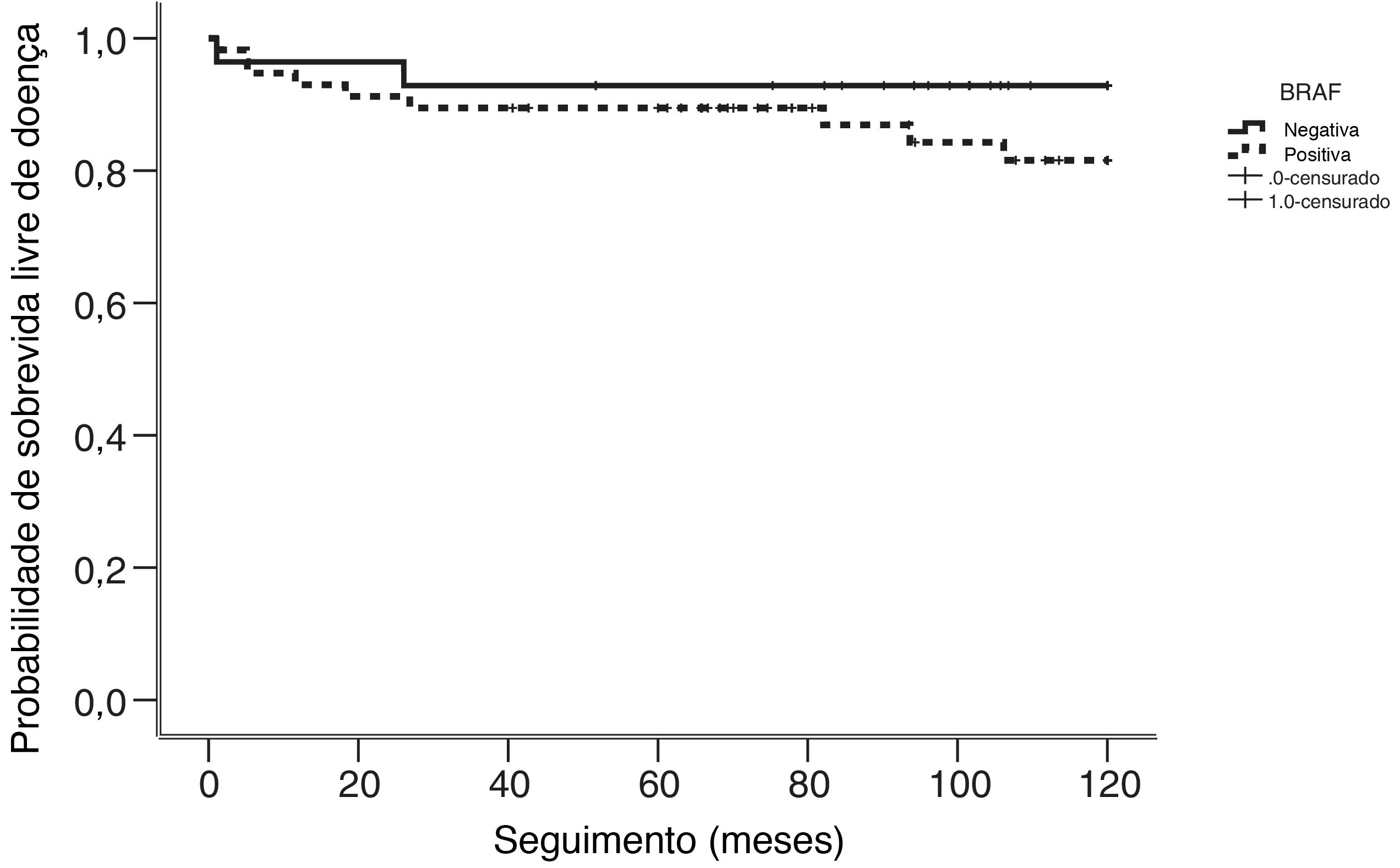
Pacientes afetados pela mutação em BRAF estão associados a tumores maiores do que 1cm (p=0,034) e com extensão extratireoidiana (p=0,033). A recorrência da doença foi detectada em 11 de 85 (13%) pacientes. Nove deles eram positivos para a mutação em BRAF. As recorrências foram locais e regionais em nove pacientes, enquanto dois apresentaram doença a distância. O seguimento médio dos pacientes com recorrência foi de 34 meses. Todas as recorrências tiveram confirmação patológica (biópsia por punção aspirativa com agulha fina ou cirurgia) ou resultados de imagem combinados com fortes evidências bioquímicas. Embora a maioria dos pacientes com recorrência fosse BRAF positivo, não foi encontrada significância estatística (p=0,325). O tempo médio para a recorrência foi de 18 meses (variação, 1‐106). A análise de Kaplan‐Meier para a sobrevida doença‐específica não mostrou associação estatisticamente significativa com a mutação em BRAF (p=0,272) (fig. 1).
DiscussãoCarcinomas de tireoide bem diferenciados derivados do epitélio folicular são os mais frequentes do sistema endocrinológico e o tipo histológico predominante é o carcinoma papilar, correspondem a 80%‐90% de todos os CDT.19 Os carcinomas papilíferos da tireoide geralmente são indolentes, com sobrevida favorável em longo prazo, usam‐se os tratamentos atualmente estabelecidos. As taxas de sobrevida geral de 10 anos para esses pacientes é de quase 90%; entretanto, 5% a 10% podem desenvolver recorrência regional e 10% a 15%, metástases a distância.2,20 Algumas características histopatológicas estão associadas a pior prognóstico, como tumores maiores com extensão extratireoidiana, metástases a distância e metástases em linfonodos cervicais. Um marcador molecular prognóstico adicional é a mutação em BRAF V600E, a alteração mais comum no CDT.6 Muitos estudos demonstraram uma associação da mutação em BRAF com desfechos mais desfavoráveis de CPT.21 Em contraste, estudos adicionais não encontraram qualquer correlação entre essa mutação e um pior prognóstico do CPT.15,22 Considerando esses achados controversos sobre o papel da mutação em BRAF V600E na agressividade clínicopatológica do CPT, investigamos a presença dessa mutação em 85 CPTs de pacientes com mais de 45 anos e sua associação com características clínicas de prognóstico ruim. A mutação em BRAF foi detectada em 67% dos casos; essa frequência é semelhante à descrita anteriormente em estudos italianos, que relataram frequências de até 66%.23 Por outro lado, a prevalência é menor na população japonesa, foi observada em apenas 38% dos pacientes, o que é semelhante à encontrada nos EUA (40%).15,24
A fim de investigar o potencial valor prognóstico da mutação em BRAF na população brasileira, associamos o status da mutação a várias características de alto risco de recorrência, inclusive idade acima de 55 anos, sexo masculino, multifocalidade, extensão extratireoidiana, tipo histológico, invasão vascular e linfática, metástases linfonodais e metástases a distância. Vários estudos relataram uma associação entre idade e taxas de mortalidade de acordo com o status da mutação em BRAF.4,7 Recentemente, um grande estudo com 2.638 pacientes com CDT demonstrou uma correlação entre o aumento da idade e a mortalidade em pacientes BRAF positivos.25 Entretanto, nenhuma correlação foi observada em pacientes BRAF negativos. Isso sugere que a idade é um forte fator de risco apenas para mutação em BRAF positiva, mas não para pacientes com CDT do tipo selvagem.25 Uma vez que o ponto de corte para a idade de 45 anos foi controverso e a idade de 55 anos demonstrou ser mais apropriada para classificar pacientes de alto risco,5 neste estudo recrutamos pacientes com mais de 45 anos e comparamos com o grupo com idade<55 anos. Contudo, não encontramos associação entre a idade (> 45 e<55) e risco de mortalidade em pacientes com mutação em BRAF. Em concordância com nossos achados, alguns estudos também não encontraram associação.5,22 Em relação ao sexo como característica prognóstica, não detectamos associação do status da mutação em BRAF e o sexo, embora um estudo de metanálise conduzido por Li et al. tenha demonstrado uma associação entre a mutação em BRAF e pacientes do sexo masculino.26
Neste estudo, observamos uma diferença significante entre os estágios T e o status da mutação em BRAF (p=0,037). Mutações em BRAF foram mais prevalentes em tumores maiores do que 1cm e essa associação também foi descrita por Li 2012 e Kim 2012.11,26 A comparação de metástases em linfonodos e mutação em BRAF não revelou correlação (p=0,423). A falta de correlação entre esaa característica prognóstica e BRAF também foi observada por outros estudos. Pelttari et al. relataram que a mutação em BRAF não foi significativamente associada a metástases em linfonodos, tamanho do tumor e metástases a distância no momento da apresentação da doença.27,28 Além disso, Koo et al. relataram que somente o tamanho do tumor e a presença de invasão linfática e vascular demonstraram ser preditores de metástases em linfonodos, independentemente da mutação em BRAF.28 Neste estudo, não detectamos correlação entre invasão linfática e vascular, envolvimento de linfonodos e mutação em BRAF (p=0,089, p=0,433, respectivamente).
A extensão extratireoidiana é uma característica importante de prognóstico desfavorável para CPT e foi associada ao aumento do risco de invasão nas estruturas cervicais, recorrência local e persistência do tumor.21 Uma metanálise conduzida por Liu et al., que incluiu 10.301 pacientes, relatou que os tumores que abrigam a mutação em BRAF têm risco aumentado de extensão extratireoidiana em comparação com os casos BRAF negativos.21 Além disso, a maioria dos estudos na literatura relatou maior frequência de extensão extratireoidiana em pacientes com mutação em BRAF.21,29 Neste estudo, também observamos que a maioria dos pacientes com extensão extratireoidiana eram BRAF positivos (80%) (p=0,033). Entretanto, os dados microscópicos ou macroscópicos da extensão não estão disponíveis, porque essas informações não foram avaliadas no momento dos procedimentos cirúrgicos. Além disso, muitos estudos descreveram a associação da mutação em BRAF com tumores multifocais.29 Porém, essa associação não foi detectada neste estudo entre essas características (p=1,0).
Embora o risco de recorrência no CPT seja relativamente baixo (5%‐10%), isso pode afetar a qualidade de vida do paciente que requer terapia adicional, como reoperação e alta dose cumulativa de radioiodo. Vários estudos de metanálise encontraram uma associação entre a mutação em BRAF e a recorrência.21,29 Um grande estudo multicêntrico também relatou que a mutação em BRAF é um fator prognóstico independente para a recorrência do CPT.27 Neste estudo, a recorrência foi observada em 11 pacientes e nove deles eram BRAF positivos. Embora a maioria dos pacientes que teve recidiva apresentasse a mutação, não foi possível observar associação significativa entre essas características (p=0,325), provavelmente devido ao número limitado de pacientes.
ConclusãoEmbora este estudo tenha avaliado um pequeno número de casos, nossos achados não sustentam a hipótese de uso da mutação em BRAF como fator prognóstico, tanto para a recorrência da doença quanto para a alteração da abordagem cirúrgica na feitura do esvaziamento cervical profilático em pacientes com mutação positiva.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aos pacientes que participaram deste estudo.
Ambos autores contribuíram de forma igual.
Como citar este artigo: Barreno LR, Mello JB, Barros‐Filho MC, Francisco AL, Chulam TC, Pinto CA, et al. Characterization of BRAF mutation in patients older than 45 years with well‐differentiated thyroid carcinoma. Braz J Otorhinolaryngol. 2022;88:523–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.