Ménière's disease is among the most frequent causes of vestibular disorders. Although it is a clinical diagnosis, a better understanding of the pathophysiology and clinical course of the disease through tests would allow improvement in the prognosis and more effective treatments.
ObjectivesTo describe the results of the cervical vestibular evoked myogenic and video head impulse test in patients with a defined diagnosis of Ménière's disease and to correlate them with disease duration.
MethodsThe sample consisted of 50 participants, of whom 29 comprised the study group and 21 the control group. The individuals were submitted to a questionnaire, otoscopy, audiometry and vestibular function assessment through the cervical vestibular evoked myogenic potential and video head impulse test.
ResultsFor the video head impulse test, lateral canal gain values below 0.77 were considered abnormal and for the vertical channels, below 0.61. The percentages of normality were 82.76% for lateral, 89.65% for posterior and 91.37% for anterior canals. For the cervical vestibular evoked myogenic potential, the upper limits of normal for latencies were defined as 18.07ms for p13 and 28.47ms for n23; and in the SG, 19.57% showed prolongation of latency of p13 and 4.35% of wave n23, whereas 18.96% did not show biphasic potential.
ConclusionsFor the video head impulse test, a decreased gain of the vestibulo‐ocular reflex for the lateral canal was observed, with a higher incidence of overt type corrective saccades compared to the control group. For the cervical vestibular evoked myogenic potential, there was a significant difference between the groups for the inter-amplitude parameter, including for asymptomatic ears. There was no correlation between the results of the tests and disease duration.
A doença de Ménière está entre as causas mais frequentes de vestibulopatias. Apesar de o diagnóstico ser clínico, compreender melhor a fisiopatologia e o curso clínico da doença por meio dos exames vestibulares permite melhores prognósticos e tratamentos.
ObjetivosDescrever resultados do potencial evocado miogênico vestibular cervical e teste de impulso cefálico por vídeo em pacientes com diagnóstico de doença de Ménière definida e correlacionar com o tempo de doença.
MétodoA amostra foi constituída por 50 participantes, dos quais 29 compuseram o grupo de estudo e 21 formaram o grupo controle. Os indivíduos foram submetidos a um questionário clínico, otoscopia, avaliação audiológica e avaliação da função vestibular por meio do potencial evocado miogênico vestibular cervical e teste de impulso cefálico por vídeo.
ResultadosPara teste de impulso cefálico por vídeo foram considerados alterados os valores de ganho para canal lateral abaixo de 0,77 e para os canais verticais abaixo de 0,61; e os percentuais de normalidade para o grupo de estudo foram 82,76% para lateral; 89,65% para posterior e 91,37% anterior. No potencial evocado miogênico vestibular cervical, os limites superiores das latências foram definidos 18,07 ms para p13 e 28,47 ms para n23; no grupo de estudo 19,57% apresentaram prolongamento da latência da p13 e 4,35% da onda n23 e 18,96% não apresentaram o potencial bifásico.
ConclusõesNo teste de impulso cefálico por vídeo observou‐se ganho do reflexo vestíbulo ocular diminuído para os canais laterais, com maior ocorrência de sacadas corretivas do tipo overt. Para o potencial evocado miogênico vestibular cervical observou‐se diferença significante entre os grupos para o parâmetro interamplitude, inclusive para orelhas assintomáticas. Não foi evidenciada correlação dos resultados dos exames com o tempo de doença.
A doença de Ménière (DM), descrita inicialmente em 1861, está entre as causas mais frequentes de vestibulopatias. É considerada uma doença multifatorial que se caracteriza pelos sintomas de vertigem episódica, perda auditiva flutuante, zumbido e plenitude aural.1,2
A hidropisia endolinfática, distensão do espaço endolinfático, foi descoberta por Hallpike e Cairns3 em ossos temporais de pacientes com essa afecção. Por muito tempo acreditou‐se que apenas a hidropisia endolinfática seria o substrato histopatológico da DM, porém esse achado não consegue explicar a complexidade desse quadro clínico.
O diagnóstico da DM é clínico e baseado na presença dos sintomas característicos. De acordo com a classificação atual, publicada em 2015, divulgada pelos comitês Bárány Society, Japan Society for Equilibrium Research, European Academy of Otology and Neurotology (EAONO), American Academy of Otolaryngology‐Head and Neck Surgery (AAO‐HNS) e Korean Balance Society, a DM pode ser classificada em definida ou provável. Categoriza‐se como DM definida quando há dois ou mais episódios de vertigem com duração entre 20 minutos a 12 horas, perda neurossensorial documentada em baixa ou média frequência (abaixo de 2 kHz) e sintomas de flutuação auditiva (hipoacusia, zumbido e/ou plenitude aural). A DM provável caracteriza‐se por dois ou mais episódios de vertigem com duração entre 20 minutos a 24 horas e sintomas de flutuação auditiva (hipoacusia, zumbido e/ou plenitude aural).1
De acordo com estudos do osso temporal, a formação da hidropisia ocorre na cóclea, no sáculo, utrículo e nos canais semicirculares, em sequência decrescente.4,5 Apesar de o diagnóstico ser clínico, compreender melhor a fisiopatologia e o curso clínico da doença permite condutas mais eficazes e, principalmente, menores prejuízos para a qualidade de vida do paciente com DM. Assim, os exames conseguem monitorar a função do sistema auditivo e vestibular e auxiliam no tratamento, principalmente em estágios iniciais.6 Atualmente, um dos exames mais estudados, principalmente devido à grande prevalência da hidropisia na região sacular, é o potencial evocado miogênico vestibular cervical − Vestibular Evoked Myogenic Potential (VEMPc). O VEMPc é um potencial bifásico muscular de curta latência que avalia a porção vestibular, especificamente o sáculo, o nervo vestibular inferior, as vias vestíbulos‐espinais e a placa neuromuscular. Após estimulação auditiva, ocorre o reflexo muscular vestíbulo‐espinal na vigência de contração musculatura cervical.7,8
Observou‐se que o VEMPc na DM é bastante útil, pois auxilia na detecção e na documentação de alterações nessas regiões vestibulares e na identificação do estágio da doença. Os achados na literatura são diversos, como a ausência do potencial bifásico, o aumento de latência, a diminuição da interamplitude e o aumento do índice de assimetria já foram descritos na DM.9–11 Outro achado interessante são as alterações na orelha assintomática, como ausência de onda ou aumento de latência, podem revelar possível evolução da doença como DM bilateral oculta.12,13
Outro exame bastante atual e que permite detectar alterações do reflexo vestíbulo ocular (RVO) nos três canais semicirculares é o teste de impulso cefálico por vídeo − Video Head Impulse Test (vHIT). Ele permite identificar e quantificar o Head Impulse Test (HIT), comumente feito na semiologia otoneurológica.
Durante a avaliação, aplicam‐se movimentos rápidos e imprevisíveis da cabeça no plano horizontal e vertical e os olhos devem manter‐se em um ponto fixo. Quando há alguma alteração do RVO, os olhos não conseguem manter essa fixação e ocorre um movimento compensatório ocular, denominado de sacada. As sacadas podem ser desencadeadas durante o impulso cefálico (covert), não visível a olho nu, ou após o impulso (overt).14 Diversos parâmetros como ganho do RVO e características das sacadas (latência, velocidade e taxa de ocorrência) proporcionaram ao vHIT um aumento da sensibilidade e especificidade em comparação ao HIT.15
Os achados na literatura sobre o uso do vHIT na DM são variáveis. A maioria dos estudos mostra ganho normal ou pequena redução do ganho do RVO.16–18 Alguns estudos correlacionam os resultados obtidos nesse exame com o período avaliado (crise ou intercrise), tempo da doença e grau da perda auditiva.19,20
O VEMPc e o vHIT são exames de fácil aplicação, não são invasivos e são bem tolerados pelo paciente. Ambos permitem uma avaliação funcional do sistema vestibular, o que favorece a investigação precoce e o acompanhamento da evolução clínica da DM. Dessa forma, testes objetivos e confiáveis como esses podem auxiliar no diagnóstico diferencial.
O estudo foi proposto diante da alta prevalência da DM na população e da necessidade de exames complementares que investiguem e auxiliem no monitoramento e evolução da doença. Poucas pesquisas avaliaram a DM de acordo com a classificação atual de 2015. Assim, busca‐se ampliar o conhecimento, explorar e identificar as estruturas envolvidas na DM e os efeitos no equilíbrio corporal, pode contribuir para a escolha da melhor estratégia terapêutica.
Os objetivos deste estudo foram avaliar os resultados dos exames VEMPc e vHIT em pacientes com diagnóstico de DM definida, nas orelhas sintomática e assintomática, e correlacionar os resultados dos exames com o tempo de doença.
MétodoEstudo observacional transversal analítico, feito no Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Escola Paulista de Medicina/Universidade Federal de São Paulo, sob aprovação do comitê de Ética em Pesquisa, número 706.875/2014.
A amostra foi constituída por 50 participantes, dos quais 29 compuseram o grupo de estudo (GE) e 21 formaram o grupo controle (GC). Foram incluídos no GE os pacientes de ambos os gêneros, entre 18 a 70 anos, com diagnóstico médico de doença de Ménière definida (uni ou bilateral), de acordo com a classificação dos comitês atuais (2015).1 Esse diagnóstico clínico foi considerado como padrão‐ouro neste estudo.
O GC foi formado por voluntários sem queixas ou antecedentes de tontura, perda auditiva, cirurgia otológica ou alteração de orelha média.
Todos os participantes da pesquisa receberam explicações e orientações sobre o estudo e foi solicitado que assinassem o termo de consentimento livre e esclarecido. Foram excluídos do estudo: pacientes com DM provável, pacientes que tenham feito algum procedimento invasivo, história de trauma craniano, cirurgia otológica, doenças de orelha média e retrococlear, doenças neurológicas e psiquiátricas, limitação ao movimento de rotação cervical e deficiente visual.
Após a avaliação clínica, feita pelo mesmo médico otorrinolaringologista, todos os indivíduos foram submetidos a um questionário clínico‐demográfico, otoscopia, avaliação audiológica e avaliação da função vestibular por meio do VEMPc e do vHIT.
O estágio da doença, de acordo com a classificação do comitê de audição e equilíbrio da AAO‐HNS (1995), foi baseado na média dos limiares tonais de 500Hz, 1kHz, 2kHz e 3kHz, da orelha sintomática, na pior audiometria. Essa média subdivide o estágio da doença em I (≤ 25 dB), II (26−40 dB), III (41−70 dB) e IV (> 70 dB).
Para a feitura do VEMPc usou‐se o equipamento ICS Charp EP 200 (GN‐ Otometrics). Foram usados eletrodos descartáveis de superfície, após dermobrasão na pele, para captação de respostas e controle da atividade eletromiográfica (EMG). A máxima impedância permitida para os eletrodos foi de 5 ohms (Ω). A colocação dos eletrodos de superfície seguiu esta ordem: eletrodo ativo colocado na metade superior do músculo esternocleidomastóideo ipsilateral à estimulação sonora e abaixo o eletrodo que controla a atividade eletromiográfica; o eletrodo de referência, sobre o manúbrio do osso esterno e o eletrodo terra, na linha média frontal. O paciente permaneceu sentado, com rotação cervical máxima da cabeça para o lado contralateral ao estímulo.21
Para o registro do VEMPc foi usado o estímulo tone burst rarefeito, apresentado pelo fone de inserção, no total de 150 estímulos. A frequência testada foi de 500Hz, com intensidade de 97 dBNA, filtros passa‐alto de 10Hz e passa‐baixo de 1000Hz e janela de registro de 60ms.
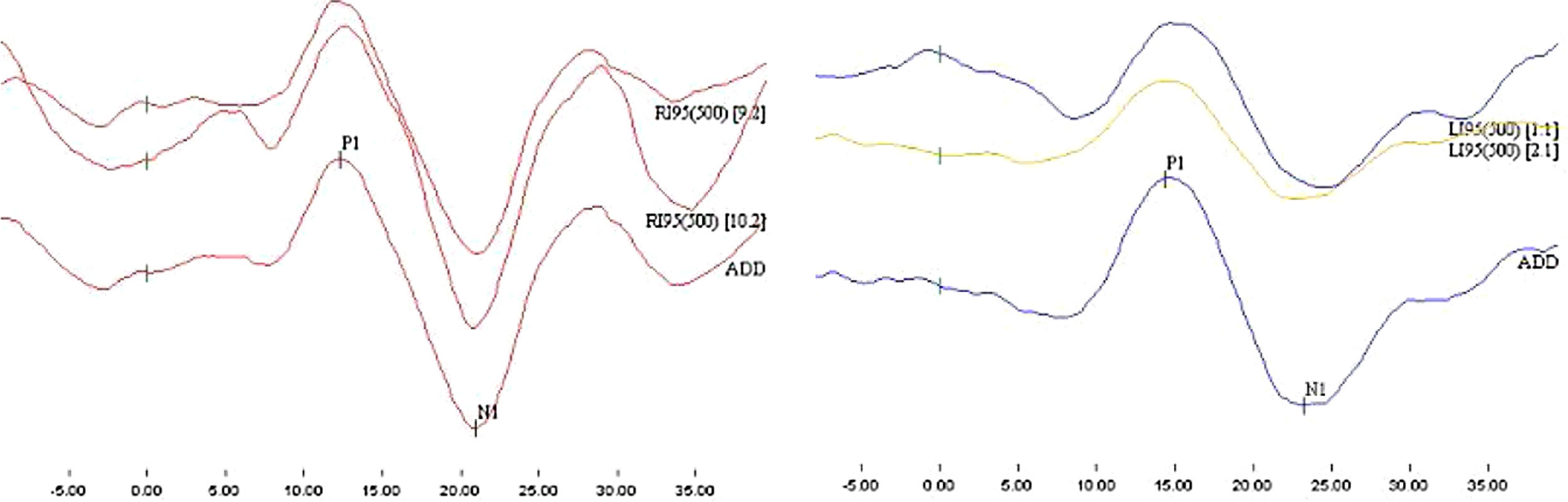
As respostas adquiridas consistiram em um potencial bifásico com a primeira onda positiva, com latência em torno de 13ms, conhecida como p13, e a segunda onda negativa, com latência em torno de 23ms, conhecida como n23. Cada orelha foi testada até obter respostas reprodutíveis, as duas melhores ondas foram escolhidas e foi feita a soma ponderal de ambas e obtido um terceiro registro, o qual foi usado para análise (fig. 1). Foram aceitas respostas eletromiográficas entre 50−200 μv, com objetivo de manter o nível de contração adequado e constante. Os parâmetros do VEMPc considerados nesse estudo foram presença do potencial bifásico, latências absolutas de p13 e n23, interamplitude de p13‐n23 e o índice de assimetria (IA).
A interpretação dos resultados do VEMPc foi baseada nos valores de referência determinados pelo GC. Os valores de referência para a interpretação da normalidade para as latências de p13 e n23, interamplitude de p13 e n23 e IA foram calculados pela média±2 desvios‐padrão (DP).22 Selecionou‐se esse método para poder classificar qualitativamente os resultados do VEMPc em normal ou alterado, uni ou bilateral. Foram interpretados como respostas alteradas a ausência do potencial bifásico, o aumento de latência de p13 ou n23, a diminuição da interamplitude p13‐n23 e o IA acima do limite superior.
Para feitura do vHIT, foi usado o equipamento ICS Impulse (GN‐ Otometrics). O sistema vHIT compõe‐se de um óculos e câmera de vídeo‐oculografia integrada com sensores que são conectados à cabeça por um elástico. A câmera analisa o movimento dos olhos com uma taxa de amostragem de até 250Hz e tem um espelho, o qual reflete a imagem do olho do paciente para a câmera. Um pequeno sensor nos óculos mede o movimento da cabeça. O teste foi aplicado com o indivíduo sentado em uma cadeira a aproximadamente 1,0m de distância do alvo, no qual o sujeito é instruído a manter o olhar fixo.19,23
O pesquisador aplicou movimentos de frequência e direção imprevisíveis nos planos dos canais semicirculares, com baixa amplitude (próximos de 10° a 20°), altas velocidades (acima de 100°s) e acelerações (2000–6000s2). Primeiramente, foram feitos movimentos no plano horizontal para avaliar os canais laterais. Logo após, a cabeça do paciente foi rodada 30° para a direita e fizeram‐se movimentos de cabeça para frente e para trás, no plano vertical, para testar os pares sinérgicos do canal semicircular anterior esquerdo e posterior direito (LARP − Left Anterior e Right Posterior). Em seguida, repetiu a instrução com a cabeça 30° para esquerda e avaliaram‐se os canais anterior direito e posterior esquerdo (RALP − Right Anterior e Left Posterior). Em todas as avaliações o indivíduo foi orientado a manter o olhar no ponto fixo. Durante o teste, foram feitos pelo menos 10 impulsos de cabeça em cada plano avaliado.14,19,24
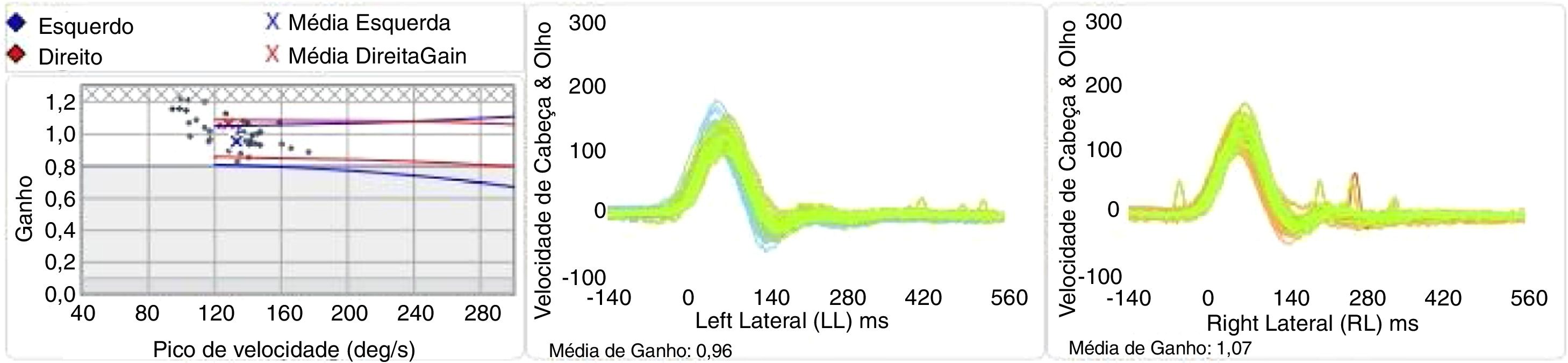
A partir do registro da velocidade cefálica e ocular, o cálculo do ganho do RVO foi feito pelo equipamento. O ganho do RVO foi representado pela razão média dessas velocidades (fig. 2). As sacadas corretivas foram detectadas pelo equipamento e classificadas qualitativamente considerando a latência. As sacadas covert, ocorreram antes do fim do impulso, aproximadamente 100ms, e as sacadas overt 100ms após o movimento da cabeça.14,25
A interpretação dos resultados do vHIT foi baseada nos valores de referência determinados pelo GC. Os resultados do vHIT foram calculados pela média±2DP. Foram interpretados como respostas alteradas o ganho do RVO diminuído e a presença de sacadas corretivas (covert ou overt).
Os dados foram tabulados e analisados com o intuito de descrever as características clínico‐demográficas dos pacientes e estabelecer padrão de distribuição entre os grupos. Para avaliar a distribuição normal entre os grupos foi usado o teste de Shapiro‐Wilks. Quando houve distribuição normal foram usados testes paramétricos e testes não paramétricos quando não houve.
O tamanho do efeito da diferença entre os grupos para cada valor foi medido por meio do cálculo do coeficiente d ou do coeficiente r. Na análise de correlação, também foi usado o cálculo do coeficiente de correlação (r), que pode variar de ‐1 a +1. O valor de significância estatística adotado foi igual a 5% (p<0,05). Os intervalos de confiança de 95% foram calculados pelo método de viés corrigido e acelerado com base em 2000 amostras bootstrap.
ResultadosA amostra do estudo foi constituída por 50 indivíduos, distribuídos em dois grupos. O Grupo de Estudo (GE) foi composto por 18 mulheres e 11 homens, com média etária de 52,24, e o Grupo Controle (GC) por 15 mulheres e 6 homens, com média de 39,67.
Quanto ao estudo de homogeneidade da amostra, não foram observadas diferenças estatisticamente significantes entre os grupos em relação ao gênero (p=0,557). Em relação à idade, os grupos não apresentaram distribuição normal. Os resultados demonstram que houve diferença estatisticamente significante entre os grupos, os pacientes do GE têm maior idade do que o GC.
Em relação à lateralidade da doença, foram identificados 22 (75,9%) pacientes com DM unilateral e 7 (24,1%) com DM bilateral, total de 36 orelhas doentes na amostra. Quanto à distribuição da DM unilateral, 12 (41,4%) com DM em orelha direita e 10 (34,5%) em orelha esquerda. Dos pacientes com DM bilateral, todos apresentaram sintomas iniciais em apenas uma das orelhas e, posteriormente, a doença evoluiu para orelha oposta.
O tempo de evolução para comprometimento da orelha contralateral variou de 2 meses a 15 anos. Em relação ao tempo de doença referido pelos pacientes, a mediana foi 6 anos, a média de 8,57 anos, variou de 4 meses a 25 anos.
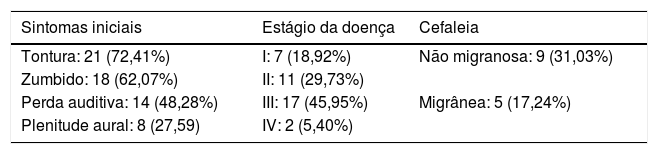
Os sintomas iniciais, o estágio da doença (perda auditiva da orelha com a DM) e a presença de cefaleia (migrânea ou não migranosa) estão descritos na tabela 1.
Características clínicas dos pacientes com doença de Ménière
| Sintomas iniciais | Estágio da doença | Cefaleia |
|---|---|---|
| Tontura: 21 (72,41%) | I: 7 (18,92%) | Não migranosa: 9 (31,03%) |
| Zumbido: 18 (62,07%) | II: 11 (29,73%) | |
| Perda auditiva: 14 (48,28%) | III: 17 (45,95%) | Migrânea: 5 (17,24%) |
| Plenitude aural: 8 (27,59) | IV: 2 (5,40%) |
No cálculo do padrão de normalidade para o vHIT, foi usada a média dos valores de ganho subtraído de 2DP. Assim, foram considerados alterados os valores de ganho para canal lateral abaixo de 0,77 e valores de ganho dos canais verticais abaixo de 0,61. Na análise dos valores do ganho do RVO no GE, considerando as orelhas sintomática e assintomática (58 orelhas), foram evidenciados 82,76% (48 orelhas) de resultados normais para canal lateral, 89,65% (52 orelhas) para canal posterior e 91,37% (53 orelhas) canal anterior.
Em relação à presença do potencial bifásico, no VEMPc, 11 orelhas (18,96%) não apresentaram a resposta no GE e 3 orelhas (7,14%) no GC. Para análise dos parâmetros VEMPc foram excluídos os indivíduos com ausência de resposta, então o GE foi composto por 25 orelhas e o GC por 39 orelhas.
O Índice de Assimetria (IA), parâmetro calculado apenas quando há presença bilateral da resposta, foi obtido em 19 indivíduos do GE e 19 pacientes do GC. Os limites superiores das latências foram definidos pela média acrescida de 2DP: 18,07ms para p13 e 28,47ms para n23. Observou‐se que 19,57% das orelhas do GE apresentaram prolongamento da latência da p13 e 4,35% da onda n23.
De acordo com a orelha afetada pela DM, o GE foi subdividido em orelha sintomática (n=36) e orelha assintomática (n=22).
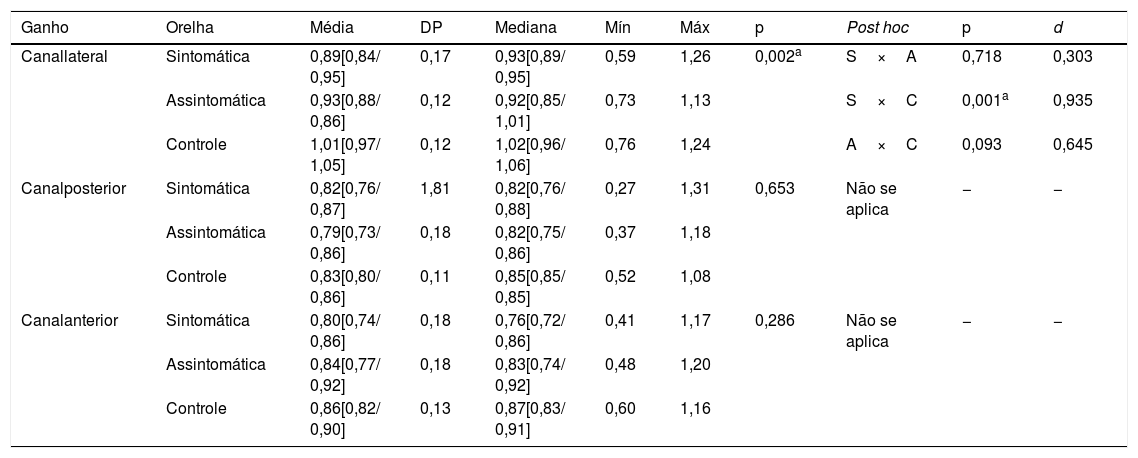
Observou‐se diferença estatisticamente significante entre os três grupos quanto ao ganho do canal lateral (p=0,002). A análise post hoc mostrou diferença entre orelhas sintomáticas e GC, mas não entre as orelhas sintomáticas e assintomáticas (p=0,718) e entre as orelhas assintomáticas e GC (p=0,093). As orelhas sintomáticas apresentaram menor ganho no canal lateral no vHIT em comparação às orelhas do GC. Em relação ao ganho dos canais posterior e anterior, não houve diferença entre as orelhas (tabela 2).
Valores descritivos e análise comparativa das orelhas em relação aos valores de ganho do reflexo vestíbulo ocular, de acordo com o canal avaliado, ao teste de impulso cefálico por vídeo
| Ganho | Orelha | Média | DP | Mediana | Mín | Máx | p | Post hoc | p | d |
|---|---|---|---|---|---|---|---|---|---|---|
| Canallateral | Sintomática | 0,89[0,84/ 0,95] | 0,17 | 0,93[0,89/ 0,95] | 0,59 | 1,26 | 0,002a | S×A | 0,718 | 0,303 |
| Assintomática | 0,93[0,88/ 0,86] | 0,12 | 0,92[0,85/ 1,01] | 0,73 | 1,13 | S×C | 0,001a | 0,935 | ||
| Controle | 1,01[0,97/ 1,05] | 0,12 | 1,02[0,96/ 1,06] | 0,76 | 1,24 | A×C | 0,093 | 0,645 | ||
| Canalposterior | Sintomática | 0,82[0,76/ 0,87] | 1,81 | 0,82[0,76/ 0,88] | 0,27 | 1,31 | 0,653 | Não se aplica | − | − |
| Assintomática | 0,79[0,73/ 0,86] | 0,18 | 0,82[0,75/ 0,86] | 0,37 | 1,18 | |||||
| Controle | 0,83[0,80/ 0,86] | 0,11 | 0,85[0,85/ 0,85] | 0,52 | 1,08 | |||||
| Canalanterior | Sintomática | 0,80[0,74/ 0,86] | 0,18 | 0,76[0,72/ 0,86] | 0,41 | 1,17 | 0,286 | Não se aplica | − | − |
| Assintomática | 0,84[0,77/ 0,92] | 0,18 | 0,83[0,74/ 0,92] | 0,48 | 1,20 | |||||
| Controle | 0,86[0,82/ 0,90] | 0,13 | 0,87[0,83/ 0,91] | 0,60 | 1,16 |
Nota: Anova de um fator com análise post hoc por meio do teste de Gabriel.
d, tamanho do efeito; DP, desvio‐padrão; Máx, máximo; Mín, mínimo.
Os valores entre colchetes indicam os limites superior e inferior dos intervalos de confiança de 95%.
Considerando a presença de sacadas corretivas no vHIT, não houve presença de sacada corretivas nos canais posterior e anterior em ambos os grupos. Para comparar as orelhas em relação à ocorrência de sacada no canal lateral, observou‐se diferença significante entre os grupos de orelhas, pois houve maiores achados de ausência de sacadas entre as orelhas assintomáticas e GC. Quanto aos subtipos de sacadas (overt e covert), não houve significância, apesar da maior ocorrência de sacadas laterais do tipo overt.
Com relação à presença do potencial bifásico do VEMPc, houve diferença estatisticamente significante entre os grupos, devido à maior ocorrência de ausência do potencial nas orelhas sintomáticas, em comparação às orelhas assintomáticas e GC. Em relação às orelhas assintomáticas e controles, não houve diferença em relação à presença do VEMPc.
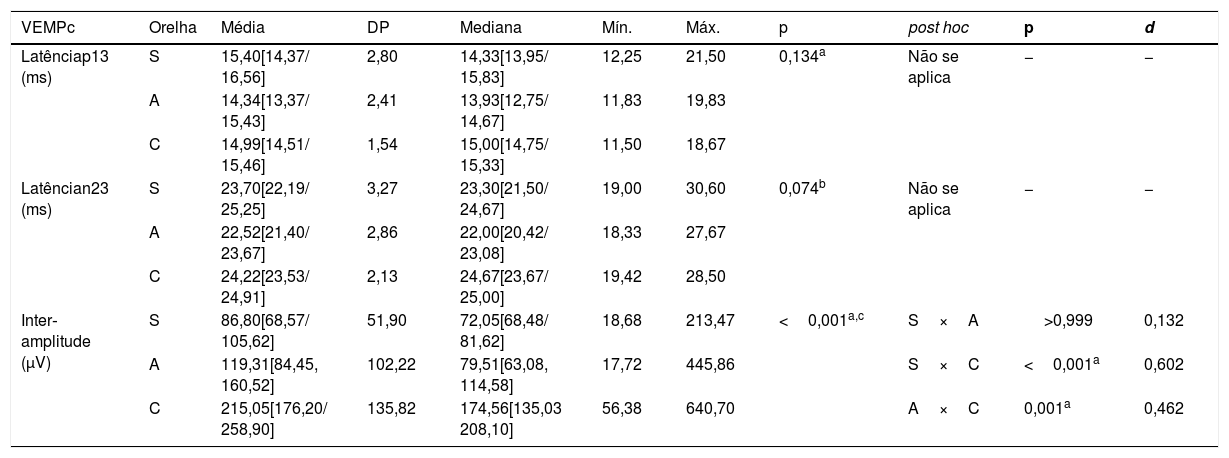
Para a análise dos resultados do VEMPc, os valores de cada orelha foram considerados individualmente, portanto para o IA não foi possível estabelecer essa análise comparativa. Os resultados da tabela 3 demonstram que houve diferença estatisticamente significante entre os três grupos quanto à interamplitude do VEMPc (p <0,002). A análise post hoc revelou que houve diferença estatisticamente significante entre o grupo de orelhas sintomáticas e o GC (p <0,001) e entre o grupo de orelhas assintomáticas e o GC (p=0,001). Assim, tanto orelhas sintomáticas quanto orelhas assintomáticas de indivíduos com DM apresentaram menor interamplitude no VEMPc em comparação com GC. Em relação à latência das ondas p13 e n23, não houve diferença estatisticamente significante entre as orelhas (tabela 3).
Valores descritivos e análise comparativa das orelhas em relação aos parâmetros avaliados pelo potencial miogênico evocado vestibular cervical nos grupos de orelhas sintomática, assintomática e do grupo controle
| VEMPc | Orelha | Média | DP | Mediana | Mín. | Máx. | p | post hoc | p | d |
|---|---|---|---|---|---|---|---|---|---|---|
| Latênciap13 (ms) | S | 15,40[14,37/ 16,56] | 2,80 | 14,33[13,95/ 15,83] | 12,25 | 21,50 | 0,134a | Não se aplica | − | − |
| A | 14,34[13,37/ 15,43] | 2,41 | 13,93[12,75/ 14,67] | 11,83 | 19,83 | |||||
| C | 14,99[14,51/ 15,46] | 1,54 | 15,00[14,75/ 15,33] | 11,50 | 18,67 | |||||
| Latêncian23 (ms) | S | 23,70[22,19/ 25,25] | 3,27 | 23,30[21,50/ 24,67] | 19,00 | 30,60 | 0,074b | Não se aplica | − | − |
| A | 22,52[21,40/ 23,67] | 2,86 | 22,00[20,42/ 23,08] | 18,33 | 27,67 | |||||
| C | 24,22[23,53/ 24,91] | 2,13 | 24,67[23,67/ 25,00] | 19,42 | 28,50 | |||||
| Inter‐amplitude (μV) | S | 86,80[68,57/ 105,62] | 51,90 | 72,05[68,48/ 81,62] | 18,68 | 213,47 | <0,001a,c | S×A | >0,999 | 0,132 |
| A | 119,31[84,45, 160,52] | 102,22 | 79,51[63,08, 114,58] | 17,72 | 445,86 | S×C | <0,001a | 0,602 | ||
| C | 215,05[176,20/ 258,90] | 135,82 | 174,56[135,03 208,10] | 56,38 | 640,70 | A×C | 0,001a | 0,462 |
Nota: Teste de Kruskal‐Wallis (a) com análise post hoc por meio do teste de Dunn‐Bonferroni e Anova de um fator (b).
A, assintomática; C, controle; d, tamanho do efeito; DP, desvio‐padrão; Máx, máximo; Mín, mínimo; S, sintomática; VEMPc, potencial miogenico evocado vestibular cervical.
Os valores entre colchetes indicam os limites superior e inferior dos intervalos de confiança de 95%.
c Valor estatisticamente significante no nível de 5% (p <0,05);
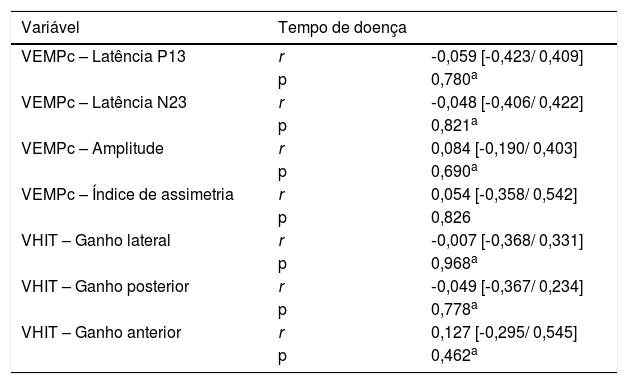
Com objetivo de verificar se houve correlação entre tempo de doença e os exames feitos, calculou‐se o valor de p, por meio do teste de Spearman (não paramétrico) ou do teste de Pearson (paramétrico) e do coeficiente de correlação (r). Os parâmetros do vHIT não mostraram correlação estatisticamente significante com o tempo de doença (tabela 4).
Análise de correlação entre tempo de doença e parâmetros dos exames: potencial miogênico evocado vestibular cervical e teste de impulso cefálico por vídeo para as orelhas sintomáticas
| Variável | Tempo de doença | |
|---|---|---|
| VEMPc – Latência P13 | r | ‐0,059 [‐0,423/ 0,409] |
| p | 0,780a | |
| VEMPc – Latência N23 | r | ‐0,048 [‐0,406/ 0,422] |
| p | 0,821a | |
| VEMPc – Amplitude | r | 0,084 [‐0,190/ 0,403] |
| p | 0,690a | |
| VEMPc – Índice de assimetria | r | 0,054 [‐0,358/ 0,542] |
| p | 0,826 | |
| VHIT – Ganho lateral | r | ‐0,007 [‐0,368/ 0,331] |
| p | 0,968a | |
| VHIT – Ganho posterior | r | ‐0,049 [‐0,367/ 0,234] |
| p | 0,778a | |
| VHIT – Ganho anterior | r | 0,127 [‐0,295/ 0,545] |
| p | 0,462a |
Nota: Teste de correlação de Pearson (a) e teste de correlação de Spearman (b)
Considerando as características demográficas dos pacientes com DM, a amostra teve maior prevalência do gênero feminino (62,02%). Em pesquisa que avaliou a prevalência da DM na população, observou‐se que as mulheres são mais afetadas do que os homens na proporção de 1,89:1.26 Em relação à idade, os pacientes avaliados tiveram média etária de 52 e faixa que variou de 19 a 69 anos. Observaram‐se média similar em outro estudo27 e valores de faixa etária parecidos.4,28–30 Considerando a média de idade do início da doença, o atual estudo encontrou 44,1 anos, resultado semelhante ao observado em outras pesquisas.31,32
Na amostra do presente estudo, a maioria dos pacientes apresentou doença unilateral 22 (75,90%). Desses, 12 (54,50%) na orelha direita. A maioria dos estudos incluiu pacientes com DM unilateral12,18,19,27 e a predileção por orelha não foi consenso.
Considerando a prevalência da DM bilateral (24,10%), outro estudo também obteve prevalência parecida, com 20% dos pacientes da amostra diagnosticados com envolvimento em ambas as orelhas.33 Os pacientes com acometimento bilateral dessa pesquisa apresentaram inicialmente DM definida em uma das orelhas e então a doença progrediu bilateralmente, o tempo de evolução variou de 2 meses a 15 anos. Na pesquisa de Perez et al.,34 o intervalo de tempo entre o diagnóstico inicial e o início da doença na orelha oposta variou entre 3 e 26 anos. A ocorrência da bilateralidade pode indicar a progressão da doença e depende de fatores como tempo de evolução e critérios diagnósticos adotados. A DM bilateral raramente se apresenta com início simultâneo entre os lados, mas de forma sequencial, o envolvimento da orelha contralateral ocorre anos depois.35
No presente trabalho, observou‐se grande variação do tempo da doença (4 meses a 25 anos). Essa extensa variação também foi encontrada em outros estudos.18,27,36 Quanto aos primeiros sintomas a aparecer nessa amostra, a tontura e o zumbido foram os mais prevalentes. Em consenso com a literatura, encontraram prevalência de tontura como sintoma inicial, seguida por zumbido.29,37 O que pode explicar a alta ocorrência da tontura, como sintoma inicial, é a possibilidade da DM vestibular ser a forma inicial de desenvolvimento da doença, que é corroborado por estudo que avaliou o início da vertigem, perda auditiva e zumbido na DM e hidropisia endolinfática associada, por meio de imagens de ressonância magnética.29
A presença de cefaleia com características migranosas também foi observada nesse estudo. A ocorrência de migrânea na DM pode variar de 22% a 56%, é mais prevalente do que na população em geral.38,39 Pesquisa sugere que possa haver mesma fisiopatologia e algum componente genético entre DM e migrânea.39 Embora ainda não comprovada, uma hipótese é que os eventos vasoespásticos associados à migrânea resultam em danos à orelha interna, predisponham a orelha a sintomas auditivos e vestibulares,35 bem como a presença de mutações em genes relacionados a canais neuronais voltagem‐dependentes.40
Quanto ao grau da perda auditiva, observou‐se prevalência em ordem decrescente dos Graus III, II, I e IV. Kim et al.,37 ao estudar DM definida, encontraram a mesma proporção de prevalência dos Graus II e III. Lee et al.,20 ao avaliar pacientes durante a crise, encontraram maior ocorrência do Estágio I, depois III e II. O estudo de Rubin et al.,18 que analisou DM unilateral em estágio avançado, com progressão maior do que um ano e mais de uma crise por mês, encontrou maior proporção do Estágio III, seguido por IV, II e I.
A DM é caracterizada por ser multifatorial e apresentar curso e duração variáveis. Para alguns autores ela parece ser um continuum de uma doença inicial que evolui para uma entidade de doença totalmente desenvolvida.29 Entretanto, trata‐se de uma afecção ainda bastante estudada e os exames tornam‐se aliados na avaliação funcional desses pacientes e no auxílio do diagnostico diferencial da doença.5 A prevalência de hidropisia é de 100% na cóclea, 86,3% no sáculo, 50% no utrículo e 36,4% nos canais semicirculares.41
Atualmente, o vHIT tornou‐se uma ferramenta clínica útil para detectar quantitativamente a função dos três pares de canais semicirculares, por meio da avaliação do RVO angular.42
Foram encontrados na literatura estudos que divergiram quanto aos resultados da presente pesquisa. A única pesquisa encontrada que avaliou o vHIT em DM definida de acordo com os mesmos critérios diagnósticos do presente estudo encontrou 100% do ganho do vHIT normal e o padrão de normalidade estipulado foi de 0,78 para canais laterais e 0,64 para canais laterais. Entretanto, a amostra contemplava apenas a DM em estágio avançado.18 Demais pesquisas que usaram os critérios anteriores da AAO‐HNS encontraram resultados diversos.17,20 As discrepâncias de resultados entre os estudos podem estar relacionadas às diferenças nos métodos usados, critérios diagnósticos, período avaliado (crise ou intercrise) e padrão de normalidade para ganho do RVO.
De acordo com a ordem de acometimento da DM, os canais semicirculares são os últimos sítios a ser afetados na orelha interna, o que poderia explicar os resultados geralmente normais no vHIT.5 Os canais semicirculares são mais resistentes à expansão hidrópica e têm paredes mais espessas e rígidas do que a região sacular, por exemplo.43 Além disso, sugere‐se que a dissociação entre vHIT normal e prova calórica alterada pode ser um indicador que o paciente tenha DM, já que hidropisia tem pouco efeito sobre as respostas da cúpula no impulso cefálico.44
A justificativa de encontrar resultados mais alterados no canal lateral, em comparação aos canais verticais, se deve à anatomia do vestíbulo e a fisiopatologia da doença. Os canais verticais têm um espaço marginal maior em comparação com os horizontais, favorecem uma resistência adicional ao volume ocasionado pela hidropisia. Assim, a pressão que prejudica o fluxo endolinfático seria proporcionalmente menor nos canais verticais.19
Quanto à presença de sacadas, o estudo de Blödow et al.25 corrobora a presente pesquisa e mostra maior prevalência do subtipo overt em comparação com covert. Esse mesmo estudo indicou ser comum a ocorrência de sacadas em disfunções vestibulares. As sacadas overt aparecem com mais frequência, de forma isolada, ou em combinação com as sacadas covert, principalmente em lesão vestibular aguda.14 Na perda vestibular há diminuição do ganho do RVO e as sacadas de refixação surgem para compensar essa falha. Quando o paciente não consegue manter os olhos no alvo, surgem as sacadas covert, como parte de uma compensação dinâmica, as quais têm como objetivo estabilizar o olhar. Porém, quando os olhos não conseguem atingir o alvo, podem aparecer as sacadas secundárias, denominadas overt, que é um sinal claro de déficit vestibular.25,45 As sacadas overt por ocorrerem tardiamente estão relacionadas a um mecanismo de disparo visual central, já as sacadas covert ainda apresentam mecanismo incerto.25 Também foi observado que à medida que as acelerações do impulso cefálico aumentaram, as sacadas covert se tornaram mais comum.45 Esse achado confirma a importância da feitura do vHIT em altas acelerações. Além disso, as sacadas são importantes na compreensão da plasticidade durante a recuperação da perda vestibular unilateral, pois elas estão relacionadas a um mecanismo de compensação ou de substituição dentro do sistema oculomotor.46
A maioria das pesquisas corroborou os resultados do presente estudo e não apontou o vHIT como um exame que detecta alterações em orelhas assintomáticas, como preditor de DM bilateral. Em pesquisa na qual foi avaliado o RVO em pacientes após antibioticoterapia parenteral com gentamicina, evidenciou‐se redução do ganho também no lado assintomático, mas esse efeito só estava presente para valores de ganho mais baixos, em torno de 0,38.47
O VEMPc por sua vez, também é um exame clínico amplamente usado para investigar diferentes afecções neurológicas e otoneurológicas.21 A última revisão sistemática feita pela Academia Americana de Neurologia8 confirma que estudos em animais sugerem que o VEMPc esteja mais intimamente ligado à função do sáculo, porém tanto o VEMP cervical como o ocular ainda têm eficácia desconhecida na identificação precisa da função vestibular do sáculo e utrículo, respectivamente. De acordo com essa revisão, os estudos de DM e VEMP apontam para a possibilidade de esse exame auxiliar na avaliação da doença, porém não há conclusões suficientes de que o VEMP possa ser usado para diagnosticar a DM. Assim, esse teste pode ser útil no monitoramento clínico dos pacientes com DM.
Na literatura, a maioria dos estudos usou os critérios diagnósticos da AAO‐ HNS (1995) para o diagnóstico da DM e demonstrou resultados variáveis e divergentes.4,9,12
O único estudo encontrado, que usou os critérios atuais de 2015, observou diferenças entre os grupos (DM definida e controle) para todos os parâmetros do VEMPc e as respostas alteradas foram 3% de ausência do potencial e 33% de alteração no prolongamento das latências das ondas p13 e n23.21
Com relação às médias e aos limites de normalidade dos parâmetros do VEMPc, há grande variabilidade entre os resultados (equipamento, tipo de estímulo, parâmetros adotados). Logo, justifica‐se a importância de cada centro de pesquisa normatizar os valores de referência a partir de exames em indivíduos saudáveis e em diferentes faixas etárias.7,10
Estudos sugerem que a ausência do VEMPc pode estar relacionada à diminuição da sensibilidade da região sacular, alteração vestibular oculta ou contração muscular insuficiente.9 Esse último fator foi descartado neste estudo, pois usou‐se o registro de eletromiografia para monitoração da contração muscular do esternocleidomastóideo. Outros autores também inferiram que, a depender da evolução da doença, os pacientes podem apresentar degeneração irreversível do epitélio sensorial da mácula sacular, culminar em ausência do potencial bifásico.6,12,48
O prolongamento das latências, principalmente do primeiro pico (p13), pode estar relacionado às alterações no mecanismo sacular, como alta pressão endolinfática nesse órgão, o que prejudica a transmissão do som.12 Outras pesquisas apontam para lesões do trato vestíbulo‐espinal, tais como esclerose múltipla e alteração retrolabiríntica.36,48 Nas orelhas assintomáticas também se observou aumento de latência das ondas, porém em menor grau, indicou possível alteração oculta bilateral.12,21
A interamplitude, parâmetro que, no presente estudo, mostrou‐se diminuído na orelha com DM, reflete a magnitude do reflexo muscular vestíbulo‐espinal.10 Muitos estudos não consideram esse parâmetro quando ele é avaliado isoladamente, por apresentar grande variação interpessoal, decorrente da variação de massa e tônus da musculatura de cada indivíduo.9,12 Para maior controle, a interamplitude na presente pesquisa foi padronizada pelo controle da atividade eletromiográfica. Algumas pesquisas também encontraram diminuição da amplitude pico a pico nos pacientes com DM.6,37
Por sua vez, o IA no atual estudo não revelou ser um parâmetro com diferença significante entre os grupos e atribuiu‐se esse resultado ao grande desvio‐padrão encontrado no GC, que se traduziu em um limite normativo superior alto. Estudo de Silva et al.21 corrobora os achados da presente pesquisa e também não encontrou diferença em relação ao IA entre os pacientes com DM e controles. Entretanto, diversas pesquisas relataram esse parâmetro alterado na DM.10,11 O aumento do índice de assimetria pode levar a duas interpretações e uma delas pode ser o aumento de amplitude da orelha afetada, o que sugere alta sensibilidade da mácula sacular diante da aproximação da hidropisia à platina do estribo. Porém, na maioria das vezes, reflete a diminuição da amplitude do lado acometido, em comparação ao lado sadio, culmina em IA elevado.22 Outras pesquisas revelam que o IA pode auxiliar no monitoramento clínico da progressão da DM, pois se observaram índices maiores para estágios mais avançados da doença, refletiram uma maior assimetria entre os labirintos.22,36
Estudos na literatura sugerem a possibilidade de o VEMPc predizer o acometimento da orelha assintomática, tanto em casos de hidropisia sacular oculta ou em alterações nas interações binaurais no arco reflexo otólito‐cervical,12,21 o que corrobora os achados da presente pesquisa. As alterações do VEMPc na orelha assintomática estão em consonância com a alta prevalência da hidropisia sacular e da grande proporção de acometimento da DM nas orelhas contralaterais.5,29
O presente estudo não evidenciou correlação dos parâmetros dos exames com o tempo de doença. Esse resultado pode estar relacionado ao tamanho amostral pequeno e da grande variação do tempo de doença. Quanto ao VEMPc, alguns estudos também não encontraram essa correlação. Pesquisa de Osei‐Lah et al.36 não encontrou evidência entre duração da DM e ausência ou presença do VEMPc. Katayama et al.,49 por sua vez, não observaram relação dos resultados do VEMPc com o estágio da doença. Já para o vHIT, o trabalho de Cerchiai et al.,50 ao comparar esse exame em dois grupos de DM unilateral, sendo um deles tratado com gentamicina intratimpânica e outro grupo submetido a uma terapia conservadora, também não evidenciou correlação com o tempo de doença para os dois grupos. Entretanto, a pesquisa de Zulueta‐Santos et al.,19 ao avaliar 36 pacientes com DM definida, sem comparação com grupo controle, observou que à medida que a doença progride o número de anormalidades aumenta nos seis canais semicirculares, mais no lado ipsilateral e, em particular, nos canais posteriores.
ConclusãoO exame vHIT na DM apresentou ganho do RVO diminuído para os canais laterais, sacadas corretivas apenas no canal lateral, com predominância do tipo overt, e não encontrou diferenças significantes entre as orelhas sintomática e assintomática.
Para o VEMPc, os pacientes com DM apresentaram ausência do potencial bifásico e prolongamento das latências e observou‐se diferença significante entre os grupos para o parâmetro interamplitude, tanto para orelhas sintomáticas e assintomáticas. Não foi evidenciada correlação dos resultados dos exames com o tempo de doença.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Grigol TA, Lopes KC, Ganança FF. Cervical vestibular evoked myogenic potentials and video head impulse test in Ménière disease. Braz J Otorhinolaryngol. 2020;86:534–44.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.