Revisar as evidências sobre a correlação entre alergia à proteína do leite de vaca e otite média aguda recorrente e otite média com efusão.
MétodosAs buscas foram feitas nas bases de dados Central, Web of Science, Embase, Medline, Lilacs e na literatura cinzenta.
ResultadosQuatro estudos foram incluídos, identificaram‐se as prevalências: 0,2% de fala atrasada devido a otite média com efusão crônica entre 382 crianças com alergia à proteína do leite de vaca, 10,7% de alergia à proteína do leite de vaca entre 242 crianças submetidas a procedimentos otorrinolaringológicos, 40% de alergia à proteína do leite de vaca entre 25 crianças com otite média com efusão recorrente e maior tendência à otite média em alérgicos à proteína do leite de vaca entre 186 crianças (1,5 + 0,6 vs. 0,4 + 0,1; p<0,1).
ConclusãoSe considerarmos as características e variações metodológicas dos estudos identificados, não é possível afirmar a existência de evidência confiável sobre a correlação entre alergia à proteína do leite de vaca e otite média.
A otite média é uma das doenças mais comuns da infância, acomete mais de 90% da população pediátrica até os dois anos. Pode apresentar‐se como otite média aguda (OMA), com surgimento rápido de sinais e sintomas de inflamação do mucoperiósteo da orelha média, ou como otite média com efusão (OME), caracterizada pela presença de fluido na cavidade timpânica sem sinais de infecção otológica aguda.1
O curso clínico e as sequelas da otite média são variáveis, algumas crianças apresentam resolução espontânea sem tratamento específico, enquanto outras, mesmo após antibioticoterapia e/ou cirurgia, evoluem com episódios recorrentes.1,2 Assim, a identificação de fatores de risco associados ao desenvolvimento de otite média recorrente (Omar) é de extrema importância para identificação das crianças mais suscetíveis, redução do uso indiscriminado de antimicrobianos e orientação de pais e cuidadores, evitam‐se, assim, sequelas auditivas e/ou estruturais.3
Estudos apontam que, no mínimo, 25% das crianças com OME evoluem com cronificação do quadro, com presença de fluido na cavidade timpânica por mais de três meses. Além disso, 15% a 20% das crianças que tiveram OMA terão Omar.1,3 Ambas podem estar associadas à perda auditiva, a alterações no equilíbrio, mau desempenho escolar, problemas comportamentais e desconforto auditivo, com grande impacto sobre a qualidade de vida.4,5 Apesar do grande número de publicações a respeito dos fatores de risco para o desenvolvimento da Omar e da OME, ainda existem controvérsias a respeito do manejo e das recomendações específicas destes. Nesse contexto, inclui‐se a busca pela correlação entre alergia à proteína do leite de vaca (APLV) e o desenvolvimento de otite média.
A proteína do leite de vaca é o principal alérgeno alimentar crianças menores de três anos e essa prevalência cai para menos de 1% em crianças com seis anos ou mais.6,7 Entretanto, a real prevalência é difícil de ser estimada devido à falta de padronização diagnóstica dos estudos que se propõem a avaliar tal parâmetro.7 A maioria das crianças com APLV desenvolve sintomas antes de um ano, geralmente dentro de uma semana após a introdução da fórmula à base de leite de vaca.8 Alguns bebês alimentados exclusivamente com leite materno também podem desenvolver APLV, sob a hipótese de que isso se deva à β‐lactoglobulina, substância presente no leite de vaca, que é encontrado no leite materno quatro a seis horas após a mãe consumir leite de vaca.9,10
O mecanismo fisiopatológico relacionado ao desenvolvimento das manifestações clínicas da APLV ainda está em elucidação. Algumas manifestações são induzidas por mecanismos mediados por IgE, por meio de reações de hipersensibilidade do tipo 1, como urticária, angioedema e anafilaxia. As reações tardias não são mediadas por IgE e/ou são reações imunes mistas e se caracterizam por acontecer de 24 horas até semanas após a exposição. São reações inespecíficas, como, por exemplo, baixo ganho ponderal, vômitos, recusa alimentar e diarreia.11 Essas características, associadas à ausência de exames laboratoriais confirmatórios, dificultam a acurácia diagnóstica para APLV e alguns estudos estimam que os sintomas de APLV podem ser encontrados em 5% a 15% dos bebês em geral.9 Assim, quando há suspeita de APLV, deve‐se fazer uma dieta com exclusão do alérgeno por 2 a 4 semanas e, posteriormente, teste de provocação oral para avaliar se há reprodutibilidade dos sintomas e, dessa forma, confirmação do diagnóstico.12
O diagnóstico correto permite que a dieta apropriada seja dada às crianças afetadas, permiteo assim crescimento e desenvolvimento adequados. Por outro lado, quando se institui uma dieta de exclusão que não é necessária ou quando essa dieta persiste, mesmo após a criança já ter desenvolvido tolerância ao alérgeno, pode haver déficits nutricionais, pioria da qualidade de vida da criança e da família, bem como geração de custos de saúde desnecessários e significativos.8,11
Em 2004, a correlação entre alergia alimentar e OME e Omar foi postulada por James a partir de uma série de estudos que apontaram a inflamação alérgica na mucosa nasal como fator causador de disfunção da tuba auditiva e subsequente OME. Entretanto, o autor discute as dificuldades de se obter a confirmação do papel da alergia alimentar na ocorrência de otite média, uma vez que os dados publicados na época eram limitados, os estudos envolvidos tinham desenhos metodológicos pouco desenvolvidos e por conseguinte levavam a resultados superestimados e controversos.9
Assim, o presente estudo tem como objetivo fazer uma revisão das evidências sobre a correlação entre APLV e o desenvolvimento de Omar e OME.
MétodosRevisão sistemática norteada pela pergunta: “Existe evidência de uma correlação entre APLV e Omar/ou OME?” A formulação da questão de pesquisa foi estruturada segundo os componentes do acrônimo PECO (População de interesse, Exposição, Comparador e Desfecho).13 A revisão incluiu estudos com texto completo publicados em qualquer data, nas línguas inglesa, portuguesa e espanhola, que avaliaram a associação entre APLV e Omar e/ou OME, com descrição dos parâmetros usados para o diagnóstico dessas condições. Foram excluídos resumos publicados em anais de congressos, relatos de caso e estudos em que os diagnósticos foram feitos por autorrelato ou não foram descritos. Todos os procedimentos para a condução desta revisão foram feitos de acordo com checklist Preferred Reporting Items for Systematic Reviews and Meta-Analyses (Prisma).14
O número de registro é: CRD42021262210.
Métodos de busca para identificação dos estudosBusca eletrônicaOs estudos foram identificados nas bases de dados Cochrane Central Register of Controlled Trials (Central), Web of Science (Clarivate Analytics), Embase (Elsevier), Medline (PubMed), Latin American and Caribbean Health Sciences Literature (Lilacs/Bireme). A seguinte estratégia de busca usada na base de dados Medline (PubMed): “Otitis Media” [MeSH] OR otitis media OR aom OR ome AND “Milk Hypersensitivity” [Mesh] OR milk proteins OR (CMA OR CMPA) OR “milk allergy” OR “milk protein allergy” OR “cow* milk protein allergy” OR allergy AND (“infant formula*” OR “milk adverse effects” OR “Food Hypersensitivity” [MeSH] OR “food allergen”. A estratégia de busca completa de acordo com cada base de dados está detalhada no Apêndice 1. Não foram aplicadas restrições de busca.
Outros recursos de buscaForam consultadas as seguintes fontes de literatura cinzenta: Google Scholar, OpenGrey, Turning Research Into Practice (TRIP) e catálogos de teses e dissertações da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes). A estratégia de busca nessas fontes está detalhada no Suplemento 1. As listas de referências dos estudos recuperados também foram pesquisadas para identificar outros estudos potencialmente elegíveis.
Coleta e análise de dadosSeleção de estudosNa etapa de triagem, três autores avaliaram de forma independente os títulos e resumos de todos os resultados da estratégia de busca, de acordo com os critérios de inclusão e exclusão. As discordâncias, quando presentes, foram resolvidas por um quarto revisor. Na etapa seguinte, foram feitas a leitura do texto completo dos estudos selecionados na etapa anterior, de modo independente, e a exclusão dos estudos que não atenderam aos critérios de inclusão.
Extração e gerenciamento de dadosOs dados dos estudos incluídos foram coletados por meio de uma ficha de avaliação padronizada.
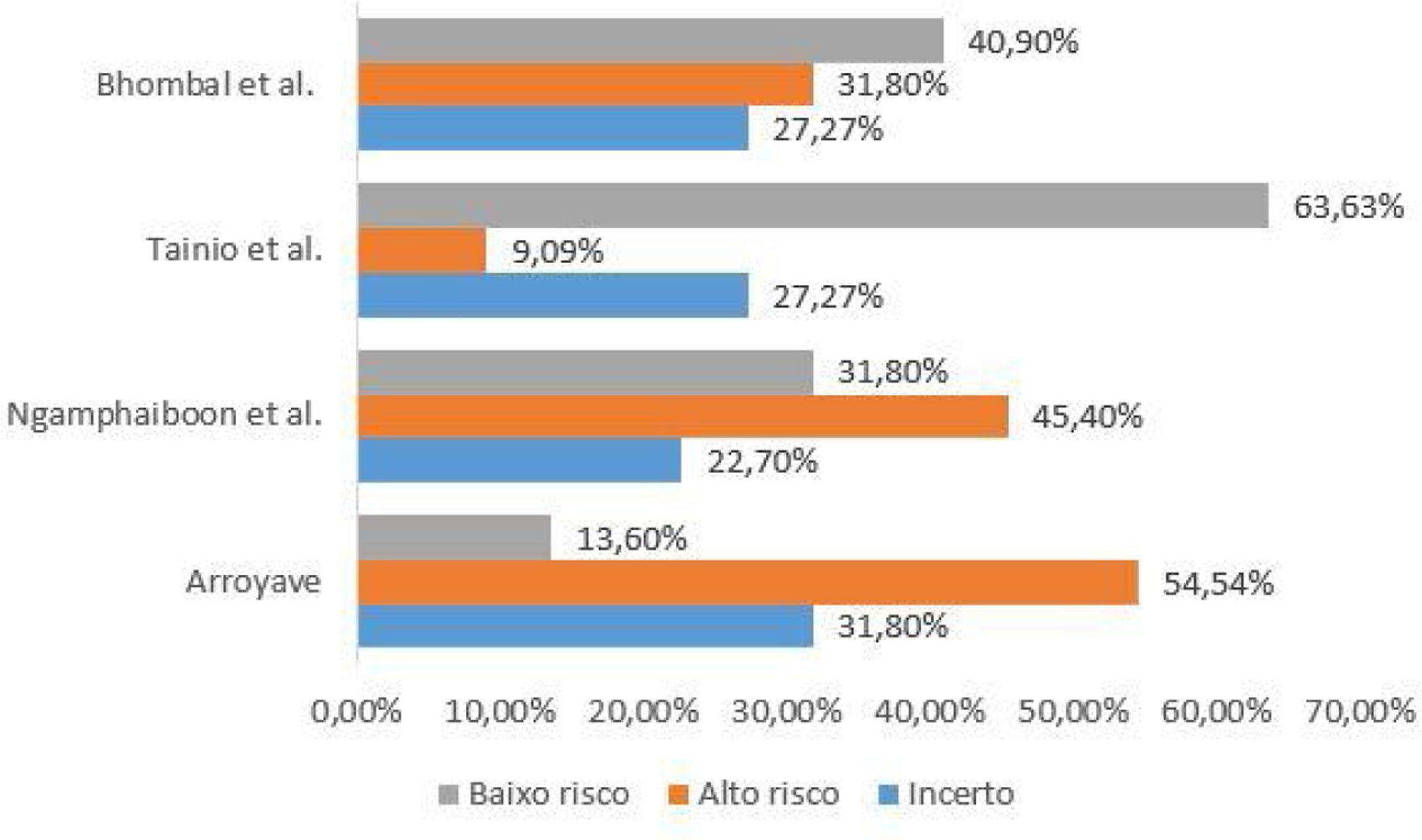
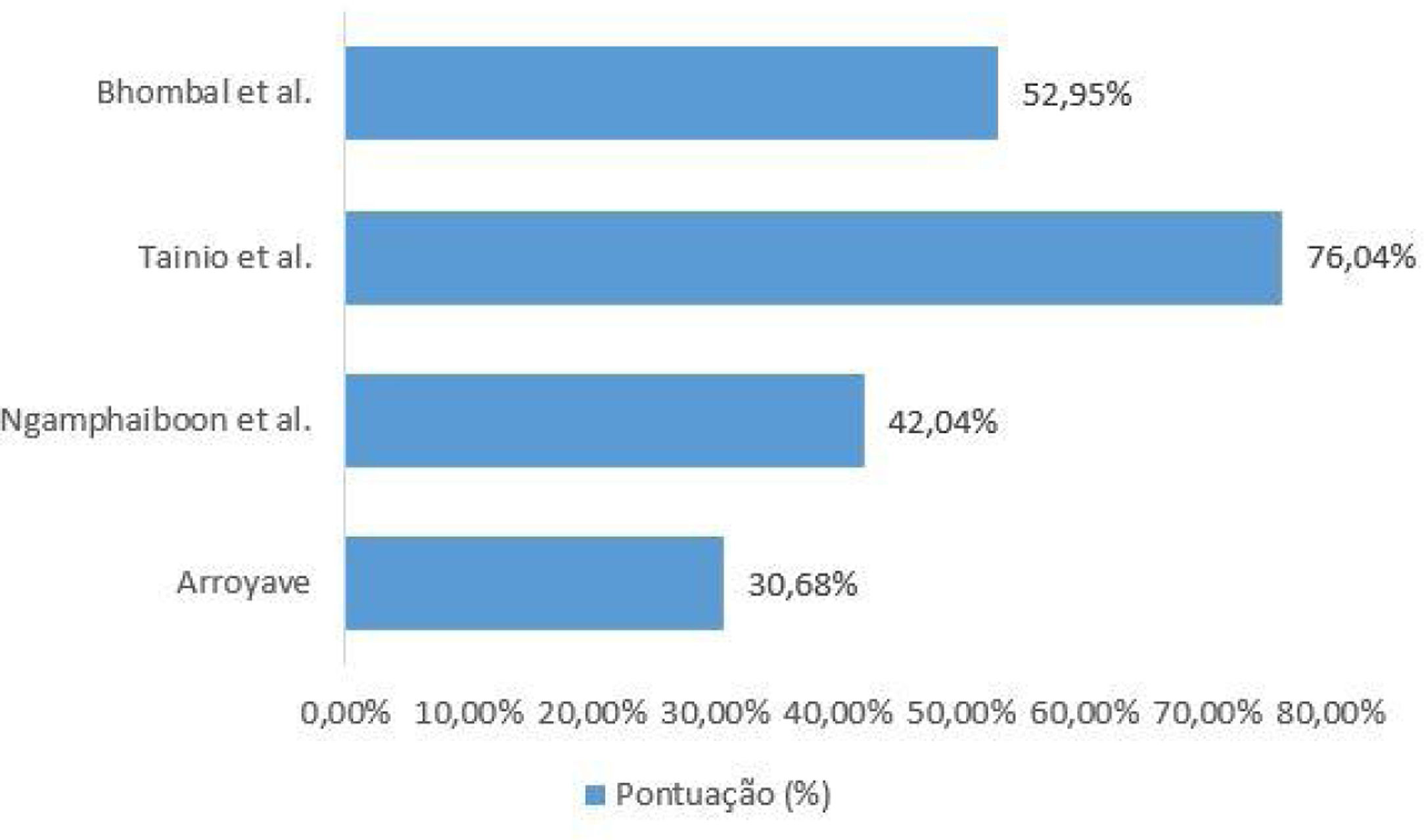
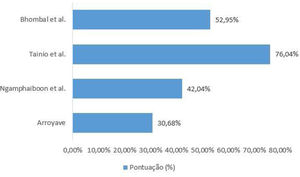
Avaliação da qualidade dos estudos incluídosO checklist fornecido pelo relatório elaborado pela iniciativa Strengthening the Reporting of Observational Studies in Epidemiology (Strobe)15 foi usado para a avaliação da qualidade dos estudos incluídos. Cada estudo foi avaliado por dois revisores de forma independente e as discrepâncias foram resolvidas por consenso. Para apresentação dos dados o checklist foi preenchido de duas formas. Na primeira, de forma qualitativa, foi atribuído para cada item do Strobe: “sim” (baixo risco de viés) quando o item foi totalmente contemplado, “não” (alto risco de viés), quando o item não foi contemplado, ou ainda “parcialmente”, quando o item não demonstrou clareza. Os resultados foram representados na figura 1. Na segunda, de forma quantitativa, foram atribuídas a cada item pontuações: 1 ponto para itens contemplados; 0,5 para itens parcialmente contemplados e 0 para itens não contemplados. Para os itens compostos por subitens a pontuação foi distribuída de maneira proporcional, isto é, em um item formado por 5 subitens cada subitem recebia o valor de 0,2. Os resultados dessa segunda abordagem estão expressos na figura 2.
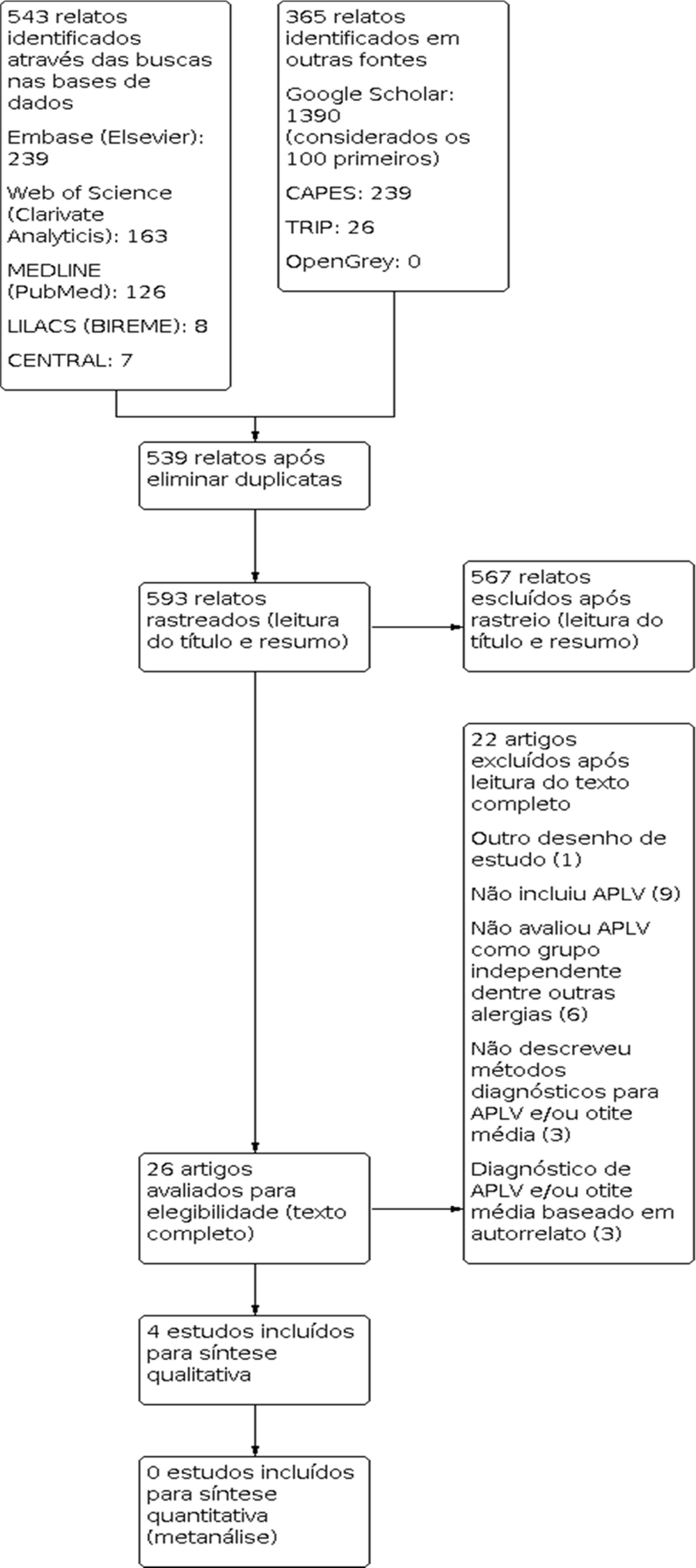
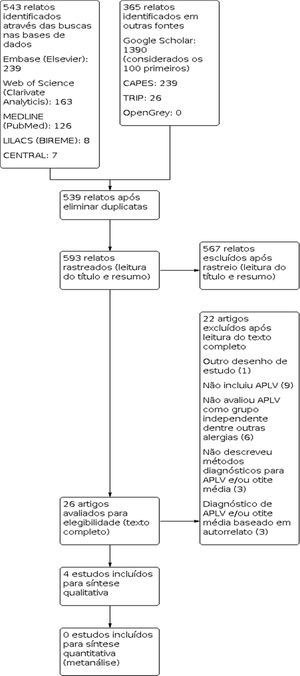
ResultadosForam identificados 908 resultados. Após a execução das etapas metodológicas foram incluídos quatro estudos para síntese qualitativa. O fluxo da informação que contém as fases desta revisão está apresentado na figura 3. Assinalamos que não foi possível acessar apenas um estudo selecionado para leitura do texto completo. Após contato com o periódico responsável pela publicação, foi informado que o estudo não se encontra disponível em meio digital (Apêndice 2).
Os quatro estudos incluídos avaliaram a correlação entre APLV e Omar ou OME. Os estudos incluíram pacientes pediátricos de diferentes grupos etários e houve variação nos critérios diagnósticos empregados, observou‐se heterogeneidade. Os estudos são do tipo observacional, três do tipo transversal e um prospectivo. As características dos estudos estão apresentadas na tabela 1. A avaliação da qualidade metodológica está apresentada nas figuras 1 e 2.
Características dos estudos incluídos
| Referência (autor(es), ano) | Local (cidade/país) | Desenho do estudo | Características da população | Método diagnóstico para o diagnóstico para APLV | Método diagnóstico para a avaliação do diagnóstico de otite média | Desfechos de interesse | ||
|---|---|---|---|---|---|---|---|---|
| Tamanho e perfil da amostra | Sexo | Idade | ||||||
| Tainio VM et al., 1988 | Finlândia, Helsinque | Coorte prospectiva | 183 (crianças saudáveis ao nascimento) | Não descrito. | Seguimento desde o nascimento até os 2 anos de idade. | Desenvolvimento repetido de sinais cutâneos, respiratórios ou gastrointestinais após ingestão de leite de vaca, e desaparecimento destes sinais em dieta com exclusão do leite de vaca; e teste de provocação oral realizado no hospital. | OMA: Exame otoscópico com visualização de perda da translucidez e dos pontos de referência da membrana timpânica, inflamação clara ou abaulamento, ausência de mobilidade, ou secreção purulenta.OMR: número de episódios separados de otite média ocorrendo no percentil 90 de toda a série de participantes durante os primeiros 2 anos (cinco episódios), ou no percentil 95 durante o segundo ano (quatro episódios). Foram considerados episódios separados: um episódio de otite média 2 meses após um episódio anterior e após um exame otoscópico normal em um intervalo | Sete crianças apresentaram APLV com manifestações cutâneas durante o primeiro ano de vida. Estas tendiam a ter otite média com mais frequência durante o primeiro ano quando comparadas às crianças sem APLV (1.5+0.6 vs. 0.4+0.1; p<0.1). Apenas duas destas sete crianças não tiveram otite média durante o primeiro ano, contra 145 das outras 176 crianças não alérgicas (p<0,001). Apenas um participante com APLV tinha OMR. |
| Bhombal S, Bothwell MR, Bauer SM, 2006 | Columbia, Estados Unidos da América | Transversal | 242 (crianças submetidas à procedimentos otorrinolaringológicos) | Masculino: 140; Feminino: 102 | Idade variou de 5 meses a 15 anos, com média de 4.7±2.9 anos. | Dosagem de anticorpos IgE totais e específicos para antígenos do leite (PharmaciaCAP™ IgE Florescence Immunoassay). | O parâmetro avaliado foi a realização de procedimentos otorrinolaringológicos (miringotomia bilateral com inserção de tubos; miringotomia bilateral com inserção de tubos+adenoidectomia; adenoidectomia; ou miringotomia bilateral com inserção de tubos+adenoidectomia+tonsilectomia). | A APLV teve uma prevalência de 26 de 242 (10,7%) na amostra estudada. Em participantes>2 anos de idade, a prevalência de APLV foi de 12.9%, e em<2 anos, de 8.5%. |
| Arroyave CM., 2001 | Quéretaro, México | Transversal | 25 (crianças com OME recorrente) | Masculino: 16; Feminino: 9 | Idade variou de 18 meses a 6 anos, com média de 3 anos. | Teste cutâneo (prick skin test) positivo e melhora clínica após retirada do alérgeno. | OME recorrente: evidência de OME com duração de mais de 3 meses ou recorrência de OME mensalmente nos últimos 6 meses. | O teste cutâneo foi positivo para leite em 10 de 25 (40%) na amostra estudada. |
| Ngamphaiboon J, Chatchatee P, Thongkaew T, 2008 | Bangkok, Tailândia | Transversal | 382 (crianças com APLV) | Masculino: 214; Feminino: 168 | Idade variou de 7 dias a 13 anos, com média de 14.8 meses. | Melhora clínica significativa após eliminação do leite de vaca e: uma recorrência dos sintomas após a reintrodução de leite de vaca. Parâmetros de laboratório, como teste cutâneo (prick skin test) ou anticorpos IgE específicos do leite de vaca séricos foram apenas de suporte. O teste de provocação duplo cego placebo controlado foi realizado em alguns pacientes. | Diagnóstico de fala atrasada devido OME crônica registrado em prontuário médico. | Fala atrasada devido a OME crônica foi observada em 0,2% de 382 na amostra estudada. |
APLV, Alergia à Proteína do Leite de Vaca; OMA, Otite Média Aguda; OME, Otite Média com Efusão; OMR, Otite Média Recorrente.
Para o diagnóstico de APLV, dois estudos usaram como parâmetro melhoria clínica após exclusão do leite de vaca e recorrência dos sintomas após reintrodução. Um desses considerou também positive o teste de provocação oral feito em hospital. Quanto aos outros dois estudos, um deles usou dosagem de anticorpos totais e específicos para antígenos do leite e o outro, teste cutâneo (prick skin test) positivo e melhoria clínica após retirada do alérgeno. Para a identificação da recorrência de otite média, dois estudos apresentaram os critérios usados para definir OMA/OME e Omar e dois estudos usaram como parâmetros o registro de procedimentos cirúrgicos otorrinolaringológicos (miringotomia bilateral com inserção de tubos, adenoidectomia e tonsilectomia) e o registro do diagnóstico de fala atrasada devido a OME crônica em prontuários médicos.
As medidas de interesse apresentadas nos estudos e de interesse para esta revisão foram: (1) Prevalência de fala atrasada devido a OME crônica em crianças com APLV; (2) Prevalência de APLV em crianças submetidas a procedimentos otorrinolaringológicos; (3) Prevalência de APLV em crianças com OME recorrente; (4) Frequência de quadros de otite média de repetição em crianças com APLV e crianças sem APLV. Dessa forma, os resultados encontrados em cada estudo foram: a prevalência de fala atrasada devido a OME crônica foi de 0,2% em uma amostra de 382 crianças com APLV; a prevalência de APLV foi de 10,7% em uma amostra de 242 crianças submetidas a procedimentos otorrinolaringológicos; a prevalência de APLV foi de 40% em uma amostra de 25 crianças com OME recorrente; em uma amostra de 183 crianças seguidas desde o nascimento, sete crianças com APLV tendiam a ter otite média com mais frequência durante o primeiro ano quando comparadas às crianças sem APLV (1,5+0,6 vs. 0,4+0,1; p<0,1). Apenas uma dessas sete crianças teve OMAR.
DiscussãoNas últimas décadas, o papel das alergias no desenvolvimento de Omar e OME tem sido consideravelmente investigado. Contudo, ao revisar os estudos que avaliam a correlação entre otite média e APLV, observamos a ausência de definições de caso claras, de critérios diagnósticos padrão ou de randomização e cegamento para controlar potenciais vieses. Os estudos incluídos nesta revisão investigaram crianças em faixas etárias mistas e apresentaram variações nos métodos para o diagnóstico de otite média e APLV.
O estudo desenvolvido por Arroyave16 avaliou a correlação entre OME e alergias alimentares. O diagnóstico de atopia foi definido por meio do teste cutâneo positivo e melhoria clínica após retirada do alérgeno. Ao investigar múltiplos alérgenos em uma amostra de 25 pacientes, foram identificados 10 (40%) pacientes com teste cutâneo positivo para antígenos do leite de vaca. É importante ressaltar que esse estudo não define de forma clara o critério usado como diagnóstico de OME na população incluída, uma vez apenas cita o número de episódios de otite, sem especificar os critérios diagnósticos usados para definição de caso. Além disso, teste cutâneo e dieta de eliminação empregados nesse estudo como método diagnóstico de APLV não são considerados o padrão‐ouro para considerar o indivíduo portador dessa alergia alimentar.
Na análise conduzida por Bhombal, Bothwell e Bauer,17 o parâmetro investigado foi o aumento das imunoglobulinas do tipo IgE totais e específicas para vários alérgenos alimentares, inclusive o leite de vaca, em crianças submetidas aos procedimentos otorrinolaringológicos: miringotomia bilateral com inserção de tubos, adenoidectomia e tonsilectomia. Foram avaliados 242 pacientes e, desses, 26 (10,7%) apresentaram aumento de IgE específico para leite de vaca quando comparados à população total. No entanto, sabe‐se que o aumento da IgE específica não serve como critério diagnóstico para APLV e apenas como um exame complementar que auxiliaria no acompanhamento dos pacientes com esse tipo de patologia. Assim, o estudo conclui que embora não seja possível estabelecer uma relação de causalidade entre alergia alimentar e a maior frequência desses procedimentos, haveria algum benefício em se estudar de forma mais aprofundada a presença de alergia alimentar na população pediátrica com indicação dessas cirurgias.
Quanto ao estudo desenvolvido por Ngamphaiboon, Chatchatee e Thongkaew,18 que teve como objetivo investigar as manifestações clínicas mais frequentes em crianças com APLV, identificou‐se atraso no desenvolvimento de linguagem devido a OME em 0,2% das 382 crianças incluídas. Apesar do estudo atribuir o atraso da fala aos episódios de OME, destaca‐se a existência de múltiplas causas para o atraso de fala na faixa etária estudada. Contudo, o estudo não descreve se há fatores de risco de confusão. Ademais, não foi feito teste de provocação oral com cegamento em todos os pacientes incluídos como portadores de APLV. Desse modo, o estudo não demonstra confiabilidade para atribuir relação de causalidade entre OME e APLV, a partir dos parâmetros avaliados.
O estudo de Tainio et al.19 teve como objetivo investigar os fatores de risco relacionados ao desenvolvimento de Omar durante o seguimento de 198 crianças desde o nascimento até dois anos. O método empregado para o diagnóstico de Omar foi o registro de cinco episódios de otite média confirmada pela otoscopia no primeiro ano de vida ou quatro episódios no segundo ano de vida e a APLV foi confirmada através de teste de provocação oral. Entre as crianças avaliadas, apenas uma portadora de APLV evoluiu com Omar. Assim, o estudo demonstrou que a APLV não pode ser considerada fator de risco para o diagnóstico de OMAR. E ainda, embora os níveis de imunoglobulinas IgG para leite de vaca séricos das crianças com Omar seja maior do que nas demais crianças dos estudos, sabe‐se que tal evidência não tem significado clínico, isto é, não confere diagnóstico de alergia.
Ao investigar a relação entre APLV e OMA, somente Tainio et al. consideraram a concomitância de fatores de risco bem estabelecidos para OMA, como tabagismo dos pais e frequência em creches, e fatores de proteção, como tempo de aleitamento materno. A ausência da descrição desses fatores em estudos similares evidencia ausência de estratégias para o controle dos fatores de confusão. A avaliação da qualidade dos estudos incluídos apresentou variação de 30,68% e 76,04% (de um total de 100%). Dessa forma, os resultados encontrados nos estudos desta revisão não demonstram rigor metodológico e não podem ser generalizados.
Por fim, salientamos que metanálises publicadas sobre os fatores de risco para o desenvolvimento de otite média apontam tabagismo passivo, uso de chupeta, cuidados em creches, ausência de aleitamento materno como fatores confiáveis.20,21 Quanto às atopias ou alergias, as evidências apontam que alergias respiratórias, como rinite alérgica, podem contribuir para o início da otite média recorrente.21 Apesar disso, no que diz respeito à para a comprovação da correlação entre APLV e Omar/OME, destacamos que ainda são necessários novos estudos.
ConclusãoForam identificados estudos observacionais que apresentaram considerável heterogeneidade quanto ao desenho metodológico, faixa etária da população estudada e métodos diagnósticos para APLV e otite média. Dessa forma, os resultados encontrados não permitem afirmar a existência de uma correlação entre APLV e o desenvolvimento de Omar ou OME. Torna‐se necessário o desenvolvimento de estudos com desenhos metodológicos adequados e padronização dos critérios diagnósticos.
Conflitos de interesseAs autoras declaram não haver conflitos de interesse.
Como citar este artigo: Oliveira KA, Esper MT, Oliveira ML, Tofoli MH, Avelino MA. Correlation between cow's milk protein allergy and otitis media: a systematic review. Braz J Otorhinolaryngol. 2022;88:802–10.