A tonsilectomia é a 2ª cirurgia ambulatorial mais comum feita em crianças nos Estados Unidos da América. Sua principal complicação é a dor, cuja intensidade varia de moderada a intensa. A dipirona é um dos analgésicos mais usados no pós‐operatório em crianças. Seu uso, entretanto, é controverso na literatura, a ponto de ser proibido em vários países devido aos seus potenciais efeitos adversos graves. Por causa dessa controvérsia, revisar o uso da dipirona como analgésico no pós‐operatório de tonsilectomia em crianças é fundamental.
ObjetivoRevisar o uso analgésico da dipirona no pós‐operatório de tonsilectomia em crianças.
MétodoRevisão sistemática da literatura, envolveu a avaliação da qualidade dos artigos nas bases de dados Medline/Pubmed, Embase e Virtual Health Library, selecionados com estratégia de busca pré‐estabelecida. Foram incluídos apenas estudos com desenho de ensaio clínico randomizado que avaliassem o uso de dipirona no pós‐operatório de tonsilectomia em crianças.
Resultados e conclusãoForam encontrados apenas 2 ensaios clínicos randomizados. Ambos compararam dipirona, paracetamol e placebo. Não foi possível fazer a metanálise porque os estudos eram muito heterogêneos (dipirona foi usada como analgésico preventivo em um estudo e somente no pós‐operatório em outro). O efeito analgésico da dipirona, medido através de escalas de dor validadas na infância, mostrou‐se superior ao placebo e semelhante ao paracetamol. Parece que a dipirona apresenta um perfil adequado para uso em crianças. Entretanto, a escassez de ensaios clínicos randomizados que avaliem seu efeito analgésico nessa faixa etária leva à conclusão de que estudos mais bem delineados ainda são necessários para estabelecer o papel da dipirona no pós‐operatório de tonsilectomia em crianças.
Dor aguda pós‐operatória é a dor apresentada por pacientes logo após um procedimento cirúrgico.1 A analgesia preventiva trata‐se da tentativa de controle da dor no período pré‐incisional. Ela visa a prevenir a hiperexcitabilidade central, que tende a se amplificar no período pós‐operatório.2 Uma revisão recente de revisões sistemáticas concluiu que as evidências da eficácia de vários medicamentos e estratégias para o manejo da dor pós‐operatória em crianças ainda são inconclusivas.3 A dipirona, entretanto, não foi avaliada nesta revisão.
A dipirona é eficaz na dor pós‐operatória em crianças. Há 8 ensaios clínicos que a usaram sozinha ou em combinação com outros medicamentos.4–11 É um dos analgésicos mais amplamente usados no período pós‐operatório em vários países europeus,12,13 africanos14 e da América Latina.15 Entretanto, há um receio sobre seu potencial de anafilaxia e agranulocitose associadas16 e seu uso é proibido em mais de 20 países.
A real incidência desses efeitos adversos, entretanto, é baixa. Em um estudo multicêntrico que envolveu mais de 1.177 crianças tratadas com dipirona no período pós‐operatório, a incidência de efeitos adversos graves foi inferior a 0,3%, sem caso de agranulocitose.17 Dois estudos, um que envolveu vários países europeus (Alemanha, Itália e Espanha)18 e outro apenas na cidade de Berlim,19 estimaram uma incidência de agranulocitose de 1,1 por milhão de habitantes/ano e 0,96 casos por milhão de habitantes/ano, respectivamente. Na cidade de Barcelona, a estimativa foi de 0,56 caso por milhão de habitantes/ano.20 O risco de complicações graves e a disponibilidade de opções continuam a contraindicar seu uso, na opinião de alguns.21 Apesar da proibição em vários países, a dipirona é o analgésico mais usado no pós‐operatório de crianças no Brasil, talvez devido ao seu baixo custo e à falta de uma forma injetável de paracetamol, pelo menos até abril de 2020.22 Em termos de medicação analgésica oral, em contraste com a preferência pelo paracetamol em diferentes regiões do mundo,23 em nosso país é a automedicação mais usada, pois é vendida sem necessidade de prescrição médica.24
A dipirona tem sido usada há décadas em crianças no pós‐operatório de tonsilectomia. Essa cirurgia é o segundo procedimento ambulatorial mais comum nos EUA.25,26 Sua principal complicação é a dor, que pode causar redução na ingestão oral, desidratação e perda de peso.27 A última edição do North‐American Clinical Practice Guideline contém 2 fortes recomendações sobre analgesia: 1) Usar analgésicos no período pós‐operatório e 2) A contraindicação do uso de opioides, especialmente em crianças menores de 2 anos.27 Essa última recomendação é baseada no alerta da FDA (Federal Drug Administration) sobre o risco de depressão respiratória e morte com uso de codeína.28 No contexto da tonsilectomia, a dipirona intravenosa pode representar uma opção aos opioides, onde a odinofagia com consequente dificuldade de deglutição é quase universal.
O objetivo deste estudo foi revisar o uso analgésico da dipirona no pós‐operatório de tonsilectomia em crianças.
MétodoRevisão sistemática da literatura, que envolveu o trabalho de dois pesquisadores que avaliaram de maneira independente a qualidade de cada artigo e um terceiro pesquisador, em caso de não concordância. A formulação da questão da pesquisa foi baseada na estratégia PICO (do inglês population/patients, intervention, comparison, outcome).29 A seguinte pergunta norteou a pesquisa bibliográfica: “A dipirona na analgesia pós‐operatória da tonsilectomia em crianças reduz as queixas de dor em comparação com o placebo, de acordo com as escalas visuais analógicas validadas?”30 A busca foi feita nos bancos de dados da PubMed, Medline, The Cochrane Library, ClinicalTrials.gov, Lilac e Embase para identificar pesquisas revisadas por pares, além da literatura cinza (Google scholar, repositórios de teses das 20 universidades mais importantes do Brasil), com termos separados e combinados, com o operador booleano OR e os seguintes descritores em ciências da saúde da Bireme (DeCS): dipyrone OR metamizole AND postoperative pain; dipyrone OR metamizole AND postoperative pain AND children, dipyrone OR metamizole AND tonsillectomy, dipyrone OR metamizole AND tonsillectomy AND children, dipyrone AND metamizole AND pre‐emptive analgesia, dipyrone OR metamizole AND pre‐emptive analgesia AND children. Além disso, as referências dos artigos selecionados foram revisadas em busca de outras publicações relevantes. A seleção dos artigos foi feita de junho de 2020 a outubro de 2020.
Os critérios de inclusão foram os seguintes: estudos que abordassem o tratamento da dor com dipirona de forma preventiva ou após o término da cirurgia em crianças. Isso foi então refinado para estudos com desenho de ensaio clínico randomizado e que tratavam exclusivamente de tonsilectomias, com uso isolado de dipirona ou em combinação com outro medicamento em um dos grupos de comparação. Não houve limite de tempo para as publicações, foram incluídos todos os artigos disponíveis na íntegra nos idiomas português, inglês, espanhol e alemão. Como critérios de exclusão, foram adotados: publicações que incluíssem exclusivamente avaliação de dor crônica e estudos em adultos.
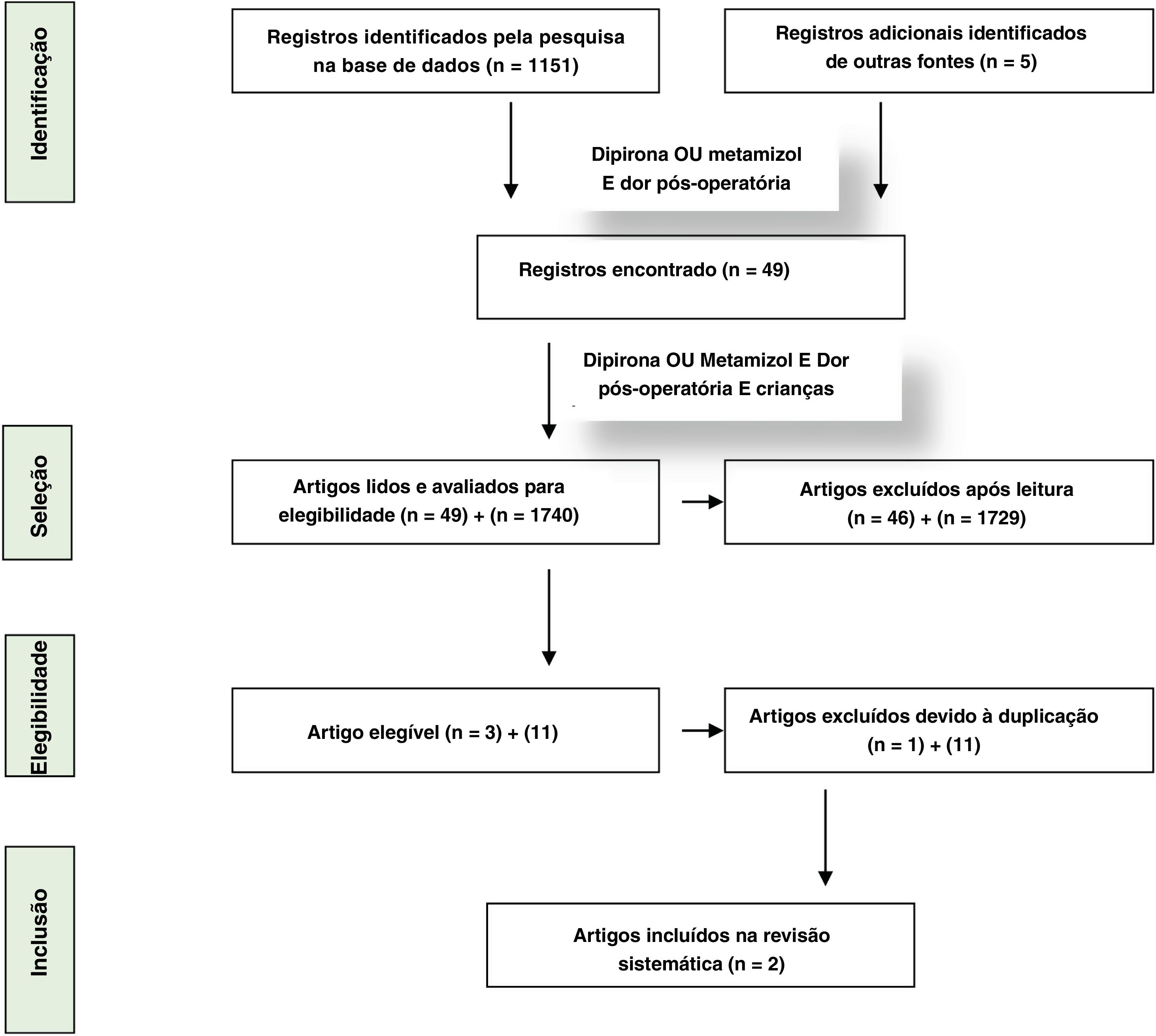
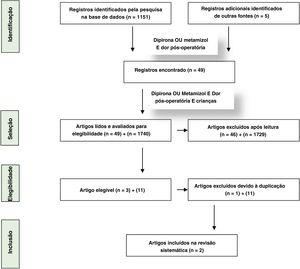
Os estudos foram descritos com a ferramenta de risco de viés da Cochrane revisada para ensaios clínicos randomizados (RoB2) (tabela 1a e 1b).31 A estratégia Prisma (preferred reporting itens for systematic reviews and meta‐analysis)32 foi usada nesta revisão para qualificar o trabalho ao fazer uma análise crítica dos estudos selecionados. A figura 1 apresenta o fluxograma de identificação, seleção e inclusão dos estudos com base nas recomendações da estratégia Prisma.
(a e b) Análises dos estudos de acordo com ROB 2
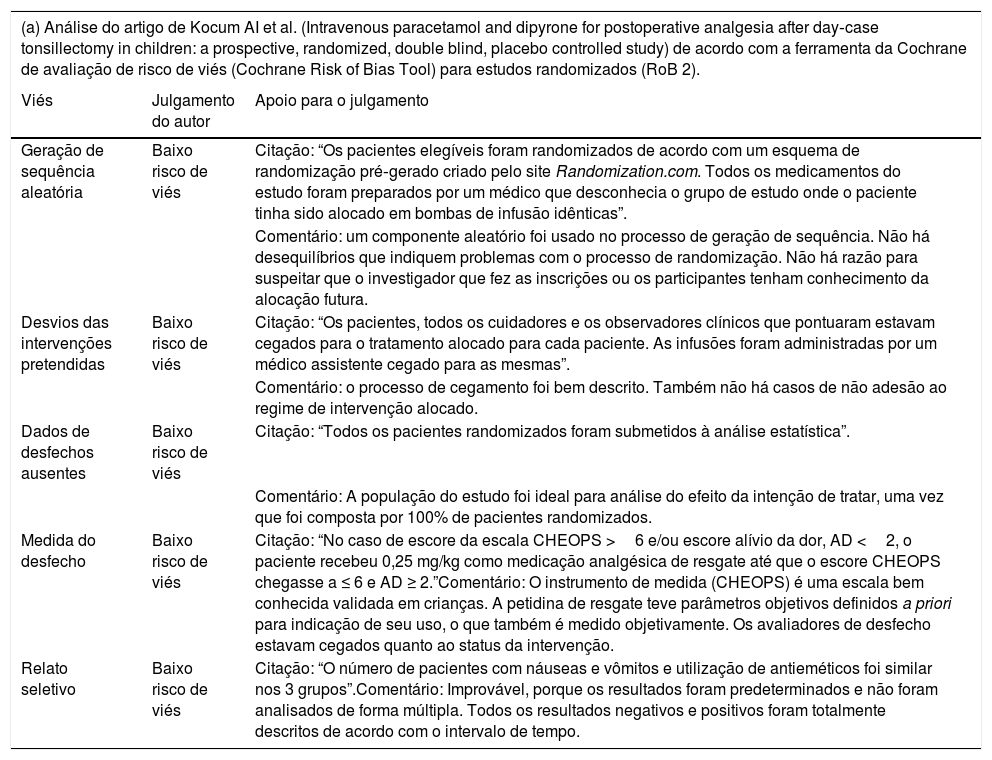
| (a) Análise do artigo de Kocum AI et al. (Intravenous paracetamol and dipyrone for postoperative analgesia after day‐case tonsillectomy in children: a prospective, randomized, double blind, placebo controlled study) de acordo com a ferramenta da Cochrane de avaliação de risco de viés (Cochrane Risk of Bias Tool) para estudos randomizados (RoB 2). | ||
|---|---|---|
| Viés | Julgamento do autor | Apoio para o julgamento |
| Geração de sequência aleatória | Baixo risco de viés | Citação: “Os pacientes elegíveis foram randomizados de acordo com um esquema de randomização pré‐gerado criado pelo site Randomization.com. Todos os medicamentos do estudo foram preparados por um médico que desconhecia o grupo de estudo onde o paciente tinha sido alocado em bombas de infusão idênticas”. |
| Comentário: um componente aleatório foi usado no processo de geração de sequência. Não há desequilíbrios que indiquem problemas com o processo de randomização. Não há razão para suspeitar que o investigador que fez as inscrições ou os participantes tenham conhecimento da alocação futura. | ||
| Desvios das intervenções pretendidas | Baixo risco de viés | Citação: “Os pacientes, todos os cuidadores e os observadores clínicos que pontuaram estavam cegados para o tratamento alocado para cada paciente. As infusões foram administradas por um médico assistente cegado para as mesmas”. |
| Comentário: o processo de cegamento foi bem descrito. Também não há casos de não adesão ao regime de intervenção alocado. | ||
| Dados de desfechos ausentes | Baixo risco de viés | Citação: “Todos os pacientes randomizados foram submetidos à análise estatística”. |
| Comentário: A população do estudo foi ideal para análise do efeito da intenção de tratar, uma vez que foi composta por 100% de pacientes randomizados. | ||
| Medida do desfecho | Baixo risco de viés | Citação: “No caso de escore da escala CHEOPS >6 e/ou escore alívio da dor, AD <2, o paciente recebeu 0,25 mg/kg como medicação analgésica de resgate até que o escore CHEOPS chegasse a ≤ 6 e AD ≥ 2.”Comentário: O instrumento de medida (CHEOPS) é uma escala bem conhecida validada em crianças. A petidina de resgate teve parâmetros objetivos definidos a priori para indicação de seu uso, o que também é medido objetivamente. Os avaliadores de desfecho estavam cegados quanto ao status da intervenção. |
| Relato seletivo | Baixo risco de viés | Citação: “O número de pacientes com náuseas e vômitos e utilização de antieméticos foi similar nos 3 grupos”.Comentário: Improvável, porque os resultados foram predeterminados e não foram analisados de forma múltipla. Todos os resultados negativos e positivos foram totalmente descritos de acordo com o intervalo de tempo. |
| (b) Análise do artigo de Sener M, et al. (Administration of paracetamol vs. dipyrone by intravenous patient‐controlled analgesia for postoperative pain relief in children after tonsillectomy) de acordo com a ferramenta da Cochrane de avaliação de risco de viés (Cochrane Risk of Bias Tool) para estudos randomizados (RoB 2). | ||
|---|---|---|
| Viés | Julgamento do autor | Apoio para o julgamento |
| Geração de sequência aleatória | Baixo risco de viés | Citação: “Os pacientes foram distribuídos aleatoriamente para um dos três grupos de estudo, de acordo com um esquema de randomização gerado pelo site randomization.com (http://www.randomization.com). A solução analgésica (500mL de NaCl a 0,9%) foi preparada por um dos pesquisadores, cegado para o protocolo de tratamento e não envolvido nos tratamentos intra e pós‐operatório dos pacientes”. |
| Comentário: um componente aleatório foi usado no processo de geração de sequência. Não há desequilíbrios que indiquem problemas com o processo de randomização. Não há razão para suspeitar que o investigador que fez as inscrições ou os participantes tenham conhecimento da alocação futura. | ||
| Desvios das intervenções pretendidas | Baixo risco de viés | Citação: “A solução analgésica (500mL de NaCl a 0,9%) foi preparada por um dos pesquisadores, cegado para o protocolo de tratamento e não envolvido nos tratamentos intra‐ e pós‐operatório dos pacientes. Os pacientes também não estavam cientes do tratamento. Os dados pós‐operatórios foram coletados por outro anestesiologista (CE), também cegado para os analgésicos usados”. |
| Dados de desfechos ausentes | Baixo risco de viés | Citação: Sem citação específica, mas o fluxograma do estudo mostrou que não houve perdas de pacientes. |
| Comentário: A população do estudo foi ideal para análise do efeito da intenção de tratar, uma vez que foi composta por 100% de pacientes randomizados. | ||
| Medida do desfecho | Baixo risco de viés | Citação: “A intensidade da dor pós‐operatória foi avaliada pelo paciente de acordo com a EVA horizontal de 0–100mm em 30 minutos, 1, 2, 4, 6, 12 e 24 horas após a operação. O escore de alívio da dor (EAD) foi avaliado pelo paciente como: 0=nenhum, 1=pouco, 2=algum, 3=muito e 4=alívio total em 30 minutos, 1, 2, 4, 6, 12 e 24 horas pós‐operatórias. Petidina IV (0,25 mg/kg --‐ 1) foi administrada a pacientes cujo escore EVA foi ≥ 40mm e/ou EAD <2 e então registrada (a dose total de petidina foi limitada a 1,5 mg/kg/6h)”. |
| Comentário: O instrumento de medida (CHEOPS) é uma escala bem conhecida validada em crianças. A petidina de resgate teve parâmetros objetivos definidos a priori para indicação de seu uso, o que também é medido objetivamente. Os avaliadores de desfecho estavam cegados quanto ao status da intervenção. | ||
| Relato seletivo | Baixo risco de viés | Citação: Nenhuma citação específica, mas a leitura das seções de método e resultados torna isso claro. |
| Comentário: Improvável porque os resultados foram predeterminados e não foram analisados de forma múltipla. Todos os resultados negativos e positivos foram totalmente descritos de acordo com o intervalo de tempo. | ||
O número máximo de 1.151 artigos foi selecionado com os descritores “dipirona ou metamizol e dor pós‐operatória”. O número de artigos encontrados na Embase foi 1.151, no Pubmed 336 e na VHL, 345. Quando o descritor “children” foi introduzido na busca anterior, os números correspondentes foram 120, 49 e 42. Ao adicionar “randomized clinical trial”, os números correspondentes foram 31, 13 e 19. Também pesquisamos a literatura cinza – Google Scholar e repositórios de teses de universidades brasileiras (1.740 resultados e 11 duplicatas) e não encontramos referências adicionais a serem incluídas. Os materiais e métodos de cada artigo obtidos na busca com os descritores “dipyrone or metamizole” e “postoperative pain and children” foram revisados manualmente. Foram identificados nove ensaios clínicos randomizados que avaliaram o efeito analgésico pós‐operatório da dipirona isoladamente ou associada a um dos grupos. Quando foram selecionados apenas estudos sobre tonsilectomia, 3 permaneceram e foi verificado que havia uma duplicata de um deles. O resultado final da busca incluiu 2 ensaios clínicos randomizados que avaliaram o efeito da dipirona em relação ao placebo, um na analgesia preventiva e outro na analgesia pós‐operatória, em crianças submetidas a tonsilectomia, com ou sem adenoidectomia ou colocação de tubos de ventilação.
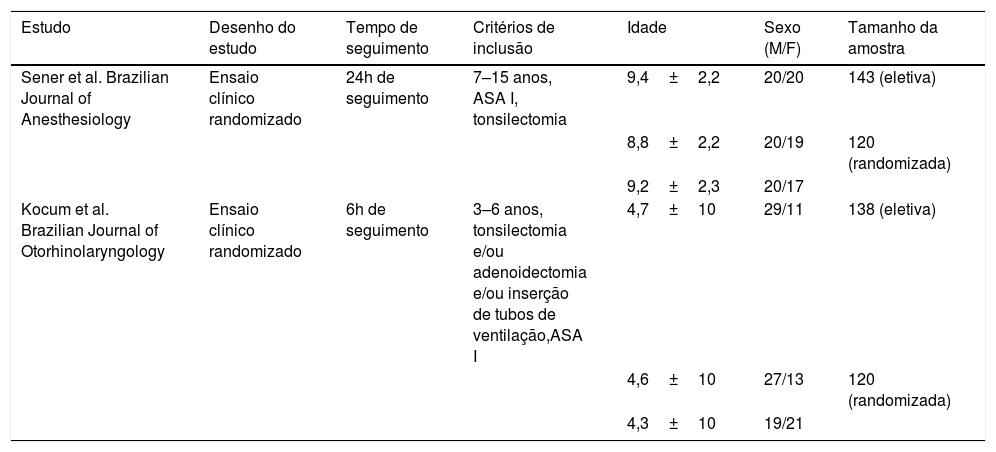
As tabelas 2, 3 e 4 mostram informações sobre os 2 artigos incluídos. A tabela 2 mostra a identificação do estudo, o modelo investigacional, tempo de seguimento, os critérios de inclusão, a idade, o sexo e tamanho da amostra.
Características dos estudos selecionados
| Estudo | Desenho do estudo | Tempo de seguimento | Critérios de inclusão | Idade | Sexo (M/F) | Tamanho da amostra |
|---|---|---|---|---|---|---|
| Sener et al. Brazilian Journal of Anesthesiology | Ensaio clínico randomizado | 24h de seguimento | 7–15 anos, ASA I, tonsilectomia | 9,4±2,2 | 20/20 | 143 (eletiva) |
| 8,8±2,2 | 20/19 | 120 (randomizada) | ||||
| 9,2±2,3 | 20/17 | |||||
| Kocum et al. Brazilian Journal of Otorhinolaryngology | Ensaio clínico randomizado | 6h de seguimento | 3–6 anos, tonsilectomia e/ou adenoidectomia e/ou inserção de tubos de ventilação,ASA I | 4,7±10 | 29/11 | 138 (eletiva) |
| 4,6±10 | 27/13 | 120 (randomizada) | ||||
| 4,3±10 | 19/21 |
Eletiva, pacientes de cirurgias eletivas; Randomizadas, randomizado atarvés de http://www.randomization.com.
Os estudos tiveram tempos de seguimento curtos (máximo de 24 horas). Enquanto o primeiro estudo envolveu apenas crianças mais velhas, o segundo estudo incluiu crianças a partir dos 3 anos. Enquanto o primeiro estudo avaliou apenas casos de tonsilectomia isolada, no estudo 2 foi permitida a inclusão de tonsilectomia com ou sem adenoidectomia associada e/ou colocação de tubos de ventilação.
A tabela 3 mostra a descrição dos dados referentes aos grupos de intervenção (número aleatório e número de indivíduos que concluíram o estudo em cada grupo), o tipo de analgesia e a forma de administração da dipirona. Ambos os estudos tiveram uma taxa de conclusão de 100% para a amostra randomizada. Enquanto no primeiro estudo a analgesia foi aplicada no pós‐operatório, no segundo ela foi aplicada preventivamente, o que dificulta a comparação direta dos dois estudos. O primeiro estudo trouxe uma inovação para o pós‐operatório da cirurgia pediátrica, com o uso da PCA (analgesia controlada pelo paciente) tabela 4.
Descrições dos estudos segundo grupos de intervenção, tipo de analgesia e forma de administração da dipirona
| Estudo | Grupos de intervenção | Tipo de analgesia | Forma de administração da dipirona |
|---|---|---|---|
| Sener TG, et al. Brazilian Journal of Anesthesiology | Paracetamol – 40 | Pós‐operatória | Paracetamol – 20 mg/mL IV |
| Dipirona – 40 | Dipirona – 20 mg/mL IV | ||
| Placebo – 40 | Placebo – 1 mL saline | ||
| 120% – 100% | Paracetamol – 10 mg/kg – 4h | ||
| PCA‐IV | Dipirona 10 mg/kg – 4h 15 mg/kg | ||
| PCA | |||
| Kocum AI, et al. Brazilian Journal of Otorhinolaryngology | Paracetamol – 40 | Preventiva (antes da indução da anestesia geral) | Paracetamol – 15 mg/kg |
| Dipirona – 40 | Dipirona – 15 mg/kg | ||
| Placebo – 40 | Placebo 009% NaCl | ||
| 120%–100% | Dose única IV | ||
| Dose única IV após a indução da anestesia |
PCA, analgesia controlada pelo paciente.
Desfechos primários e secundários e principais resultados dos dois estudos analisados
| Estudo | Pontos fortes e fracos | Desfechos primários e secundários | Principais resultados |
|---|---|---|---|
| Sener TG, et al.Brazilian Journal of Anesthesiology | Critérios de inclusão e exclusão: OKRandomização: OKDuplo‐cego: OKNenhum cálculo do tamanho da amostra antes da alocação (análise de poder com base na necessidade total de petidina dos primeiros 15 pacientes)Erro tipo I de tabela de dupla entrada de 0,05 e poder de teste de 80% | a) Escala Analógica Visual (EVA 0–100mm) em 30min, 1h, 2h, 4h, 6h, 12h, 24hb) Escores de alívio da dor (1–4) 1h, 2h, 4h, 6h, 12h, 24hc) Necessidade total de opioides 30min, 1h, 2h, 4h, 6h, 12h, 24hd) Incidência de náuseas, vômitos e necessidade de medicação antiemética | a) Ambos os grupos ativos significativamente melhores do que o placebo às 6h. A dipirona também foi melhor aos 30min.b) Não houve diferença entre os grupos.c) Significativamente menor com os grupos paracetamol e dipirona em comparação com o grupo placebo (62%, 68,4%, vs. 90%, p <0,05)d) Não houve diferença entre os grupos. |
| Kocum AI, et al.Brazilian Journal of Otorhinolaryngology | Critérios de inclusão e exclusão: OKRandomização: OKDuplo‐cego: OKNenhum cálculo do tamanho da amostra antes da alocação (análise de poder com base na necessidade total de petidina dos primeiros 15 pacientes)Diferenças estatisticamente significativas em p <0,05 | a) Intensidade da dor:Escala de dor (CHEOPS – Children's Hospital East Ontario Pain Scale) com escores variando de 4 a 13. 0.25; 0.5; 1; 2; 4 e 6 após a chegada à unidade de cuidados pós‐anestésicosb) Alívio da dor: escala verbal de 5 pontos avaliada pelo investigadorc) Medicação analgésica de resgate (petidina) | a) Não houve diferença no escore CHEOPSb) Não houve diferença entre os grupos em 0.5 h; 1h e 2h‐ O efeito do paracetamol foi significativamente maior do que o grupo placebo em 0,5 e 4h de tratamento (p=0,04; p=0,01, respectivamente)‐ Nenhuma diferença nos grupos de comparação entre dipirona vs. placebo e dipirona vs. paracetamol em 5h de acompanhamento‐ Às 6h de acompanhamento, o escore de alívio da dor foi significativamente maior no grupo paracetamol quando comparado ao grupo placebo (p <0,001) e dipirona (p=0,04). Além disso, em 6h de acompanhamento, o escore de alívio da dor foi significativamente maior no grupo dipirona do que no grupo placebo (p=0,03)c) O uso cumulativo de petidina não foi diferente entre os grupos após 0,25; 0,5; 1h; 2h e 4h de seguimento. Após 6h de seguimento, ambos os grupos ativos apresentaram menor necessidade de analgésico de resgate (p=0,01 para paracetamol e p=0,03 para dipirona) |
É evidente que ambos os estudos demonstraram cuidado em sua abordagem metodológica. Em relação aos resultados analgésicos medidos por escalas de dor validadas na infância, dipirona e paracetamol foram superiores ao placebo e semelhantes entre si em muitos intervalos medidos. O mesmo foi observado para o uso da petidina de resgate, não diferiu entre os grupos de comparação ativa.
DiscussãoEficácia de analgésicos diversos com ênfase na dipirona no período pós‐operatório de tonsilectomia em criançasA dipirona tem uma eficácia medida pelo número de pacientes necessários para tratar para atingir uma redução de 50% na dor pós‐operatória em 4 a 6 horas, que é menor do que o diclofenaco de potássio e o etoricoxibe, mas maior do que a de vários AINEs (paracetamol, naproxeno, ibuprofeno, celecoxibe, aspirina e diclofenaco sódico). Infelizmente, todas essas estimativas são para adultos e não há estudos semelhantes em crianças.33 Há somente uma revisão sistemática que avalia especificamente a eficácia da dipirona na dor pós‐operatória em crianças.34 Dez revisões sistemáticas foram identificadas sobre analgesia pós‐operatória em tonsilectomia feita em crianças. O primeiro estudou o uso de paracetamol sistêmico, AINEs e opioides. No entanto, o estudo não discorreu sobre a dipirona.35 Dois analisaram o efeito da ketamina via injeção peritonsilar ou sistêmica,36,37 dois estudaram o efeito dos corticosteroides,38,39 um focalizou no efeito da bupivacaína40 e o outro na dexmedetomidina em comparação à morfina ou fentanil.41 Uma revisão sistemática da Cochrane analisou a forma de prescrição de analgésicos (diferentes analgésicos, mas nunca dipirona), se necessária, ou de horário fixo.42 Por fim, houve outra revisão que se restringiu ao uso de enxaguantes orais e sprays para melhorar a recuperação após a tonsilectomia.43 Uma visão geral de todas essas revisões sistemáticas foi fornecida no recente trabalho de Boric et al., 2017.3
Como demonstrado na presente revisão, existem apenas dois ensaios clínicos randomizados que avaliaram o efeito analgésico da dipirona no período pós‐operatório de tonsilectomia em crianças.6,7 Infelizmente, não foi possível fazer uma metanálise, pois um estudo incluiu tonsilectomia isoladamente7 e o outro permitiu a inclusão de adenoidectomia associada e/ou tubos de ventilação,6 que podem levar a diferentes níveis de dor, devido à maior manipulação dos pacientes. Além disso, um estudo avaliou a analgesia preventiva6 e o outro, analgesia pós‐operatória.7 Finalmente, no estudo de analgesia preventiva, foi administrada uma dose única de dipirona ou placebo logo após a introdução do anestésico,6 enquanto o outro estudo avaliou a analgesia iniciada no período pós‐operatório de acordo com o PCA.7 A limitação é que o PCA não está disponível na maioria dos hospitais e requer a compreensão e a colaboração do paciente, é assim ineficaz para crianças pequenas.
Ambos os estudos demonstraram cuidados metodológicos adequados, com cálculos amostrais e randomização feita através do site randomization.com. Além disso, hipóteses foram estabelecidas a priori, com o uso de um placebo com as mesmas características da medicação ativa, com cegamento adequado de pacientes e examinadores e com medidas de desfecho eficazes e validadas, além de uma escolha criteriosa dos testes estatísticos usados.
No entanto, os estudos têm tempos de seguimento curtos (máximo 24 horas). Seria preferível um tempo de seguimento mais longo para monitorar o efeito da dipirona, pois a dor após a tonsilectomia persiste por pelo menos 7 dias. Outra limitação dos resultados é que, além de terem sido desenvolvidos pelo mesmo grupo de pesquisadores e não poderem ser combinados para uma metanálise pelos motivos já especificados, os dados nunca foram reproduzidos em outro lugar por diferentes pesquisadores, o que pode limitar a extrapolação de dados para outras populações que não os pacientes turcos.
AgranulocitoseA agranulocitose é definida como uma contagem absoluta de neutrófilos circulantes inferior a 500μL.44 O curso clínico mais comum da agranulocitose está associado à faringotonsilite, estomatite e/ou pneumonia. A frequência da doença varia com a idade, com apenas 10% dos casos relatados em crianças e adultos jovens. Mais da metade dos episódios ocorreu em indivíduos com mais de 60 anos. É uma condição rara e está associada a uma taxa de letalidade de 8% a 10%. As taxas de associação com o uso de medicamentos variam nos diferentes estudos, mas no Brasil, por exemplo, fica em torno de 56%.45
Nenhum ensaio clínico randomizado que usou dipirona como analgésico pós‐operatório em crianças relatou a ocorrência de agranulocitose até o momento. Estudos mostram que a incidência de agranulocitose varia entre os países. O estudo LATIN45 foi um estudo prospectivo caso‐controle feito em cidades do Brasil, Argentina e México. A taxa de incidência geral foi estimada em 0,38 por milhão de habitantes/ano. O metimazol foi o único medicamento significativamente associado à agranulocitose (p <0,001) e não houve associação significativa com a dipirona. Uma rara incidência de agranulocitose associada a medicamentos foi relatada em um estudo retrospectivo na cidade de São Paulo, Brasil (0,44 a 0,82 caso por milhão de habitantes/ano)46 e no estudo colaborativo do Brasil, Argentina e México mencionado acima, semelhante ao achado na Tailândia (0,8:1 milhão de habitantes/ano).47 Isso contrasta com a maior incidência relatada nos Estados Unidos da América, de 2,4 a 15,4 por milhão de habitantes/ano,48 e em países europeus, como no estudo colaborativo da Alemanha, Itália, Espanha, Hungria, Bulgária e Suécia, além de Israel, que encontrou 1,1 a 6,2 casos/milhão/ano e taxa de mortalidade de 0,5 caso/milhão/ano. Entretanto, esse estudo observou uma grande variabilidade regional na apresentação de discrasias sanguíneas.49 O risco foi significativamente associado ao uso de ticlopidina, sulfonamidas, medicamentos anti‐inflamatórios não esteroidais, dobesilato de cálcio, antitireoidianos, espironolactona e dipirona. Houve um estudo subsequente, na cidade de Barcelona, que encontrou uma incidência de agranulocitose associada a medicamentos de 3,46 casos por milhão de habitantes/ano.20 Na França, o número correspondente foi de 6 casos por milhão de habitantes/ano. A incidência específica de agranulocitose associada à dipirona variou de uma para cada 1.439 prescrições na Suécia,36 a 0,56 casos por milhão de habitantes/ano em Barcelona,20 chegou a 0,96 casos por milhão/ano em Berlim.19 Uma coorte de pacientes hospitalizados em Bogotá, Colômbia, que incluiu 2.743 pacientes, não apresentou casos de agranulocitose. No estudo LATIN,46 a odds ratio (OR) para agranulocitose associada a medicamentos foi de 2,4 (IC95% 0,8–6,7). Os números correspondentes em Barcelona foram 25,8 (IC95% 8,8–79,1).20 Em um estudo publicado em 2020, a OR para agranulocitose e neutropenia induzida por medicamentos foi de 3,03 (IC95% 2,49–3,69). O risco de desenvolver agranulocitose e neutropenia após uma prescrição de dipirona foi de 1:1.602 (IC95% 1:1.926–1:1.371). Há várias explicações possíveis para as diferenças encontradas na incidência entre os diversos estudos, variam do uso de diferentes metodologias até a heterogeneidade genética das populações, com prováveis polimorfismos gênicos próprios, ainda não estudados especificamente para a dipirona.
Embora o risco de agranulocitose com dipirona seja possível, sua real incidência na população não é conhecida, mas presume‐se que seja baixa. Por esse motivo, o consenso alemão que reuniu várias entidades representativas concluiu que a dipirona apresenta uma taxa de risco‐benefício positiva em relação a outros analgésicos não opioides e recomendou seu uso.
Outros efeitos adversos (gastrointestinais, cardiovasculares e anafilaxia)Condições não graves incluem náusea, vômito, dor epigástrica, boca seca, astenia, rash e hipotensão sem síncope. Anafilaxia, reações semelhantes à asma, colapso hemodinâmico, doença do soro, síndrome de Steven Johnson, vasculite, alveolite, pneumonite, hepatite, síndrome hemolítico‐urêmica e agranulocitose são consideradas graves. Todos os dados discutidos aqui são válidos para o uso em curto prazo, não superior a duas semanas (geralmente até 7 dias), pois não existem estudos que analisem a ocorrência de efeitos adversos com o uso de dipirona em médio e longo prazo.
A taxa de incidência de efeitos adversos à dipirona varia entre os países. Prurido, edema e rash foram relatados em um paciente cada (total de 0,3%, IC95% 0,035–0,56) de uma amostra de 1.177 crianças menores de 6 anos em 6 centros pediátricos na Alemanha que usaram dipirona perioperatória. Não houve efeitos adversos na frequência cardíaca e pressão arterial, bem como na respiração, e o estudo não foi capaz de detectar caso de agranulocitose.22 Em uma coorte colombiana de pacientes hospitalizados,50 foi encontrada uma incidência global de efeitos adversos de 0,3% (7/2.743), que pode ser traduzida em 0,5/1.000 indivíduos/dia ou 0,14 caso/1.000 doses aplicadas. Em outras palavras, a incidência de um caso a cada 1.979 indivíduos/dia ou 6.928 indivíduos‐dose. Em 100% dos casos, as reações adversas notificadas foram reações cutâneas, revertidas com a suspensão do fármaco e com terapêutica específica. Não houve admissão à UTI nem mortalidade associada à dipirona nesse estudo.50 Em todos os ensaios clínicos com uso de dipirona no pós‐operatório de crianças, a incidência de náuseas e vômitos foi igual entre o grupo ativo e o placebo.
Há vários relatos de casos que descrevem anafilaxia após a administração do medicamento.51 Para a maioria dos analgésicos não opioides, a incidência de anafilaxia está na faixa de 5 a 15 casos/100.000 pacientes expostos.52 As estimativas variam de 2.1/100.000 para aspirina oral a 16/100.000 para supositório de diclofenaco. A dipirona oral ou parenteral tem uma incidência intermediária entre 7 e 8 episódios/100.000 pacientes.52 É uma incidência menor do que com penicilina parenteral (32/100.000) ou meios de contraste radiológico (71/100.000), por exemplo.52
Deve‐se notar que há descrições de anafilaxia com o uso de outros analgésicos comuns, como aspirina e ibuprofeno.53 A metanálise que comparou o resultado dos efeitos adversos entre o uso de curto prazo de dipirona e outros analgésicos, inclusive estudos com quase 4.000 participantes combinados, não mostrou diferença significante entre eles (risco relativo 0,91, IC95% 0,79‐1,05).54
Outro estudo que usou o banco de dados de farmacovigilância da Organização Mundial da Saúde (VigiBase – https://tools.Who‐umc.org/webroot/[access restricted]), que inclui dados de 110 países e mais de 10 milhões de notificações de casos individuais, demonstrou que a dipirona era ainda mais segura do que outros analgésicos não esteroides para o trato gastrointestinal e rins. O risco de desenvolver úlceras duodenais ou gástricas foi de 0,9 (IC95% 0,7‐1,2) para dipirona e 14,3 (IC95% 13,8‐14,9) para diclofenaco, por exemplo. Os números correspondentes para sangramento digestivo superior foram 1,5 (1,3‐1,7) e 9,1 (8,8‐9,3), respectivamente. Quanto ao declínio da função renal, a diferença em favor da dipirona foi menor, mas ainda significativa, com um risco relativo estimado para a dipirona de 1,3 (1,0–1,4) e 2,3 (2,2–2,4) para o diclofenaco.33 Foi demonstrado que a menor incidência de sangramento digestivo com a dipirona é o principal fator que contribui para o menor risco de efeitos adversos fatais com o uso da dipirona em comparação com o diclofenaco (25 vs. 592 por 100 milhões de usuários).55
Embora possa ocorrer hipotensão levemente sintomática em alguns pacientes, sem repercussões hemodinâmicas, é possível que também possa ocorrer hipotensão grave, mesmo sem uma reação alérgica. Quando dipirona intravenosa foi administrada, em 7 (0,34%) de 2.053 pacientes, houve uma diminuição na pressão sistólica de pelo menos 20mmHg, ocorreu em minutos até 6 horas.56
ConclusãoEmbora pareça que a dipirona exibe um perfil adequado para uso no pós‐operatório em crianças, conforme demonstrado em ensaios clínicos de cirurgias abdominais e outras cirurgias nessa faixa etária, estudos mais bem delineados são necessários para estabelecer seu papel no pós‐operatório de tonsilectomia devido à escassez de ensaios clínicos randomizados que avaliem seu efeito analgésico pós‐operatório. O argumento para a ocorrência de agranulocitose não parece ser forte o suficiente para justificar o abandono desses estudos, porque sua incidência é muito baixa, principalmente em crianças, pelo menos na América Latina. Principalmente em países de baixa renda, seu uso é atraente por ter baixo custo e poder ser usado por via intravenosa, uma característica vantajosa no pós‐operatório de tonsilectomia, no qual a odinofagia tende a ser grave e universal.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Stangler MI, Lubianca JP, Lubianca JN, Lubianca Neto JF. Dipyrone as pre-emptive measure in postoperative analgesia after tonsillectomy in children: a systematic review. Braz J Otorhinolaryngol. 2021;87:227–36.