Crianças submetidas a amigdalectomias apresentam dor intensa no pós‐operatório. Uma das opções farmacológicas de analgesia são os opioides, como a morfina. No entanto, os riscos de efeitos adversos, como aumento do tempo de recuperação da anestesia e depressão respiratória, podem limitar o seu uso.
ObjetivosAvaliar o uso de morfina endovenosa intraoperatória na redução da dor pós‐operatória imediata de crianças submetidas a amigdalectomia.
MétodoNeste estudo cego randomizado, crianças de 3 a 10 anos foram submetidas a amigdalectomia, com ou sem adenoidectomia, e divididas em dois grupos. As crianças do grupo M receberam 0,1 mg.kg‐1 de morfina endovenosa na indução anestésica, enquanto as do grupo controle receberam anestesia convencional sem morfina. As percepções de dor no pós‐operatório foram avaliadas aos 30, 60, 120, 180 e 240 min após a recuperação da anestesia, pelas próprias crianças e também pelos seus pais ou responsáveis, com uma escala de dor pela face.
ResultadosForam incluídas 57 crianças, 30 no grupo com morfina e 27 no grupo sem morfina. De acordo com as próprias crianças, a dor pós‐operatória foi menor durante as avaliações feitas aos 30 minutos após o despertar da anestesia (p=0,023), enquanto segundo seus pais/responsáveis a dor foi menos intensa nas avaliações feitas aos 30 (p=0,002), 60 (p=0,006) e 180 minutos (p=0,007) após o despertar. Além disto, analgésicos no pós‐operatório foram menos solicitados pelas crianças do grupo da morfina. Não foram observados efeitos colaterais associados ao uso da morfina.
ConclusãoUma dose única de morfina endovenosa durante a indução anestésica reduziu a intensidade da dor pós‐operatória imediata de crianças submetidas a amigdalectomia, sem aumento do tempo de despertar da anestesia e com menor consumo de analgésicos de resgate.
As amigdalectomias são um dos procedimentos mais comuns feitos em crianças em todo o mundo.1 Embora a taxa de mortalidade seja baixa, a dor pós‐operatória pode ser intensa, mesmo com a variedade de métodos de analgesia disponíveis,2,3 já que ainda não há consenso sobre qual a estratégia terapêutica ideal de controle da dor.4
Os opioides são uma das várias opções de tratamento farmacológico eficazes na redução da dor pós‐amigdalecomia, atuam não apenas como analgésicos,5 mas também reduzem a agitação causada frequentemente pela anestesia inalatória em crianças.6 No entanto, o risco de levarem à depressão respiratória, particularmente nas cirurgias otorrinolaringológicas, pode limitar o uso de alguns, como o tramadol e a codeína.7
A morfina é um opioide com potencial analgésico amplamente conhecido, é prescrita até para o alívio da dor pós‐operatória na pediatria. Porém, seus riscos associados podem incluir aumento do tempo de recuperação anestésica, sonolência excessiva, aspiração e hipóxia no pós‐operatório, principalmente entre pacientes pediátricos com comorbidades como excesso de peso ou grave apneia do sono.8–10
Outro aspecto desafiador da dor pós‐operatória em crianças pode ser a sua mensuração, pois a dor vivenciada por elas muitas vezes pode ser difícil de quantificar, principalmente em pacientes menores de cinco anos.11 Mas apesar das limitações dos métodos atualmente disponíveis, são através deles que se pode gerenciar analgesia adequada.12
O objetivo deste estudo foi avaliar a eficácia da morfina endovenosa intraoperatória na redução da dor pós‐operatória de crianças submetidas à amigdalectomia com ou sem adenoidectomia.
MétodoEste foi um estudo cego, randomizado e controlado, aprovado pelo comitê de ética local (CAAE 46153415.6.0000.5078 e número do parecer do CEP: 1.252.240) e registrado no Rebec (Registro Brasileiro de Ensaios Clínicos), desenvolvido de junho de 2016 a junho de 2019, e incluiu crianças entre 3 e 10 anos, classificadas como estado físico 1 ou 2da Sociedade Americana de Anestesiologistas (ASA), com indicação para amigdalectomia, com ou sem adenoidectomia, para tratamento do distúrbio respiratório do sono por obstrução devido aumento das adenoides, com obstrução acima de 70% à nasovideoendoscopia e/ou hipertrofia da amígdalas graus III ou IV, ou ainda por amigdalites recorrentes, definidas como 7 infecções confirmadas em um ano, ou 5 infecções confirmadas ao ano por 2 anos ou ainda 3 infecções ao ano por 3 anos. Estimou‐se que com 27 pacientes em cada grupo o estudo teria um poder de 80% de detectar diferenças clinicamente importantes entre os grupos sobre a escala de dor FPS, assumiu‐se um tamanho de efeito grande (Cohen d=0,80), em um nível de significância de 5%. Ao tamanho da amostra foram acrescidos 10% para compensar possíveis perdas ao longo do período de acompanhamento, obteve‐se um tamanho total de 60 pacientes, randomizados aos dois grupos.
As crianças que atenderam aos critérios de inclusão foram atendidas em um protocolo de cirurgia de um dia (ambulatorial). Durante a visita pré‐anestésica, essas crianças e seus pais ou responsáveis foram convidadas a participarda pesquisa, com assinatura dos termos de consentimento de menores e adultos. Após concordar em participar, foram apresentados para familiarização a uma escala validada de avaliação da dor com faces (FPS – faces pain scale),13 que usa desenhos infantis com expressões de dor facial e que representam graduações indo desde nenhuma dor até a maior dor possível.
Os critérios de exclusão incluíram comorbidades como disfunção cardiopulmonar, paralisia cerebral, obesidade, uso crônico de analgésicos, anticonvulsivantes ou neurolépticos, complicações relacionadas à anestesia (laringo ou broncoespasmos graves, anafilaxia e/ou hemorragia), história de hipersensibilidade à anestésicos e necessidade de medicamentos além dos descritos no protocolo.
As cirurgias de amigdalectomia foram feitas com a técnica de dissecção (cirurgia a frio) e a hemostasia com procedimento cirúrgico padrão de sutura com fio categut. A anestesia foi geral, a monitoração consistiu em oximetria de pulso, cardioscópio, pressão arterial não invasiva e capnografia. A indução anestésica foi feita com sevoflurano a 6%–8% sob máscara e oxigênio a uma FiO2 de 100%. Após a venóclise, seguiu‐se a administração intravenosa de propofol (2 mg.kg‐1) e fentanil (0,5 μg.kg‐1), com intubação orotraqueal. Os pacientes foram então divididos em dois grupos. A lista de randomização foi previamente gerada através de um programa de computador, com letras aleatórias (M de morfina ou O de nenhuma droga) colocadas e distribuídas em envelopes de papél pardo opaco, selados e numerados sequencialmente, mantidos em sigilo até o momento intraoperatório. Assim, os do Grupo M receberam 0,10 mg.kg‐1 de morfina endovenosa durante o período de indução da anestesia, enquanto os do Grupo O não receberam medicação adicional. Foram ainda administrados por via endovenosa a todos os pacientes dimenidrinato (1,25 mg.kg‐1), ondansetrona (0,15mg.kg‐1), dexametasona (0,10mg.kg‐1), dipirona (30 mg.kg‐1) e ranitidina (1 mg.kg‐1). A anestesia foi mantida com 2%–4% de sevoflurano e FiO2 de 50%. Todos os pacientes foram anestesiados pelo investigador principal e as cirurgias feitas por residentes da otorrinolaringologia. A duração da cirurgia foi definida como o período entre a primeira incisão e a hemostasia final, o tempo da anestesia como o momento entre o início da anestesia inalatória e o momento da extubação e o tempo de despertar da anestesia como o horário de desligamento do sevoflurano até a extubação traqueal. Um cronômetro foi usado para registrar todos os horários.
No fim do procedimento, os pacientes foram extubados com reflexos de proteção (tosse e deglutição), respiração espontânea e eficaz, choro e movimento, e levados à sala de recuperação pós‐anestésica (SRPA), onde foram continuamente monitorados por pelo menos quatro horas por um anestesista diferente do que fez a anestesia, pela equipe de enfermagem e também pelo responsável pela criança, todos cegados em relação ao uso da morfina. Assim, com exceção do anestesiologista que fez a anestesia e sorteou o envelope, todos os outros profissionais e também parentes eram cegados para os grupos de estudo. O objetivo principal foi a avaliação da dor, feita com a escala FPS na SRPA, registraram‐se dados aos 30, 60, 120, 180 e 240 minutos após os indivíduos despertarem da anestesia. Nessa Escala de Dor pela Face (FPS), sete faces são mostradas e pontuadas, desde uma correspondente ao estado de ausência até a que reflete a pior dor possível (0: sem dor; 1: dor leve; 2: dor moderada; 3: dor; 4: dor intensa; 5: dor muito severa; 6: pior dor). Se de acordo com a escala FPS a criança e também seus pais/responsáveis indicassem intensidade da dor maior ou igual a 2, analgesia era feita pela administração endovenosa de 0,5–2 μg.kg‐1 de fentanil e se necessária repetida. Nesses casos, esses pacientes eram excluídos das avaliações horárias subsequentes sobre o nível de dor, para evitar a influência desse analgésico nos resultados. Oxigênio suplementar era administrado por cateter nasal ou máscara de oxigênio se a saturação de oxigênio diminuísse abaixo de 94%. Como desfechos secundários foram registrados o uso de analgésicos de resgate no pós‐operatório e as ocorrências de eventos adversos, como náuseas, vômitos, sangramentos, sonolência excessiva, prurido e depressão respiratória, bem como quaisquer outros sintomas ou eventos inesperados. A escala de Aldrete‐Kroulik também foi usada para alta da SRPA.
Os grupos foram comparados em termos de idade, peso, duração da cirurgia e tempo de despertar da anestesia com o teste não paramétrico de Mann‐Whitney. O grupo M foi comparado ao grupo O para determinar quaisquer diferenças nas percepções da dor ao longo do tempo, conforme relatadas pelos pacientes e seus pais/responsáveis. Nessas comparações, um modelo misto e de análise de variância de medidas repetidas (Anova) foi aplicado. Estimador de Kaplan‐Meier foi usado na construção de curvas de sobrevivência entre os dois grupos para se estimar a probabilidade de sobrevivência da necessidade do uso de resgate. Comparações foram feitas com o teste de log‐rank. O nível de significância foi estabelecido em p<0,05 e as análises estatísticas foram feitas no software SAS®, versão 9.4 (SAS Institute, Cary, NC).
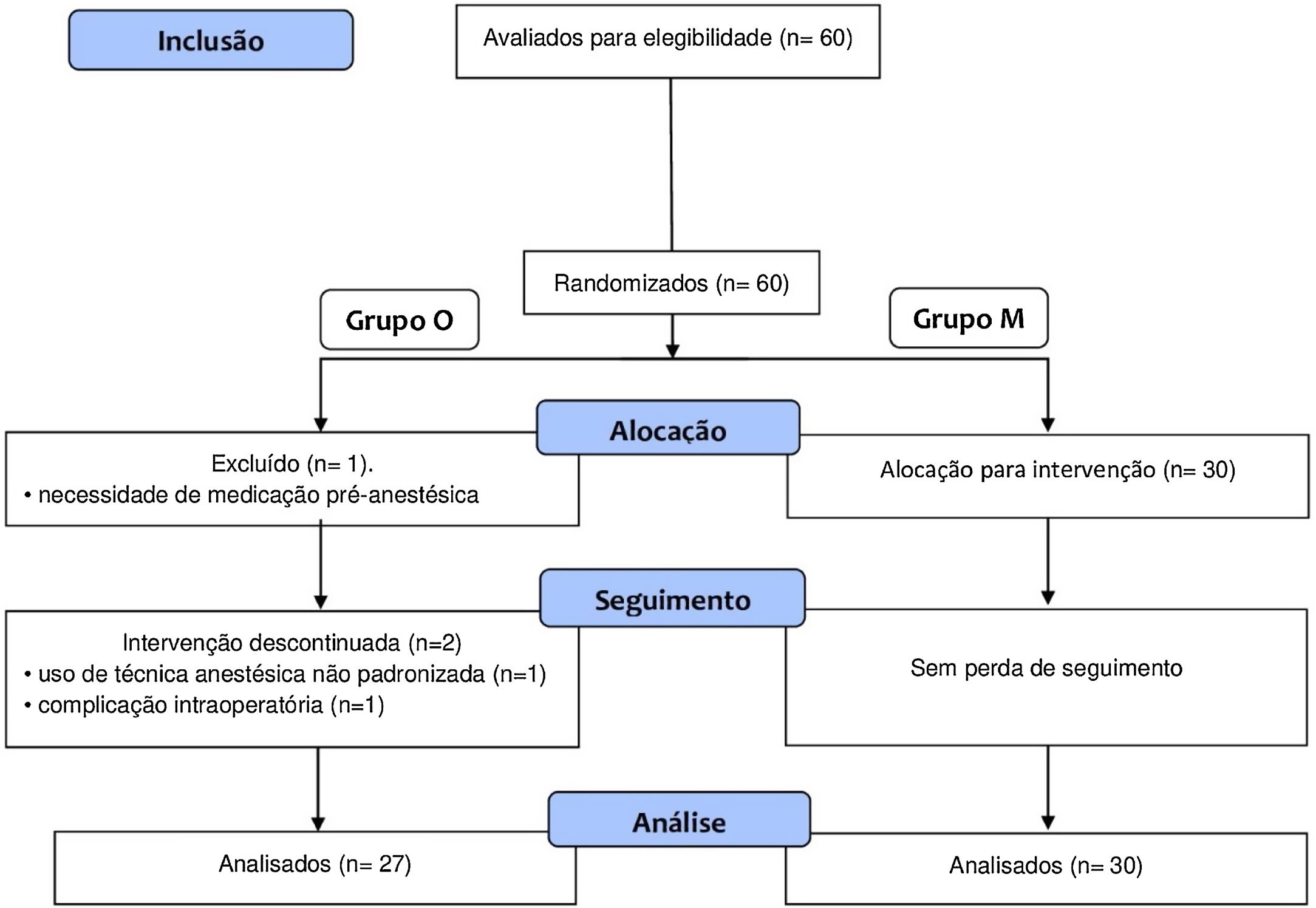
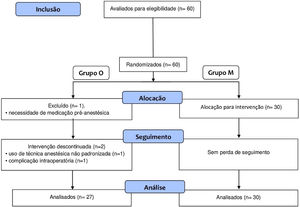
ResultadosForam selecionadas 60 crianças, 30 no grupo M e 30 no grupo O, com idade média de 5,9±2 anos, 60% do sexo masculino. Três pacientes, todos pertencentes ao grupo controle (grupo O), foram excluídos do estudo (fig. 1): um por necessidade de medicação pré‐anestésica, outro por não seguir o protocol‐padrão de anestesia e um por apresentar laringe espasmo grave durante a extubação. Os grupos não diferiram significativamente em termos de duração da cirurgia ou do tempo de despertar da anestesia, a média da primeira foi de 43 minutos e o tempo médio do segundo de 12 minutos (tabela 1).
Número de participantes, duração da cirurgia e o tempo de despertar da anestesia
| Variáveis | Grupos | p‐valora | |
|---|---|---|---|
| O (média±DP) | M (média±DP) | ||
| N° participantes (masc./fem.) | 27 (19/8) | 30 (15/15) | |
| Duração da cirurgia (min.) | 44,5±13,8 | 42±17,3 | 0,196 |
| Tempo de despertar da anestesia (min.) | 13,22±5,35 | 12,10±6,23 | 0,378 |
DP, desvio‐padrão; O, sem medicação; M, morfina.
Test t independente.
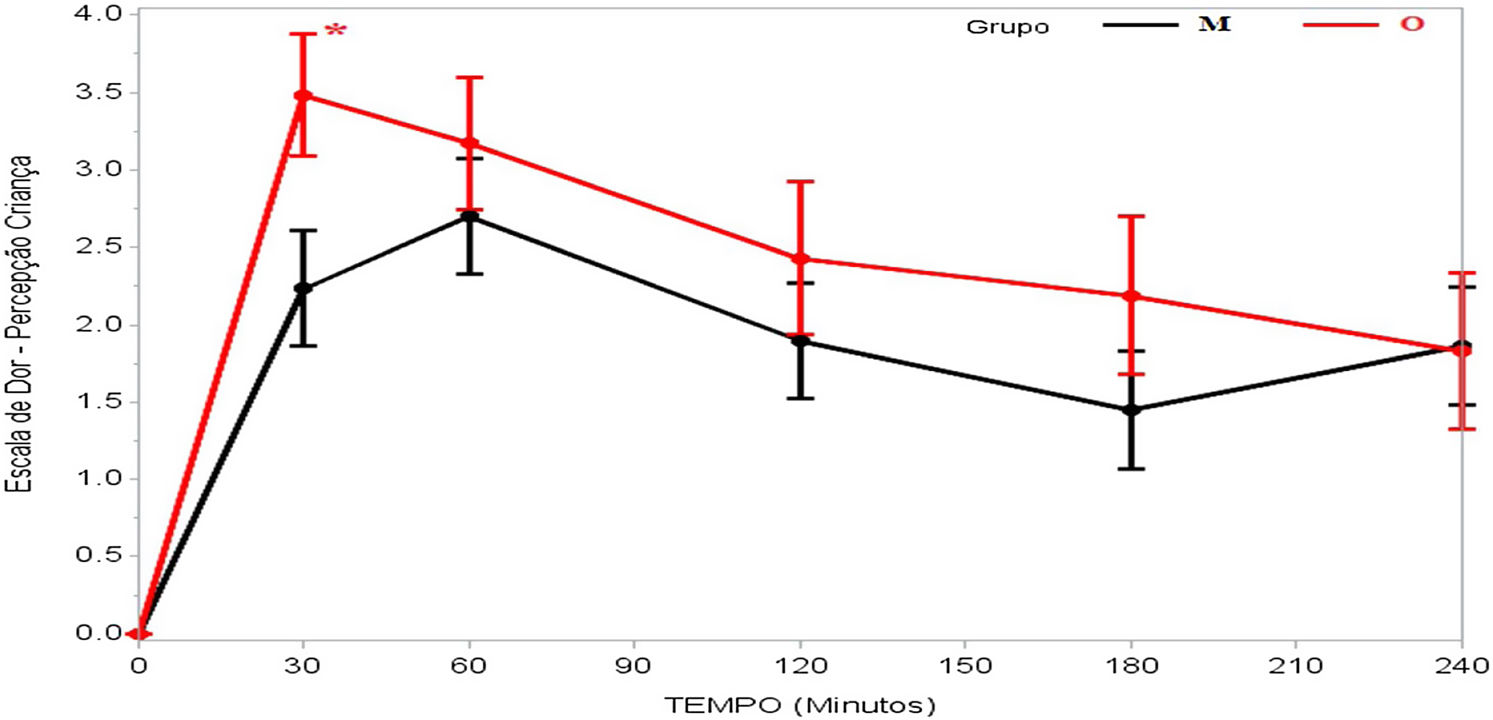
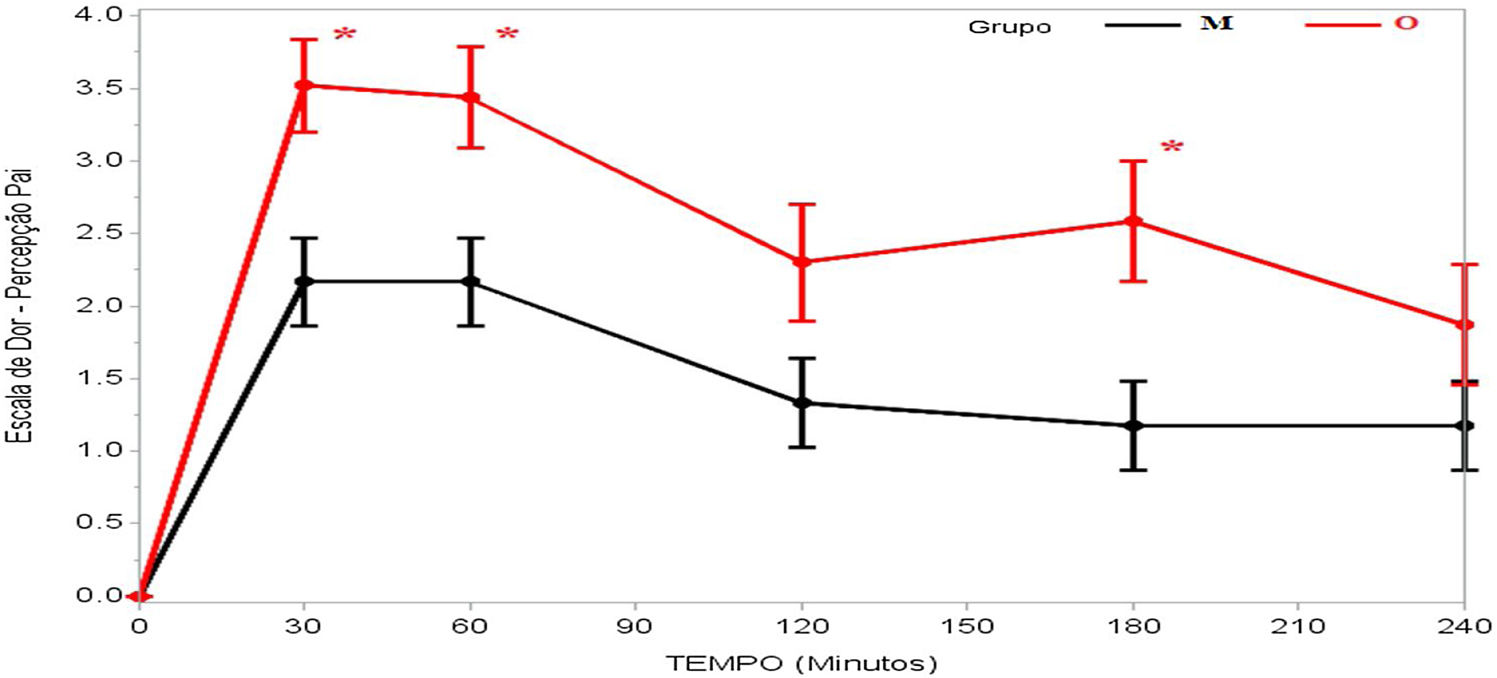
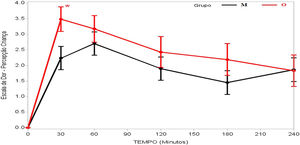
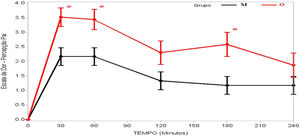
A dor foi relatada como mais intensa no início do pós‐operatório, tanto no grupo M quanto no grupo O, geralmente com intensidade progressivamente menor até a quarta hora de avaliação, e houve diferença significativa em termos dos escores de avaliação das crianças (p=0,036) e dos pais/responsáveis (p=0,003) em relação aos grupos M e O (tabela 2).
Valores médios para a percepção da dor pelas crianças e pais/responsáveis nos diversos períodos de tempo do pós‐operatório
| Momento de registro da dor relatada pela criança | Grupo O | Grupo M | p‐valora | p‐valor |
|---|---|---|---|---|
| (média±DP) | (média±DP) | O×M | Interação entre grupo e tempo | |
| 30 min | 3,48±0,39 | 2,23±0,37 | 0,023b | 0,036b |
| 60 min | 3,17±0,43 | 2,70±0,37 | 0,406 | |
| 120 min | 2,43±0,49 | 1,90±0,37 | 0,394 | |
| 180 min | 2,19±0,51 | 1,45±0,38 | 0,242 | |
| 240 min | 1,83±0,51 | 1,86±0,38 | 0,962 | |
| Momento de registro da dor relatada pelos pais/responsáveis | 0,003b | |||
| 30 min | 3,52±0,32 | 2,17±0,30 | 0,002b | |
| 60 min | 3,44±0,35 | 2,17±0,30 | 0,006b | |
| 120 min | 2,30±0,40 | 1,33±0,30 | 0,057 | |
| 180 min | 2,58±0,41 | 1,17±0,31 | 0,007b | |
| 240 min | 1,87±0,41 | 1,17±0,31 | 0,180 |
O, sem medicação; M, morfina.
Na avaliação dos pacientes, houve relato de dor menos intensa no grupo M aos 30 minutos após despertar da anestesia (p=0,023), enquanto todas as outras avaliações foram semelhantes (tabela 2 e fig. 2). Já quando os pais/responsáveis foram solicitados a avaliar a dor dos pacientes, seus relatos foram significativamente menores no grupo M nas avaliações feitas aos 30 (p=0,002), 60 (p=0,006) e 180 minutos (p=0,007) após despertar da anestesia (tabela 2 e fig. 3).
Com relação aos níveis de dor relatados dentro de cada um dos grupos, para comparar o referido pela criança com o descrito pelos pais/responsáveis, as interações entre grupo e tempo não foram significativas para qualquer dos grupos (p=0,751 e p=0,918), demonstrou que o comportamento da escala de dor ao longo do tempo de acompanhamento não diferiu entre as avaliações das crianças e a dos pais para qualquer tempo (tabela 3).
Comparação da intensidade de dor referida pela criança e pelos pais/responsáveis de um mesmo grupo no período pós‐operatório
| Interação entregrupos e tempo(p‐valor)a | Grupo O | Grupo M | ||
|---|---|---|---|---|
| 0,918 (média±DP) | 0,751 (média±DP) | |||
| Crianças | Pais/Resp. | Crianças | Pais/Resp. | |
| 30 min | 3,48±0,41 | 3,52±0,41 | 2,23±0,30 | 2,17±0,30 |
| 60 min | 3,17±0,43 | 3,46±0,43 | 2,70±0,30 | 2,17±0,30 |
| 120 min | 2,53±0,49 | 2,40±0,49 | 1,90±0,30 | 1,33±0,30 |
| 180 min | 2,30±0,50 | 2,70±0,50 | 1,44±0,31 | 1,17±0,31 |
| 240 min | 1,95±0,50 | 1,98±0,50 | 1,85±0,31 | 1,17±0,31 |
O, sem medicação; M, morfina.
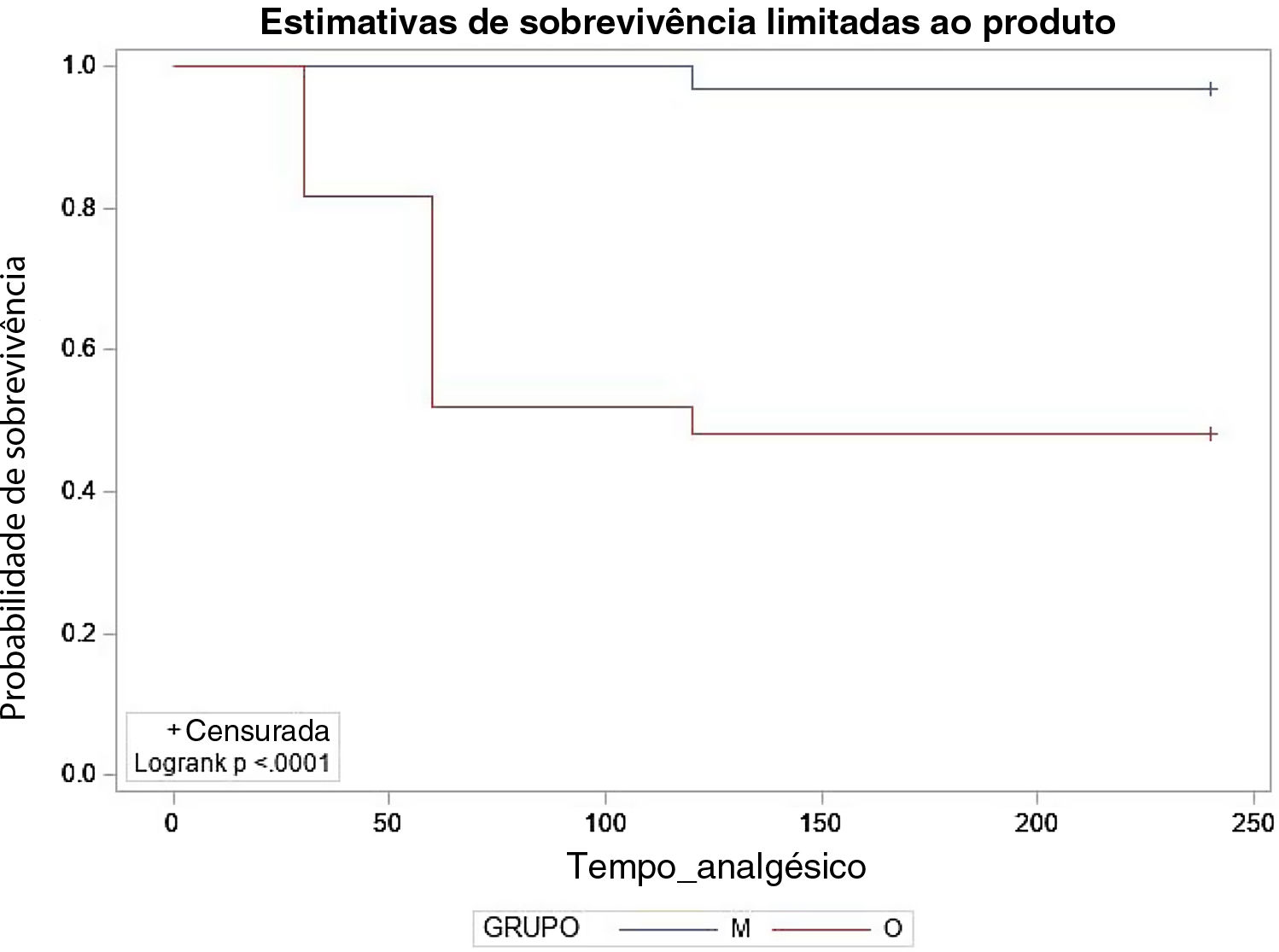
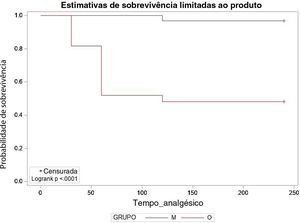
O uso de analgésicos de resgate foi diferente nos grupos, com 14 pacientes (51,85%) no grupo O com necessidade de analgesia de resgate no pós‐operatório, em média após 53,57 minutos, e dose média de 0,65 mcg.kg‐1 de fentanil, enquanto no grupo M apenas um paciente (3,33%) requereu analgésico, aos 120 minutos (tabela 4). Uma curva de Kaplan‐Meier foi construída para compararmos o tempo de necessidade do uso de resgate, tendo em vista que foi feito um seguimento prospectivo em vários tempos (fig. 4). Apesar de haver restrições quanto à quantidade de pontos representativos, pelo resultado do teste log‐rank, as duas curvas de sobrevivência diferem, demostraram que pacientes do grupo M apresentaram maior probabilidade de permanecer sem a necessidade do uso de analgesia de resgate do que os pacientes do grupo O ao longo do tempo de seguimento (p <0,0001). Quanto aos efeitos adversos, apenas um paciente do grupo O apresentou náuseas e vômitos, sem relatos de outras complicações.
Uso de analgésico de resgate no período pós‐operatório
| Analgésico | Grupo O | Grupo M | p‐valor |
|---|---|---|---|
| Sem necessidade de analgésico, n (%) | 13 (48,15%) | 29 (96,67%) | 0,002a |
| Necessidade de analgésico | 14 (51,85%) | 1 (3,33%) | |
| Média de horário no pós‐operatório (min.) | 53,57±24,05 | 120 | |
| Dose média (mcg.kg‐1) | 0,65 | 0,22 | |
| Total de crianças | 27 | 30 |
O, sem medicação; M, morfina
Crianças submetidas a amigdalectomia experimentam dor significativa e severas limitações funcionais pós‐operatórias por até duas semanas,3 geralmente mais intensas nos primeiros dias e que são fontes de grande ansiedade para pais e também para as próprias crianças. Incluem dores de ouvido, recusa a comer, beber ou tomar medicamentos orais, edema, disfagia e perda de peso.4,5 Esses quadros podem ser influenciados pelo sofrimento psicológico e também pelo delirium de emergência no pós‐operatório imediato.6
Para evitar tais efeitos e propiciar adequada analgesia pós‐operatória, várias estratégias são usadas, como medicação pré‐anestésica, participação ativa dos pais durante período perioperatório e medidas não farmacológicas e farmacológicas. Alguns medicamentos podem aumentar o risco de hipóxia pós‐operatória, como opioides como a codeína (polimorfismos do CYP2D6),7 e o tramadol, o que leva a seu pouco uso. Além disso, têm outros efeitos colaterais importantes, que incluem náuseas, vômitos, retenção urinária, prurido e constipação. Apesar disso, a morfina ainda pode ser usada com bons resultados no controle da dor pós‐amigdalectomia,8‐10 com várias outras opções farmacológicas, como anti‐inflamatórios não esteroides, dexametasona, acetaminofeno, cetamina, dexmedetomidina e anestesia infiltrativa.14‐16
De acordo com os resultados deste estudo, a administração intraoperatória de 0,1 mg.kg‐1 de morfina endovenosa em crianças submetidas à amigdalectomia reduziu a intensidade da dor pós‐operatória na avaliação das próprias crianças e também na de seus pais/responsáveis, foi eficaz na redução da dor após 30 minutos do tempo de despertar da anestesia, de acordo com os pacientes, e após 30, 60 e 180 min, de acordo com os pais/responsáveis, diminuiu o uso de medicação analgésica de resgate no pós‐operatório e sem prolongar o tempo de despertar da anestesia geral desses pacientes ou os efeitos adversos no perioperatório imediato. Importante observar que ainda assim houve um paciente no grupo que usou morfina que necessitou de analgésico de resgate no pós‐operatório, indicou que a analgesia pode não ser adequada em todos os casos e reiterou a necessidade de implantar outras opções de tratamento analgésico.
A morfina tem índice terapêutico estreito, com variações da resposta analgésica e dos efeitos colaterais, vão desde o alívio inadequado da dor até ao extremo de resultados adversos graves. Grande parte dessa variabilidade interindividual pode ser explicada por polimorfismos de nucleotídeos únicos em subconjunto de genes que codificam proteínas envolvidas em mecanismos de dor e opioides. O estudo da relação entre esse genótipo e os resultados clínicos associados à analgesia e efeitos adversos poderia identificar por meio de testes genéticos quais pacientes se beneficiariam de sua aplicação,17,18 mesmo que isso ainda seja uma realidade distante. Assim, a definição e titulação de doses de morfina mais seguras poderiam minimizar seus efeitos adversos, atender às necessidades individuais do paciente e limitar o risco de sobre dosagem.19,20 É importante sempre enfatizar que o uso de opioides para aliviar a dor pode diminuir a resposta à hipoxemia e potencializar o risco de depressão respiratória e que comorbidades como apneia do sono, distúrbios craniofaciais, broncopneumonia, asma, obesidade e infecções do trato respiratório, combinadas ao edema pós‐operatório, podem agravar seus efeitos respiratórios. Assim, um aspecto imprescindível, mesmo com todos os cuidados e administração nas doses padronizadas, é a recuperação desses pacientes na SRPA, sob constante vigilância.
Nos resultados deste ensaio clínico, eventos adversos graves não foram observados. Algumas condutas adotadas podem ter minimizado o aparecimento desses efeitos, como a ausência de medicações pré‐anestésicas como benzodiazepínicos ou agonistas alfa 2 como clonidina. A administração da morfina logo após a indução anestésica propicia maior tempo para sua circulação e abordagem terapêutica precoce de seus efeitos clínicos indesejados, como a apneia, assim como a duração da cirurgia, em média de 43 minutos, que também pode ter contribuído para a ausência desses efeitos, já que as cirurgias foram feitas por residentes e demoraram mais do que se tivessem sido feitas por cirurgiões mais experientes. Outro fator pode ter sido a ausência de crianças com comorbidades importantes, como baixo peso, obesidade ou apneia do sono grave, as quais podem levar a um maior risco de hipóxia pós‐operatória.21 Mais um aspecto neste estudo foi a baixa ocorrência de náuseas e vômitos no pós‐operatório, apenas um paciente, provavelmente devido à estratégia farmacológica de prevenção usada já no intraoperatório. Um outro fator que pode ser discutido como limitação deste ensaio clínico é a ausência de pesquisa de outros elementos, como estudo genético ou o sexo do paciente, que também poderiam interferir na farmacocinética da morfina. Além disso, a dose de fentanil na indução anestésica também pode ser considerada baixa, pois uma dose mais alta provavelmente contribuiria para uma analgesia mais longa e menores escores de dor durante os primeiros 30 minutos do pós‐operatório, mesmo se considerarmos ter sido usada em ambos os grupos. Assim, embora possa ter limitações e ser específico para um grupo específico de pacientes, este estudo sugere uma melhoria da dor no pós‐operatório de crianças com o uso da morfina, independentemente de outras variáveis.
Um importante aspecto neste tipo de estudo pode ser a dificuldade com que as crianças demostrem claramente seu nível álgico e sua necessidade de analgésicos, já que a capacidade de avaliar adequadamente a dor geralmente começa a se desenvolver apenas por volta dos cinco anos.11 Crianças pequenas que ainda não foram matriculadas na escola não estão acostumadas a receber perguntas de estranhos e também não têm a experiência de fornecer classificações ou estimativas quantitativas. Os relatos de dor desses pacientes também podem ser afetados por sua percepção das consequências dessa classificação, pois se elas acreditarem que podem receber uma injeção por relatar dor talvez minimizem suas experiências ou relatem uma intensidade menor. A correlação com a avaliação feita pelos pais/responsáveis atenua esse problema. Apesar disso, as avaliações da dor feitas por escalas de autorrelatos pelas crianças, como as deste trabalho, são amplamente usadas, pois são meios de mais fácil compreensão, fornecem informações úteis e constituem uma ferramenta válida. A FPS é um método de fácil entendimento, disponível em muitos países e idiomas e validada para uso na língua portuguesa, por isso é considerada neste estudo, apesar de várias outras também serem aceitas e usadas no mundo.12 Uma possível limitação seria não ser validada para menores de 4 anos, embora em sua descrição original ela tenha sido usada em crianças a partir de 3 anos, aparentemente com boa compreensão.13
Outro aspecto importante consiste na escala FPS não ser válida para avaliação da dor pós‐operatória por meio dos pais e cuidadores. Porém nenhuma escala de dor foi padronizada para uso pelos pais no período pós‐operatório imediato, de até 4h, como neste estudo. Apesar disso, a FPS modificada pode ser equivalente à PPPM (Post‐operative Pain Measurement), escala particularmente útil para avaliação da dor em casa pelos pais após cirurgia ambulatorial, na quantificação álgica em crianças pós‐amigdalectomia.22
A analgesia pós‐operatória já deve ser pensada desde antes mesmo do estímulo cirúrgico. Começando com o uso de medicações pré‐anestésicas e acompanhamento dos pais, passa pelas técnicas anestésico‐cirúrgicas para um despertar tranquilo e culmina com analgésicos de resgate no pós‐operatório. Porém, muitas vezes o cuidado com a analgesia dessas crianças pode levar a uma sedação excessiva no pós‐operatório, aumentar o risco de intercorrências como depressão respiratória. Alguns medicamentos usados como medicação pré‐anestésica, como midazolam, clonidina ou cetamina, podem melhorar a analgesia, mas também potencializar complicações. Medidas para prevenção e tratamento da dor desse tipo de paciente e a segurança do pós‐operatório, para evitar efeitos adversos, podem ter um equilíbrio frágil, variar entre a eficácia analgésica proporcionada e a segurança assegurada. Neste estudo, optamos por evitar sedação excessiva após o despertar da anestesia e por isso não usamos medicações pré‐anestésicas.
Estudos com morfina, administrada de forma isolada, em outras doses, associada a outros fármacos analgésicos ou ainda em faixas etárias diferentes, podem agregar maior conhecimento aos apresentados por este trabalho.
ConclusãoA morfina administrada via endovenosa e durante o intraoperatório em crianças submetidas à amigdalectomia reduz a intensidade da dor pós‐operatória imediata, sem aumentar o tempo de despertar da anestesia e com menor consumo de analgésicos de resgate no pós‐operatório, sem apresentar efeitos adversos significativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Oliveira Araújo MC, Sousa Caixeta JA, Vilarinho BF, Avelino MA. Single dose of intraoperative intravenous morphine for analgesia in children undergoing tonsillectomy: randomized, double‐blind clinical trial. Braz J Otorhinolaryngol. 2022;88:427–33.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.