Hearing loss is conceptualized as any impairment of the ability to hear and/or detect speech or environment sounds, regardless of cause, type, or degree. It may occur at different stages of life; during pregnancy or childbirth, in childhood, adulthood or old age. It should be noted that aging is the most common cause of sensorineural hearing loss followed by noise‐induced hearing loss, and both are closely related to the formation of reactive oxygen species. Dietary antioxidant supplementation has been employed as a therapeutic strategy to prevent and/or delay the risks of major human diseases.
ObjectiveTo assess randomized clinical trials to determine the effect of antioxidant supplementation on the auditory thresholds in patients of different age groups with sensorineural hearing loss.
MethodsThis systematic review consisted of a search in the following databases: MEDLINE, CENTRAL, ScienceDirect, Scopus, Web of Science, LILACS, SciELO and ClinicalTrials.gov. Additionally, the gray literature was also searched. The search strategy included terms related to the intervention (antioxidant supplementation), primary outcome (sensorineural hearing loss), as well as terms related to randomized clinical trials to improve search sensitivity.
ResultsBased on 977 potentially relevant records identified through the search in the databases, ten full‐text publications were retrieved for further evaluation. The increase in threshold at the 4kHz frequency was statistically higher in the control group (1.89 [1.01–2.78], p<0.0001) when compared to the NAC group and the ginseng group, whereas at 6kHz, the threshold increase was higher in the control group (1.42 [−1.14–3.97], p=0.28), but no statistically significant differences were found between groups.
ConclusionGinseng was the antioxidant agent that showed the best effect in preventing auditory threshold worsening at the frequency of 4kHz, but not at 6kHz in patients with sensorineural hearing loss caused by exposure to high sound pressure levels. There was no improvement in the thresholds with vitamin E supplementation.
A perda auditiva é conceituada como qualquer diminuição da capacidade de ouvir e/ou detectar sons da fala ou do ambiente, independentemente da causa, tipo ou grau e pode ocorrer em diversos estágios da vida, durante a gestação ou parto, na infância, vida adulta ou na terceira idade. Convém destacar que o envelhecimento é a primeira causa de perda auditiva do tipo sensorioneural e em segundo lugar a perda auditiva induzida pelo ruído, ambas estão intimamente relacionadas com a formação de espécies reativas de oxigênio. Evidências têm sido acumuladas indicando que a suplementação com antioxidantes via alimentação tornou‐se estratégia terapêutica para prevenir e/ou retardar os riscos das principais doenças humanas.
ObjetivoAvaliar ensaios clínicos aleatórios para determinar qual o efeito da suplementação com antioxidantes sobre o limiar auditivo na perda auditiva sensorioneural em pacientes de diversas faixas etárias.
MétodoA formulação desta revisão sistemática consistiu na busca dos estudos nas seguintes bases de dados: MEDLINE, CENTRAL, ScienceDirect, Scopus, Web of Science, LILACS, SciELO e ClinicalTrials.gov. Adicionalmente, a literatura cinzenta também foi pesquisada. A estratégia de busca incluiu termos relacionados à intervenção (suplementação de antioxidantes), o desfecho primário (perda auditiva sensorioneural), bem como termos relacionados aos ensaios clínicos randomizados para melhorar e a sensibilidade da busca.
ResultadosA partir de 977 registros potencialmente relevantes identificados através da busca nas bases de dados, dez publicações em texto completo foram recuperadas para avaliação mais aprofundada. O aumento no limiar na frequência de 4kHz foi estatisticamente maior no Grupo Controle (1,89 [1,01–2,78], p<0,0001) quando comparados com o Grupo NAC e o Grupo Ginseng, já na frequência de 6kHz o aumento no limiar foi maior no Grupo Controle (1,42 [‐1,14–3,97], p=0,28), porém, não foram encontradas diferenças estatisticamente significativas entre grupos.
ConclusãoO Ginseng foi o antioxidante que evitou a piora do limiar auditivo na frequência de 4kHz, mas não em 6kHz, em pacientes com perda auditiva sensorioneural causada por exposição a elevados níveis de pressão sonora. Não foi observada melhora nos limiares com a suplementação com Vitamina E.
A integridade do sistema auditivo é importante para a comunicação do indivíduo e sua interação social.1 Atualmente, a surdez é considerada como um problema de saúde pública em virtude de sua significativa prevalência, mas, sobretudo, pelas múltiplas consequências que pode acarretar ao desenvolvimento humano nos aspectos intelectuais, sociais, linguísticos, cognitivos, emocionais e culturais.1–4 Cerca de 9,7 milhões de brasileiros são portadores de deficiência auditiva e no mundo estima‐se que 360 milhões de pessoas tenham tal problema de saúde.5
A perda auditiva é conceituada como qualquer diminuição da capacidade de ouvir e/ou detectar sons da fala ou do ambiente, independentemente da causa, do tipo ou do grau, e pode ocorrer em diversos estágios da vida, durante a gestação ou parto, na infância, vida adulta ou na terceira idade.6 Segundo Lloyd & Kaplan (1978),7 pode ser classificada quanto ao grau em leve, moderada, moderadamente severa, severa ou profunda, pode afetar uma ou ambas as orelhas; quanto ao tipo pode ser classifica em condutiva, neurossensorial e/ou mista;8 e quanto a sua origem pode ser adquirida ou congênita.6
As principais causas da perda auditiva congênita são genéticas, infecções congênitas e uso de medicamentos ototóxicos durante a gravidez. Já a deficiência auditiva adquirida pode ocorrer como consequência de diversos fatores, como: predisposição genética, sequela da meningite, exposição a ruídos, envelhecimento, uso de medicamentos ototóxicos e em algumas situações a etiologia permanece desconhecida.9
Convém destacar que o envelhecimento é a primeira causa de perda auditiva do tipo sensorioneural e em segundo lugar a perda auditiva induzida pelo ruído, ambas estão intimamente relacionadas com a formação de espécies reativas de oxigênio (Eros), as quais são responsáveis por uma série de danos a moléculas biológicas, presentes na cóclea, como também ao desenvolvimento de várias outras doenças humanas. Diante disto, existe a necessidade permanente de inativar ou reduzir a formação desses radicais livres, com o uso de antioxidantes, por exemplo, que são agentes responsáveis pela inibição e redução das lesões causadas pelos radicais livres nas células.10
Os alimentos, principalmente as frutas, verduras e legumes, também contêm agentes antioxidantes, tais como as vitaminas C, E e A, a clorofilina, os flavonoides, carotenoides, curcumina e outros que são capazes de restringir a propagação das reações em cadeia e as lesões induzidas pelos radicais livres.11–13 Evidências acumuladas indicam que a suplementação com antioxidantes via alimentação tornou‐se estratégia terapêutica para prevenir e/ou retardar os riscos das principais doenças humanas.10
Assim, a presente metanálise objetivou avaliar ensaios clínicos aleatórios para determinar qual o efeito da suplementação com antioxidantes sobre o limiar auditivo na perda auditiva sensorioneural em pacientes de diversas faixas etárias.
MétodoA formulação desta revisão sistemática buscou responder a seguinte pergunta: “Os pacientes de diversas faixas etárias com perda auditiva sensorioneural que receberam suplementação com antioxidantes apresentaram melhores limiares auditivos?” A partir dessa pergunta, a presente metanálise está relatada de acordo com o Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (Prisma) Statement.14 O protocolo foi previamente publicado na base de dados Prospero (http://www.crd.york.ac.uk/PROSPERO), mediante o n° CRD42015027677.
Considerando o seguimento dos critérios do Prisma, as questões abordadas no objetivo remetem‐se à estratégia de PICO, os pacientes são aqueles de diversas faixas etárias com perda auditiva sensorioneural, a intervenção corresponde à suplementação com antioxidantes comparados com sujeitos que não receberam a suplementação, os resultados se relacionam com os limiares auditivos e o desenho dos estudos investigados foi o ensaio clínico randomizado.
Estratégia de buscaAs seguintes bases de dados foram pesquisadas até junho de 2016: Medline, Central, ScienceDirect, Scopus, Web of Science, Lilacs, SciELO e ClinicalTrials.gov. Adicionalmente, as seguintes bases de dados referentes a literatura cinzenta também foram pesquisadas: OpenGrey.eu, DissOnline.de, NYAM.org e ClinicalEvidence.com. Não houve busca manual dos artigos incluídos e especialistas na área não foram contatados para evitar o risco de viés.15 A estratégia de busca incluiu termos relacionados à intervenção (suplementação de antioxidantes), ao desfecho primário (perda auditiva sensorioneural), bem como termos relacionados aos ensaios clínicos randomizados para melhorar a sensibilidade da busca.16 Esses descritores foram usados em inglês para a busca na grande maioria das bases de dados, no entanto os artigos necessitavam apresentar ao menos o título e/ou resumo em inglês para compor a presente seleção. A estratégia de pesquisa completa é mostrada no material suplementar (Apêndice 1). A pesquisa não foi restrita a qualquer ano de publicação ou idioma.
Critérios de elegibilidadeApenas ensaios clínicos randomizados que preencheram os seguintes critérios foram incluídos: 1) Indivíduos apresentavam diagnostico de perda auditiva sensorioneural (induzida por substâncias ototóxicas, como cisplatina, gentamicina, amicacina, canamicina, neomicina e outros; induzida por ruído e presbiacusia); 2) Presença de um grupo submetido à suplementação com antioxidantes através da alimentação oral (Vitamina C, Vitamina E, carotenoides, flavonoides e outros) e outro grupo controle. Não houve restrições baseadas no sexo, na etnia ou em comorbidades. No mínimo, os estudos precisavam ter avaliado o limiar auditivo como resultado e deveriam relatar os valores médios encontrados ou as diferenças entre os valores médios.
Os critérios de exclusão foram: 1) Estudos nos quais a intervenção dietética não se relacionava com a avaliação da perda auditiva e; 2) Publicações duplicadas.
Extração dos dadosOs títulos e resumos dos artigos recuperados foram avaliados, de forma independente, por dois investigadores que não estavam cegos para os autores ou os títulos de periódicos. As versões completas dos artigos potencialmente elegíveis foram recuperadas para avaliação mais aprofundada.
O resultado primário investigado nos estudos foi a melhoria dos limiares auditivos após a suplementação com antioxidantes, mediante a identificação prévia do tipo de perda auditiva verificada e do instrumento de avaliação usado. Além disso, foram verificados, como resultado secundário, fatores associados ao uso dos antioxidantes, como: o tipo de substância usada, quantidade de ingestão do antioxidante e o tempo de suplementação.
Todas as informações necessárias foram extraídas a partir dos artigos publicados, protocolos e comentários relacionados a cada estudo e, quando necessário, os autores foram contatados para obter informações adicionais. Para os estudos que tiveram mais do que dois grupos experimentais, o mais adequado ao objetivo proposto foi escolhido pelos autores. Quaisquer divergências foram resolvidas por consenso. Nos casos em que não houve consenso, um terceiro autor foi convocado para tomar a decisão final.
Além dos dados do desfecho também foram extraídos os nomes dos autores, título, ano de publicação, país, as faixas etárias dos grupos, o número de sujeitos em cada grupo, tipo e grau da perda auditiva, por orelha. Um formulário padrão para armazenamento de dados foi criado com base no modelo adotado pela Cochrane.17
Avaliação do risco de viésO risco de viés foi analisado de acordo com as recomendações do Handbook da Cochrane18 no nível do resultado primário.
A qualidade dos estudos foi avaliada por dois investigadores independentes em quatro categorias: geração da sequência adequada; sigilo de alocação; mascaramento dos participantes, do pesquisador e dos avaliadores e manejo de dados ausentes para posterior julgamento final.
Análise dos dadosA melhoria do limiar auditivo após a suplementação com antioxidantes foi analisada. Os efeitos do tratamento através dos ensaios foram combinados e a diferença de média ponderada para as medidas de resultados foi calculada.
Para isso, foi usado como medida do efeito da diferença média entre os grupos e como método estatístico de análise um modelo de efeitos aleatórios. Um valor de α ¿ 0,05 foi considerado estatisticamente significante. Quando não foi possível obter dados adequados para análise, seguiram‐se as recomendações da Cochrane.
A heterogeneidade estatística entre os estudos foi analisada com o teste de Cochrane e a inconsistência com o teste do I.2 Um valor de p ¿ 0,10 foi considerado estatisticamente significante. Quando necessário, características do estudo consideradas potenciais fontes de heterogeneidade foram incluídas em uma análise de subgrupos. Além disso, em caso de heterogeneidade, os estudos foram removidos, um por um, para investigar se o estudo removido fora a fonte de heterogeneidade.
Todas as análises foram conduzidas com o software RevMan 5.3 (Cochran Collaboration).
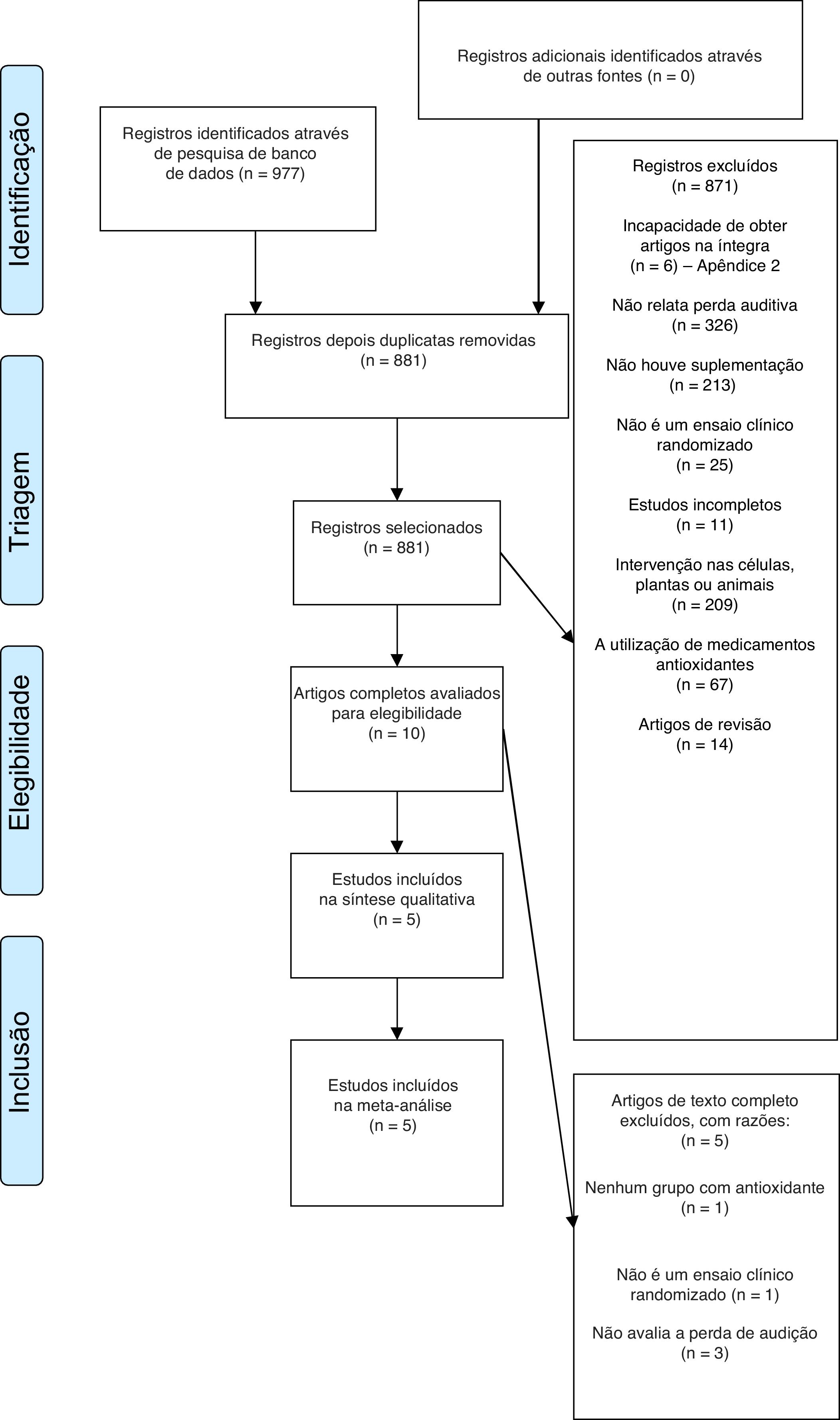
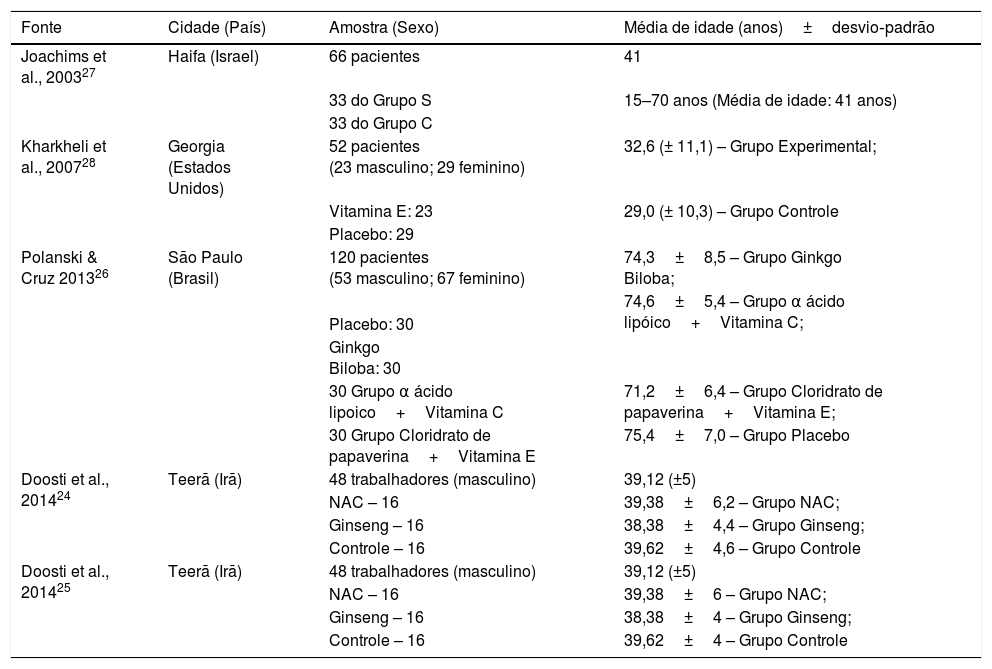
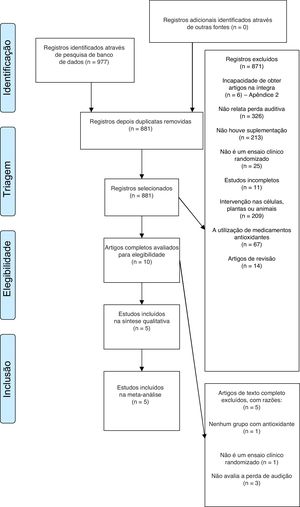
ResultadosEstudos incluídosA partir de 977 registros potencialmente relevantes identificados através da busca nas bases de dados, dez publicações em texto completo foram recuperadas para avaliação mais aprofundada. Desses, cinco foram excluídos após a análise de texto completo, foram incluídos cinco artigos na análise qualitativa e desses quatro na análise quantitativa (tabela 1). O diagrama de fluxo que ilustra a pesquisa e a seleção dos estudos está exposto na figura 1.
Características gerais dos estudos incluídos
| Fonte | Cidade (País) | Amostra (Sexo) | Média de idade (anos)±desvio‐padrão |
|---|---|---|---|
| Joachims et al., 200327 | Haifa (Israel) | 66 pacientes | 41 |
| 33 do Grupo S | 15–70 anos (Média de idade: 41 anos) | ||
| 33 do Grupo C | |||
| Kharkheli et al., 200728 | Georgia (Estados Unidos) | 52 pacientes (23 masculino; 29 feminino) | 32,6 (± 11,1) – Grupo Experimental; |
| Vitamina E: 23 | 29,0 (± 10,3) – Grupo Controle | ||
| Placebo: 29 | |||
| Polanski & Cruz 201326 | São Paulo (Brasil) | 120 pacientes (53 masculino; 67 feminino) | 74,3±8,5 – Grupo Ginkgo Biloba; |
| 74,6±5,4 – Grupo α ácido lipóico+Vitamina C; | |||
| Placebo: 30 | |||
| Ginkgo Biloba: 30 | |||
| 30 Grupo α ácido lipoico+Vitamina C | 71,2±6,4 – Grupo Cloridrato de papaverina+Vitamina E; | ||
| 30 Grupo Cloridrato de papaverina+Vitamina E | 75,4±7,0 – Grupo Placebo | ||
| Doosti et al., 201424 | Teerã (Irã) | 48 trabalhadores (masculino) | 39,12 (±5) |
| NAC – 16 | 39,38±6,2 – Grupo NAC; | ||
| Ginseng – 16 | 38,38±4,4 – Grupo Ginseng; | ||
| Controle – 16 | 39,62±4,6 – Grupo Controle | ||
| Doosti et al., 201425 | Teerã (Irã) | 48 trabalhadores (masculino) | 39,12 (±5) |
| NAC – 16 | 39,38±6 – Grupo NAC; | ||
| Ginseng – 16 | 38,38±4 – Grupo Ginseng; | ||
| Controle – 16 | 39,62±4 – Grupo Controle |
NAC, N‐acetil‐cisteína.
Entre os cinco estudos excluídos, o trabalho de Kaya et al. (2014),19 apesar de ser incluído para verificação dos critérios de elegibilidade, foi posteriormente excluído, pois a escolha de receber ou não a suplementação dos antioxidantes ficava a critério do paciente, não foi feita de maneira aleatória, o que não caracteriza um ensaio clínico randomizado.
Já o estudo de Schmitz et al. (2012)20 referia‐se ao risco de perda auditiva, e não à perda auditiva propriamente dita, distanciou‐se dos objetivos dos demais trabalhos incluídos nesta revisão, foi, portanto, excluído também. Os estudos de Guilles et al. (2014)21 e Quaranta et al. (2012)22 foram eliminados pois verificaram a perda auditiva temporária. Por fim, o estudo de Reisser & Weidauer (2001)23 também não foi incluído porque no grupo de indivíduos que recebeu os antioxidantes usou‐se a técnica de infusão, e não a de suplementação, que corresponde à intervenção do presente estudo. A tabela 1 refere‐se às características gerais dos artigos incluídos.
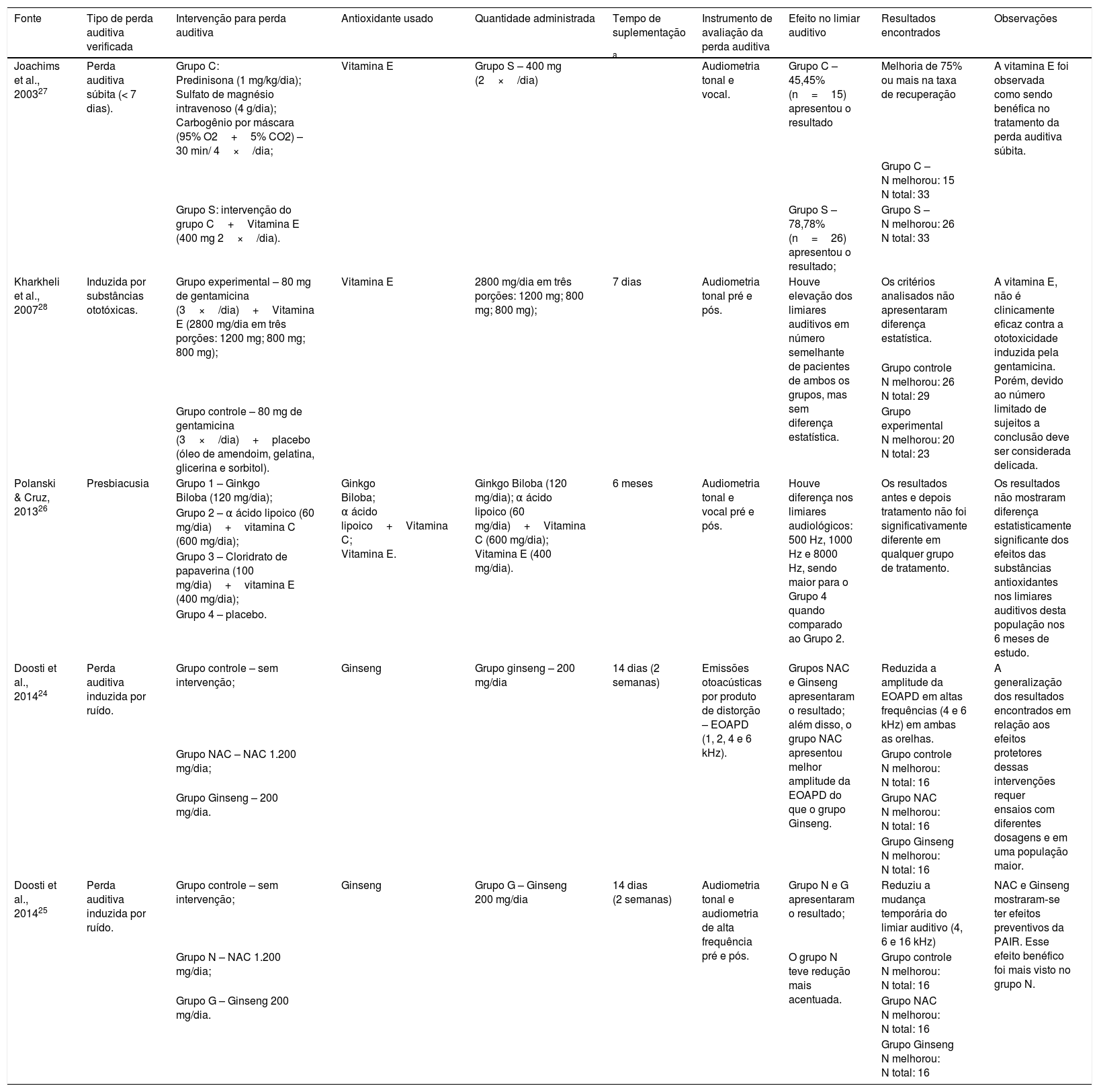
A tabela 2 retrata as características da intervenção feita e os resultados encontrados pelos artigos incluídos nesta revisão sistemática.
Características dos estudos incluídos quanto à intervenção e os resultados encontrados
| Fonte | Tipo de perda auditiva verificada | Intervenção para perda auditiva | Antioxidante usado | Quantidade administrada | Tempo de suplementação | Instrumento de avaliação da perda auditiva | Efeito no limiar auditivo | Resultados encontrados | Observações |
|---|---|---|---|---|---|---|---|---|---|
| Joachims et al., 200327 | Perda auditiva súbita (< 7 dias). | Grupo C: Predinisona (1 mg/kg/dia); Sulfato de magnésio intravenoso (4 g/dia); Carbogênio por máscara (95% O2+5% CO2) – 30 min/ 4×/dia; | Vitamina E | Grupo S – 400 mg (2×/dia) | a | Audiometria tonal e vocal. | Grupo C – 45,45% (n=15) apresentou o resultado | Melhoria de 75% ou mais na taxa de recuperação | A vitamina E foi observada como sendo benéfica no tratamento da perda auditiva súbita. |
| Grupo C – N melhorou: 15 N total: 33 | |||||||||
| Grupo S: intervenção do grupo C+Vitamina E (400 mg 2×/dia). | Grupo S – 78,78% (n=26) apresentou o resultado; | Grupo S – N melhorou: 26 N total: 33 | |||||||
| Kharkheli et al., 200728 | Induzida por substâncias ototóxicas. | Grupo experimental – 80 mg de gentamicina (3×/dia)+Vitamina E (2800 mg/dia em três porções: 1200 mg; 800 mg; 800 mg); | Vitamina E | 2800 mg/dia em três porções: 1200 mg; 800 mg; 800 mg); | 7 dias | Audiometria tonal pré e pós. | Houve elevação dos limiares auditivos em número semelhante de pacientes de ambos os grupos, mas sem diferença estatística. | Os critérios analisados não apresentaram diferença estatística. | A vitamina E, não é clinicamente eficaz contra a ototoxicidade induzida pela gentamicina. Porém, devido ao número limitado de sujeitos a conclusão deve ser considerada delicada. |
| Grupo controle N melhorou: 26 N total: 29 | |||||||||
| Grupo controle – 80 mg de gentamicina (3×/dia)+placebo (óleo de amendoim, gelatina, glicerina e sorbitol). | Grupo experimental N melhorou: 20 N total: 23 | ||||||||
| Polanski & Cruz, 201326 | Presbiacusia | Grupo 1 – Ginkgo Biloba (120 mg/dia); | Ginkgo Biloba; α ácido lipoico+Vitamina C; Vitamina E. | Ginkgo Biloba (120 mg/dia); α ácido lipoico (60 mg/dia)+Vitamina C (600 mg/dia); Vitamina E (400 mg/dia). | 6 meses | Audiometria tonal e vocal pré e pós. | Houve diferença nos limiares audiológicos: 500 Hz, 1000 Hz e 8000 Hz, sendo maior para o Grupo 4 quando comparado ao Grupo 2. | Os resultados antes e depois tratamento não foi significativamente diferente em qualquer grupo de tratamento. | Os resultados não mostraram diferença estatisticamente significante dos efeitos das substâncias antioxidantes nos limiares auditivos desta população nos 6 meses de estudo. |
| Grupo 2 – α ácido lipoico (60 mg/dia)+vitamina C (600 mg/dia); | |||||||||
| Grupo 3 – Cloridrato de papaverina (100 mg/dia)+vitamina E (400 mg/dia); | |||||||||
| Grupo 4 – placebo. | |||||||||
| Doosti et al., 201424 | Perda auditiva induzida por ruído. | Grupo controle – sem intervenção; | Ginseng | Grupo ginseng – 200 mg/dia | 14 dias (2 semanas) | Emissões otoacústicas por produto de distorção – EOAPD (1, 2, 4 e 6 kHz). | Grupos NAC e Ginseng apresentaram o resultado; além disso, o grupo NAC apresentou melhor amplitude da EOAPD do que o grupo Ginseng. | Reduzida a amplitude da EOAPD em altas frequências (4 e 6 kHz) em ambas as orelhas. | A generalização dos resultados encontrados em relação aos efeitos protetores dessas intervenções requer ensaios com diferentes dosagens e em uma população maior. |
| Grupo NAC – NAC 1.200 mg/dia; | Grupo controle N melhorou: N total: 16 | ||||||||
| Grupo Ginseng – 200 mg/dia. | Grupo NAC N melhorou: N total: 16 | ||||||||
| Grupo Ginseng N melhorou: N total: 16 | |||||||||
| Doosti et al., 201425 | Perda auditiva induzida por ruído. | Grupo controle – sem intervenção; | Ginseng | Grupo G – Ginseng 200 mg/dia | 14 dias (2 semanas) | Audiometria tonal e audiometria de alta frequência pré e pós. | Grupo N e G apresentaram o resultado; | Reduziu a mudança temporária do limiar auditivo (4, 6 e 16 kHz) | NAC e Ginseng mostraram‐se ter efeitos preventivos da PAIR. Esse efeito benéfico foi mais visto no grupo N. |
| Grupo N – NAC 1.200 mg/dia; | O grupo N teve redução mais acentuada. | Grupo controle N melhorou: N total: 16 | |||||||
| Grupo G – Ginseng 200 mg/dia. | Grupo NAC N melhorou: N total: 16 | ||||||||
| Grupo Ginseng N melhorou: N total: 16 |
NAC, N‐acetil‐cisteína.
O risco de viés dos estudos em nível do resultado primário é mostrado na tabela 3. Dos cinco estudos incluídos, três não relataram o método usado para geração da sequência; quanto ao sigilo de alocação, todos os artigos não fornecem informações suficientes sobre esse processo para permitir julgamento. Todos os cinco artigos relataram a existência do mascaramento dos avaliadores, bem como a justificativa para os dados ausentes, quando esses ocorreram.
Riscos de viés dos artigos incluídos
| Fonte | Geração da sequência | Sigilo da alocação | Mascaramento do participante e pesquisador | Mascaramento dos avaliadores | Manejo de dados ausentes |
|---|---|---|---|---|---|
| Joachims et al., 200327 | Incerto | Incerto | Baixo | Baixo | Baixo |
| Kharkheli et al., 200728 | Incerto | Incerto | Baixo | Incerto | Baixo |
| Polanski & Cruz, 201326 | Baixo | Baixo | Baixo | Baixo | Baixo |
| Doosti et al., 201424 | Baixo | Baixo | Baixo | Baixo | Baixo |
| Doosti et al., 201425 | Baixo | Baixo | Baixo | Baixo | Baixo |
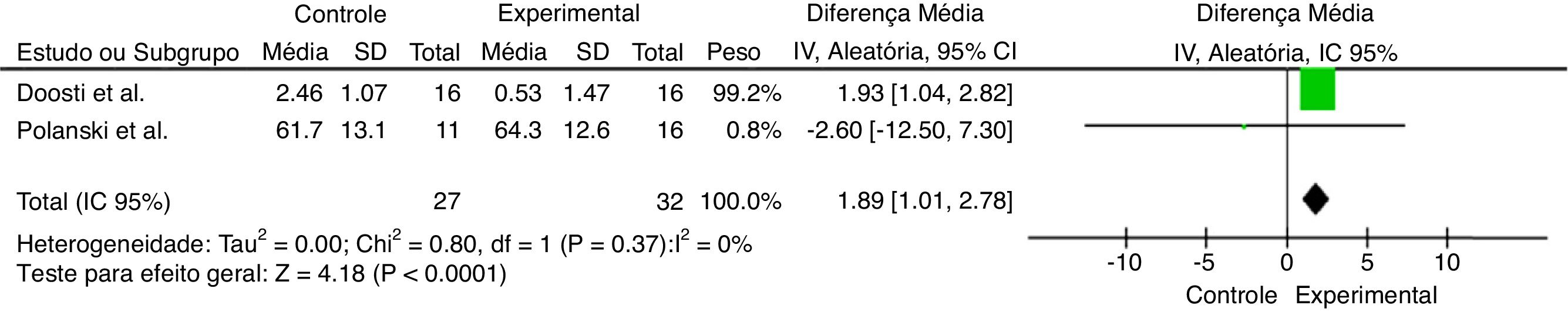
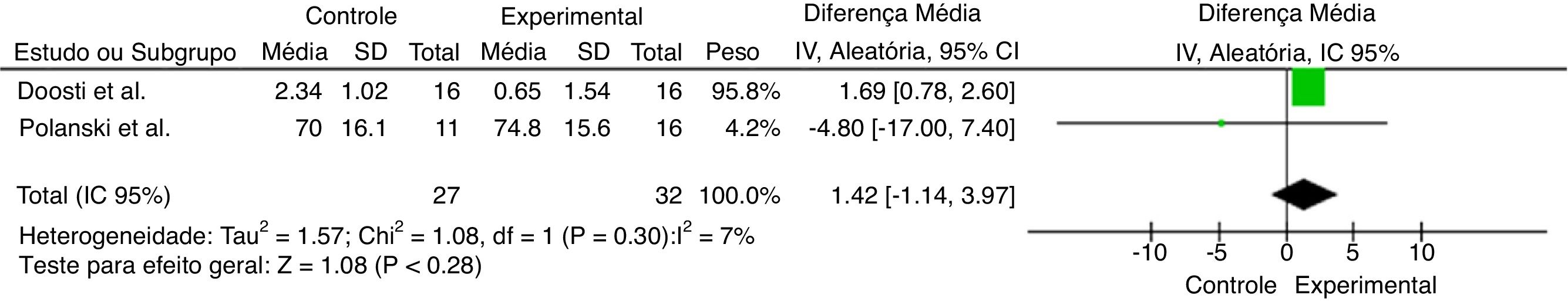
Ao considerar a diversidade dos objetivos e das metodologias dos artigos selecionados, foram feitas análises quantitativas de dados ao combinar os artigos que apresentaram resultados em comum. A figura 2 representa os trabalhos que proporcionaram melhoria no limiar auditivo após a suplementação com antioxidantes. Já as figuras 3 e 4 representam o efeito global da suplementação de antioxidantes sobre o limiar auditivo nas frequências especificas de 4 kHz e 6 kHz, respectivamente.
Verifica‐se que apesar de o trabalho de Doosti et al. (2014)24 comprovar a melhoria na amplitude da EOAPD em altas frequências (4 e 6 kHz) e indicar em ambas as orelhas melhoria na função das células ciliadas, não apresentou dados suficientes que sinalizassem a melhoria/piora do limiar auditivo após o uso de antioxidantes, nem dados que permitissem a comparação com os demais estudos, Doosti et al. (2014)25 e Polanski & Cruz (2013),26 em relação ao efeito sobre as frequências especificas de 4 e 6 KHz.
O grupo controle apresentou um risco maior de piorar o limiar auditivo (RR = 0,93 [0,82–1,05]; p=0,24); porém, não foram encontradas diferenças estatisticamente significativas entre grupos.
O aumento no limiar foi estatisticamente maior no Grupo Controle (1,89 [1,01–2,78]; p < 0,0001) quando comparado com o Grupo NAC e o Grupo Ginseng.
O aumento no limiar foi maior no Grupo Controle (1,42 [‐1,14–3,97]; p=0,28); porém, não foram encontradas diferenças estatisticamente significativas entre grupos.
A partir das metanálises feitas dos estudos supracitados, como pode ser observado na figura 2, constata‐se que os trabalhos selecionados buscaram verificar a taxa de recuperação‐melhoria no tratamento27,28 e nas figuras 3 e 4 está a mudança temporária do limiar auditivo (nas frequências 4 e 6 kHz).25,26 Apesar de os resultados mostrarem uma possível melhoria geral no limiar auditivo do Grupo Experimental,27,28 além de aumento no limiar auditivo para a frequência de 6 kHz do Grupo Experimental,25,26 a metanálise feita não apresentou diferenças significativas entre os grupos. Contudo, para a frequência de 4 kHz a pioria do limiar auditivo foi significativamente menor no Grupo Experimental, quando comparada com a do Grupo Controle.25,26
DiscussãoOs quatro estudos incluídos na análise quantitativa corresponderam a 286 indivíduos distribuídos aleatoriamente para condições de um grupo que recebeu a suplementação com antioxidantes e outro que não recebeu (Grupo Controle). Os quatro estudos tinham, além da suplementação de antioxidantes, usado fármacos concomitantes, foi escolhida a intervenção referente à suplementação e um estudo teve mais de dois grupos de intervenção, foram determinados por consenso os grupos que se encaixavam melhor na análise.
Os estudos24–28 avaliaram diferentes tipos de perda auditiva e por conseguinte usaram intervenções distintas para verificar o efeito da suplementação de antioxidantes nos respectivos tipos de perda. Além disso, os estudos se diferenciaram quanto ao antioxidante suplementado, à dose usada e ao tempo de suplementação. Os instrumentos de avaliação da perda auditiva foram: audiometrias tonal e vocal,27 emissões otoacústicas por produto de distorção,24 audiometria tonal e audiometria tonal de alta frequência pré e pós25 e audiometria tonal pré e pós26,28 e, portanto, os resultados foram diferentes entre os estudos.
O estudo de Joachims (2003)27 teve como objetivo investigar o possível benefício do efeito antioxidante da Vitamina E no tratamento de surdez súbita. O delineamento experimental consistiu na divisão dos participantes em dois grupos, o Grupo C foi composto de pacientes que receberam prednisona (1 mg/kg/dia), sulfato de magnésio intravenoso (4 g/dia) e carbogênio por máscara (95% O2+5% CO2) por 30 minutos durante quatro vezes ao dia e o Grupo S recebeu, além da intervenção do Grupo C, a Vitamina E (400 mg, duas vezes por dia). A taxa de recuperação, calculada como ganho de audição dividida pela diferença de nível de audição entre os afetados e ouvido afetado, foi maior do que 75% em 41 dos 66 (62,12%) pacientes incluídos no estudo. Essa taxa foi alcançada em 26 (78,78%) pacientes no Grupo S (tratados com a Vitamina E), comparados com 15 (45,45%) pacientes no Grupo de Controle (Grupo C). Verificou‐se melhoria dos pacientes tratados com a adição da Vitamina E; porém os autores recomendaram mais estudos para melhor compreensão do papel dos antioxidantes em surdez súbita.
Com o objetivo de verificar o efeito otoprotetor da Vitamina E sobre o efeito ototóxico da gentamicina, Kharkheli et al. (2007)28 distribuíram, aleatoriamente, 52 pacientes que estavam em uso da gentamicina para tratamento de infecção pulmonar aguda em dois diferentes grupos, o primeiro foi determinado como Grupo Experimental, que recebia a dosagem de 80 mg de gentamicina (três vezes ao dia) associada com 2.800 mg/dia de Vitamina E, dividida em três porções (1.200 mg; 800 mg; 800 mg), o segundo foi intitulado como Grupo Controle, também recebia 80 mg de gentamicina (três vezes ao dia) associada a placebo constituído de óleo de amendoim, gelatina, glicerina e sorbitol. O experimento foi feito durante sete dias e para fins de análise compararam‐se os dados obtidos pela audiometria tonal antes do início e após seis a oito semanas da conclusão da suplementação. Observou‐se elevação dos limiares auditivos em ambos os grupos, mas sem diferença estatisticamente significante, o que sugere que a Vitamina E não apresente efeito otoprotetor sobre o efeito ototóxico exercido pela gentamicina.
Esses dois estudos foram os únicos que apresentaram o “n” de participantes de cada grupo estudado (grupo controle e o grupo intervenção, foi escolhido aquele que continha a Vitamina E), bem como seus respectivos percentuais de melhoria. Apesar de ambos estudarem o efeito do mesmo antioxidante na perda auditiva sensorioneural, as causas dessa perda foram diferentes em cada um dos estudos. Enquanto no estudo de Joachims (2003)27 a perda auditiva sensorioneural foi de origem súbita e avaliada de maneira unilateral e sugeriu uma possível melhoria com a suplementação da Vitamina E, Kharkheli et al. (2007)28 estudaram a perda auditiva sensorioneural provocada pelo uso da gentamicina, um dos principais medicamentos ototóxicos usados para o tratamento de infecção pulmonar, e o uso da mesma vitamina não exerceu a função otoprotetora.
Considerando que foram encontrados poucos artigos que usaram suplementação com antioxidantes para avaliar a proteção e a melhoria auditiva e ainda que os trabalhos encontrados não se agrupem numa mesma categoria, em relação ao antioxidante avaliado e à causa da perda auditiva sensorioneural analisada, além do uso de amostras pequenas, identifica‐se uma fragilidade dos estudos encontrados, bem como desta metanálise, sinaliza a necessidade de outros estudos nessa temática.
Polanski & Cruz (2013)26 buscaram avaliar o efeito de agentes antioxidantes no limiar de audição de pacientes com presbiacusia. Para tanto, a amostra (n=120) foi dividida em quatro grupos que receberam os seguintes tratamentos: extrato seco de ginkgo biloba (120 mg/dia), ácido α‐lipoico (60 mg/dia) e Vitamina C (600 mg/dia), cloridrato de papaverina (100 mg/dia) e Vitamina E (400 mg/dia) ou placebo. Todos os participantes foram avaliados no recrutamento e depois de seis meses, por meio dos limiares da audiometria tonal (por médias e por frequências isoladas) e do Índice Percentual de Reconhecimento de Fala (IRPF). Como resultado, não houve alteração estatisticamente significante no limiar auditivo após os tratamentos testados, durante o período de estudo.
O estudo de Doosti et al. (2014)25 teve como objetivo verificar o efeito otoprotetor da N‐acetil‐cisteína (NAC) e do Ginseng em trabalhadores expostos a elevados índices de pressão sonora, ou seja, na Perda Auditiva Induzida por Ruído (PAIR).
Os autores separaram aleatoriamente 48 trabalhadores expostos a ruído contínuo em uma fábrica têxtil em três grupos: 1) Grupo Controle (n=16) correspondeu àqueles que não receberam drogas antioxidantes; 2) Grupo (n=16), que recebeu a N‐acetil‐cisteína (NAC) via oral (1200 mg/dia) e; 3) Grupo Ginseng (n=16), que recebeu o antioxidante por via oral (200 mg/dia). As audiometrias tonais e de alta frequência foram feitas no primeiro dia e após 15 dias da intervenção. Os resultados mostraram melhoria temporária dos limiares induzidos pelos ruídos para o Grupo NAC e para o Grupo Ginseng nas frequências de 4, 6 e 16 kHz (p <0,001) em ambas as orelhas. Além disso, os efeitos otoprotetores foram maiores no Grupo NAC. Assim, o estudo mostra que o NAC e o ginseng podem reduzir o impacto do ruído ocupacional ao qual os trabalhadores estão expostos e recomenda mais estudos para comprovar os benefícios dos antioxidantes em programas de conservação de audição.
Os trabalhos de Polanski & Cruz (2013)26 e Doosti et al. (2014)25 usaram como instrumento para avaliação da perda auditiva a audiometria e apesar de usarem antioxidantes diferentes, analisaram frequências audiométricas similares, como a de 4 e 6 kHz. Considerando os resultados na metanálise, verificou‐se que na frequência de 6 kHz não foi observada melhoria com o uso de antioxidantes, talvez devido ao tempo de exposição/uso do antioxidante para ocorrência disso. Contudo, não é possível afirmar, devido à técnica de avaliação usada, que não houve uma melhoria da função das células ciliadas nessa frequência. Para isso, seria necessário uma avaliação auditiva mais aprofundada, com análise das emissões otoacústicas produto de distorção.
Por outro lado, a metanálise mostrou que a frequência de 4 kHz apresentou resultados significativos com o uso antioxidantes, destacaram‐se a PAIR como causa da perda auditiva sensorioneural e o Ginseng como um dos antioxidantes responsáveis pelo efeito otoprotetor. Tais resultados se assemelham ao encontrado por Doosti et al. (2014),25 uma vez que o mesmo responde por 99,2% do peso na metanálise (figura 3).
A exposição a ruídos intensos ao longo do tempo ativa mecanismos, físicos, morfológicos e mecânicos, que podem provocar lesão na cóclea e causar perda auditiva.29,30 Além disso, mecanismos moleculares e metabólicos também podem ser responsáveis por esse tipo de lesão.31,32
Tais lesões podem ser temporárias ou permanentes.25 Os mecanismos da perda auditiva permanente por origem coclear são ocasionados pela morte de células ciliadas (internas e externas), neurônios aferentes primários ou ambos.33 Já o mecanismo exato da perda auditiva temporária não está claro.34 Estudos recentes indicam que a formação de espécies reativas de oxigênio (Eros) e o estresse oxidativo são as principais causas metabólicas da perda auditiva temporária.33,34
As Eros são moléculas caracterizadas por apresentar um elétron desemparelhado e naturalmente estão presentes no organismo ao participar do processo de homeostase e em importantes vias de sinalização. No entanto, como consequência do desbalanço do sistema antioxidante endógeno, as concentrações de EROS podem se elevar a níveis tóxicos e causar desde danos às membranas, ao citosol e às mitocôndrias até a morte celular.35,36
Especificamente, o excesso de radicais livres no epitélio sensorial coclear, nos neurônios ganglionares espirais e nas células da estria vascular da cóclea pode ter papel relevante no desenvolvimento de perda auditiva.36 O excesso de Eros é claramente o fator‐chave na patogênese de outras condições otológicas induzidas pelo estresse e pela idade e que também resultam em perdas auditivas pela exposição a ruídos intensos e pelo efeito das drogas ototóxicas.37,38
Sabe‐se que a NAC é um potente eliminador de radicais livres e um precursor de glutationa (GSH), um das principais enzimas antioxidantes, que pode neutralizar o ruído39 e aumenta a produção de GSH.40 Alguns estudos mostraram efeito positivo no uso de NAC na perda auditiva permanente.37,39 O estudo de Lin et al. (2010)41 mostrou que a administração oral de NAC de 1.200 mg/dia durante 14 dias reduziu a perda auditiva temporária ocasionada de ruído induzido nas frequências de 3, 4 e 6 kHz. O Ginseng apresenta importantes propriedades antioxidantes e antiapoptóticas e consequentemente pode desempenhar importante função na PAIR.40
O fato de o agente antioxidante ter retardado a pioria do limiar auditivo na frequência específica de 4 kHz pode ter sido determinado devido a esse grupo específico de células ser o mais ativado durante a exposição a ruídos intensos. Tal ativação acontece pela ação de três mecanismos principais: 1) Ressonância do conduto auditivo externo, que ocorre, em média, na frequência de 3,8 kHz e do pavilhão auditivo em torno de 5 kHz; 2) Transmissão energética não linear na orelha média, sobretudo na membrana timpânica, mais eficiente nas frequências de 1–5,5 kHz; 3) Reflexo acústico só atenua sons intensos que têm frequências abaixo de 2 kHz, é mais eficiente abaixo de 1 kHz;42 além da possibilidade de existirem outros mecanismos fisiológicos desconhecidos na cóclea e na via auditiva. Assim, uma maior ativação dessa região resultaria no aumento do metabolismo celular e consequentemente poderia ser mais bem beneficiada pelos antioxidantes presentes no Ginseng.
O uso do ginseng atenuou o estresse oxidativo induzido pelo peróxido de hidrogênio e a apoptose em células de neuroblastoma humano, porém apenas estudos em animais foram conduzidos para observar o efeito do ginseng na PAIR25,43 (Doosti et al., 2014b; Cheng et al., 2005). É sugestivo como efetivo na prevenção de danos auditivos em pacientes expostos a ruídos intensos, embora não haja ensaios clínicos randomizados para testar a intervenção do ginseng na PAIR25,44 (Choung et al., 2011; Doosti et al., 2014b).
Diante dos resultados encontrados, sugere‐se que os antioxidantes possam apresentar efeitos otoprotetores ao reduzir os efeitos danosos das espécies reativas de oxigênio na cóclea e, consequentemente, na perda auditiva sensorioneural.
ConclusãoO ginseng foi o antioxidante que evitou a pioria do limiar auditivo na frequência de 4 kHz, mas não em 6 kHz, em pacientes com perda auditiva sensorioneural causada por exposição a elevados níveis de pressão sonora. Não foi observada melhoria nos limiares com a suplementação com Vitamina E.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Souza ME, Costa KV, Vitorino PA, Bueno NB, Menezes PL. Effect of antioxidant supplementation on the auditory threshold in sensorineural hearing loss: a meta‐analysis. Braz J Otorhinolaryngol. 2018;84:368–80.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.