The electrophysiological responses obtained with the complex auditory brainstem response (cABR) provide objective measures of subcortical processing of speech and other complex stimuli. The cABR has also been used to verify the plasticity in the auditory pathway in the subcortical regions.
ObjectiveTo compare the results of cABR obtained in children using hearing aids before and after 9 months of adaptation, as well as to compare the results of these children with those obtained in children with normal hearing.
MethodsFourteen children with normal hearing (Control Group–CG) and 18 children with mild to moderate bilateral sensorineural hearing loss (Study Group–SG), aged 7–12 years, were evaluated. The children were submitted to pure tone and vocal audiometry, acoustic immittance measurements and ABR with speech stimulus, being submitted to the evaluations at three different moments: initial evaluation (M0), 3 months after the initial evaluation (M3) and 9 months after the evaluation (M9); at M0, the children assessed in the study group did not use hearing aids yet.
ResultsWhen comparing the CG and the SG, it was observed that the SG had a lower median for the V–A amplitude at M0 and M3, lower median for the latency of the component V at M9 and a higher median for the latency of component O at M3 and M9. A reduction in the latency of component A at M9 was observed in the SG.
ConclusionChildren with mild to moderate hearing loss showed speech stimulus processing deficits and the main impairment is related to the decoding of the transient portion of this stimulus spectrum. It was demonstrated that the use of hearing aids promoted neuronal plasticity of the Central Auditory Nervous System after an extended time of sensory stimulation.
As respostas eletrofisiológicas obtidas com o Potencial Evocado Auditivo de Tronco Encefálico complexo (Peate-c) fornecem medidas objetivas do processamento subcortical dos estímulos de fala e outros estímulos complexos. O Peate-c também vem sendo utilizado para verificar a plasticidade na via auditiva nas regiões subcorticais.
ObjetivoComparar os resultados do Peate-c obtidos em crianças usuárias de Aparelho de Amplificação Sonora Individual (AASI), antes e após 9 meses da adaptação, bem como comparar os resultados destas crianças com os obtidos em crianças com audição normal.
MétodoForam avaliadas 14 crianças com audição normal (Grupo Controle – GC) e 18 crianças com perda auditiva neurossensorial de grau leve a moderado bilateral (Grupo Estudo – GE), na faixa etária de 7 a 12 anos. As crianças foram submetidas às Audiometrias Tonal e Vocal, Medidas de Imitância Acústica e Peate com estímulo de fala, sendo submetidas às avalições em três momentos diferentes: avaliação inicial (M0), 3 meses após avaliação inicial (M3) e 9 meses após a avaliação inicial (M9), sendo que no M0 as crianças do grupo estudo ainda não faziam uso do AASI.
ResultadosNa comparação entre GC e GE, observou-se que o GE apresentou menor mediana para a amplitude V-A no M0 e no M3, menor mediana para a latência do componente V no M9 e, maior mediana para a latência do componente O no M3 e no M9. Observou-se no GE, redução na latência do componente A no M9.
ConclusãoCrianças com perda auditiva de grau leve a moderado apresentaram déficit no processamento do estímulo de fala sendo que o principal prejuízo está relacionado à decodificação da porção transitória do espectro deste estímulo. Evidenciou-se que o uso do AASI promoveu a plasticidade neuronal do Sistema Nervoso Auditivo Central após um tempo prolongado de estimulação sensorial.
O potencial evocado auditivo de tronco encefálico (Peate, em inglês, Auditory Brainstem Response – ABR) é muito usado na prática clínica para avaliar a integridade da via auditiva no tronco encefálico, bem como o limiar eletrofisiológico em crianças e bebês. Embora de grande importância na prática clínica, o Peate com os estímulos clique e tone burst fornecem poucas informações sobre o processamento auditivo para sons ambientais.1
A terminologia usada na literatura para se referir às respostas eletrofisiológicas captadas no tronco encefálico e eliciadas por estímulos sonoros complexos é variada, e, assim, encontram‐se Peate‐complexo (Peate‐c, em inglês, complex‐ABR ou cABR), Peate‐fala (speech‐evoked ABR) e, ainda, Peate‐música (music‐evoked ABR).
As respostas eletrofisiológicas obtidas com o Peate‐c fornecem medidas objetivas do processamento subcortical dos estímulos de fala e outros estímulos complexos.2,3 A geração dessas respostas envolve um circuito neural que interage com processos cognitivos e sofre influência do processamento top‐down.4
Assim, o Peate‐c corresponde à decodificação (ou codificação) neural dos estímulos sonoros complexos, tais como música, fala, sons ambientais, entre outros. Uma das características do Peate‐c é que as respostas eletrofisiológicas captadas são similares ao espectro do estímulo acústico complexo usado, reproduzem assim suas características espectrais e temporais.4
Diversos estímulos podem ser usados para investigar como as características temporais e espectrais sonoras estão preservadas no Peate, um dos mais estudados é o estímulo de fala, especialmente as respostas evocadas por sílabas (consoante–vogal).3
Visto que as características acústicas do estímulo de fala estão diretamente envolvidas nas respostas que surgirão no Peate‐c (ou Peate‐fala), alguns estudos usaram sílabas no formato consoante‐vogal (ex:/da/) com um tempo de duração de 40 ms e identificaram o surgimento de sete componentes (V, A, C, D, E, F e O), os quais representariam as características transientes (breve) e sustentadas do estímulo acústico.3,5–7 Os componentes V, A e C correspondem às características transientes do estímulo, enquanto que D, E e F à porção sustentada do estímulo (FFR – Frequency Following Response).3
Para alguns autores, a fala está representada no tronco encefálico da seguinte forma: os componentes V, A, C e O são gerados por mecanismos neurais que refletem as características transitórias associadas com aspectos do filtro de fala (exemplos: ponto e modo articulatório e modificação nos articuladores – informação fonética), enquanto os componentes D, E e F são gerados por mecanismos neurais que codificam a fonte da produção do estímulo, como a frequência fundamental (F0)8,9 e os harmônicos contidos entre a transição consoante–vogal.3
Os componentes V, A e C representam o início do vozeamento e o componente O, o seu fim. O complexo V–A surge pela plosão da consoante/d/(onset response),3 enquanto a resposta O representa o offset (fim do estímulo).9
De acordo com a literatura, o Peate‐c é usado em pesquisas com diversas populações: músicos,10,11 adultos com audição normal,5,12 crianças e adultos com alteração de processamento auditivo central,6,13 crianças com transtorno fonológico,14 gagueira,15 entre outras, visto que fornece dados objetivos do processamento auditivo de estímulos complexos. O Peate‐c também tem sido usado para verificar a plasticidade na via auditiva nas regiões subcorticais.10
O processamento da fala tem início na via auditiva periférica e ocorre em diversas estruturas da via auditiva central finalizada no córtex auditivo.16 Durante essa trajetória, as células ciliadas internas têm o papel de transdução do estímulo mecânico (estímulo sonoro) em elétrico, para que esse seja propagado pelo sistema nervo auditivo. Assim, as alterações do sistema auditivo periférico interferem na qualidade do sinal auditivo que será enviado para o SNAC e prejudicam, assim, a discriminação auditiva.17
O uso do Peate‐c em indivíduos usuários de aparelho de amplificação sonora individual (AASI) tem sido sugerido pela literatura, visto que esse procedimento reflete tanto os processos sensoriais quanto os cognitivos, pode, dessa forma, auxiliar na avaliação da função auditiva central, na adaptação do AASI, além de acompanhar a maturação/plasticidade da via auditiva após a adaptação do AASI.4,9
Visto que a privação de estímulos sensoriais, como na deficiência auditiva, prejudica o desenvolvimento normal e as conectividades necessárias para formar um sistema auditivo funcional,18 torna‐se importante avaliar a via auditiva central de crianças com perda auditiva.
Portanto, o objetivo do presente estudo foi comparar os resultados do Peate com estímulo de fala obtidos em crianças usuárias de AASI, antes e após nove meses da adaptação do AASI, além de comparar os resultados dessas crianças com os obtidos em crianças com audição normal.
MétodoEstudo prospectivo e longitudinal, aprovado pelo Comitê de Ética em Pesquisa, sob o parecer n° 266.512/2013. A pesquisa foi feita após orientação dos pais ou responsáveis e após a assinatura do Termo de Consentimento Livre e Esclarecido. Foi necessário, também, que a criança aceitasse participar da pesquisa, com explicação de todos os procedimentos por meio do Termo de Assentimento.
Participaram da pesquisa 32 crianças na faixa de sete a 12 anos (média de nove anos e oito meses [Grupo Controle] e nove anos e dois meses [Grupo Estudo]), de ambos os gêneros, sem comprometimento neurológico ou qualquer alteração que pudesse interferir nas medidas do Peate‐c, 14 com audição normal (limiares de audibilidade dentro da normalidade: ≤ 15 dBNA nas frequências de 250, 500, 1.000, 2.000, 4.000, 8.000 Hz) (Grupo Controle – GC) e 18 com perda auditiva neurossensorial de grau leve a moderado bilateral,19 sem experiência prévia com qualquer tipo de dispositivo de amplificação sonora (Grupo Estudo – GE).
As crianças foram submetidas a audiometrias tonal e vocal com o audiômetro marca Grason Stadler, modelo GSI 61, e fone supra‐aural modelo TDH 50; medidas de imitância acústica com o imitanciômetro Zodiac 901, marca Madsen; Peate‐c com um equipamento de dois canais, modelo universal Smart Box Jr.™ Smart EP da Marca Intelligent Hearing System, calibrado em nível de audição (dBnNA), com fone de inserção ER3A. O Peate‐c foi feito somente na orelha direita.
Para obtenção do Peate‐c, a criança permaneceu sentada em uma posição confortável, em uma sala acústica e eletricamente tratada. Foi feita a limpeza da pele com pasta abrasiva, os eletrodos foram fixados à pele por meio de pasta eletrolítica e fita adesiva (micropore). O eletrodo ativo (Fz) e o terra (Fpz) foram posicionados na fronte e o eletrodo de referência na mastoide direita (M2). O posicionamento dos eletrodos estava de acordo com a norma International Electrode System IES 10–20.20 Os valores de impedância dos eletrodos foram verificados e situavam‐se abaixo de 5 kOhms. Na obtenção do Peate‐c foi apresentado o estímulo de fala/da/, sintético, com duração de 40 ms a 80 dBnNA, em uma velocidade de apresentação de 11,1 estímulos por segundo, em um total de 3.000 estímulos (três varreduras de 1.000 estímulos), com polaridade alternada, filtro passa‐alto de 100 Hz e passa‐baixo de 3.000 Hz e com uma janela de gravação de 60 ms. As três varreduras de 1.000 estímulos foram somadas e, no traçado resultante, foram identificados e analisados os componentes V, A, C, D, E, F e O.
As crianças foram avaliadas em três momentos: GC – avaliação inicial (M0), após três (M3) e nove (M9) meses da avaliação inicial; GE – antes da adaptação do AASI (M0), após três (M3) e nove (M9) meses de uso do AASI. Cabe ressaltar que duas crianças do GE e uma do GC não compareceram às três avaliações.
Todas as avaliações foram feitas pelo mesmo avaliador nos três momentos e a análise dos componentes do Peate‐c foi feita pelo avaliador e por dois juízes, foi considerada a marcação de consenso. Nos casos em que não houve consenso entre os três juízes com relação às marcações, os traçados foram desconsiderados e excluídos da amostra.
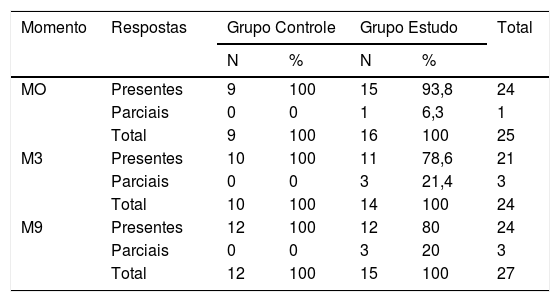
Além da tabulação dos valores de latência e amplitude dos componentes do Peate‐c em cada momento de avaliação, os resultados, para cada indivíduo, foram classificados em: presentes (presença de todos os componentes) e parciais (ausência de um ou mais componentes). Não foram observados indivíduos com ausência de todos os componentes nesta amostra (tabela 1).
Comparação entre a distribuição da ocorrência de respostas presentes e parciais em cada momento para os grupos Controle e Estudo
| Momento | Respostas | Grupo Controle | Grupo Estudo | Total | ||
|---|---|---|---|---|---|---|
| N | % | N | % | |||
| MO | Presentes | 9 | 100 | 15 | 93,8 | 24 |
| Parciais | 0 | 0 | 1 | 6,3 | 1 | |
| Total | 9 | 100 | 16 | 100 | 25 | |
| M3 | Presentes | 10 | 100 | 11 | 78,6 | 21 |
| Parciais | 0 | 0 | 3 | 21,4 | 3 | |
| Total | 10 | 100 | 14 | 100 | 24 | |
| M9 | Presentes | 12 | 100 | 12 | 80 | 24 |
| Parciais | 0 | 0 | 3 | 20 | 3 | |
| Total | 12 | 100 | 15 | 100 | 27 | |
N, tamanho da amostra.
Na análise estatística verificou‐se que a distribuição dos dados não respeitava a normalidade para todas as variáveis; assim, para a análise descritiva, foram usados mediana e intervalo interquartil. Para a análise inferencial foram usados testes não paramétricos. A Anova de Friedman comparou o desempenho dos indivíduos nos três momentos de avaliação (M0, M3 e M9); o teste de Mann‐Whitney comparou o desempenho entre os grupos. O nível de significância adotado foi de 5% e os resultados significantes foram marcados com asterisco (*).
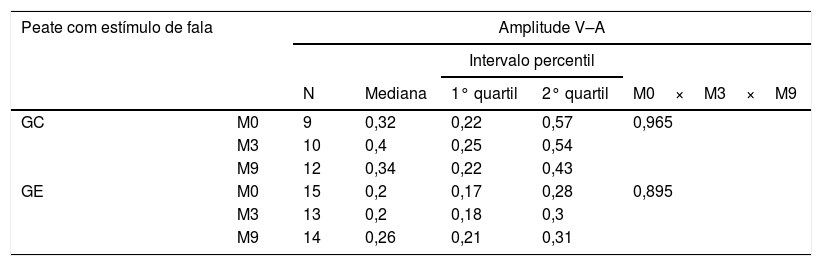
ResultadosNa tabela 2 verifica‐se que não ocorreram diferenças estatisticamente significantes para a amplitude V–A entre todos os momentos estudados (M0×M3×M9), tanto para o GE como para o GC.
Comparação da amplitude V–A do Peate com o estímulo de fala entre os momentos 0, 3, 9 meses, no Grupo Controle (GC) e no Grupo Estudo (GE)
| Peate com estímulo de fala | Amplitude V–A | |||||
|---|---|---|---|---|---|---|
| Intervalo percentil | ||||||
| N | Mediana | 1° quartil | 2° quartil | M0×M3×M9 | ||
| GC | M0 | 9 | 0,32 | 0,22 | 0,57 | 0,965 |
| M3 | 10 | 0,4 | 0,25 | 0,54 | ||
| M9 | 12 | 0,34 | 0,22 | 0,43 | ||
| GE | M0 | 15 | 0,2 | 0,17 | 0,28 | 0,895 |
| M3 | 13 | 0,2 | 0,18 | 0,3 | ||
| M9 | 14 | 0,26 | 0,21 | 0,31 | ||
N, tamanho da amostra.
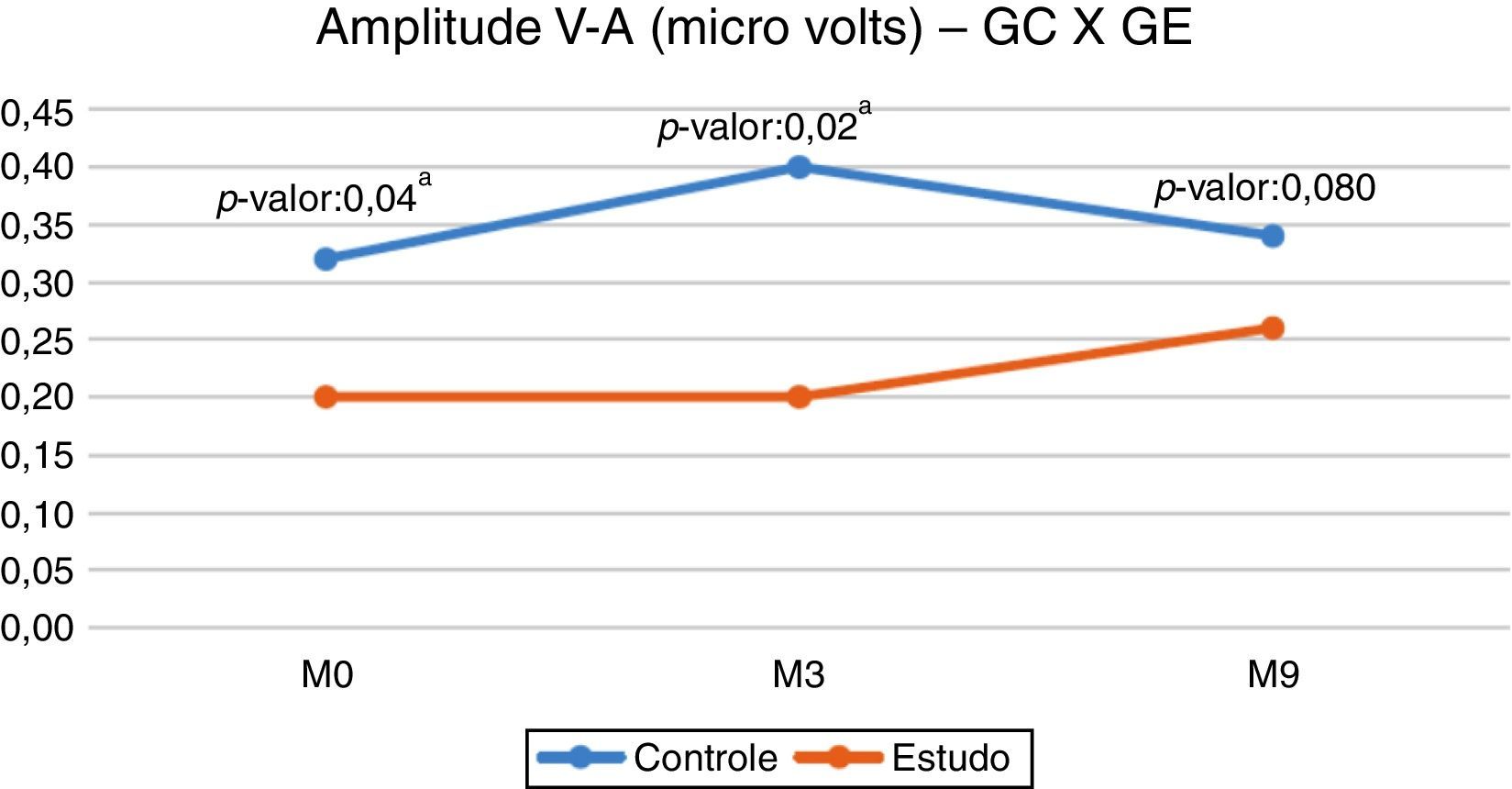
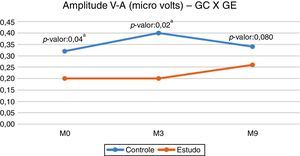
Na comparação entre o GC e o GE para a amplitude V–A, observou‐se diferença estatisticamente significante na avaliação inicial (M0) e na segunda avaliação (M3), o GC apresentou maior mediana (fig. 1).
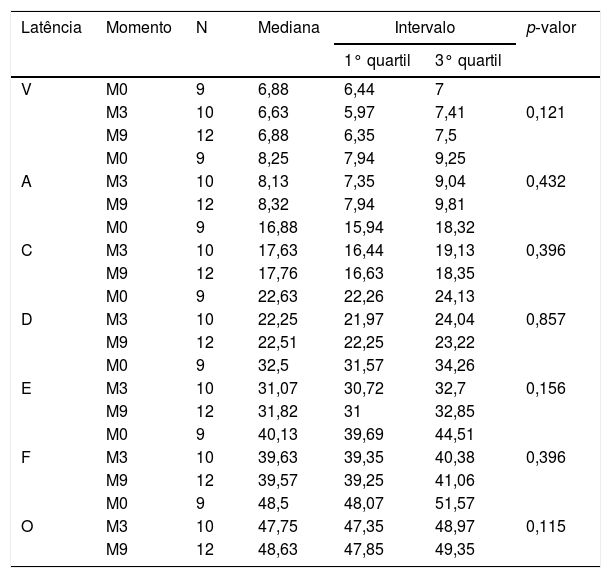
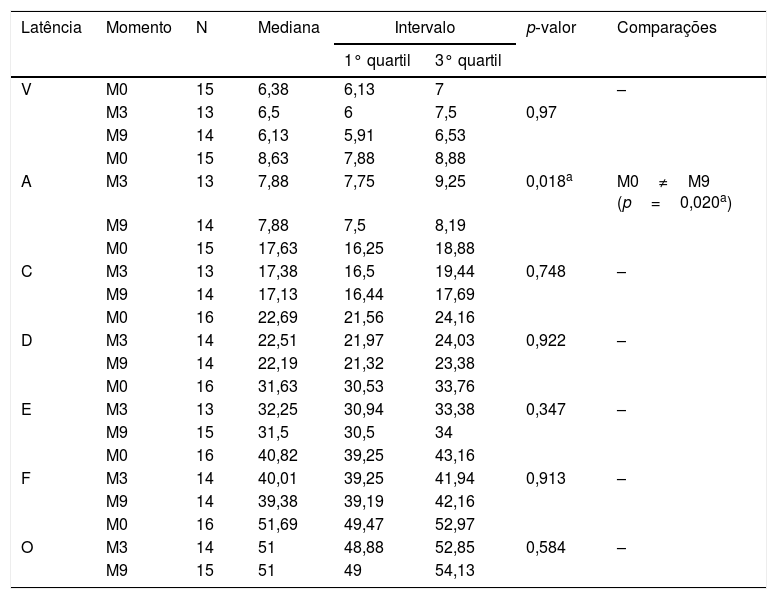
No que diz respeito ao GC, não foram observadas diferenças estatisticamente significantes na comparação das latências dos componentes do Peate com estímulo de fala entre os momentos estudados (tabela 3). No entanto, para o GE, verificou‐se diferença estatisticamente significante para a latência do componente A entre os momentos M0×M9, no M9 a latência apresentou‐se com valor reduzido (tabela 4).
Comparação das latências no Peate com o estímulo de fala no Grupo Controle
| Latência | Momento | N | Mediana | Intervalo | p‐valor | |
|---|---|---|---|---|---|---|
| 1° quartil | 3° quartil | |||||
| V | M0 | 9 | 6,88 | 6,44 | 7 | |
| M3 | 10 | 6,63 | 5,97 | 7,41 | 0,121 | |
| M9 | 12 | 6,88 | 6,35 | 7,5 | ||
| M0 | 9 | 8,25 | 7,94 | 9,25 | ||
| A | M3 | 10 | 8,13 | 7,35 | 9,04 | 0,432 |
| M9 | 12 | 8,32 | 7,94 | 9,81 | ||
| M0 | 9 | 16,88 | 15,94 | 18,32 | ||
| C | M3 | 10 | 17,63 | 16,44 | 19,13 | 0,396 |
| M9 | 12 | 17,76 | 16,63 | 18,35 | ||
| M0 | 9 | 22,63 | 22,26 | 24,13 | ||
| D | M3 | 10 | 22,25 | 21,97 | 24,04 | 0,857 |
| M9 | 12 | 22,51 | 22,25 | 23,22 | ||
| M0 | 9 | 32,5 | 31,57 | 34,26 | ||
| E | M3 | 10 | 31,07 | 30,72 | 32,7 | 0,156 |
| M9 | 12 | 31,82 | 31 | 32,85 | ||
| M0 | 9 | 40,13 | 39,69 | 44,51 | ||
| F | M3 | 10 | 39,63 | 39,35 | 40,38 | 0,396 |
| M9 | 12 | 39,57 | 39,25 | 41,06 | ||
| M0 | 9 | 48,5 | 48,07 | 51,57 | ||
| O | M3 | 10 | 47,75 | 47,35 | 48,97 | 0,115 |
| M9 | 12 | 48,63 | 47,85 | 49,35 | ||
N, tamanho da amostra.
Comparação das latências no Peate com o estímulo de fala no Grupo Estudo
| Latência | Momento | N | Mediana | Intervalo | p‐valor | Comparações | |
|---|---|---|---|---|---|---|---|
| 1° quartil | 3° quartil | ||||||
| V | M0 | 15 | 6,38 | 6,13 | 7 | – | |
| M3 | 13 | 6,5 | 6 | 7,5 | 0,97 | ||
| M9 | 14 | 6,13 | 5,91 | 6,53 | |||
| M0 | 15 | 8,63 | 7,88 | 8,88 | |||
| A | M3 | 13 | 7,88 | 7,75 | 9,25 | 0,018a | M0≠M9 (p=0,020a) |
| M9 | 14 | 7,88 | 7,5 | 8,19 | |||
| M0 | 15 | 17,63 | 16,25 | 18,88 | |||
| C | M3 | 13 | 17,38 | 16,5 | 19,44 | 0,748 | – |
| M9 | 14 | 17,13 | 16,44 | 17,69 | |||
| M0 | 16 | 22,69 | 21,56 | 24,16 | |||
| D | M3 | 14 | 22,51 | 21,97 | 24,03 | 0,922 | – |
| M9 | 14 | 22,19 | 21,32 | 23,38 | |||
| M0 | 16 | 31,63 | 30,53 | 33,76 | |||
| E | M3 | 13 | 32,25 | 30,94 | 33,38 | 0,347 | – |
| M9 | 15 | 31,5 | 30,5 | 34 | |||
| M0 | 16 | 40,82 | 39,25 | 43,16 | |||
| F | M3 | 14 | 40,01 | 39,25 | 41,94 | 0,913 | – |
| M9 | 14 | 39,38 | 39,19 | 42,16 | |||
| M0 | 16 | 51,69 | 49,47 | 52,97 | |||
| O | M3 | 14 | 51 | 48,88 | 52,85 | 0,584 | – |
| M9 | 15 | 51 | 49 | 54,13 | |||
N, tamanho da amostra.
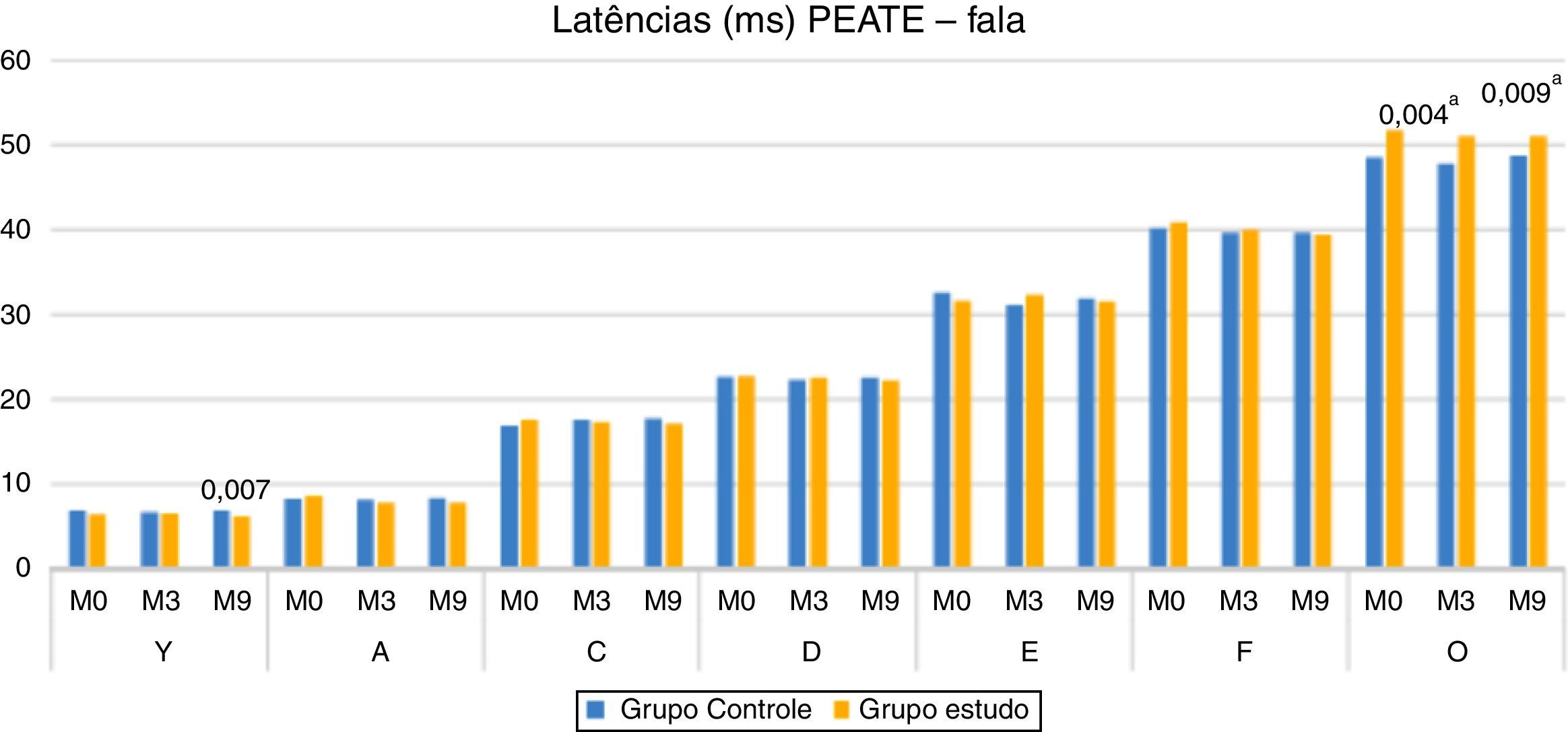
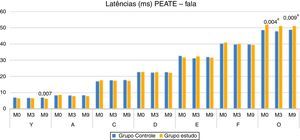
Na comparação das latências dos componentes do Peate com estímulo de fala entre o GC e o GE, verificou‐se diferença estatisticamente significante para o componente V no M9 (mediana maior no GC) e para o componente O tanto no M3 quanto no M9, o GE apresentou maior mediana (fig. 2).
DiscussãoO Peate‐c tem sido usado em pesquisas com diversas populações, pois fornece dados objetivos a respeito do processamento de estímulos relevantes na região subcortical do SNAC,3 além de ser uma ferramenta muito importante na verificação da plasticidade da via auditiva dessas estruturas.9,10
Na presente pesquisa, ao compararmos a amplitude V–A entre os diferentes momentos avaliados, verificamos que as medianas se mantiveram semelhantes em cada grupo, não houve diferença estatisticamente significante entre os momentos estudados (tabela 2). Cabe ressaltar que a amplitude V–A refere‐se ao onset burst, ou seja, a resposta eletrofisiológica correspondente à plosão da consoante/d/. Assim, os grupos mantiveram estabilidade no padrão de resposta neuronal durante os nove meses de acompanhamento.
No entanto, ao compararmos o GC e o GE, encontramos diferenças entre os momentos M0 e M3, o GE apresentou menores valores de amplitude (fig. 1). Esses resultados reforçam a ideia de que uma via auditiva íntegra e com funcionamento adequado (GC) apresenta uma quantidade maior de neurônios ativados pelo estímulo acústico. O resultado do presente estudo evidenciou que a privação da estimulação sensorial adequada, como na deficiência auditiva, pode prejudicar o desenvolvimento normal e as conectividades necessárias para formar um sistema auditivo funcional.18
Embora o GE tenha apresentado menor valor de amplitude V–A no M9, verificamos que não ocorreu diferença estatisticamente significante entre os grupos, demonstrou‐se assim que ocorreu uma modificação na via auditiva central das crianças do GE após nove meses de uso de AASI e evidenciou‐se que a resposta para o onset burst (fig. 1) aproximou‐se daquelas obtidas pelas crianças ouvintes (GC). Essa modificação ocorrida após o uso de AASI indica uma possível neuroplasticidade do sistema auditivo central após a estimulação auditiva, devido ao uso do AASI. Para Cramer et al. (2011),21 a neuroplasticidade é a capacidade do sistema nervoso de reorganizar suas estruturas, funções e conexões em resposta a estímulos intrínsecos e extrínsecos.
Com relação ao estudo das latências dos componentes do Peate‐c em cada grupo separadamente (tabelas 3 e 4), verificou‐se estabilidade na latência dos componentes do GC nos os três momentos avaliados (durante os nove meses de testagem). No entanto, houve diminuição significante do valor da latência do componente A no GE entre M0 e M9 (tabela 4). Ao verificar a latência dos demais componentes do Peate‐c no GE, observou‐se uma redução, porém, sem apresentar diferença estatística.
Tais achados indicam que o processo maturacional da via auditiva central de crianças na faixa de sete a 12 anos, em nove meses, não apresentou efeito sobre os resultados do Peate‐c no grupo de crianças com audição normal (GC). No entanto, a estimulação da via auditiva por meio do uso do AASI (GE), durante nove meses, parece ter favorecido uma mudança estrutural/funcional dos neurônios responsáveis pela transmissão e decodificação do estímulo de fala. Tal neuroplasticidade foi evidenciada principalmente pela redução no tempo de transmissão/decodificação nas estruturas responsáveis pela geração da onda A.
Embora não tenham usado Peate‐c, estudos com potencial evocado auditivo cortical em crianças com perda auditiva neurossensorial demonstraram melhoria nos valores de latência do componente P1,18,22 bem como melhoria significativa na morfologia do componente N223 pós‐estimulação acústica por meio do implante coclear.
Ao comparar os grupos, observou‐se que, no M9, as crianças do GE apresentaram latência menor do componente V do que as crianças do grupo controle (fig. 2). A modificação da amplitude V–A (M9), a redução da latência do componente A no GE (M9) e a menor latência do componente V no GE (M9) reforçam a ocorrência da plasticidade neuronal, visualizada na melhoria da resposta eletrofisiológica após nove meses de estimulação auditiva devido ao uso do AASI. Esses achados demonstram também que, além da importância do uso do AASI, o tempo de estimulação foi um fator decisivo, tendo em vista que as mudanças significativas ocorreram no M9.
O uso do AASI possivelmente promoveu maior estimulação auditiva e aumento de fibras neuronais responsivas e, assim, novas conexões neuronais das regiões subcorticais SNAC. As respostas eletrofisiológicas mostraram mudanças significativas a partir do nono mês de uso do AASI, evidenciou‐se que o processo de plasticidade neuronal foi dependente de um período maior de estimulação auditiva. Os achados do presente estudo demonstraram descompasso com os estudos que evidenciaram mudanças eletrofisiológicas a partir do primeiro mês de uso do dispositivo de amplificação sonoro individual.18,22 Uma das hipóteses para essa discrepância pode ser o fato de que os estudos citados avaliaram os potenciais evocados auditivos corticais, enquanto na presente pesquisa as respostas do Peate‐c refletem o processamento subcortical do estímulo de fala.2,3
Os resultados da presente pesquisa demonstraram ainda que o GE apresentou valores de latência maiores do componente O no M0, M3 e M9, estatisticamente significante no M3 e no M9. Esses resultados sugerem que, mesmo com a estimulação auditiva por meio do AASI, as crianças do GE apresentaram atraso na maturação da via auditiva central responsável pela geração do componente O (offset), ou seja, nas estruturas que decodificam o fim da sílaba (/da/). De acordo com a literatura, crianças que sofreram privação auditiva (perda auditiva profunda) por mais de sete anos não atingem a normalidade esperada para o componente P1, mesmo após anos de estimulação (implante coclear), o que evidencia atraso na maturação da via auditiva central.18
Cabe ressaltar que os resultados do presente estudo demonstraram resultados semelhantes entre os grupos para alguns componentes do Peate‐c (A, C, D, E e F). Uma das hipóteses para esses achados pode ser o grau da perda auditiva (leve a moderado) nos indivíduos deste estudo; assim, a privação sensorial não foi completa, o que levou a um menor comprometimento na decodificação do estímulo de fala. Além disso, sabe‐se que a perda auditiva interfere nas respostas eletrofisiológicas de maneira geral, reduz a amplitude e aumenta a latência dos componentes,24 entretanto não foram verificados esses padrões de respostas para os componentes supracitados, embora o grupo estudo tenha sido avaliado com fone de inserção (sem o uso da AASI).
Verificou‐se que os componentes que apresentaram piores resultados no GE (amplitude V–A e latência O) são gerados por mecanismos neurais que refletem as características transitórias do espectro do estímulo de fala e estão associadas com aspectos do filtro de fala (ex: ponto e modo articulatório e modificação nos articuladores – informação fonética).8,9 Tais resultados sugerem que crianças com perda auditiva neurossensorial de grau leve a moderado apresentam comprometimento em regiões sensoriais auditivas responsáveis pela decodificação da informação fonética.
Os resultados do presente estudo foram similares aos encontrados por Johnsons et al. (2007),25 que avaliaram o Peate‐c em crianças com alterações de aprendizagem. De acordo com os autores, essas crianças apresentaram atraso de latência dos componentes A, C (inícioda vocalização) e O (fimda vocalização), quando comparadas com aquelas em desenvolvimento típico. Isso sugere que crianças com alterações de aprendizagem apresentam uma resolução temporal pobre.25
A resolução temporal é a habilidade de o sistema auditivo detectar pequenas mudanças (amplitude e conteúdo espectral) no estímulo sonoro ao longo do tempo 26 e é uma importante habilidade para a discriminação da fala. A percepção do tamanho do intervalo de silêncio entre a plosão e a vogal de uma sílaba (Voice Onset Time – VOT) está diretamente vinculada à discriminação entre dois fonemas (ex:/ba/e/pa/).27 Assim, alterações no processamento de sinais acústicos transitórios rápidos (onset) levam a uma habilidade pobre de distinção de fonemas.28
Em um estudo com indivíduos com perda auditiva neurossensorial de grau leve a moderado, observou‐se que essa população apresenta um desempenho significativamente pobre na resolução temporal.29 Assim, os resultados encontrados na presente pesquisa podem sugerir que crianças com perda auditiva neurossensorial de grau leve a moderado apresentam comprometimento na resolução temporal, visto que as alterações se concentraram no início da plosão (onset) e no fim da vocalização (offset) que correspondem às características transientes do estímulo de fala.
Na presente pesquisa, o Peate‐c demonstrou ser uma ferramenta importante no acompanhamento da evolução do processamento auditivo e da plasticidade do sistema auditivo após estimulação com AASI. Pesquisas com esse potencial podem trazer importantes contribuições para a prática clínica, especialmente no que se refere ao uso desses marcadores biológicos na avaliação da efetividade e dos benefícios do uso do AASI ao longo do processo de reabilitação auditiva.
ConclusãoCrianças com perda auditiva de grau leve a moderado apresentaram prejuízo no processamento do estímulo de fala mensurado pelo Peate‐c, quando comparadas com crianças com audição dentro da normalidade. O principal prejuízo está relacionado à decodificação da porção transitória do espectro do estímulo de fala (componentes V–A e O) e pode ter como origem uma resolução temporal alterada.
Além disso, evidenciou‐se que o uso do AASI promoveu a plasticidade neuronal do SNAC, levou a mudanças estruturais e temporais das respostas obtidas em indivíduos com perda auditiva, após um tempo prolongado de estimulação sensorial.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) pelo financiamento do pós‐doutorado, processo: 2012/18633‐7.
Como citar este artigo: Leite RA, Magliaro FC, Raimundo JC, Gândara M, Garbi S, Bento RF, et al. Effect of hearing aids use on speech stimulus decoding through speech‐evoked ABR. Braz J Otorhinolaryngol. 2018;84:66–73.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.