Otomycosis, an infection of the ear canal by fungi, is prevalent in hot and humid weather. Nevertheless, there is not sufficient evidence for the effectiveness of different topical antifungal treatments. Tolnaftate, is a topical antifungal agent described to be effective in the treatment of otomycosis. Currently there are not sufficient studies that prove its efficacy.
ObjectivesTo compare the efficacy of clotrimazole and tolnaftate administration in the treatment of otomycosis.
Material and methodsA controlled, randomized and open clinical trial included patients diagnosed with fungal external otitis who were treated with topical antifungals, randomized into two treatment groups: (1) clotrimazole cream; (2) tolnaftate solution. They were microscopically evaluated at one and two weeks of treatment to determine resolution of disease. Recurrence and complications were recorded. Demographic and clinical variables were collected and analyzed. Follow‐up and final outcomes (absence of infection) were compared between groups.
ResultsForty eight patients were included, 28 in the clotrimazole group and 20 in the tolnaftate group. Spring was the weather most commonly associated with otomycosis, while otic manipulation was the risk factor more common in both groups. Predominant symptoms were itching and otic fullness. Aspergillus niger organism was isolated most frequently. Treatment with clotrimazole resulted in 75% resolution vs 45% resolution with treatment with tolnaftate at one week of treatment (p=0.007). The Tolnaftate treatment group demonstrated higher recurrence rates and treatment failures, 20% and 15% respectively.
ConclusionsClotrimazole cream treatment is more effective than tolnaftate for uncomplicated otomycosis. More studies are needed to corroborate our results.
Otomicose, uma infecção fúngica do canal auditivo externo, é prevalente em climas quentes e úmidos. No entanto, a literatura não apresenta evidências suficientes sobre os diferentes tratamentos antifúngicos tópicos. O tolnaftato é um antifúngico tópico descrito como eficaz no tratamento da otomicose; entretanto, sua eficácia não está suficientemente comprovada.
ObjetivoComparar a eficácia do uso de clotrimazol e tolnaftato no tratamento da otomicose.
Material e métodoEnsaio clínico controlado e randomizado; incluiu pacientes diagnosticados com otite externa fúngica tratados com antifúngicos tópicos, randomizados em dois grupos de tratamento: 1) clotrimazole (creme); 2) solução de tolnaftato. Eles foram avaliados microscopicamente uma e duas semanas após o início do tratamento para avaliar a resolução da doença. Recorrência e intercorrências foram registradas; além disso, as variáveis demográficas e clínicas foram coletadas e analisadas. Os dados do acompanhamento e desfechos finais (ausência de infecção) foram comparados entre os grupos.
ResultadosO estudo incluiu 48 pacientes, 28 dos quais foram alocados ao grupo clotrimazole e 20 ao grupo tolnaftato. A primavera foi a estação mais comum; a manipulação foi o fator de risco mais comum em ambos os grupos. Os sintomas mais comuns foram coceira e plenitude auricular. Aspergillus niger foi o micro‐organismo mais comumente isolado. Após uma semana, o tratamento com clotrimazol apresentou uma taxa de resolução de 75% vs. 45% com o tratamento com tolnaftato (p=0,007). O tratamento com tolnaftato apresentou maiores taxas de recidiva e falhas: 20% e 15%, respectivamente.
ConclusõesEm casos de otomicose não complicada, o uso de clotrimazol (creme) é mais eficaz do que o de tolnaftato. Mais estudos são necessários para corroborar os presentes resultados.
Otomicose é um termo usado para descrever infecções do epitélio do canal auditivo externo (CAE) causadas por leveduras e fungos filamentosos;1,2 tais infecções representam 9% das otites externas. Os fungos são normalmente encontrados na orelha externa como colonizadores, uma vez que essa superfície apresenta os requisitos necessários para o seu crescimento: proteínas, carboidratos, umidade, temperatura e pH adequados.3 Os fatores predisponentes incluem climas tropicais e úmidos, uso de antibióticos ou esteroides em longo prazo, sistema imunológico deficiente, falta de higiene, ambiente de trabalho com exposição à poeira, corpos estranhos no CAE, limpeza do CAE com cotonetes, fatores genéticos, dermatite seborreica e presença de cerume; todos esses fatores favorecem a germinação dos esporos e conídios dos fungos prevalentes.2,4–8Aspergillus (60% a 90%), geralmente A. niger, e Candida (10% a 40%) são os patógenos mais comumente observados.2–5,7,8
O desbridamento cuidadoso do CAE é essencial para facilitar a eliminação do organismo infeccioso e permitir que os medicamentos tópicos alcancem o tecido‐alvo. Na maioria dos casos, o tratamento tópico é curativo, embora as taxas de recorrência sejam altas.5 Muitos agentes com diferentes propriedades antifúngicas têm sido usados, apresentam taxas de sucesso variáveis; não há consenso sobre qual agente é mais eficaz. Este estudo teve como objetivo comparar a eficácia da administração de medicamentos antifúngicos tópicos (clotrimazol creme vs. solução de tolnaftato) no tratamento da otite externa fúngica.
MétodoEntre março de 2016 e julho de 2017, foi feito um ensaio clínico controlado, randomizado e aberto no departamento de otorrinolaringologia e cirurgia de cabeça e pescoço de um centro hospitalar secundário. Pacientes com diagnóstico clínico de otomicose (visualização compatível com restos fúngicos ao exame microscópico) foram randomizados a um dos dois grupos de tratamento, usou‐se uma tabela de randomização gerada por computador. Dados demográficos e clínicos foram coletados. Além disso, duas amostras do CAE afetado foram coletadas de cada paciente, com auxílio de uma cureta e/ou ponta de aspiração; em seguida, as amostras foram colocadas em meio de transporte estéril para exame microscópico direto e cultura, a fim de identificar os patógenos fúngicos. Para o exame direto, foi feito um esfregaço em lâmina com solução salina, coberto com lamínula e visualizado sob microscopia óptica com magnificação de 10 × e 40 ×. Para a cultura, a amostra foi implantada em ágar Saboraud dextrose e incubada a 27°‐30°C por um período mínimo de sete dias. Todos os pacientes foram submetidos a limpeza e desbridamento do CAE. Nos pacientes do grupo clotrimazole, o fármaco foi aplicado e deixado no CAE por sete dias; após esse período, o resíduo do creme foi removido e a condição local foi reavaliada. Os pacientes do grupo 2 foram instruídos a aplicar solução de tolnaftato (duas gotas a cada 12 horas por sete dias); após esse período, a condição local foi reavaliada. O resultado clínico final consistia em um paciente assintomático, com CAE limpo e seco, confirmado através de exame microscópico. Em ambos os grupos, caso a infecção persistisse, o CAE era limpo novamente e um segundo tratamento com o mesmo medicamento era administrado. Nos pacientes que apresentaram infecção após dois ciclos de tratamento, esse foi modificado para o fármaco usado no outro grupo. Todos os pacientes receberam a recomendação de manter as orelhas secas e evitar os fatores predisponentes identificados. O grau de melhoria foi avaliado pela comparação dos sintomas e achados do exame físico semanal e aquele feito uma semana após a resolução da doença infecciosa para avaliar a resolução ou recorrência. Considerando‐se que vários estudos observaram que os fármacos do grupo imidazol são eficazes no tratamento da otomicose, o clotrimazol foi usado como padrão de tratamento.
O estudo foi submetido à avaliação e aprovação pelo Comitê de Ética deste hospital (n°. 0149) e todos os pacientes assinaram o termo de consentimento livre e esclarecido. O estudo seguiu os preceitos estabelecidos pela Declaração de Helsinque da Associação Médica Mundial.
Os dados coletados foram inseridos em um banco de dados no SPSS. Variáveis demográficas e características basais foram analisadas por medidas de tendência central e dispersão de dados. O teste qui‐quadrado foi usado para analisar variáveis categóricas, enquanto variáveis contínuas foram avaliadas pelo teste t de Student. Valores‐p < 0,05 foram considerados significantes. A intenção de tratar foi avaliada; os casos de perda no acompanhamento foram considerados casos de falha, desde que uma visita de acompanhamento tivesse sido feita.
Para encontrar equivalência entre os medicamentos, calculou‐se uma amostra de 25 pacientes, com um poder de 90%. A diferença de efeito entre os medicamentos foi estimada entre ‐0,05 a 0,15 e assumiu‐se uma diferença sobre clotrimazol de 0,5; o teste Z foi usado e adotou‐se uma significância de 0,05.
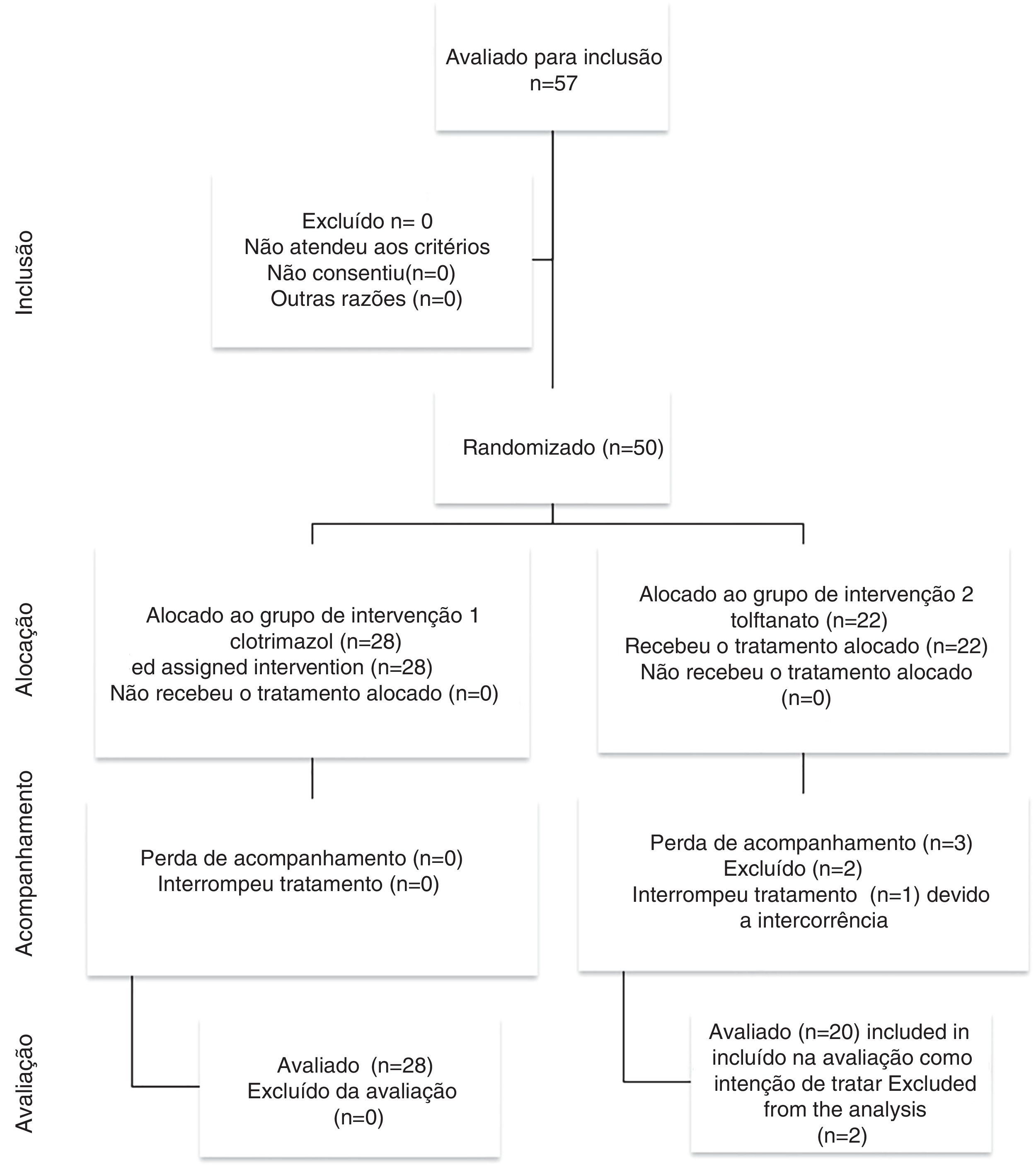
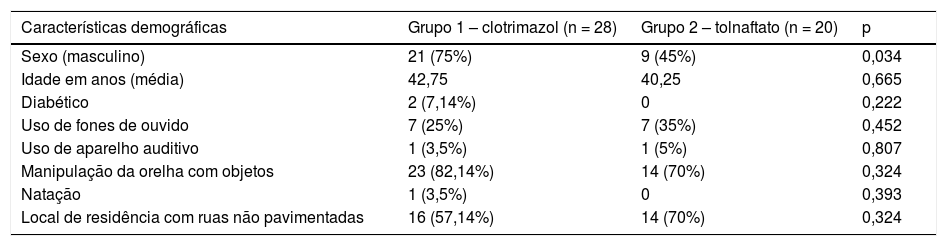
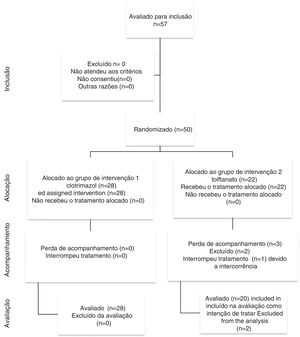
ResultadosA figura 1 apresenta o fluxograma do presente estudo. Dos 48 pacientes estudados, 28 pacientes foram selecionados aleatoriamente para ser incluídos no grupo 1 (clotrimazol) e 20 no grupo 2 (tolnaftato) de acordo com o software de randomização. A tabela 1 apresenta as características demográficas e os fatores de risco encontrados em cada grupo. Dos 48 pacientes, 30 (62,5%) eram do sexo masculino e 18 (37,5%) do sexo feminino, com relação homem/mulher de 1,6:1. A idade variou de 12 a 77 anos, com uma média de 41,70 ± 17,44. A faixa etária mais acometida foi a de 50 a 59 anos, representou 20,83% (n = 10) de todos os pacientes. O grupo clotrimazole tinha mais pacientes do sexo masculino do que o grupo de tolnaftate (p = 0,034).
Características demográficas iniciais e fatores de risco nos grupos clotrimazol e tolnaftato
| Características demográficas | Grupo 1 – clotrimazol (n = 28) | Grupo 2 – tolnaftato (n = 20) | p |
|---|---|---|---|
| Sexo (masculino) | 21 (75%) | 9 (45%) | 0,034 |
| Idade em anos (média) | 42,75 | 40,25 | 0,665 |
| Diabético | 2 (7,14%) | 0 | 0,222 |
| Uso de fones de ouvido | 7 (25%) | 7 (35%) | 0,452 |
| Uso de aparelho auditivo | 1 (3,5%) | 1 (5%) | 0,807 |
| Manipulação da orelha com objetos | 23 (82,14%) | 14 (70%) | 0,324 |
| Natação | 1 (3,5%) | 0 | 0,393 |
| Local de residência com ruas não pavimentadas | 16 (57,14%) | 14 (70%) | 0,324 |
Dois pacientes foram excluídos do estudo. Um devido a uma intercorrência na primeira semana de tratamento e evidência de uma infecção bacteriana. O outro não compareceu à primeira consulta de acompanhamento.
As principais ocupações dos pacientes foram donas de casa (18,75%, n = 9) e estudantes (18,75%, n = 9), o que não foi significante entre os grupos de tratamento (p = 0,892). Em ambos os grupos de tratamento, a maioria dos pacientes (91,6%, n = 44) relatou morar na cidade. De maneira geral, a primavera foi a estação com a maior taxa de infecção, com 43,75% (n = 21) dos casos, seguida pelo inverno, com 27,08% (n = 13).
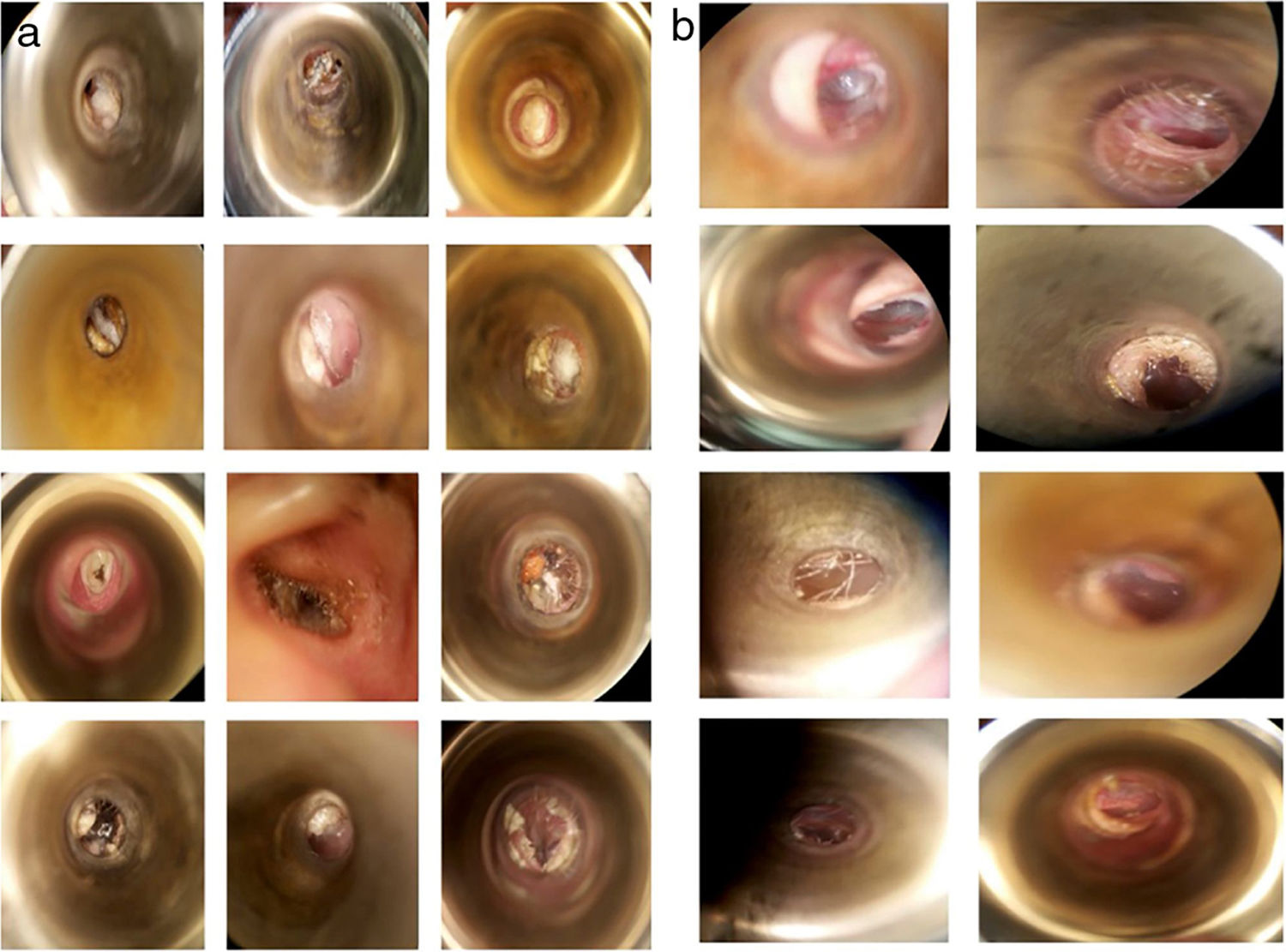
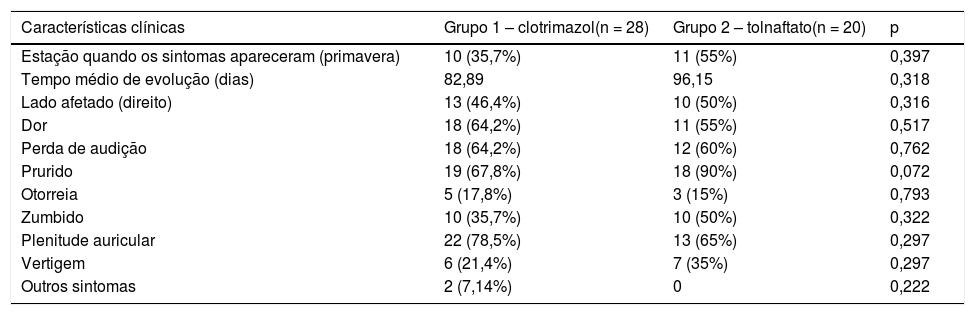
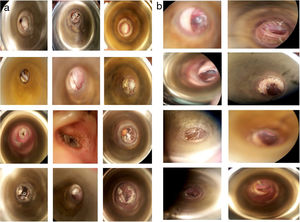
Os sintomas mais frequentes foram prurido (77,08%, n = 37), plenitude auricular (72,91%, n = 35) e perda auditiva (62,5%, n = 30). Não foram observadas diferenças significantes entre os grupos quanto à distribuição dos sintomas iniciais (tabela 2). Os achados do exame físico do CAE (fig. 2A) evidenciaram obstrução por material ceruminoso, hifas brancas (85,4% n = 41), negras (10%, n = 5) e amarelas (2%, n = 1), além de descamação abundante (2%, n = 1).
Características clínicas nos grupos clotrimazol e tolnaftato
| Características clínicas | Grupo 1 – clotrimazol(n = 28) | Grupo 2 – tolnaftato(n = 20) | p |
|---|---|---|---|
| Estação quando os sintomas apareceram (primavera) | 10 (35,7%) | 11 (55%) | 0,397 |
| Tempo médio de evolução (dias) | 82,89 | 96,15 | 0,318 |
| Lado afetado (direito) | 13 (46,4%) | 10 (50%) | 0,316 |
| Dor | 18 (64,2%) | 11 (55%) | 0,517 |
| Perda de audição | 18 (64,2%) | 12 (60%) | 0,762 |
| Prurido | 19 (67,8%) | 18 (90%) | 0,072 |
| Otorreia | 5 (17,8%) | 3 (15%) | 0,793 |
| Zumbido | 10 (35,7%) | 10 (50%) | 0,322 |
| Plenitude auricular | 22 (78,5%) | 13 (65%) | 0,297 |
| Vertigem | 6 (21,4%) | 7 (35%) | 0,297 |
| Outros sintomas | 2 (7,14%) | 0 | 0,222 |
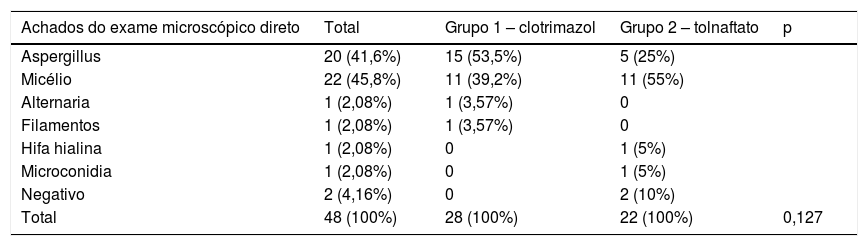
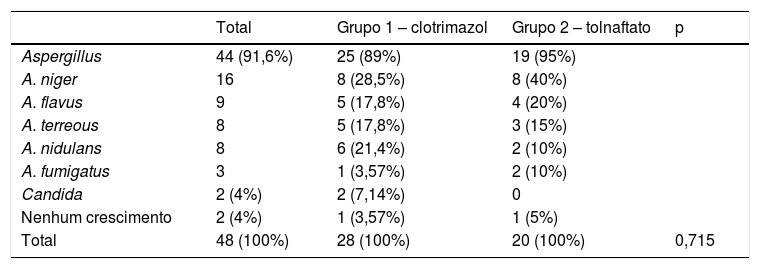
O exame micológico do exame direto das amostras foi positivo em 95,8% (n = 46) dos casos, evidenciou que 45,8% (n = 22) dos pacientes apresentavam estruturas fúngicas miceliais e 41,6% (n = 20) dos pacientes apresentavam características de Aspergillus. Esses dados são apresentados na tabela 3. No estudo microscópico das culturas, o gênero mais encontrado foi o Aspergillus (91,6%, n = 44; tabela 4).
Achados do exame microscópico direto no grupo clotrimazol, grupo tolnaftato e total
| Achados do exame microscópico direto | Total | Grupo 1 – clotrimazol | Grupo 2 – tolnaftato | p |
|---|---|---|---|---|
| Aspergillus | 20 (41,6%) | 15 (53,5%) | 5 (25%) | |
| Micélio | 22 (45,8%) | 11 (39,2%) | 11 (55%) | |
| Alternaria | 1 (2,08%) | 1 (3,57%) | 0 | |
| Filamentos | 1 (2,08%) | 1 (3,57%) | 0 | |
| Hifa hialina | 1 (2,08%) | 0 | 1 (5%) | |
| Microconidia | 1 (2,08%) | 0 | 1 (5%) | |
| Negativo | 2 (4,16%) | 0 | 2 (10%) | |
| Total | 48 (100%) | 28 (100%) | 22 (100%) | 0,127 |
Organismos isolados em culturas no grupo clotrimazol, grupo tolnaftato e total
| Total | Grupo 1 – clotrimazol | Grupo 2 – tolnaftato | p | |
|---|---|---|---|---|
| Aspergillus | 44 (91,6%) | 25 (89%) | 19 (95%) | |
| A. niger | 16 | 8 (28,5%) | 8 (40%) | |
| A. flavus | 9 | 5 (17,8%) | 4 (20%) | |
| A. terreous | 8 | 5 (17,8%) | 3 (15%) | |
| A. nidulans | 8 | 6 (21,4%) | 2 (10%) | |
| A. fumigatus | 3 | 1 (3,57%) | 2 (10%) | |
| Candida | 2 (4%) | 2 (7,14%) | 0 | |
| Nenhum crescimento | 2 (4%) | 1 (3,57%) | 1 (5%) | |
| Total | 48 (100%) | 28 (100%) | 20 (100%) | 0,715 |
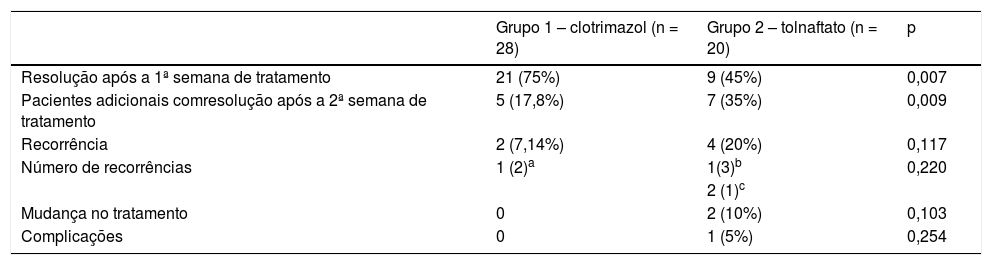
Quanto aos resultados do tratamento (tabela 5), após uma semana de tratamento, as infecções dos pacientes tratados com clotrimazol foram completamente resolvidas em 75% dos casos (n = 21), enquanto no grupo tolnaftato elas só foram resolvidas em 45% dos casos (n = 9). Em ambos os grupos, a resolução da infecção após a primeira e segunda semanas de tratamento apresentou uma diferença estatisticamente significante, com valores‐p de 0,007 e 0,009, respectivamente.
Comparação dos resultados do tratamento nos grupos clotrimazol ou tolnaftato
| Grupo 1 – clotrimazol (n = 28) | Grupo 2 – tolnaftato (n = 20) | p | |
|---|---|---|---|
| Resolução após a 1ª semana de tratamento | 21 (75%) | 9 (45%) | 0,007 |
| Pacientes adicionais comresolução após a 2ª semana de tratamento | 5 (17,8%) | 7 (35%) | 0,009 |
| Recorrência | 2 (7,14%) | 4 (20%) | 0,117 |
| Número de recorrências | 1 (2)a | 1(3)b | 0,220 |
| 2 (1)c | |||
| Mudança no tratamento | 0 | 2 (10%) | 0,103 |
| Complicações | 0 | 1 (5%) | 0,254 |
O grupo 2 apresentou uma taxa de falha do tratamento de 15% (n = 3); em 5% (n = 1) dos pacientes, a infecção não foi resolvida na primeira semana de tratamento e apresentou intercorrências (perfuração timpânica e supercrescimento bacteriano). No entanto, apesar do acompanhamento inadequado (n = 3), 20 pacientes do grupo 2 foram incluídos na análise sob o princípio da intenção de tratar.
Nos pacientes que continuaram a apresentar manifestações clínicas após a primeira semana de tratamento, o sintoma mais prevalente foi o prurido (41,66%, n = 20; tabela 5). A resolução foi avaliada de acordo com o desaparecimento dos sintomas e a apresentação do CAE, sem hifas ou sinais clínicos de infecção ao microscópio (fig. 2B).
DiscussãoAs opções de tratamento para otomicoses são múltiplas e algumas, como o tolnaftato, ainda não foram claramente comprovadas na literatura. Por outro lado, alguns estudos têm relatado que azóis são muito eficazes no tratamento da otomicose. No presente estudo, os autores compararam a eficácia do tolnaftato vs. clotrimazol em um ensaio clínico controlado.
Quanto à epidemiologia dessa doença, a prevalência de otomicose está intimamente relacionada à área geográfica; o México tem um clima quente e subúmido e apresenta ótimas condições climatológicas para o crescimento de fungos patogênicos. A maioria dos estudos sobre a etiologia da otomicose foi feita em áreas de alto calor, umidade e poeira.4,9–17 A prevalência por gênero varia com relação aos diferentes estudos; no presente estudo, os homens foram os mais afetados (62,5%), com uma relação semelhante à relatada por Viswanatha;18 essa diferença foi estatisticamente significante (p = 0,034). Quanto às faixas etárias, no presente estudo os pacientes na faixa dos 50 anos foram mais afetados, um resultado similar ao do estudo de Viswanatha.18
A alta prevalência de otomicose no verão foi relatada por vários autores;19–21 no entanto, no presente estudo, a maior incidência ocorreu na primavera em ambos os grupos, sem significância estatística.
A otomicose é relatada principalmente como unilateral em pacientes imunocompetentes,22; entretanto, Prasad8 observou que 5% dos casos são bilaterais, um achado similar ao do presente estudo (6%). Os sinais e sintomas mais frequentes relatados na literatura são: prurido, otalgia, otorreia, plenitude auricular, hipoacusia e zumbido.2,6,8,20,23,24 Todos esses sintomas foram observados nos pacientes do presente estudo, sem diferenças estatisticamente significantes entre os grupos.
O diagnóstico de otomicose é geralmente baseado em achados clínicos; no entanto, no presente estudo o diagnóstico também foi confirmado por achados laboratoriais micológicos. No exame direto, 100% das amostras do grupo 1 e 90% das amostras do grupo 2 apresentaram estruturas fúngicas. Os resultados da cultura variam muito: Hueso‐Gutiérrez 25 observou apenas 22,6% de culturas positivas, enquanto outros estudos alcançaram resultados próximos a 79%; no presente estudo, a cultura confirmou o diagnóstico em 96% dos casos. Vários estudos relatam que os gêneros mais frequentemente isolados são Aspergillus e Candida, as espécies mais comuns são A. niger e C. albicans.2,8,9,14,16,22,26 Araiza27 observou que A. flavus era o patógeno mais comum na Cidade do México. No presente estudo, o gênero mais frequentemente identificado foi Aspergillus, 89,2% no grupo 1 e 95% no grupo 2; em ambos os grupos, a espécie mais comum foi A. niger, condizente com o relatado em outros estudos em regiões quentes e úmidas.
O tratamento da otomicose é difícil devido às altas taxas de recorrência.6 Ho2 relatou ausência de resposta ao tratamento em até 13% dos casos; a taxa de recorrência varia de 5% a 15%.28,29
As recomendações de tratamento são o controle de fatores predisponentes, o desbridamento local e o uso de antifúngicos; no presente estudo, esse protocolo foi seguido desde o primeiro dia de avaliação. Durante a primeira semana de tratamento, foram avaliadas as características subjetivas, o prurido foi o sintoma mais frequentemente descrito em ambos os grupos, semelhante ao relatado na literatura.
Em relação aos antifúngicos, no estudo Malik, o grupo imidazol mostrou uma taxa de resolução de 80% na aplicação inicial com escassa probabilidade de recorrência.12 Por outro lado, Jackman classificou o clotrimazol como o tratamento mais popular e eficaz30 e outros autores relataram taxas de eficácia de 50% a 100%.3,14,16,29 Esses achados coincidem com os resultados do presente estudo, no qual 82,14% dos casos tratados com clotrimazol foram completamente resolvidos após uma semana de tratamento. No nosso estudo, apenas 7,14% dos pacientes tratados com clotrimazol apresentaram recorrência; nesses casos, a infecção foi resolvida com mais uma semana de tratamento, sem necessidade de alteração do fármaco. Além disso, a aplicação do clotrimazol foi mais fácil e menos dispendiosa para o paciente, pois foi feita no consultório médico com acompanhamento semanal.
O tolnaftato tem sido recomendado para casos refratários;14 entretanto, os presentes resultados mostraram que apenas 45% dos casos se resolveram após uma semana de tratamento, 20% apresentaram recorrência, 10% necessitaram alteração para clotrimazol, que resolveu a infecção, e 5% dos casos apresentaram intercorrências; no entanto, recorrências, alterações no tratamento ou intercorrências não foram estatisticamente significantes, provavelmente devido à pequena amostra deste estudo.
Além disso, observou‐se diferença significante entre os dois grupos de tratamento na resolução da otomicose após a primeira e segunda semanas de tratamento. O tratamento com tolnaftato também exigiu maior capacidade de adesão do paciente, pois era aplicado em casa a cada 12 horas por 7 dias. O creme é provavelmente mais eficaz do que as gotas, uma vez que cobre toda a extensão do CAE e permanece em contato com essa superfície por mais tempo.
As limitações desses estudos foram principalmente a falta de cegamento do tratamento, tanto para os pacientes quanto para os médicos. A dificuldade de cegar reside nas diferentes apresentações, já que em um grupo a medicação em creme era aplicada no consultório, enquanto no outro grupo a medicação, em gotas, era aplicada topicamente em casa. Esse último tratamento exige maior capacidade de adesão do paciente, que foi avaliada nas visitas de acompanhamento. Considerando‐se o reduzido tamanho da amostra, mais estudos são necessários para corroborar os presentes resultados.
Por outro lado, os destaques do presente estudo foram a comparação de duas opções de tratamento para otomicose pouco descritas na literatura e um planejamento cuidadoso de um estudo controlado randomizado.
ConclusãoDe acordo com os resultados do presente estudo, conclui‐se que a aplicação semanal de clotrimazol é recomendada em pacientes com otomicoses sem complicações. Em casos de otomicose não complicada, o uso de clotrimazol (creme) é mais eficaz do que o de tolnaftato.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao CIDOCS UAS; a Ivonne Carolina Leon Leyva, Sergio Verdiales Lugo, Nidia Karina Bermudez Tirado, Isaura Beatriz Zazueta López, José Maria Alarid e Lucero Escobar Aispuro.
Como citar este artigo: Jimenez‐Garcia L, Celis‐Aguilar E, Díaz‐Pavón G, Muñoz Estrada V, Castro‐Urquizo Á, Hernández‐Castillo N, et al. Efficacy of topical clotrimazole vs. topical tolnaftate in the treatment of otomycosis. A randomized controlled clinical trial. Braz J Otorhinolaryngol. 2020;86:300–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.