Metanálises tradicionais sobre a precisão diagnóstica de lesões orais têm sido conduzidas, mas são inerentemente limitadas a comparações pareadas diretas entre um único método e uma única opção, enquanto múltiplas opções de diagnóstico e suas classificações ainda não foram metodologicamente possíveis.
ObjetivoAvaliar os valores diagnósticos de vários métodos em pacientes com doença oral potencialmente maligna e fazer uma metanálise de rede.
MétodoDois autores pesquisaram independentemente os bancos de dados (Medline, Scopus, Cochrane Register of Controlled Trials e Google Scholar) até junho de 2020 para estudos que comparassem a precisão diagnóstica de várias ferramentas (autofluorescência, quimioluminescência, citologia, imagem de banda estreita e cloreto de tolônio) com exame visual ou outras ferramentas. Os resultados de interesse para esta análise foram sensibilidade, especificidade, valor preditivo negativo, valor preditivo e precisão. Tanto uma metanálise pareada padrão quanto uma metanálise de rede foram conduzidas.
ResultadosRedes de tratamento compostas por seis intervenções foram definidas para a metanálise de rede. Os resultados da metanálise tradicional mostraram que, entre seis métodos, a imagem de banda estreita apresentou maior sensibilidade, especificidade, valor preditivo negativo, valor preditivo e precisão em comparação ao exame visual. Os resultados da metanálise de rede mostraram que a autofluorescência, a quimioluminescência e a imagem de banda estreita obtiveram maior sensibilidade em comparação com o exame visual e que a quimioluminescência e a imagem de banda estreita apresentaram maior valor preditivo negativo em comparação com o exame visual. Entretanto, a autofluorescência e a quimioluminescência mostraram especificidade inferior em comparação com o exame visual. Não houve diferenças significativas no valor preditivo e na precisão entre as seis intervenções.
ConclusãoEste estudo demonstrou que a imagem de banda estreita demonstra superioridade em termos de sensibilidade e valor preditivo negativo em comparação com os outros cinco agentes testados.
Apesar do notável desenvolvimento das técnicas cirúrgicas e terapias adjuvantes para o carcinoma espinocelular oral, o prognóstico dos pacientes permanece ruim, sem mudanças significativas na taxa de sobrevida de 5 anos há décadas.1 Portanto, a importância da detecção precoce antes que o câncer progrida tem sido cada vez mais enfatizada. As lesões orais potencialmente malignas (LOPMs) têm consistentemente apresentado evidências de um estágio pré‐canceroso.2 Portanto, a detecção precoce de LOPMs desempenha um papel importante na melhoria do prognóstico. Entretanto, isso depende somente da capacidade do médico de distinguir essas lesões de condições benignas. A LOPM pode ser assintomática e assumir uma aparência clínica benigna, pode ser difícil distingui‐la de condições reativas ou inflamatórias da mucosa oral.3 Como a análise histopatológica da amostra de biópsia é o padrão‐ouro para o diagnóstico da malignidade oral, sua dependência da experiência clínica do médico para diferenciar lesões cancerosas de lesões benignas permanece uma questão importante.4 Portanto, várias técnicas, como coloração vital, detecção baseada em luz, técnicas de diagnóstico óptico e citologia oral, têm sido usadas para compensar a baixa confiabilidade clínica; essas técnicas têm como objetivo facilitar o diagnóstico precoce do câncer oral.3
As metanálises tradicionais sobre a precisão diagnóstica adjuntiva de lesões orais têm sido feitas, mas são inerentemente limitadas a comparações pareadas diretas entre um método único e uma única opção, enquanto opções diagnósticas múltiplas e sua classificação não foram ainda metodologicamente possíveis. Em contraste, uma metanálise de rede (NMA, do inglês Network Meta‐Analysis) pode ser usada para comparar várias opções de tratamento simultaneamente, pois combina todas as evidências diretas e indiretas de estudos relacionados. Além disso, a NMA fornece uma classificação das opções avaliadas de tratamento, permite que os médicos escolham a abordagem mais eficaz conforme determinado estatisticamente.5 Nesta revisão, apresentamos os resultados de nossa NMA sobre a eficácia de seis ferramentas diagnósticas adjuvantes usadas para lesões orais. Os dados baseados em evidências podem simplificar a tomada de decisão clínica para o diagnóstico de pacientes com LOPMs ou lesões cancerosas.
MétodoConsiderações éticasEste estudo de revisão não fez tratamento de participantes humanos. Portanto, nosso comitê de ética istitucional dispensou a necessidade do consentimento informado para esta revisão sistemática e metanálise.
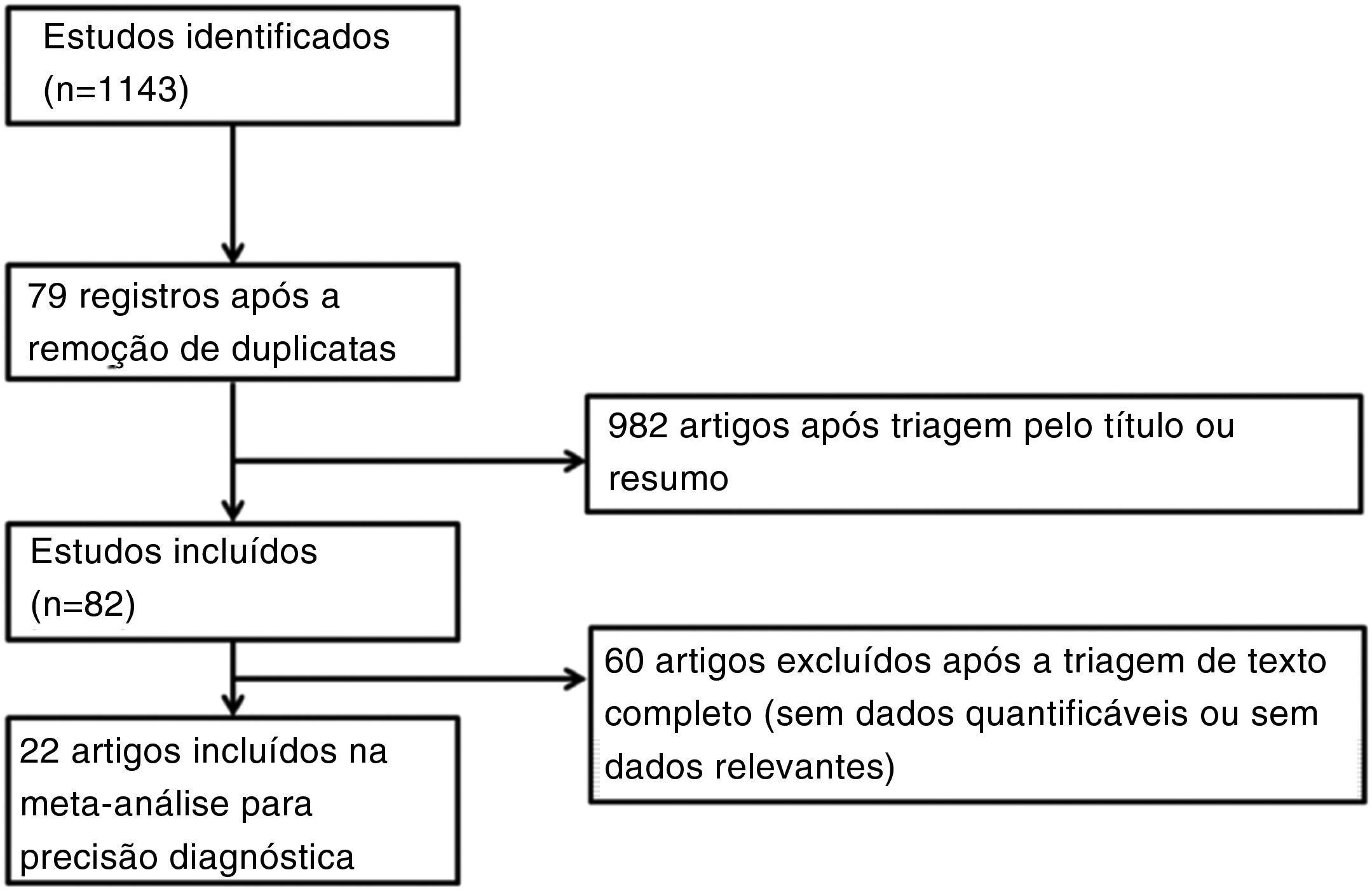
Estratégia de busca e seleção de estudosA estratégia de busca foi criada e revisada por um bibliotecário clínico, um especialista em informação com 10 anos de experiência. A pesquisa nas bases de dados, que incluiu Medline, Scopus, Cochrane Register of Controlled Trials e Google Scholar, foi feita em junho de 2020. Também verificamos as listas de referência dos estudos incluídos e as revisões sistemáticas existentes para identificar artigos relevantes. As estratégias usadas são mostradas nas tabelas suplementares 1 a 3 e os diagramas do processo de seleção do estudo são mostrados na figura 1. Estudos sobrepostos ou irrelevantes foram excluídos por dois revisores independentes, a triagem de títulos e resumos e a reavaliação de textos completos de artigos potencialmente elegíveis também foi concluída. Qualquer discrepância na seleção da literatura foi resolvida por consenso ou pelo terceiro autor.
Os critérios de inclusão foram: 1) uso de ferramentas diagnósticas adjuvantes não invasivas [autofluorescência, quimioluminescência, citologia, imagem de banda estreita (NBI, do inglês Narrow Band Imaging) e cloreto de tolônio]; 2) protocolo de estudo prospectivo ou retrospectivo; 3) comparação de ferramentas diagnósticas adjuvantes não invasivas com outras ferramentas ou exame visual; e 4) análises de sensibilidade e especificidade. Os critérios de exclusão foram: 1) formato de relato de caso; 2) formato de artigo de revisão; 3) diagnóstico de outros tumores (câncer de laringe ou tumores de cavidade nasal); e 4) falta de dados diagnósticos. Dados ausentes ou incompletos nos estudos incluídos foram obtidos diretamente dos autores. Esta NMA é baseada nos Preferred Reporting Items of Systematic Reviews and Meta‐analyses para NMA.
Extração de dados e avaliação de risco de viésA extração de dados foi feita a partir dos estudos incluídos, usou formulários padronizados por dois autores de forma independente. Os desfechos avaliados consistiram em sensibilidade, especificidade, valor preditivo negativo, valor preditivo positivo e precisão.2,6–33 A precisão foi calculada como (verdadeiros positivos+verdadeiros negativos)/(verdadeiros positivos+verdadeiros negativos+falsos negativos+falsos positivos).34 Os resultados foram comparados em relação às outras estratégias diagnósticas e ao exame visual. De todos os estudos, foram coletados dados relativos ao número de pacientes, os valores verdadeiros‐positivos, verdadeiros‐negativos, falsos‐positivos e falsos‐negativos. A qualidade do estudo foi analisada com a ferramenta Quality Assessment of Diagnostic Accuracy Studies (ver. 2; QUADAS‐2).
Análise estatísticaA metanálise foi feita com o pacote R 3.5.0 “netmeta” (R Foundation for Statistical Computing, Viena, Áustria). Uma NMA de efeitos aleatórios foi feita dentro de uma estrutura frequentista34 para alcançar resultados combinados na forma de odds ratio e intervalo de confiança de 95% (IC95%) para uso em todos os estudos, com o objetivo de avaliar sensibilidade, especificidade, valor preditivo negativo (VPN), valor preditivo positivo (VPP) e precisão.35 Em todos os outros casos, os resultados da análise de incidência foram avaliados através de odds ratio. Para classificar as opções de tratamento graficamente, o modelo Surface Under the Cumulative Ranking Curve (Sucra) e as médias das classificações foram adotadas. A Sucra representa a probabilidade de um tratamento com a melhor classificação.36 Neste estudo, a Sucra variou de 0 a 1, o 1 indicava que a opção de tratamento era estatisticamente a melhor e 0, a pior. As comparações diretas e indiretas foram adequadamente homogêneas. Uma abordagem de loop específica foi usada para distinguir a heterogeneidade em todos os loops triangulares ou quadrados no modelo NMA.37 A discrepância entre as evidências diretas e indiretas com o IC95% foi usada para distinguir a heterogeneidade em todos os loops. A heterogeneidade foi definida como a diferença entre as evidências diretas e indiretas com um IC95% que excluiu 0. O modelo de node‐splitting foi usado para distinguir a heterogeneidade entre as evidências diretas e indiretas.38 Além disso, foram construídos gráficos de funil ajustados por comparação para avaliar o potencial viés de publicação.39
ResultadosA revisão da literatura resultou em 24 estudos com 1.914 participantes. A tabela 1 mostra o resumo das características do estudo e avaliação do viés.
Resumo dos estudos incluídos na metanálise da rede
| Estudo | Ano | Nacionalidade | Padrão de diagnóstico de malignidade ou altamente suspeito | Idade | Número | Sexo | Tipo | Lesão | Modalidade diagnóstica |
|---|---|---|---|---|---|---|---|---|---|
| Allegra | 2009 | Itália | Carcinoma invasivo ou 100% displasia | 59 (42–82) | 32 | 19/13 | Pros | 45 | T vs. V |
| Amirchaghmaghi | 2018 | Irã | Carcinoma invasivo ou 100% displasia | 52,3±14,8 | 45 | 21/24 | T | 54 | A vs. V |
| Awan | 2015 | Paquistão | Carcinoma invasivo ou 100% dysplasia | NR | 116 | 65/51 | Pros | 116 | A vs. Q vs. T |
| Chaudhry | 2016 | Índia | Carcinoma invasivo ou 100% displasia | 45 | 100 | 74/26 | Retro | 100 | Q vs. T |
| Guneri | 2011 | Turquia | Carcinoma invasivo ou 100% displasia | NR | 35 | NR | Pros | 43 | T vs. A vs. cy |
| Hanken | 2013 | Alemanha | Carcinoma invasivo ou 100% displasia | 41–76 | 60 | 25/35 | Pros | 60 | A vs. V |
| Jayaprakash | 2009 | EUA | Carcinoma invasivo ou 100% displasia | 59.8 (12.5) | 60 | 41/19 | Pros | 249 | V vs A |
| Kammerer | 2015 | Alemanha | Carcinoma invasivo ou 100% displasia (de moderado) | 60.4 | 44 | 25/19 | Pros | 50 | T vs. Q vs. V |
| Mehrotra | 2010 | Índia | Carcinoma invasivo ou 100% displasia | 41 | 156 | 140/16 | T | 156 | A vs. Q |
| Mojsa | 2012 | Polônia | Carcinoma invasivo ou 100% displasia | NR | 30 | NR | Pros | 41 | T vs. V |
| Petruzzi | 2014 | Itália | Carcinoma invasivo ou 100% displasia | 56.7 | 49 | 22/27 | Pros | 56 | A vs. T |
| Piazza | 2016 | Itália | Displasia (leve‐moderada), Ca in situ, Câncer | NR | 128 | NR | Pros | 128 | N vs. V |
| Piazza | 2010 | Itália | Displasia (leve‐moderada), Ca in situ, Câncer | 61.79 (35–86) | 96 | 58/38 | Pros | 96 | N vs. V |
| Rahman | 2012 | Índia | Carcinoma invasivo ou 100% displasia | 43 (26–60) | 86 | 68/18 | Pros | 86 | T vs. ci |
| Rajmohan | 2012 | Índia | Carcinoma invasivo ou 100% displasia | NR | 30 | NR | Pros | 30 | Q vs. T |
| Ram | 2005 | Malásia | Carcinoma invasivo ou 100% displasia | 35–80 (56.75) | 31 | NR | Pros | 31 | Q vs. T |
| Rana | 2012 | Alemanha | Carcinoma invasivo ou 100% displasia | 62.5±10.81 | 123 | 46/77 | T | 123 | A vs. V |
| Roblyer | 2010 | EUA | Carcinoma invasivo ou 100% displasia | NR | 72 | NR | Pros | 175 | Q vs. V |
| Sharma | 2011 | Índia | Carcinoma invasivo ou 100% displasia | 44.34±10.78 | 50 | 35/15 | Pros | 50 | Q vs. TS vs. ci |
| Shukla | 2018 | Índia | Carcinoma invasivo ou 100% displasia | 21–60 | 42 | 37/5 | Pros | 42 | Q vs. T |
| Simonato | 2017 | Brasil | Carcinoma invasivo ou 100% displasia | 52.13 | 15 | 11/4 | Pros | 15 | A vs. V |
| Simonato | 2019 | Brasil | Carcinoma invasivo ou 100% displasia | NR | NR | NR | Pros | 61 | A vs. V |
| Ujaoney | 2012 | Índia | Carcinoma invasivo ou 100% displasia | 44.4 (15) | 55 | 51/4 | Pros | 99 | Q vs. T |
| Vashisht | 2014 | Índia | Carcinoma invasivo ou 100% displasia | NR | 35 | NR | Pros | 35 | Q vs. T |
Pros, Prospectivo; Retro, Retrospectivo; T, transversal; NR, Não relatado; V, Exame Visual; A, Autofluorescência; Q, Quimioluminescência; ci, citologia; N, Imagem de banda estreita; T, Cloreto de tolônio; VP, Verdadeiro positivo; FP, Falso positivo; FN, Falso negativo; VN, Verdadeiro negativo.
A tabela 2 apresenta a metanálise tradicional de diferentes ferramentas diagnósticas adjuvantes sobre a sensibilidade, especificidade, valor preditivo negativo, valor preditivo positivo e precisão.
Metanálise tradicional de diferentes ferramentas diagnósticas em relação à sensibilidade, especificidade, valor preditivo negativo, valor preditivo positivo e precisão
| Métodos diagnósticos | Sensibilidade | Especificidade | Valores preditivos negativos | Valores preditivospositivos | Precisão |
|---|---|---|---|---|---|
| Autofluorescência (9 estudos) | 0,8556 [0,7435; 0,9237 | 0,4882 [0,2871; 0,6933] | 0,8655 [0,7219; 0,9411], | 0,4933 [0,2699; 0,7194] | 0,6638 [0,5143; 0,7864]) |
| Quimioluminescência (11 estudos) | 0,8750 [0,7586; 0,9397] | 0,5680 [0,2940; 0,8059] | 0,8338 [0,6994; 0,9154] | 0,6639 [0,3854; 0,8615] | 0,7452 [0,5981; 0,8518] |
| Citologia (3 estudos) | 0,7212 [0,4517; 0,8904] | 0,8623 [0,7269; 0,9364] | 0,8491 [0,6478; 0,9451]] | 0,7509 [0,5296; 0,8898] | 0,8187 [0,6232; 0,9250] |
| Imagem de banda estreita (2 estudos) | 0,9035 [0,8341; 0,9458] | 0,9480 [0,7571; 0,9907] | 0,9350 [0,6152; 0,9923] | 0,9364 [0,8725; 0,9694] | 0,9422 [0,8062; 0,9846] |
| Cloreto de tolônio (14 estudos) | 0,7142 [0,6069; 0,8018] | 0,8115 [0,6792; 0,8974] | 0,7078 [0,5299; 0,8389] | 0,8114 [0,7099; 0,8832] | 0,7585 [0,6641; 0,8330] |
| Exame Visual (11 estudos) | 0,7608 [0,6253; 0,8584] | 0,7952 [0,5930; 0,9119] | 0,8014 [0,6378; 0,9024] | 0,7671 [0,6140; 0,8722] | 0,8030 [0,7360; 0,8563] |
Os resultados de autofluorescência mostraram sensibilidade: 0,8556 [0,7435; 0,9237], especificidade: 0,4882 [0,2871; 0,6933], VPN: 0,8655 [0,7219; 0,9411], VPP: 0,4933 [0,2699; 0,7194]; e precisão: 0,6638 [0,5143; 0,7864]). De maneira geral, a autofluorescência mostrou alta sensibilidade e VPN e baixa especificidade, VPP e precisão. A quimioluminescência mostrou sensibilidade: 0,8750 [0,7586; 0,9397]; especificidade: 0,5680 [0,2940; 0,8059]; VPN: 0,8338 [0,6994; 0,9154]; e VPP: 0,6639 [0,3854; 0,8615]; e precisão: 0,7452 [0,5981; 0,8518]]. Em resumo, a quimioluminescência mostrou poder diagnóstico adjuvante semelhante à autofluorescência. Os resultados do cloreto de tolônio mostraram sensibilidade: 0,7142 [0,6069; 0,8018]; especificidade: 0,8115 [0,6792; 0,8974]; VPN: 0,7078 [0,5299; 0,8389]; VPP: 0,8114 [0,7099; 0,8832]; e precisão: 0,7585 [0,66441; 0,8330]. O exame visual mostrou sensibilidade: 0,7608 [0,6253; 0,8584]; especificidade: 0,7952 [0,5930; 0,9119]; VPN: 0,8014 [0,6378; 0,9024]; VPP: 0,7671 [0,6140; 0,8722]; e precisão: 0,8030 [0,7360; 0,8563]. Portanto, o cloreto de tolônio e o exame visual mostraram poder diagnóstico adjuvante moderado semelhante.
Os resultados da citologia mostraram sensibilidade: 0,7212 [0,4517; 0,8904]; especificidade: 0,8623 [0,7269; 0,9364]; VPN: 0,8491 [0,6478; 0,9451]; VPP: 0,7509 [0,5296; 0,8898]; e precisão: 0,8187 [0,6232; 0,9250]. Portanto, a citologia mostrou alta especificidade e VPN. A NBI mostrou sensibilidade: 0,9035 [0,8341; 0,9458]; especificidade: 0,9480 [0,7571; 0,9907]; VPN: 0,9350 [0,6152; 0,9923]; VPP: 0,9364 [0,8725; 0,9694]; e precisão: 0,9422 [0,8062; 0,9846]. Como resultado, a NBI apresentou valores elevados em todos os parâmetros diagnósticos adjuvantes. Entretanto, esses dois métodos incluíram poucos estudos (dois a três) em termos de precisão diagnóstica adjuvante, sugeriram que nossos resultados devem ser interpretados com cautela e mais estudos com mais pacientes são necessários.
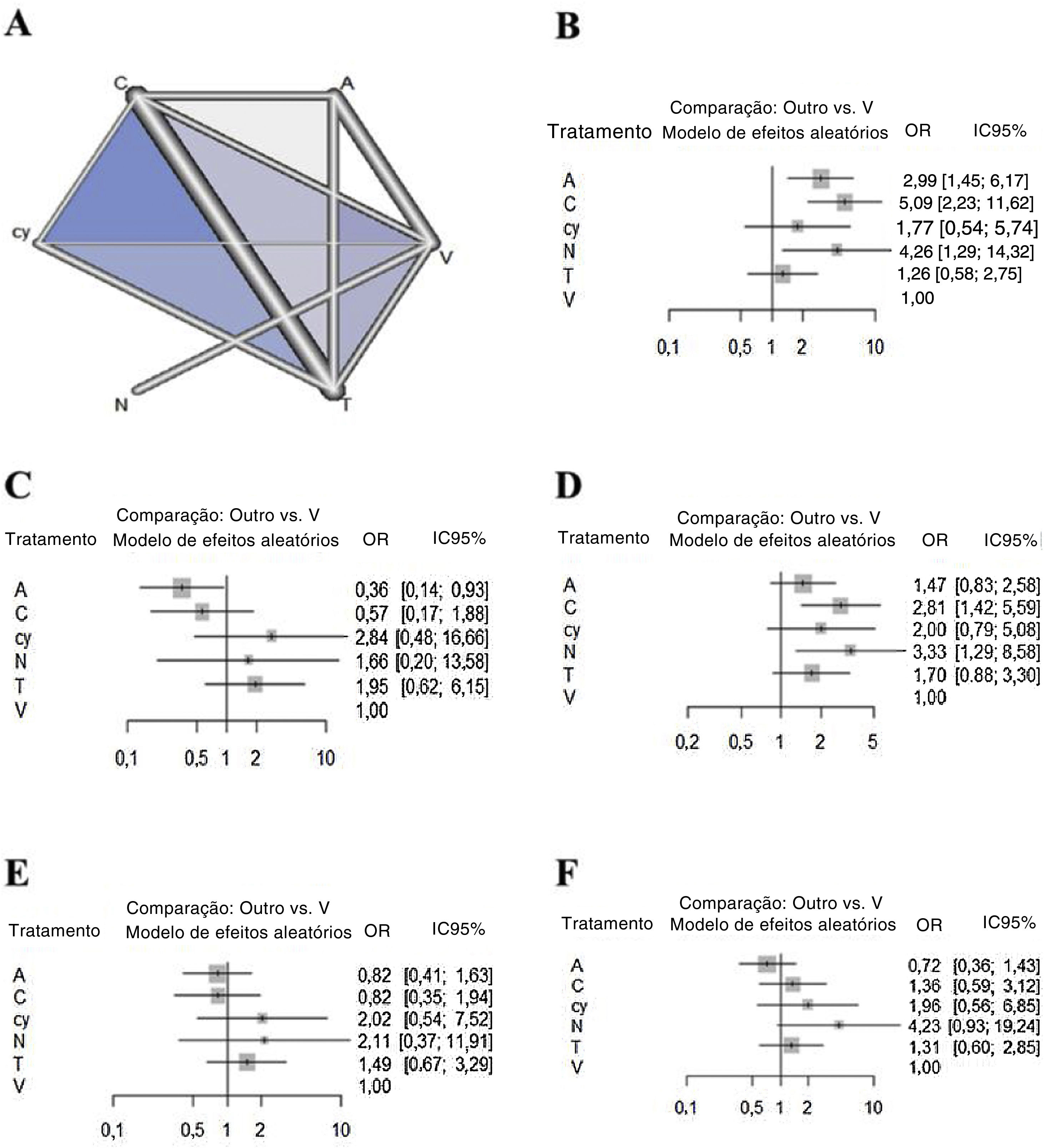
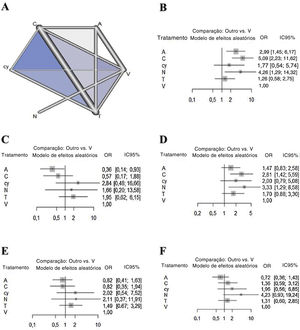
Metanálise de redeEm relação ao resultado da sensibilidade, a quimioluminescência apresentou a maior sensibilidade em comparação com o exame visual (5,08 [IC 95% 2,22 a 11,62]), seguida pela NBI (4,29 [IC 95% 1,28 a 14,31]) e autofluorescência (2,98 [IC 95% 1,44 a 6,17]). Não houve diferenças significantes entre a citologia, o cloreto de tolônio e o exame visual (fig. 2). Em termos de especificidade, a autofluorescência mostrou a especificidade mais baixa em comparação com o exame visual (0,36 [IC 95% 0,14 a 0,93]). Embora a quimioluminescência tendesse a ser menos específica em comparação com o exame visual (0,57 [IC 95% 0,17 a 1,88]), não houve diferenças significativas na especificidade entre os outros métodos, inclusive a quimioluminescência. Em termos de VPN, embora todos os métodos apresentem tendência a ter maior valor preditivo negativo em comparação com o exame visual, apenas a quimioluminescência (2,81 [IC 95% 1,41 a 5,59)]) e a NBI (3,32 [IC 95% 1,28 a 8,58]) mostraram uma diferença significante. Em termos de VPP, embora a autofluorescência (0,81 [IC 95% 0,41 a 1,63)]) e a quimioluminescência (0,82 [IC 95% 0,34 a 1,93)]) tendessem a ter menor valor preditivo positivo em relação ao exame visual, não houve diferenças significantes em especificidade entre todos os métodos. Em termos de precisão, a autofluorescência (0,7179 [IC 95% 0,3597 a 1,4327)]) tendeu a ser menos precisa e a citologia (1,9591 [IC 95%: 0,5604 a 6,8491)]) e a NBI (4,2276 [IC 95% 0,9287 a 19,2444)]) tendeu a ser mais precisa em comparação com o exame visual. No entanto, não houve diferenças significativas na precisão entre todos os métodos.
Uma avaliação para saber se as comparações diretas e indiretas foram suficientemente semelhantes na NMA não mostrou inconsistências globais em relação à sensibilidade (p=0,3878), especificidade (p=0,2333), VPN (p=0,9884), VPP (p=0,4254) ou precisão (p=0,7371). Além disso, não houve inconsistências locais entre os desfechos (tabelas suplementares 4 a 8).
Resultados da hierarquia de classificaçãoOs valores de Sucra dos seis métodos diagnósticos adjuvantes foram resumidos e são mostrados na tabela 3. Considerando os parâmetros diagnósticos adjuvantes gerais, a autofluorescência apresentou valores de Sucra mais baixos (sensibilidade: 63,95%; especificidade: 6,83%; VPN: 31,89%; VPP: 22,20%; precisão: 8,01%). A NBI apresentou maiores valores de SUCRA (sensibilidade: 77,91%; especificidade: 63,78%; VPN: 83,54%; VPP: 72,52%; precisão: 90,82%).
Probabilidades classificadas da eficácia de diferentes ferramentas diagnósticas em sensibilidade, especificidade, valor preditivo negativo, valor preditivo positivo e precisão
| Tratamento | Sensibilidade | Especificidade | VPN | |||
|---|---|---|---|---|---|---|
| Sucra | Classificação | Sucra | Classificação | Sucra | Classificação | |
| Exame visual | 0,0920 | 6 | 0,4745 | 4 | 0,0460 | 6 |
| Autofluorescência | 0,6395 | 3 | 0,0683 | 6 | 0,3189 | 5 |
| Quimioluminescência | 0,8923 | 1 | 0,2382 | 5 | 0,8264 | 2 |
| Citologia | 0,3893 | 4 | 0,8346 | 1 | 0,5534 | 3 |
| Imagem de banda estreita | 0,7791 | 2 | 0,6378 | 3 | 0,8354 | 1 |
| Cloreto de tolônio | 0,2078 | 5 | 0,7465 | 2 | 0,4200 | 4 |
| Tratamento | VPP | Precisão | ||
|---|---|---|---|---|
| Sucra | Classificação | Sucra | Classificação | |
| Exame visual | 0,3800 | 4 | 0,2974 | 5 |
| Autofluorescência | 0,2220 | 6 | 0,0801 | 6 |
| Quimioluminescência | 0,2223 | 5 | 0,5220 | 3 |
| Citologia | 0,7752 | 1 | 0,7017 | 2 |
| Imagem de banda estreita | 0,7252 | 2 | 0,9082 | 1 |
| Cloreto de tolônio | 0,6753 | 3 | 0,4906 | 4 |
Sucra, Surface under the Cumulative Ranking Curve.
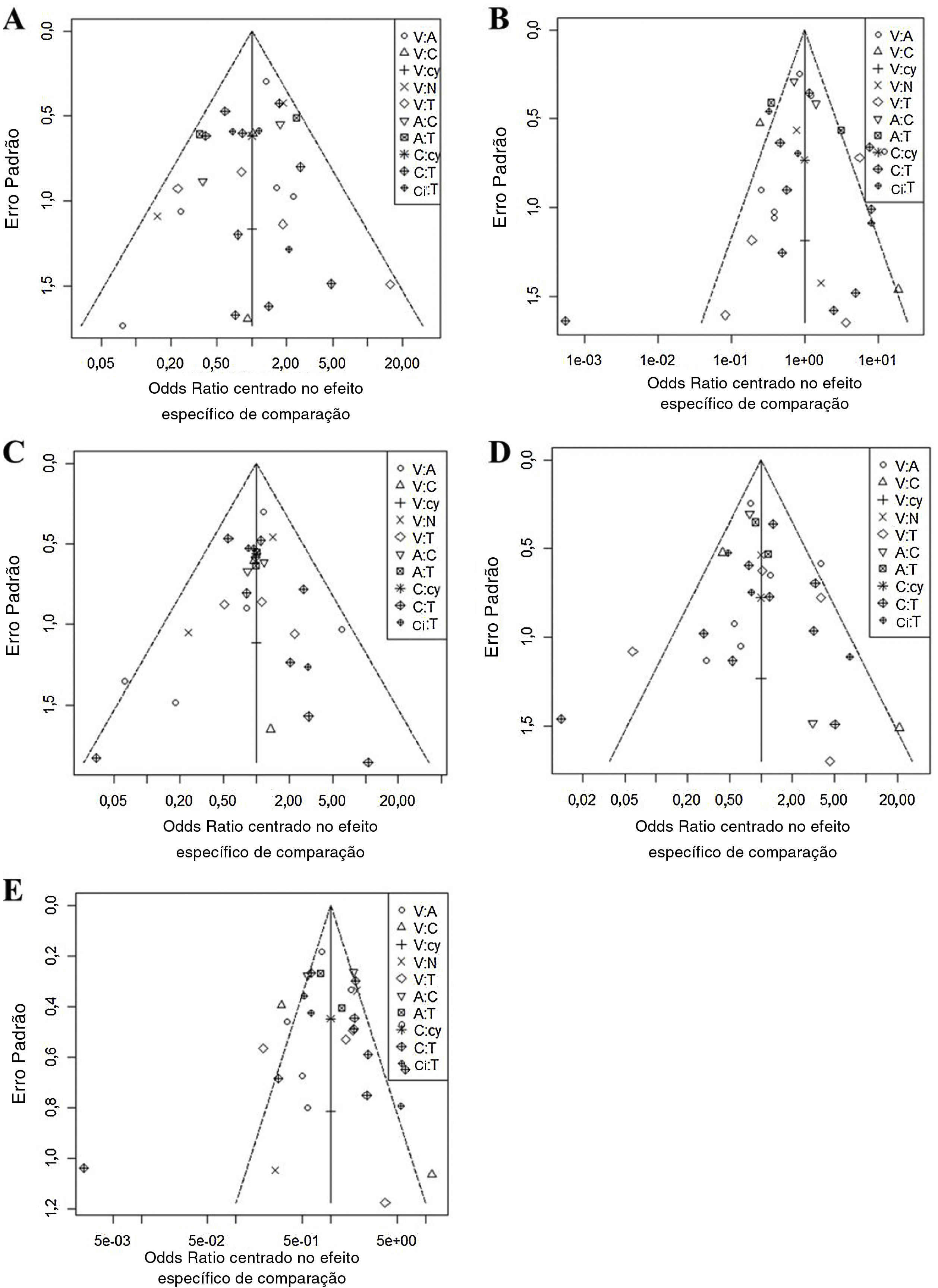
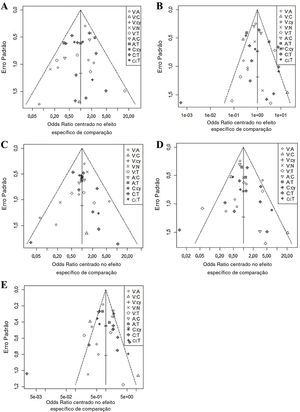
Em todos os seis gráficos de funil ajustados por comparação (fig. 3), as dispersões dos mesmos símbolos foram visualmente simétricas. Isso significa que o viés de publicação foi relativamente baixo para sensibilidade, especificidade, valor preditivo negativo, valor preditivo positivo e precisão. O teste de regressão linear da assimetria do gráfico de funil também não mostrou viés de publicação significante (p> 0,05).
DiscussãoA avaliação visual convencional e o exame tátil da cavidade oral continuam a ser o padrão‐ouro para a identificação de lesões da mucosa oral.15 No entanto, foi relatado um método auxiliar para detectar LOPMs, mostrou um desempenho diagnóstico adequado.25 Portanto, nossa rede conduziu uma metanálise desses novos estudos e incluiu comparações detalhadas de outras ferramentas diagnósticas adjuvantes com o exame visual convencional. Metanálises anteriores ou revisões sistemáticas documentaram a eficácia de várias ferramentas diagnósticas adjuvantes na detecção precoce de LOPMs ou lesões cancerosas e na melhoria da taxa de sobrevida para câncer oral.40 Entretanto, as limitações desses estudos prejudicaram sua relevância clínica, visto que consistiram em metanálises diagnósticas separadas ou revisões descritivas sem análise estatística; eles não puderam avaliar vários tratamentos ou fornecer uma classificação de sua eficácia.35 Isso torna difícil para os médicos selecionar o método ideal entre vários métodos que demonstraram ser eficazes em metanálises ou revisões sistêmicas anteriores.
A NMA é uma nova abordagem analítica que permite comparações simultâneas de várias intervenções. Também permite comparações quantitativas de tratamentos que não haviam anteriormente sido comparados diretamente com dados diretos e indiretos e combinações de evidências de diferentes dimensões.5 Este estudo usou a NMA para resolver as limitações de estudos anteriores de métodos diagnósticos adjuvantes para lesões pré‐cancerosas orais que avaliaram opções de tratamento únicas, em vez de múltiplas, ou descrever as revisões sistemáticas sem a apresentação de valores objetivos. Especificamente, fizemos uma revisão sistemática com NMAs para classificar os efeitos de cinco métodos diagnósticos adjuvantes e exame visual usados para detectar LOPMs.
Em relação aos cinco métodos diagnósticos adjuvantes, no método de autofluorescência, a autofluorescência do tecido produzida por tecidos submucosos saudáveis pode ser detectada por espectroscopia de fluorescência.21 A perda de autofluorescência ocorre nas LOPMs devido a alterações bioquímicas das células epiteliais, processos inflamatórios e angiogênese que ocorrem no início do processo neoplásico.41 Verificou‐se que a fonte de estímulo (luz ultravioleta) de 400nm impulsiona a membrana mucosa oral, que pode ser observada como luz na coloração “verde‐maçã” através de filtros ópticos. A lesão poderia ser observada em áreas escuras bem demarcadas devido à perda de autofluorescência do tecido.41 O método de quimioluminescência usa comprimentos de onda específicos que são absorvidos pelas células normais e são refletidos nas células anormais devido à sua proporção citoplasmática nuclear. Portanto, as anormalidades atípicas da mucosa aparecem em cor branca brilhante.25 A NBI avalia as características do tecido com filtros de largura de banda estreita que compartilham os picos de absorção com a hemoglobina. Esse método usa luz azul e verde para revelar os vasos sanguíneos da mucosa superficial e da submucosa, permite a detecção de lesões mucosas superficiais e anormais.42 O cloreto de tolônio é a técnica de coloração vital mais comumente usada e amplamente estudada. É um corante com alta afinidade por componentes ácidos e tinge tecidos com ácidos nucléicos ricos. As células displásicas ou neoplásicas contêm canais intracelulares mais largos em comparação com as células normais, facilitam a penetração do corante. A citologia esfoliativa oral tem sido usada desde a década de 1950 para coletar células epiteliais para avaliação morfológica ao microscópio ótico. Com a coleta esfoliativa de células com o uso de uma escova de cerdas (citologia de escova), o epitélio de espessura total, inclusive as células epiteliais basais, pode ser obtido. É conhecida por ser um método bem tolerado que reduz a necessidade de biópsias cirúrgicas desnecessárias em lesões clinicamente benignas.17
A autofluorescência e a quimioluminescência mostraram maior sensibilidade, mas menor especificidade. Esses resultados indicam que não haveria diferença entre esses métodos de detecção baseados em uso de luz e o exame clínico ao avaliar lesões neoplásicas óbvias; entretanto, quando o exame clínico resulta em achados neoplásicos negativos, esses métodos são mais sensíveis para identificar lesões suspeitas. A alta sensibilidade desses métodos pode ser atribuída ao aumento do brilho e da clareza das lesões orais, o que pode dar suporte ao conceito de que esses dispositivos podem detectar novas lesões e revelar as margens do tumor.15 Portanto, esses dispositivos seriam mais eficazes do que o exame clínico na identificação de lesões não sintomáticas e clinicamente obscuras.15,26
Entretanto, as especificidades combinadas foram menores em comparação com as do exame clínico, principalmente devido aos resultados falso‐positivos obtidos com esses dispositivos. Portanto, eles podem ser úteis para identificar todos os tipos de lesão, mas podem não ser confiáveis para distinguir lesões orais benignas de displasia ou carcinoma espinocelular.43 A baixa especificidade pode ser explicada pelo mecanismo de autofluorescência e quimioluminescência.19,44 Para misturas quimioluminescentes, incluímos uma pré‐lavagem com ácido acético para remover resíduos e camadas de glicoproteína, o que aumenta a penetração e o reflexo da luz. No entanto, o ácido acético causa desidratação celular e coagulação de proteínas, o que reduz a transparência epitelial. Essa transparência reduzida pode causar a aparência das lesões acetobrancas.44 Além disso, o uso de uma pré‐lavagem com ácido acético pode estimular a secreção das glândulas salivares. Isso resulta em significativa refletividade da superfície da mucosa e pode dificultar a identificação dos limites da lesão.11
A alta taxa de resultados falsos positivos criou preocupações sobre seus riscos potenciais, como causar estresse e medo desnecessários nos pacientes, bem como aumento da morbidade devido a procedimentos cirúrgicos para biópsias desnecessárias.19 Além disso, a avaliação por quimioluminescência tem várias limitações, como a necessidade de um ambiente escuro, alto custo, ausência de um registro permanente (exceto por fotografias) e incapacidade de medir os resultados de visualização objetivamente.45 Os resultados do presente estudo também sugerem que esses métodos não devem substituir o exame clínico de lesões malignas e potencialmente malignas na mucosa oral.
A precisão diagnóstica do cloreto de tolônio e da citologia esfoliativa oral mostrou uma tendência a ser maior do que a do exame clínico, mas não houve diferenças significativas. Além disso, a Folha de Dados de Segurança de Material indica que o cloreto de tolônio pode ter efeitos perigosos se ingerido.46 O cloreto de tolônio não é apenas caro, mas também tem efeitos relativamente tóxicos nos fibroblastos, induz a mutagênese de células coradas sob irradiação de alta energia.47 A citologia esfoliativa oral também aumenta o custo e atrasa o diagnóstico definitivo.48 Portanto, os resultados desta metanálise indicam que esses métodos não teriam vantagens adicionais em relação às suas desvantagens e, portanto, não constituem um substituto conveniente para os testes de triagem convencionais que usam testes com lâmpada de luz padrão.
Em nosso estudo, a NBI ficou entre os 3 primeiros de todos os parâmetros de precisão diagnóstica. NBI melhorou a sensibilidade diagnóstica de um exame endoscópico convencional para avaliar as características do tecido com filtros de largura de banda estreita, com picos de absorção na hemoglobina. A NBI usa dois espectros de luz (azul e verde), que podem expor vasos sanguíneos na mucosa superficial e áreas submucosas. A NBI pode diferenciar lesões mucosas superficiais não detectadas sob a endoscopia de imagem com luz branca padrão, torna‐se uma ferramenta útil para o diagnóstico patológico precoce preciso e diagnóstico de lesões orais pré‐malignas ou cancerosas.
Houve algumas limitações neste estudo. Pode haver limitações significativas para generalização devido ao número muito pequeno de estudos incluídos (dois). Em segundo lugar, embora tenha havido dois métodos, inclusive padrões de mucosa (áreas acastanhadas bem demarcadas)24,49 e padrão vascular (classificação IPCL)49,50 para discriminar lesões patológicas de lesões benignas da mucosa, apenas padrões de mucosa (áreas acastanhadas bem demarcadas) foram incluídas para comparar a utilidade da NBI para auxiliar na detecção de LOPMs e lesões malignas na cavidade oral. Considerando essas limitações, precisamos incluir mais relatos com método de avaliação padronizado em estudos futuros para apoiar ou generalizar nossos resultados positivos para a NBI. Terceiro, uma vez que este artigo julgou com base em um critério (precisão diagnóstica), os valores clinicamente importantes que cada uma das cinco ferramentas diagnósticas auxiliares podem ter sido negligenciados.
Nossos resultados sugerem que os métodos adjuvantes não invasivos atuais (exceto a NBI) para detectar LOPMs podem não melhorar a precisão diagnóstica em comparação com o exame convencional. Entretanto, a autofluorescência, a quimioluminescência e a NBI são úteis para a triagem em massa e permitem diagnósticos óticos em tempo real mais precisos. O cloreto de tolônio pode tornar o local da biópsia mais claro para lesões ambíguas. A citologia pode ajudar a determinar se a biópsia real é necessária em pacientes com contraindicações para procedimentos cirúrgicos, é útil para fazer a avaliação do tipo de célula no próprio epitélio oral e pode ser útil quando é difícil estabelecer um ambiente de triagem populacional. Portanto, ao determinar se essas ferramentas diagnósticas auxiliares devem ser usadas, as situações clínicas devem ser consideradas com cuidado. Embora a NBI seja uma boa ferramenta para o diagnóstico adjuvante de LOPMs, mais estudos com critérios diagnósticos padronizados são necessários para determinar a utilidade da NBI.
ConclusãoOs resultados de nossa NMA mostraram que apenas a NBI seria útil para detectar LOPMs. Os outros métodos (autofluorescência, quimioluminescência, citologia e cloreto de tolônio) apresentam poucos benefícios em comparação com o exame convencional. Considerando seu custo e efeitos adversos, esses métodos não seriam recomendados como ferramentas diagnósticas adjuvantes. Para o uso de NBI, novos estudos com método de avaliação padronizado são necessários para dar suporte aos nossos resultados.
FinanciamentoEsta pesquisa recebeu apoio do Programa de Pesquisa em Ciência Básica através da National Research Foundation of Korea (NRF) financiada pelo Ministério da Educação (2020R1I1A1A01051844, 2018R1D1A1B07045421), o Programa de Desenvolvimento de Biotecnologia e Tecnologia Médica da National Research Foundation of Korea (NRF) financiada pela Ministério da Ciência e ICT (2018M3A9E8020856, 2019M3A9H2032424 2019M3E5D5064110) e o Korea Health Industry Development Institute financiado pelo Ministério da Saúde e Bem‐estar (HI14C3228). Os patrocinadores não tiveram qualquer papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Kim DH, Kim SW, Hwang SH. Efficacy of non‐invasive diagnostic methods in the diagnosis and screening of oral cancer and precancer. Braz J Otorhinolaryngol. 2022;88:937–47.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.