Methicillin‐resistant staphylococcus aureus is an emerging problem for the treatment of chronic suppurative otitis media, and also for pediatric tympanostomy tube otorrhea. To date, there are no effective topical antibiotic drugs to treat methicillin‐resistant staphylococcus aureus otorrhea.
ObjectiveIn this study, we evaluated the ototoxicity of topical KR‐12‐a2 solution on the cochlea when it is applied topically in the middle ear of guinea pigs.
MethodsThe antimicrobial activity of KR‐12‐a2 against methicillin‐resistant staphylococcus aureus strains was examined by using the inhibition zone test. Topical application of KR‐12‐a2 solution, gentamicin and phosphate buffered saline were applied in the middle ear of the guinea pigs after inserting ventilation tubes. Ototoxicity was assessed by auditory brainstem evoked response and scanning electron microscope examination.
ResultsKR‐12‐a2 produced an inhibition zone against methicillin‐resistant staphylococcus aureus from 6.25μg. Hearing threshold in the KR‐12‐a2 and PBS groups were similar to that before ventilation tube insertion. However, the gentamicin group showed elevation of the hearing threshold and there were statistically significant differences compared to the phosphate buffered saline or the KR‐12‐a2 group. In the scanning electron microscope findings, the KR‐12‐a2 group showed intact outer hair cells. However, the gentamicin group showed total loss of outer hair cells. In our experiment, topically applied KR‐12‐a2 solution did not cause hearing loss or cochlear damage in guinea pigs.
ConclusionIn our experiment, topically applied KR‐12‐a2 solution did not cause hearing loss or cochlear damage in guinea pigs. The KR‐12‐a2 solution can be used as ototopical drops for treating methicillin‐resistant staphylococcus aureus otorrhea; however, further evaluations, such as the definition of optimal concentration and combination, are necessary.
O staphylococcus aureus resistente à meticilina é um problema emergente não só para a otite média supurativa crônica, mas também para casos de otorreia crônica em crianças com tubo de ventilação. Até o momento, não há antibióticos tópicos efetivos para a otorreia causada por staphylococcus aureus resistente à meticilina.
ObjetivoNesse estudo, avaliamos a ototoxicidade da solução tópica de KR‐12‐a2 na cóclea quando aplicada topicamente na orelha média de cobaias.
MétodoA atividade antimicrobiana de KR‐12‐a2 contra cepas de staphylococcus aureus resistente à meticilina foi avaliada utilizando‐se o teste de zona de inibição de crescimento. Foram aplicados na orelhas médias de 3 grupos de cobaias, ou solução tópica de KR‐12‐a2, ou gentamicina ou solução salina tamponada com fosfato após timpanostomia. A ototoxicidade foi avaliada através do exame auditivo de potencial evocado auditivo de tronco encefálico e por microscopia eletrônica de varredura.
ResultadosO KR‐12‐a2 produziu uma zona de inibição contra o staphylococcus aureus resistente à meticilina a partir de 6,25μg. Alterações do limiar de audição no grupo KR‐12‐a2 e no grupo com solução salina foram semelhantes aos observados antes da inserção do tubo de ventilação. No entanto, o grupo gentamicina apresentou um limiar auditivo mais elevado, estatisticamente significativo em comparação ao grupo solução salina ou ao grupo KR‐12‐a2. Nos achados da microscopia eletrônica, o grupo KR‐12‐a2 apresentou células ciliadas externas intactas. No entanto, o grupo gentamicina apresentou perda total das células ciliadas externas. Em nosso experimento, a solução de KR‐12‐a2 aplicada topicamente não causou perda auditiva ou dano coclear em cobaias.
ConclusãoEm nosso experimento, a solução de KR‐12‐a2 aplicada topicamente não causou perda auditiva ou dano coclear em cobaias. A solução de KR‐12‐a2 pode ser utilizada como gotas otológicas para o tratamento da otorreia causada por staphylococcus aureus resistente à meticilina; no entanto, são necessárias outras avaliações, para a definição da concentração e das associações ideais.
A resistência aos antibióticos está rapidamente se tornando um problema clinicamente significativo para o sistema de saúde. O tratamento da otite média crônica causada por bactérias resistentes a múltiplos agentes antimicrobianos, surgiu como um dos maiores desafios enfrentados pelos profissionais médicos. Consequentemente, as infecções por Staphylococcus aureus resistente à meticilina (MRSA) não conseguem ser tratadas com gotas ototópicas de ciprofloxacina comercialmente disponíveis.1,2 Sabe‐se que a prevalência de MRSA na otite média supurativa crônica (OMSC) é maior do que ∼ 60% a 70% entre S. Aureus isolados em hospitais Coreanos.3 Além da OMSC, MRSA é também um problema emergente relacionado à otorreia crônica pediátrica pós colocação de tubos de ventilação. Até a presente data, protocolos de tratamento padrão não foram desenvolvidos, e há um variado espectro de tratamentos clínicos relatados. O uso adicional de antibióticos orais tais como linezolida,4 sulfametoxazol‐trimetoprima,5 ácido fusídico,6 ou rifampicina para tratar otorreia causada por MRSA pode ser útil, mas após a administração sistêmica, a concentração biodisponível eficaz na orelha média para erradicar a infecção não pode ser precisamente medida ou descrita. A utilização de fármacos ototópicos representa uma alternativa altamente promissora aos antibióticos orais na terapêutica das doenças infecciosas da orelha média.
O uso de vancomicina para o tratamento de infecções por MRSA tem aumentado.7 Um dos autores desse trabalho utilizou vancomicina tópica para tratar pacientes com OMSC causada por MRSA e obteve bons resultados.8 Entretanto, a preocupação com o uso da vancomicina é a possível emergência de cepas resistentes ao fármaco, como o S. aureus com resistência intermediária à vancomicina (VISA) e o Enterococcus resistente à Vancomicina (ERV). Em contextos clínicos, a sua utilização menos frequente pode facilitar a diminuição do aparecimento de cepas resistentes. Portanto, é necessário desenvolver novos compostos antimicrobianos contra o MRSA. Recentemente, os Peptídeos Antimicrobianos (PAMs) foram considerados novos antibióticos contra microrganismos resistentes, tais como MRSA, e alguns deles estão sendo avaliados em testes clínicos.9 PAMs são componentes fundamentais da imunidade inata dos mamíferos que controlam as infecções microbianas e representam a primeira linha de defesa contra diferentes patógenos nas superfícies epiteliais epidérmicas e mucosas. PAMs desempenham um papel significativo de defesa da imunidade inata do hospedeiro na prevenção de infecções primárias10 e são produzidos por macrófagos, células sanguíneas e células epiteliais em mamíferos. Os PAMs identificados em seres humanos incluem membros das famílias da catelicidina, defensina, trombocidina e histatina.11
A expressão de um PAM na pele do canal auditivo externo e na orelha média já foi relatada anteriormente.12–14 A catelicidina LL‐37 humana é um peptídeo antimicrobiano α‐helicoidal anfipático catiônico com 37 resíduos de comprimento.15 Além da sua ação bactericida direta, sabe‐se que a LL‐37 possui uma potente atividade neutralizadora de lipopolissacarídeo (LPS) em vários tipos de células.16–18 O KR‐12 (resíduos 18‐29 de LL‐37) é o menor peptídeo da catelicidina humana LL‐37 que possui atividade antimicrobiana.19 Recentemente, desenvolvemos novos análogos de KR‐12, desenhados com base na análise estrutura‐atividade do KR‐12 (KRIVQRIKDFLR‐NH2),20 que mostrou potente atividade antimicrobiana e anti‐endotóxica.
A otorreia purulenta é uma manifestação comum em pacientes que apresentam OMSC. Pacientes com OMSC e infecção por MRSA geralmente têm uma inflamação crônica na orelha média e mastoide, com uma perfuração persistente da membrana timpânica, geralmente associada a otorreia recorrente. Medicações ototópicas provavelmente utilizam doses mais baixas de antibióticos em comparação às medicações sistêmicas. Além disso, a eficácia de antibióticos sistêmicos para o tratamento de implantes infectados na orelha média não está bem elucidada. Entretanto, o uso de gotas ototópicas contra MRSA não estão comercialmente disponíveis ainda. Nesse estudo, avaliou‐se o efeito ototóxico coclear de uma solução tópica de KR‐12‐a2 (KRIVQRIKKWLR‐NH2), um análogo de KR‐12, após aplicação tópica do medicamento na orelha média de cobaias.
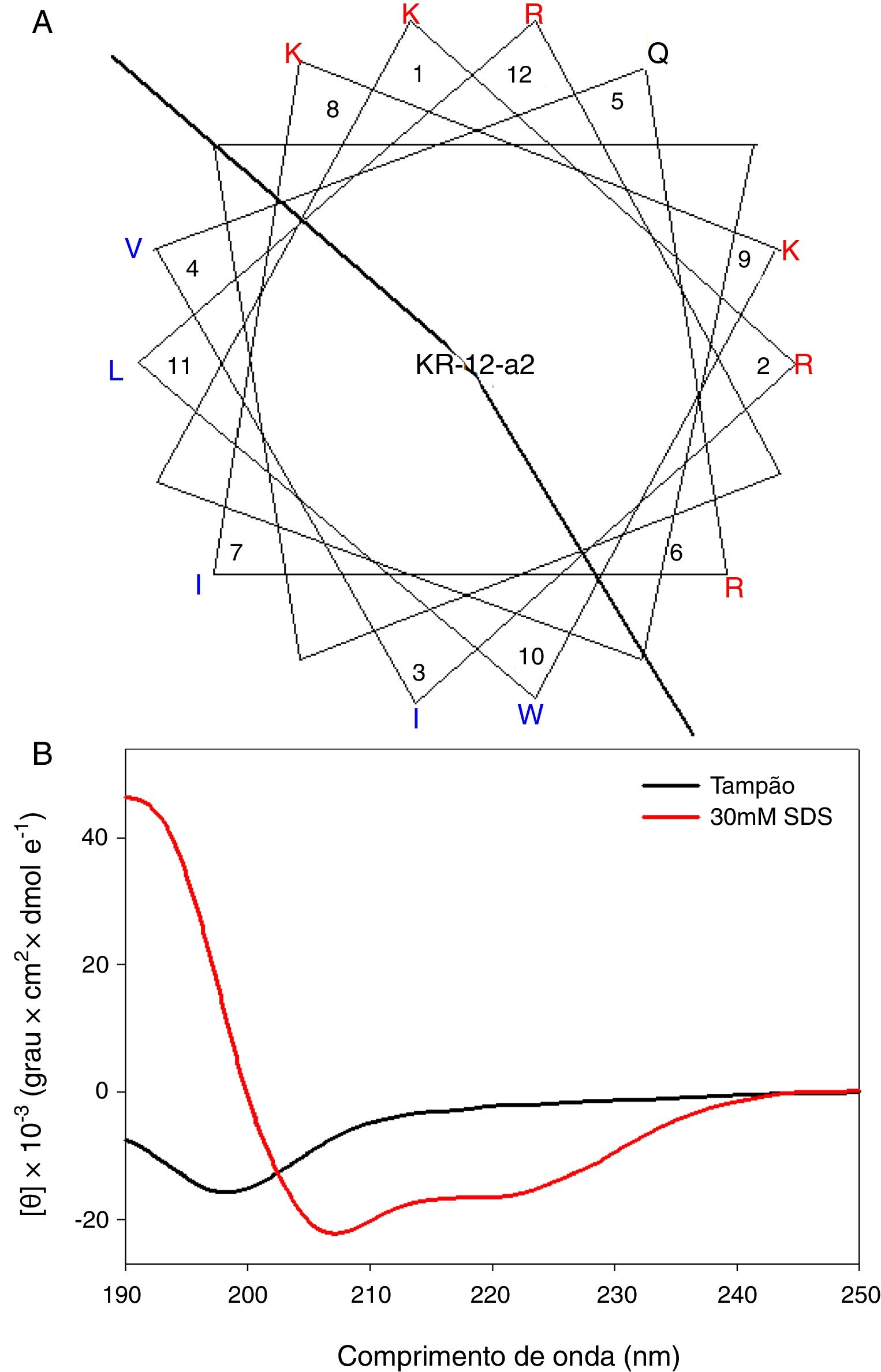
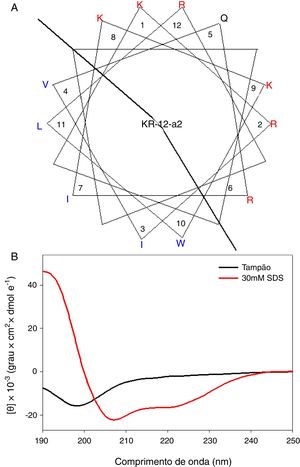
MétodoSíntese do peptídeoKR‐12‐a2 foi preparado como descrito anteriormente pelos autores.19 Resumidamente, a preparação do KR‐12‐a2 envolve a técnica de síntese padrão em fase sólida baseada em 9‐fluorenil‐metoxicarbonil (Fmoc) em resina 4‐metil benzidril amina (0,54 mmoL/g). Foram utilizados diciclohexilcarbodiimida (DCC) e N‐hidroxibenzotriazole (HOBt) como reagentes de acoplamento, e foi adicionado um excesso de 10 vezes de aminoácidos Fmoc durante cada ciclo de acoplamento. Após clivagem e desproteção com uma mistura de ácido trifluoroacético/água/tioanisole/fenol/etanoditiol/triisopropilsilano (3,26 mL/0,2mL/0,2mL/0,2mL/0,1mL/0,04mL) por 2h à temperatura ambiente, o peptídeo bruto foi repetidamente extraído com éter dietílico e purificado através de cromatografia líquida de alto rendimento de fase inversa (RP‐HPLC) em uma coluna preparativa Vydac C18 (20mm × 250mm, 300Å, tamanho de partícula de 15mm) utilizando uma solução apropriada a 0‐90% de água/acetonitrilo na presença de ácido trifluoroacético a 0,05%. A pureza final dos peptídeos (> 95%) foi determinada por RP‐HPLC em uma coluna Vydac C18 analítica (4,6 × 250mm, 300Å, tamanho de partícula 5mm). O sucesso da síntese do peptídeo foi confirmado através de análise utilizando espectrometria de massa com ionização e dessorção a laser assistida por matriz, tempo de voo (MALDI‐TOF) (Shimadzu, Japão). Como mostrado na sua projeção de roda α‐helicoidal (fig. 1A), o KR‐12‐a2 foi projetado para ser anfipático quando dobrado em uma estrutura α‐helicoidal, através da convergência dos resíduos hidrofóbicos (Val, Leu, Ile e Trp) para um lado e os resíduos hidrofílicos (Lys e Arg) para o outro lado do eixo helicoidal. Além disso, o KR‐12‐a2 apresentou um espectro de DC a‐helicoidal característico com dois valores mínimos dicroicos a 208 e 222nm e uma banda positiva perto de 192nm em micelas de Dodecil Sulfato de Sódio (DSS) 30mM (ambientes que imitam a membrana) (fig. 1B).
(A) Diagramas em roda α‐helicoidal para KR‐12‐a2. Os aminoácidos carregados positivamente e hidrofóbicos são representados usando as cores vermelha e azul, respectivamente. A linha indica a interface entre a face hidrofóbica e a face positivamente carregada. (B) Espectros de Dicroísmo Circular (DC) dos peptídeos em solução‐tampão de fosfato de sódio 10mM, pH 7,2, e micelas de Dodecil Sulfato de Sódio (DSS), 30mM.
MRSA foi cultivado de um dia para o outro, por 18h, a 37°C em 10mL de caldo LB e então 10μL dessa cultura foram inoculados em 10mL de LB fresco e incubados durante 3h adicionais a 37°C para obter organismos de fase logarítmica média. A suspensão bacteriana (2 × 105 UFC/mL em LB) foi misturada com 0,7% de agarose e colocada em uma placa de Petri de 10cm. Colocaram‐se alíquotas de dez microlitros de uma diluição seriada de KR‐12‐a2 em cada círculo de papel (≈ 6mm de diâmetro) que foram colocados nas placas de agarose e depois incubadas a 37°C durante a noite. Mediram‐se os diâmetros das zonas de clearance bacteriano em torno do círculo de papel para a quantificação de atividades inibitórias.
Miringotomia e inserção de tubo de ventilação e aplicação tópicaOs experimentos foram realizados em 15 cobaias machos jovens (pesando 250‐300g cada) com membranas timpânicas normais. Todos os experimentos com animais seguiram um protocolo aprovado pelo Comitê de Experimentação Animal (CNU IACUC‐H‐2014‐36). As cobaias foram anestesiadas utilizando uma injeção intraperitoneal de zoletil e cloridrato de xilazina. Os meatos acústicos externos e as membranas timpânicas das cobaias foram examinados sob um microscópio cirúrgico. excluindo‐se a possibilidade de processos infecciosos. Após avaliação basal pré‐operatória da audição, realizou‐se a miringotomia e a inserção de um tubo de ventilação Mini Shah (diâmetro interno 0,76, JEDMED Co, St. Louis, EUA) na porção anterior da membrana timpânica. Foi realizada a aplicação tópica de 50μL de solução de KR‐12‐a2 (g/mL de PBS diluído) (Grupo I, n = 5) utilizando‐se uma seringa de calibre 30 com agulha longa, na orelha média, através do tubo de ventilação. Foi aplicada topicamente solução salina tamponada com fosfato (PBS) 50μL (Grupo II, n = 5) e gentamicina 50μL (40mg/mL) (Grupo III, n = 5). As administrações intra‐timpânicas foram realizadas duas vezes ao dia durante 7 dias e um adesivo de papel foi aplicado localmente após a remoção do tubo de ventilação.
Medida do potencial evocado auditivo do tronco encefálico (PEATE) antes e depois da aplicação tópicaAs cobaias foram anestesiadas através de uma injeção intraperitoneal de zoletil e cloridrato de xilazina. Os PEATEs foram registrados utilizando‐se um sistema de potencial evocado (Tucker‐Davis Technologies, Flórida, EUA) e um computador Samsung. Os estímulos foram sintetizados digitalmente utilizando‐se o software Siggen® e foram apresentados através de um fone de inserção (ER‐2, Etymotic Research, Inc. Illinois, EUA). Os estímulos acústicos, compreendendo um clique e tone bursts de 4, 8 e 16kHz, foram então produzidos. A intensidade dos estímulos acústicos foi expressa em decibéis (dB). Os animais receberam uma série de intensidade de estímulos, que foi iniciada a 90 Db NPS e atingiu um mínimo de 10dB NPS. A intensidade do estímulo foi progressivamente reduzida em decréscimos de 10dB. Cada média consistiu em 500 apresentações de estímulos, com um tempo de análise de 10ms. A atividade elétrica foi registada através de um eletrodo de agulha de platina inserido no couro cabeludo no vértice e referenciado a outro eletrodo de agulha em um músculo profundo do pescoço. Um terceiro eletrodo de agulha na pina serviu como fio‐terra. As intensidades que pareciam estar próximas do limiar foram repetidas. O limiar foi definido como a menor intensidade capaz de produzir uma resposta de PEATE visivelmente detectável e reprodutível; os valores foram extrapolados para os 5dB mais próximos, assumindo uma queda log‐linear com intensidade decrescente. No limiar, a amplitude basal‐ao‐pico do maior componente do PEATE foi reduzida para < 10% daquela evocada pelos estímulos de 90dB. Os PEATEs foram avaliados no pré‐operatório e no oitavo dia após a aplicação tópica do fármaco. Utilizou‐se a análise de variância (ANOVA) de medidas repetidas para avaliar as diferenças entre os grupos. Um valor de p < 0,05 foi considerado estatisticamente significante.
Avaliação da cóclea por microscopia eletrônica de varreduraApós os registros finais do PEATE, os animais anestesiados foram perfundidos intracardialmente com paraformaldeído a 4% sob anestesia geral. Os ossos temporais foram isolados e os espaços peri‐linfáticos da cóclea foram cuidadosamente injetados com 2,5% de glutaraldeído em PBS 0,1M, realizando‐se cocleostomias nas janelas redondas e ovais. As cápsulas ósseas foram removidas para expor o órgão de Corti, e então os espécimes foram pós‐fixados em 2,5% de glutaraldeído por uma noite a 4°C. Os espécimes foram lavados três vezes em PBS e depois fixados em tetróxido de ósmio a 1% durante 1h a 4°C. As amostras do órgão de Corti foram então desidratadas através de uma série graduada de soluções de etanol e foram desidratados até o ponto crítico utilizando dióxido de carbono líquido. Essas amostras do órgão de Corti foram montadas em placas de SEM com tinta de alumínio e, em seguida, revestidas com ouro‐paládio. As células ciliadas exteriores (CCE) do órgão de Corti foram examinadas utilizando‐se um microscópio eletrônico de varredura. A quantificação das células ciliadas que sobreviveram em todos os giros foi realizada.
ResultadosTeste de atividade antimicrobiana e citotoxicidade in vitroKR‐12‐a2 produziu uma zona de inibição com o maior e menor diâmetro médio contra 100μg e 6,25μg de MRSA, respectivamente (fig. 2).
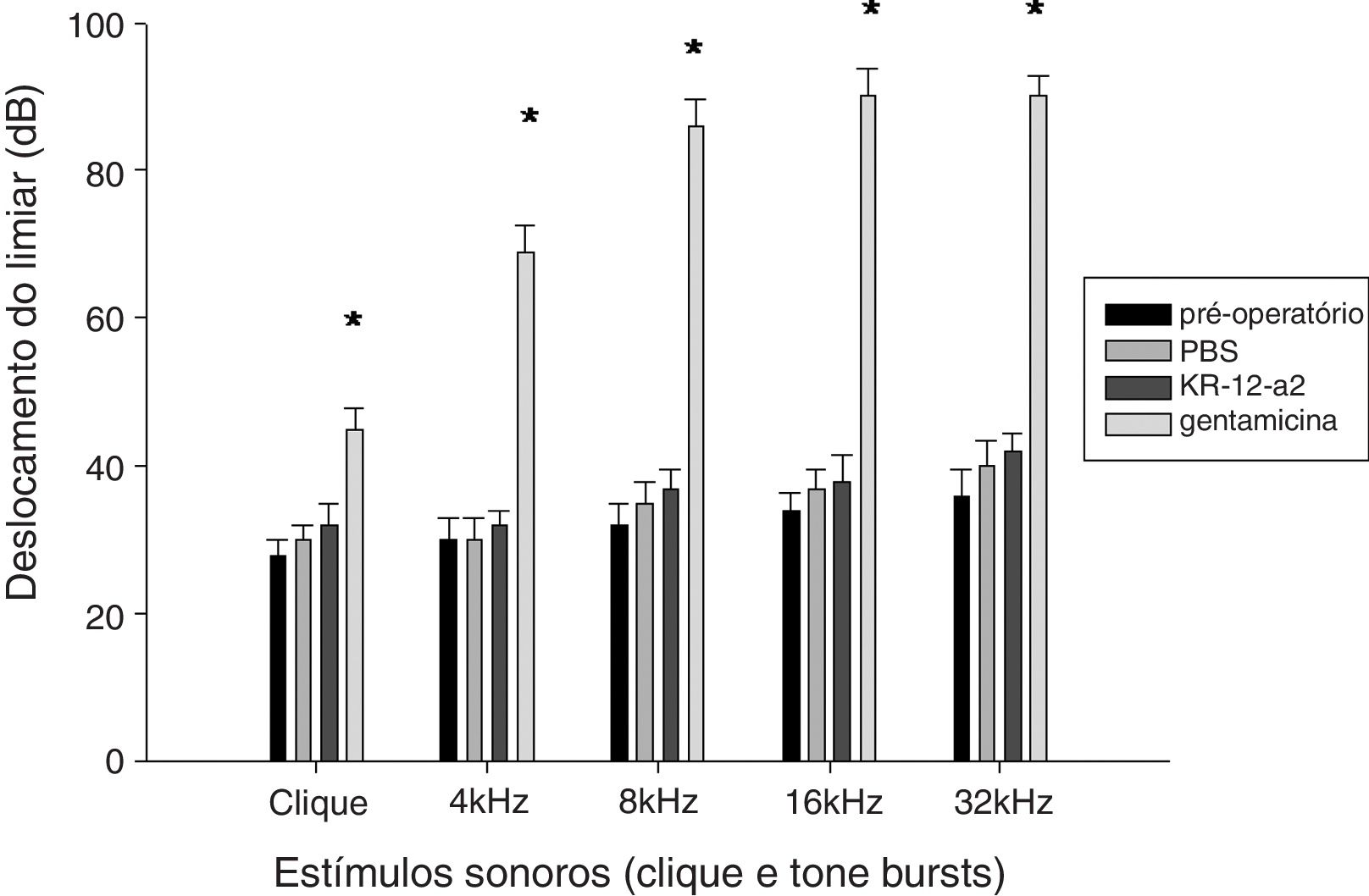
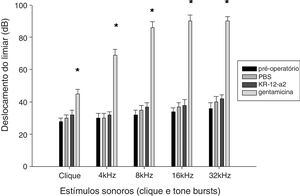
Resultados do PEATETodos os animais sobreviveram sem complicações ou otite média. Não houve diferenças estatisticamente significantes nos limiares do PEATE antes e após a colocação do tubo de ventilação. Os limiares auditivos nos grupos KR‐12‐a2 PBS e foram semelhantes aos anteriores à inserção do tubo de ventilação. No entanto, o grupo gentamicina mostrou um limiar auditivo mais elevado e demonstrou diferenças estatisticamente significantes quando comparado com os grupos PBS ou KR‐12‐a2 (fig. 3).
A audição foi preservada após aplicação tópica de KR‐12‐a2 bem como PBS, mas a mesma deteriorou após a aplicação de GM. O grupo GM apresentou diferenças significantes em comparação com o grupo PBS ou com o grupo KR‐12‐a2. Clique (p = 0,014), 4kHz (p = 0,011), 8kHz (p = 0,009), 16kHz (p = 0,003), 32kHz (p = 0,002). Não houve diferenças significantes entre os grupos PBS e KR‐12‐a2 no pré‐operatório.
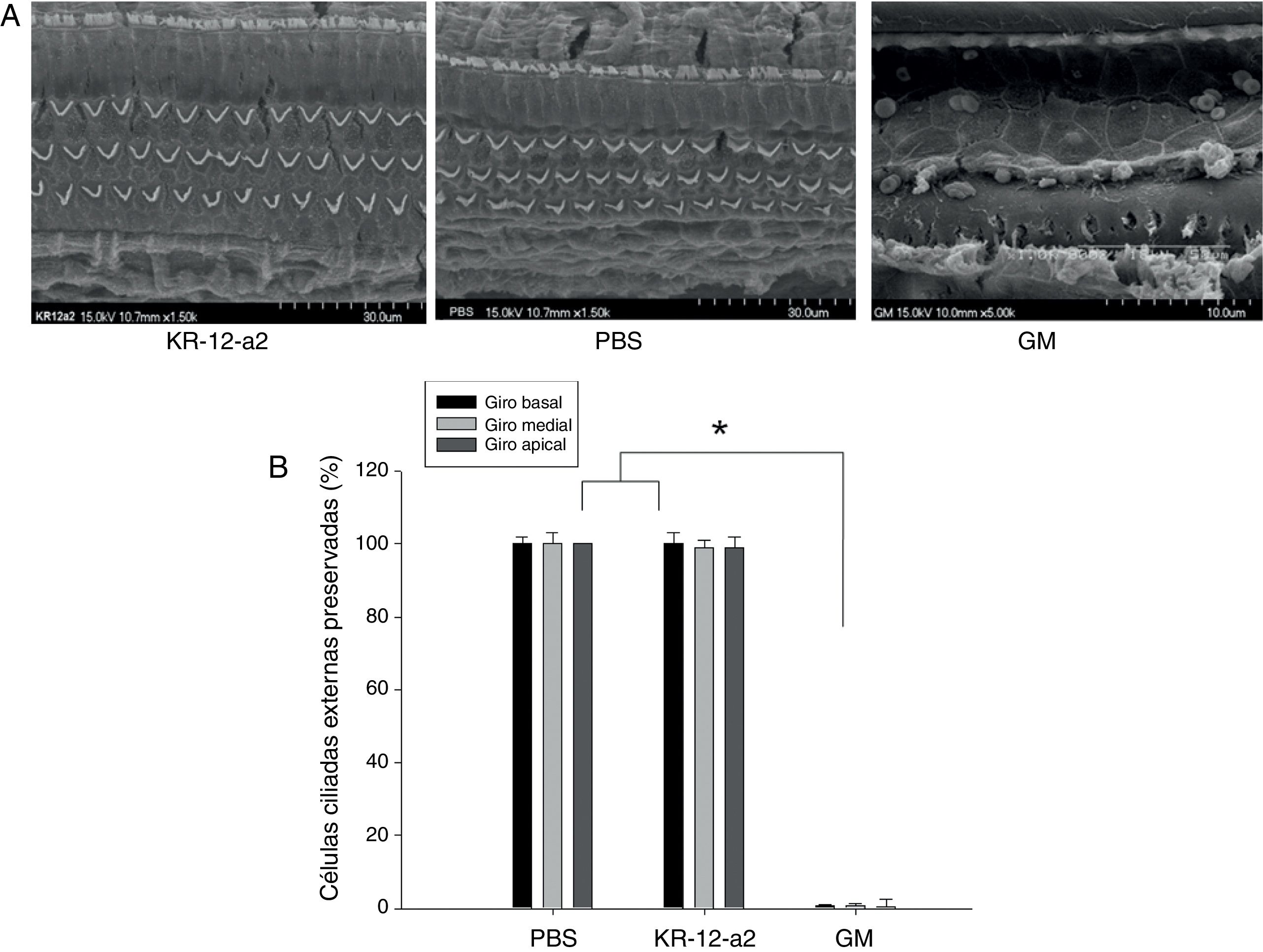
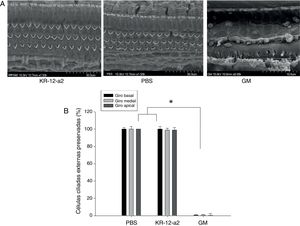
Em relação aos achados da SEM, os grupos KR‐12‐a2 e PBS apresentaram Células Ciliadas Internas (CCI) e CCE bem preservadas em todos os giros. Os resultados mostraram CCI e CCE intactas como no grupo PBS. No entanto, o grupo gentamicina mostrou perda total de CCE no giro basal e a quase total nos giros medial e apical (fig. 4A‐B).
(A) Achados de microscopia eletrônica de varredura mostraram células ciliadas bem preservadas no grupo KR‐12‐a2; contudo, perda total de células ciliadas foi observada no grupo GM. (B) Não há diferenças entre os grupos PBS e KR‐12‐a2, exceto em relação aos resultados da gentamicina.
O MRSA deve ser considerado nos casos de otorreia persistente nos quais a terapia padrão antibiótica com gotas otológicas/ou sistêmica falha. As taxas de isolados de MRSA entre as infecções de orelha por S. aureus aumentaram consistentemente em até 60,9%.3
Fishman et al. relataram que em uma grande revisão de pacientes com otorreia persistente e tubo de ventilação e cultura positiva, o S. aureus era responsável por 52% dos organismos cultivados, dos quais 57% eram MRSA.20 Atualmente, o antibiótico mais comumente utilizado contra o MRSA é a vancomicina. Tanto as experiências laboratoriais como os estudos clínicos não demonstraram ototoxicidade significativa após o tratamento com vancomicina.21–24 Embora não haja surgimento de Staphylococcus aureus resistente à vancomicina (VRSA) na OMSC, novos peptídeos anti‐MRSA precisam ser estudados para a prevenção de VRSA ou VISA. Mandal et al. relataram que aproximadamente 15% das cepas de MRSA também eram resistentes à vancomicina (VRSA).25 Recentemente, a aplicação tópica de daptomicina, um antibiótico lipopeptídico que ocorre naturalmente em Streptomyces roseosporus, um saprófito do solo e que é útil no tratamento de infecções por MRSA, não revelou qualquer ototoxicidade em cobaias.26 No entanto, o surgimento de MRSA resistente à daptomicina já foi relatado em outras doenças,27 além da resistência à vancomicina.28 Portanto, novos PAMs devem ser desenvolvidos para a otorreia por MRSA. O único peptídeo da família da catelicidina que é encontrado no corpo humano é o LL‐37, que tem demonstrado ter amplos efeitos antibacterianos contra bactérias gram‐positivas e gram‐negativas.29 Considera‐se que o LL‐37 desempenha um papel importante na primeira linha de defesa contra a infecção local e sistêmica e na invasão sistêmica de agentes patogênicos em locais de inflamação e feridas.30 Recentemente, Hou et al.31 relataram que o peptídeo antimicrobiano LL‐37 e o peptídeo regulador de defesa inato IDR‐1 poderiam melhorar a pneumonia induzida por MRSA, exercendo uma propriedade anti‐inflamatória e atenuando a liberação de citocinas pró‐inflamatórias, proporcionando assim suporte à hipótese de que ambos os peptídeos inatos e sintéticos podem desempenhar um papel de proteção contra MRSA in vivo.
No presente estudo, observamos a atividade antimicrobiana de KR‐12‐a2 contra MRSA, demonstrada pelos testes de zona de inibição e tempo de morte. Investigamos ainda a ototoxicidade por aplicação tópica de KR‐12‐a2, GM, e PBS duas vezes por dia durante 7 dias. O dano às células ciliadas foi avaliado através de PEATE e SEM. Não houve diferença significativa do limiar auditivo e na preservação das células ciliares entre os grupos PBS e KR‐12‐a2. No entanto, o grupo GM apresentou perda total de células ciliadas externas. As lesões na orelha interna ocorrem predominantemente no giro basal, seguido pelo giro apical com maior comprometimento da primeira fileira das CCE, com posterior extensão para as CCI, estria vascular, ligamento espiral e membrana de Reissner.32 Nesse estudo, avaliamos apenas as células ciliadas. No grupo GM, observou‐se a perda das CCE no giro basal ao invés do apical. A gentamicina é altamente solúvel em água e tem uma natureza polar que impede que ela atravesse facilmente uma membrana. Uma taxa de absorção mais elevada resultaria em giro basal da cóclea com um nível mais elevado de aminoglicosídeo antes do seu equilíbrio na perilinfa.33 Até hoje, a ototoxicidade induzida pela gentamicina depende da suscetibilidade, da predisposição genética e da morte celular apoptótica dependente de caspase.34 A toxicidade pode ser um fenômeno dose‐dependente na orelha interna, com níveis mais altos resultando em perda auditiva acentuada.35 Nesse estudo, utilizamos maior quantidade de GM do que a dosagem utilizada por Kimura et al. Uma vez que a limitação do presente estudo é a não‐demonstração dos efeitos terapêuticos de KR‐12‐a2 em modelos animais, estudos de seguimento in vivo são considerados necessários. Assim, pesquisas futuras serão focadas na avaliação dos efeitos do uso tópico de KR‐12‐a2 utilizando um modelo animal de otite causada por MRSA.
ConclusãoEm nosso experimento, a solução de KR‐12‐a2 aplicada topicamente não causou perda auditiva ou dano coclear em cobaias. A solução de KR‐12‐a2 pode ser utilizada como gotas otológicas para o tratamento de otorreia causada por MRSA; no entanto, são necessárias outras avaliações, tais como a definição da concentração e associações ideais.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sung CM, Kim HC, Cho YB, Shin SY, Jang CH. Evaluating the ototoxicity of an anti‐MRSA peptide KR‐12‐a2. BrazJ Otorhinolaryngol. 2018;84:441–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.