A abordagem diagnóstica de pacientes com linfadenopatia cervical assintomática isolada varia entre biópsia excisional e o simples seguimento. Quando a anamnese, o exame físico, os achados laboratoriais e de imagem não são suficientes para identificar a etiologia, faz‐se uma biópsia excisional para o diagnóstico diferencial de linfoma em estágio inicial ou causas infecciosas ou reativas. Se a biópsia excisional, a qual pode incorrer em algumas complicações cirúrgicas, não é feita, isso pode gerar atraso no diagnóstico de linfoma. Esse desafio diagnóstico pode ser evitado com o uso de marcadores preditivos.
ObjetivosDeterminar o valor preditivo da relação neutrófilos/linfócitos no diagnóstico do linfoma Hodgkin e não Hodgkin em pacientes com linfadenopatia cervical assintomática isolada e submetidos à biópsia excisional.
MétodoForam incluídos no estudo 90 pacientes entre 2016 a 2015 admitidos em nossa clínica com linfadenopatia cervical assintomática isolada, presente por pelo menos 4 semanas, com linfonodos patológicos persistentes na região cervical. Biópsia excisional de linfonodo foi feita em todos os 90 pacientes.
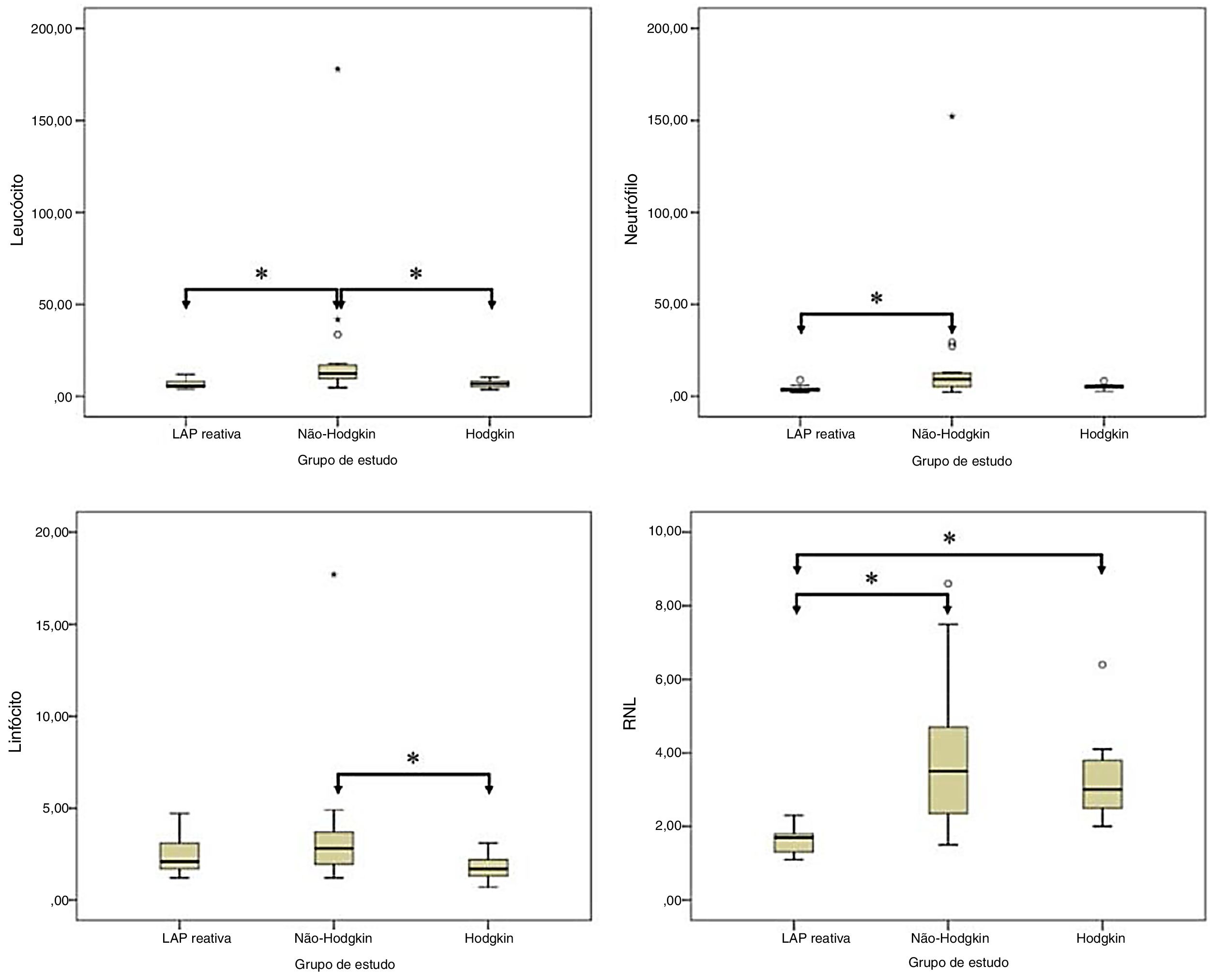
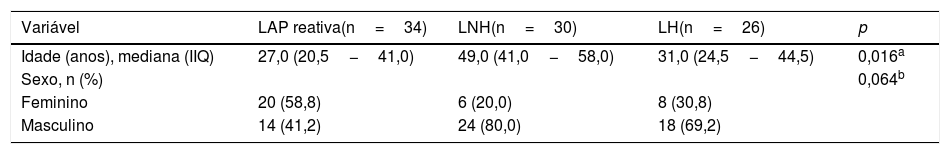
ResultadosDos 90 pacientes submetidos à biópsia excisional, 34 apresentaram linfadenopatia reativa, dos quais 30 tinham linfoma não Hodgkin e 26 linfoma Hodgkin. Foram diagnosticados 56 pacientes com linfoma (62,2%), tanto Hodgkin quanto não Hodgkin, e 34 pacientes (38,8%) foram diagnosticados com linfadenopatia reativa. A mediana da idade, a contagem total de leucócitos e a contagem de neutrófilos dos grupos com linfoma foram significantemente maiores do que no grupo linfadenopatia reativa, enquanto a contagem de linfócitos foi significantemente menor nos pacientes com linfoma. A mediana da relação neutrófilos/linfócitos foi de 1,7 no grupo linfadenopatia reativa, 3,5 no grupo não Hodgkin e 3,0 no grupo Hodgkin (p <0,001).
ConclusãoA relação neutrófilo/linfócito foi significantemente maior em pacientes admitidos com linfadenopatia assintomática isolada e com diagnóstico de linfoma e com diagnóstico de linfoma Hodgkin e não Hodgkin em estágio inicial em comparação com aqueles que apresentaram linfadenopatia reativa. A relação neutrófilo/linfócito, um teste de baixo custo, rápido e de fácil acesso, tem um valor preditivo no diagnóstico de linfoma em pacientes com linfadenopatia assintomática.
Os linfomas são tumores malignos que surgem do tecido linfoide. De acordo com a classificação da OMS de 2016, eles são divididos em dois grupos principais: linfomas de Hodgkin e linfomas não Hodgkin. No linfoma de Hodgkin (LH), 60% a 80% dos casos apresentam linfadenopatia (LAP) indolor na região cervical.1 Enquanto 20% dos sintomas B são observados no LH em seu estágio inicial, essa taxa pode aumentar na doença em estágio avançado. Em outras palavras, aproximadamente 80% dos casos de linfoma de Hodgkin em estágio inicial com envolvimento supradiafragmático podem ser assintomáticos.2 As manifestações clínicas do linfoma não Hodgkin (LNH) variam de acordo com o subtipo histológico. Os sintomas B podem ser observados em 40% dos casos de LNH com subtipo histológico agressivo, enquanto formas progressivas indolentes são observadas de 20% a 25% consecutivamente.3 O diagnóstico do linfoma é feito por exame histopatológico. Embora a biópsia feita por punção aspirativa por agulha fina (PAAF) possa ser feita para diferenciar carcinoma e tumores que causam metástase linfonodal, esse exame não é suficiente para o diagnóstico específico de linfoma, a biópsia excisional é necessária para a subtipagem histológica. Embora a PAAF ou biópsias cegas sejam benéficas na recorrência da doença, os resultados falso‐negativos da PAAF em pacientes recém‐diagnosticados constituem um desafio diagnóstico.
A relação neutrófilos/linfócitos (RNL) é um parâmetro que mostra a condição inflamatória sistêmica. Houve muitos desenvolvimentos em relação à correlação entre câncer e inflamação.4 As publicações indicam que a RNL pode ser um marcador prognóstico de mortalidade em eventos cardíacos importantes, diversos tumores sólidos e neoplasias hematológicas.5–10
Com a LAP cervical assintomática isolada, nos casos em que a anamnese, o exame físico e os achados de imagem não puderem determinar a causa etiológica, os médicos fazem uma biópsia excisional para a diferenciação entre o linfoma em estágio inicial ou causas infecciosas ou reativas. O procedimento cirúrgico a ser feito pode ser arriscado de acordo com a experiência do cirurgião e a complexa anatomia da região e, por esses motivos, o diagnóstico de linfoma pode chegar a não ser estabelecido em pacientes não submetidos à cirurgia. Portanto, em pacientes com LAP assintomática são necessários alguns testes preditivos para apoiar o diagnóstico de linfoma antes da biópsia.
Este estudo retrospectivo foi criado para determinar o valor preditivo da RNL no diagnóstico de LH e LNH em pacientes com LAP cervical assintomática isolada e submetidos à biópsia excisional.
MétodoAprovação do Comitê de ÉticaO estudo foi conduzido de acordo com os princípios da Declaração de Helsinque e foi aprovado pelo Harran University Corporate Ethics Committee, com permissão da HRU/20.02.08 de 27/01/2020.
Características dos pacientesForam incluídos em nosso estudo retrospectivo 90 pacientes admitidos entre 2016 e 2019 nas clínicas de otorrinolaringologia e hematologia do Sanliurfa Mehmet Akif Inan Training and Research Hospital devido à LAP cervical assintomática isolada, presente por pelo menos 4 semanas com linfonodos patológicos persistentes na região cervical. Foram incluídos pacientes com idade mínima de 18 anos, sem causa etiológica determinada através de anamnese, exame físico e achados laboratoriais, com suspeita de linfoma. Foi feita biópsia excisional de linfonodo em todos os 90 pacientes. Todos os pacientes foram submetidos a exame otorrinolaringológico completo, inclusive exame da orelha, exame endoscópico das cavidades nasais e nasofaringe, orofaringe, hipofaringe, palpação da laringe, exames endoscópicos, exame do couro cabeludo e facial, exame da tireoide e palpação do pescoço. Os pacientes foram submetidos a estudo de alta definição completa com tecnologia HDR (high dynamic range) e especial imaging modes (SIM) com o uso de sistemas endoscópicos (Richard Wolf, Endocam Logic HD Knittlingen, Alemanha) no exame da nasofaringe e também por meio indireto com investigação laringoscópica, a qual determinou que não havia lesões nas mucosas. Os exames de velocidade de hemossedimentação e níveis de proteína C‐reativa foram solicitados a todos os pacientes. Todos os pacientes foram testados para anticorpos IgM e IgG antitoxoplasma, citomegalovírus (CMV), rubéola, herpes e para capsídeo viral da mononucleose (EBV). Em todos os pacientes, os resultados sorológicos de anticorpos IgM foram negativos e a presença de infecção viral aguda foi excluída. Além disso, os testes anti‐HIV, anti‐HCV (vírus da hepatite) e HbsAg foram negativos para todos os pacientes. Testes sorológicos específicos, como brucelose, tularemia, sífilis, CMV‐PCR e EBV e parvovírus B19, foram solicitados para pacientes potencialmente suspeitos e possíveis doenças infecciosas virais/bacterianas foram excluídas. Além disso, caso houvesse suspeita de doença autoimune, os níveis de anticorpos antinucleares (ANA) e anticorpos do fator reumatoide (FR) foram verificados e os distúrbios reumatológicos excluídos. O teste cutâneo de tuberculina (PPD) foi solicitado em pacientes com histórico de tuberculose e os pacientes com diagnóstico de tuberculose foram excluídos. Todos os pacientes receberam antibioticoterapia por 14 dias contra possíveis agentes infecciosos. Pacientes que apresentavam lesão sólida foram excluídos. Considerando que pacientes com massas cervicais unilaterais e massa supraclavicular poderiam apresentar metástases iniciais, foram solicitadas avaliações de doenças torácicas, clínica médica e avaliações oncológicas e os pacientes sem suspeita de linfoma foram excluídos. Pacientes que apresentaram linfocitose absoluta (> 5×103μL) no hemograma completo e cuja análise de citometria de fluxo para leucemia linfocítica crônica (LLC) apresentou linfoma folicular ou forma leucêmica do linfoma da zona marginal não foram incluídos. Os pacientes que haviam recebido, por qualquer motivo, corticoterapia nos 6 meses anteriores não foram incluídos. As amostras de sangue dos pacientes foram coletadas de veias periféricas no momento da admissão. Os hemogramas foram feitos com o sistema Abbott Architect c‐8000. A contagem de leucócitos, neutrófilos e linfócitos de todos os pacientes foram confirmadas por esfregaço de sangue periférico. A RNL foi calculada dividindo‐se a contagem absoluta de neutrófilos no sangue total pela contagem absoluta de linfócitos, cujas relações foram confirmadas por esfregaço de sangue periférico. As análises histopatológicas de todos os pacientes foram avaliadas pelo mesmo patologista e os pacientes foram avaliados em três grupos: linfadenopatia (LAP) reativa, LH e LNH.
Técnica cirúrgicaAs biópsias dos pacientes foram feitas com anestesia local, sedação ou anestesia geral conforme preferência do paciente e a decisão do cirurgião. Em todos os pacientes, o campo cirúrgico foi depilado, caso necessário, antes do início do procedimento cirúrgico. Os pacientes foram colocados em posição supina, com a cabeça voltada para o lado oposto. A cabeça foi colocada em extensão, colocou‐se um suporte sob os ombros e o pescoço. O sítio cirúrgico foi submetido à assepsia com solução de iodo e cobertura estéril. Adrenalina (0,025mg/mL) e lidocaína (20mg/mL) foram aplicadas com uma seringa calibre 22 para reduzir o sangramento da incisão. Então foi feita uma incisão menor com bisturi lâmina 15, por onde o linfonodo foi removido por inteiro. Uma vez ultrapassados a pele e o tecido adiposo subcutâneo, quando as estruturas vasculares e os nervos no campo cirúrgico puderam ser preservados no local, eles foram protegidos com um retrator tipo Farabeuf. Quando as estruturas não puderam ser preservadas, elas foram removidas do campo cirúrgico e suturadas com vicril (Pegelak® Rapid Doğsan Ankara, Turquia) ou cauterizadas com cautério bipolar (Petaş Petkot 500S, Ankara, Turquia) e então a cápsula do linfonodo pode ser abordada. As estruturas nervosas sempre foram retraídas e protegidas.
Com a ajuda do fórceps Kelly, juntamente com a cápsula linfonodal, o linfonodo foi totalmente removido por dissecção romba. Após o controle do sangramento com cautério bipolar e sutura vascular com 4,0 vycril rapidle (Pegelak® Rapid, Doğsan Ankara, Turquia), foi feita sutura subcutânea com 4,0‐5,0 prolene (Propylene®, Doğsan Ankara, Turquia). Não foram usados drenos. Finalmente, curativos de compressão foram feitos com a aplicação de pomada de tiocilina no campo cirúrgico. Todos os pacientes receberam alta após um período de observação de 6 a 8 horas. Se os pacientes não fossem submetidos a avaliação após a remoção dos curativos no dia seguinte, o sítio cirúrgico era ocluído com uma pequena gaze e nenhum curativo era feito a partir do 2° dia de pós‐operatório. Na alta hospitalar os pacientes receberam prescrição oral de amoxicilina‐clavulanato por uma semana, além de paracetamol para dor, quando necessário. Se nenhum problema fosse observado após uma semana, o tratamento clínico era encerrado com a remoção das suturas.
Análise estatísticaAs análises estatísticas foram feitas com o software SPSS versão 20 (IBM Corp., Armonk, NY).
Os testes de Kolmogorov‐Smirnov e Shapiro‐Wilk foram usados para avaliar a distribuição dos dados. Os dados descritivos são apresentados como frequências (n) e porcentagens (%) para variáveis categóricas e mediana com intervalo interquartil (IIQ) para variáveis numéricas sem distribuição normal. O teste do qui‐quadrado de Pearson foi usado para comparar variáveis categóricas, o teste de Kruskal‐Wallis foi usado para comparar variáveis numéricas entre os grupos. O teste post hoc de Dunn foi usado para comparação post hoc em pares; um valor de p <0,05 foi considerado como estatisticamente significante.
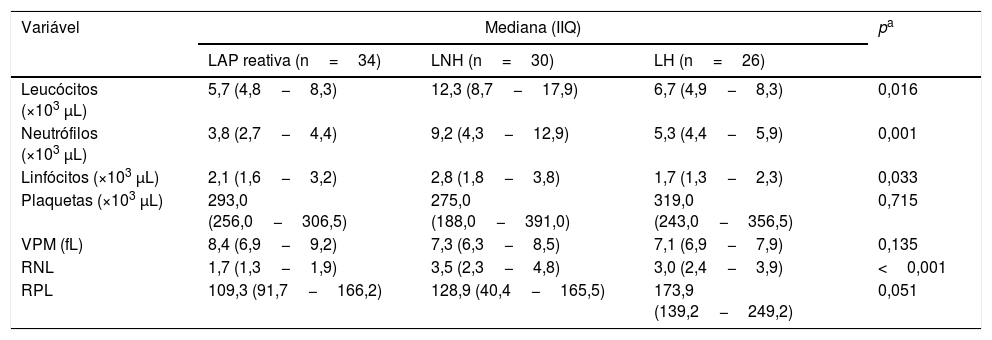
ResultadosEste estudo comparativo foi feito com 90 pacientes admitidos em nossa clínica de otorrinolaringologia e hematologia com LAP cervical, submetidos à biópsia excisional diagnóstica de linfonodo e diagnosticados com LAP reativa, LNH ou LH. Dos pacientes, 34 apresentaram LAP reativa, 30 tinham LNH e 26 tinham LH. Foram diagnosticados 56 pacientes com linfoma (62,2%), LH ou LNH, enquanto 34 pacientes (38,8%) foram diagnosticados com LAP reativa. A mediana da idade foi de 27,0 anos no grupo LAP reativa, 49,0 anos no grupo LNH e 31,0 anos no grupo LH. Houve diferença estatisticamente significante entre os grupos (p=0,016) (tabela 1). Nas comparações pareadas por idade, houve diferença estatisticamente significante apenas entre os grupos LAP reativa e LNH (p=0,016).
Dados demográficos dos pacientes
| Variável | LAP reativa(n=34) | LNH(n=30) | LH(n=26) | p |
|---|---|---|---|---|
| Idade (anos), mediana (IIQ) | 27,0 (20,5−41,0) | 49,0 (41,0−58,0) | 31,0 (24,5−44,5) | 0,016a |
| Sexo, n (%) | 0,064b | |||
| Feminino | 20 (58,8) | 6 (20,0) | 8 (30,8) | |
| Masculino | 14 (41,2) | 24 (80,0) | 18 (69,2) |
LAP, linfadenopatia; LNH, linfoma não Hodgkin; LH, linfoma de Hodgkin; IIQ, intervalo interquartil.
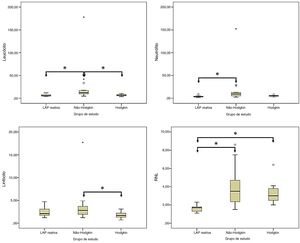
A mediana da contagem de leucócitos foi de 5,7×103μL no grupo LAP reativa, 12,3×103μL no grupo LNH e 6,7×103μL no grupo LH. Essa diferença foi estatisticamente significante (p=0,016). A mediana da contagem de neutrófilos foi de 3,8×103μL no grupo LAP reativa, 9,2×103μL no grupo LNH e 5,3×103μL no grupo LH. A diferença entre os grupos foi estatisticamente significante (p=0,001). A mediana da contagem de linfócitos foi de 2,1×103μL no grupo LAP reativa, 2,8×103μL no grupo LNH e 1,7×103μL no grupo LH. A diferença foi estatisticamente significante para a contagem de linfócitos entre os grupos (p=0,033). A mediana da contagem de plaquetas foi de 293,0×103μL no grupo LAP reativa, 275,0×103μL no grupo LNH e 319,0×103μL no grupo LH. Essa diferença não foi estatisticamente significante (p=0,715). A mediana da RNL foi de 1,7 no grupo LAP reativa, 3,5 no grupo LNH e 3,0 no grupo LH. Essa diferença foi estatisticamente significante (p <0,001). A mediana da RPL foi de 109,3 no grupo LAP reativa, 128,9 no grupo LNH e 173,9 no grupo LH. A diferença na RPL não foi estatisticamente significante entre os grupos (p=0,051) (tabela 2).
Comparação das variáveis do hemograma completo entre os grupos de estudo
| Variável | Mediana (IIQ) | pa | ||
|---|---|---|---|---|
| LAP reativa (n=34) | LNH (n=30) | LH (n=26) | ||
| Leucócitos (×103 μL) | 5,7 (4,8−8,3) | 12,3 (8,7−17,9) | 6,7 (4,9−8,3) | 0,016 |
| Neutrófilos (×103 μL) | 3,8 (2,7−4,4) | 9,2 (4,3−12,9) | 5,3 (4,4−5,9) | 0,001 |
| Linfócitos (×103 μL) | 2,1 (1,6−3,2) | 2,8 (1,8−3,8) | 1,7 (1,3−2,3) | 0,033 |
| Plaquetas (×103 μL) | 293,0 (256,0−306,5) | 275,0 (188,0−391,0) | 319,0 (243,0−356,5) | 0,715 |
| VPM (fL) | 8,4 (6,9−9,2) | 7,3 (6,3−8,5) | 7,1 (6,9−7,9) | 0,135 |
| RNL | 1,7 (1,3−1,9) | 3,5 (2,3−4,8) | 3,0 (2,4−3,9) | <0,001 |
| RPL | 109,3 (91,7−166,2) | 128,9 (40,4−165,5) | 173,9 (139,2−249,2) | 0,051 |
IIQ, intervalo interquartil; LAP, linfadenopatia; LNH, linfoma não Hodgkin; LH, linfoma de Hodgkin; VPM, volume plaquetário médio; RNL, relação neutrófilos/linfócitos; RPL, relação plaquetas/linfócitos.
Na comparação pareada, houve diferenças estatisticamente significantes na contagem de linfócitos entre os grupos LAP reativa e LNH e entre os grupos LNH e LH (p=0,002 e p=0,004, respectivamente); na contagem de neutrófilos entre os grupos LAP reativa e LNH (p <0,001); e na contagem de linfócitos entre os grupos LNH e LH (p=0,030). Além disso, a RNL foi estatisticamente significativamente maior nos grupos LNH e LH do que no grupo LAP reativa (p <0,001 e p <0,001, respectivamente) (fig. 1).
DiscussãoLesões tumorais de cabeça e pescoço podem ser vistas com bastante frequência em todas as faixas etárias. Existem complexidades e controvérsias sobre as abordagens no diagnóstico diferencial e, portanto, uma abordagem sistemática é necessária. Muitas doenças podem ser consideradas no diagnóstico diferencial dos tumores de cabeça e pescoço. Há um amplo espectro de doenças, inclusive lesões benignas relacionadas a processos inflamatórios infecciosos e tumores congênitos, causas traumáticas e tumores malignos. Embora a anamnese, o exame físico, os exames laboratoriais e radiológicos orientem o diagnóstico dessas lesões, geralmente é possível obter um diagnóstico definitivo com o exame histopatológico das amostras do tecido obtidas cirurgicamente nesses pacientes.11 A biópsia por punção aspirativa com agulha fina é um método acessível, confiável e simples que pode ser usado para o diagnóstico dessas lesões cervicais. As desvantagens mais conhecidas desse exame são o fato de necessitar de citologistas experientes, não fornecer resultados das lesões e não poder ser feito na região onde a doença está presente.12 Sabe‐se que a PAAF é um método diagnóstico eficaz para tumores de cabeça e pescoço, exceto para linfomas. Essa especificidade, sensibilidade e precisão diagnóstica em outras lesões de cabeça e pescoço perdem sua validade quando se trata de linfoma.13 Considerando casos falso negativos, um resultado negativo de PAAF não consegue excluir o diagnóstico de linfoma.14 Os benefícios da PAAF para o diagnóstico são limitados quando se trata de subtipagem. Nesse caso, a biópsia excisional é necessária, porque alterará a forma do tratamento.15
LAP é o termo usado para definir as circunstâncias em que os linfonodos se tornam anormais em tamanho, consistência e número. Na etiologia da LAP, estão incluídas causas infecciosas, doenças autoimunes, tumores de órgãos sólidos, neoplasias hematológicas, medicamentos e doenças sistêmicas.16 A LAP pode ser localizada ou generalizada. Como a região cervical é rica em tecido linfoide, LAP reativa pode ocorrer por causas infecciosas e doenças malignas hematológicas, como leucemia e linfoma, e que geralmente podem se originar nessa região. De fato, em alguns linfomas em estágio inicial, a área afetada pode ser apenas a região cervical.
Na abordagem etiológica dos pacientes com LAP, um histórico completo e exame físico são essenciais para obter algumas pistas sobre a doença subjacente. Tempo de aparecimento, velocidade de crescimento achados de processo infeccioso, presença de doenças subjacentes, medicamentos usados, exposição prévia à radiação (radioterapia ou exposição à radiação), prurido associado, aumento da dor na região do linfonodo com a ingestão de álcool e a presença de sintomas B sistêmicos (febre, suores noturnos e perda de pelo menos 10% do peso corporal nos últimos 6 meses) podem fornecer algumas pistas etiológicas.17–19 Além disso, no exame físico, o diâmetro dos linfonodos, a estrutura, se é fixo ou não, sensibilidade/fixação, presença de achados associados de infecção e presença de hepatoesplenomegalia também podem dar uma ideia sobre a etiologia dos linfonodos. No entanto, alguns pacientes podem ser assintomáticos e apresentar LAP cervical isolada. A presença de LAP maior do que 1cm na região presente há pelo menos 4 semanas requer uma investigação mais aprofundada.20,21
Estudos demonstraram que essas características linfonodais podem ter um papel importante no desenvolvimento de câncer, no processo inflamatório e na sobrevivência de pacientes com câncer.4 Também há evidências de que os neutrófilos, que são os componentes da inflamação relacionada ao câncer, têm um papel na progressão tumoral e no desenvolvimento de metástases.22 Além disso, foi demonstrado que os linfócitos no microambiente do tecido tumoral são supressores de tumores e, ao contrário dos neutrófilos, suprimem a inflamação e a tumorigênese.23 Após esses avanços na detecção de transformação maligna, acredita‐se que houve um aumento no número de estudos sobre a RNL e que ambos podem ser um indicador, um aumento na contagem de neutrófilos e supressão de linfócitos, demonstram o equilíbrio entre o estado pró‐inflamatório e a imunidade antitumoral. O valor prognóstico da RNL tem sido relatado como um dos indicadores de inflamação sistêmica, em muitos tipos de câncer e neoplasias hematológicas, especialmente nos subtipos de linfoma.6–10
Existem estudos sobre a previsão de malignidade do linfoma por meio de marcadores bioquímicos antes da biópsia da LAP. No estudo de Matsumoto et al., os níveis séricos de IL‐2R, outro indicador de processo inflamatório, demonstraram ser mais altos em pacientes com linfoma do que no grupo LAP reativa.24 Em outro estudo, Tjusi et al. demonstraram que antes da biópsia da LAP os níveis séricos de timidina quinase e IL‐2R eram mais altos no grupo de linfoma maligno.25 Um estudo na literatura investigou o valor preditivo diagnóstico da RNL antes da biópsia excisional em pacientes com LH.20 No presente estudo, comparamos a RNL no grupo LAP reativa em pacientes diagnosticados com LNH e LH, com o resultado da biópsia.
Em nosso estudo, pacientes que apresentavam LAP cervical isolada assintomática e foram submetidos a biópsia excisional da LAP foram incluídos e examinados após serem divididos em três grupos, de acordo com o resultado da histopatologia. A média de idade dos pacientes diagnosticados com LH e LNH foi superior ao grupo LAP reativa. Na literatura, estudos com grandes populações de pacientes mostraram achados semelhante ao do nosso estudo para etiologia da LAP: aumento das taxas de malignidade com o aumento da idade.21–25
Em nosso estudo, a predominância do sexo masculino foi detectada de acordo com o grupo LAP reativa, embora não tenha sido estatisticamente significante em pacientes com LH e LNH considerando‐se o resultado da biópsia. Os estudos na literatura demonstraram que tanto LH quanto LNH são mais comuns em homens, o que está de acordo com nossos achados.26
Tanto a contagem total de leucócitos (WBC, do inglês White Blood Cells) quanto a contagem de neutrófilos nos grupos LNH e LH foram significantemente maiores do que no grupo LAP reativa. A mediana da contagem de linfócitos também foi significantemente maior no grupo LNH do que nos grupos LAP reativa e LH. A mediana da RNL foi de 1,7 no grupo LAP reativa, 1,7 (1,3‐1,69) no grupo LH 3 (2,4−3,9) e 3,5 no grupo LNH (2,3−4,8). Antes da excisão da LAP, a RNL era significativamente maior no grupo linfoma do que no grupo LAP reativa (p <0,001).
Em um estudo sobre valores normais da RNL, no qual o valor de corte deveria ser adotado, o valor médio da RNL foi de 1,65 em 413 adultos saudáveis.27 Os valores de corte da RNL foram determinados de maneira diferente em diferentes subtipos de linfoma. No linfoma angioimunoblástico de células T em 2020, uma RNL ≥ 2,2 demonstrou estar relacionada a um prognóstico ruim.28 No LNH de células NK‐T, a RNL ≥ 3,6 foi associada a um prognóstico ruim.29 Na metanálise de 2.297 casos e 9 grandes estudos relacionados ao papel prognóstico da RNL no LNH difuso de grandes células B, foi demonstrado o efeito da elevada RNL na sobrevida geral (SG) e na sobrevida livre de progressão (SLP). O valor do ponto de corte da RNL foi determinado como <3 em 7 desses estudos.30 Em nosso estudo, semelhantemente à literatura, a mediana da RNL no braço LH foi 3 e no braço LNH foi 3,5.
Há sete parâmetros no sistema International Prognostic Score (IPS), o mais frequentemente usado na determinação do prognóstico de LH em estágio avançado. Dois desses 7 parâmetros, que já demonstraram estar associados a um mau prognóstico, são: número total de leucócitos >15.000 microL e contagem absoluta de linfócitos <600 microL.31 Um dos melhores marcadores desses dois parâmetros na IPS que mostra aumento da contagem de leucócitos e diminuição da contagem de linfócitos é a RNL. Verificou‐se que a elevação da RNL no LH está associada a um mau prognóstico.32
Existem também estudos sobre o valor diagnóstico da RNL na doença oncológica. No estudo de Seretis et al., relacionado à neoplasia maligna e RNL em nódulos tireoidianos, como resultado da biópsia, RNL de 1,8‐1,9 foi detectada no grupo com nódulo tireoidiano benigno, enquanto uma RNL de 3‐3,1 foi detectada em pacientes com câncer papilar da tireoide e foi demonstrado que a RNL pode predizer a malignidade de nódulos tireoidianos.33 Kılıçkap et al. verificaram que, nos casos em que a biópsia endoscópica era suspeita de câncer de cólon, a RNL> 2,02 antes da biópsia estava associada ao diagnóstico de câncer de cólon.34
Há um estudo de Çolak et al. sobre o valor preditivo diagnóstico da RNL em pacientes com LAP. Em 46 pacientes com LAP cervical assintomática, a RNL foi calculada antes da biópsia excisional. Nos pacientes com diagnóstico de LH, a média da RNL foi de 5,8, enquanto no grupo LAP reativa foi de 2,6. Antes da biópsia excisional, a RNL era significantemente maior no grupo de linfoma de Hodgkin do que no grupo LAP reativa.20 Em nosso estudo, a mediana da RNL=3 foi detectada no braço LH. Nesse último estudo, acreditou‐se que a detecção da RNL no grupo LH, maior do que em nosso estudo, era devida ao fato de alguns dos casos deste estudo estarem em estágio avançado. Todos os pacientes do nosso estudo são casos de linfoma em estágio inicial diagnosticado com LAP cervical isolada. Outro estudo mostrou que a RNL é menor no estágio inicial do que no estágio avançado.35
A relação entre a RNL e o prognóstico em muitos tumores sólidos e subtipos de linfoma e seu papel preditivo no diagnóstico de alguns tipos de câncer já foram investigados. No entanto, não há estudo sobre o valor diagnóstico da RNL em pacientes com LNH em pacientes submetidos à biópsia excisional da LAP com um pré‐diagnóstico de linfoma. Embora exista um estudo relacionado ao papel da RNL no diagnóstico de LH, o papel da RNL no LH em estágio inicial, com LAP cervical isolada, como em nossa série de casos, não foi estudado. As maiores limitações do nosso estudo foram o desenho retrospectivo, o baixo número de casos e a incapacidade de analisar os subtipos de linfoma não Hodgkin. O valor preditivo da RNL no diagnóstico de linfoma deve ser apoiado por estudos prospectivos multicêntricos com um número maior de casos.
ConclusãoDe acordo com os resultados de nosso estudo, a RNL foi significantemente maior em pacientes admitidos com LAP assintomática isolada e com diagnóstico de linfoma e que foram diagnosticados com LH e LNH em estágio inicial em comparação àqueles com LAP reativa. A RNL, que é um teste de baixo custo, rápido e de fácil acesso, tem um valor preditivo no diagnóstico de linfoma em pacientes com LAP assintomática.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Kaplama ME, Güneş AK, Erden B. Evaluation of the predictive role of neutrophil/lymphocyte ratio in the diagnosis of lymphoma in patients with asymptomatic and isolated cervical lymphadenopathy. Braz J Otorhinolaryngol. 2021;87:210–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.