Tumores de glândulas salivares são um grupo diversificado de lesões, com várias origens e comportamentos extremamente diferentes, resultam em distintos desfechos para os pacientes. Portanto, a necessidade de descobrir novos marcadores com a capacidade de predizer o comportamento de neoplasias de glândulas salivares benignas e malignas é crucial. O syndecan‐1 é uma proteína da superfície celular com papéis significativos em vários aspectos da função tumoral. Sua expressão nas neoplasias das glândulas salivares, especialmente seu componente estromal, ainda não foi investigada.
ObjetivosAvaliar a imunopositividade do syndecan‐1 nos componentes epiteliais e estromais das neoplasias de glândulas salivares e compará‐la entre os subtipos benigno e maligno, além de avaliar sua correlação com os parâmetros clínico‐patológicos.
MétodoForam corados 133 tumores de glândulas salivares imuno‐histoquimicamente com syndecan‐1 e a intensidade e porcentagem dessa proteína foram determinadas, comparadas entre as lesões e correlacionadas com fatores clínico‐patológicos.
ResultadosA análise estatística das lesões com tamanho amostral suficiente mostrou diferenças significantes em porcentagem e intensidade entre os componentes epiteliais e estromais de todos os tumores (p<0,05). As comparações pareadas demonstraram uma porcentagem de coloração significantemente maior das células epiteliais (p=0,02) no tumor de Warthin em comparação com o adenoma pleomórfico e o carcinoma adenoide cístico. Da mesma forma, foram observadas intensidades de coloração e/ou percentagens significantemente maiores no carcinoma mucoepidermoide e no carcinoma adenoide cístico em comparação ao adenoma pleomórfico e ao tumor de Warthin (p<0,05). Dos fatores clinico‐patológicos, houve apenas uma correlação negativa significante entre o percentual estromal de carcinoma mucoepidermoide e a idade; e uma diferença significante entre a intensidade estromal+porcentagem de carcinoma adenoide cístico e sexo (p<0,05).
ConclusõesDe acordo com nossos achados, o syndecan‐1 estromal se correlaciona com o comportamento maligno de tumores de glândulas salivares, demonstra uma expressão mais alta, indica um papel para o syndecan‐1 na invasão e metástase tumoral.
O sistema salivar é composto por três pares bilaterais das glândulas salivares maiores (parótida, submandibular e sublingual) e centenas de glândulas salivares menores localizadas e disseminadas no trato respiratório superior.1 Os tumores originados desses tecidos exibem considerável variação histológica e são classificados em neoplasias benignas e malignas, com agressividade variável e potencial para desenvolver metástases.2 Como as glândulas salivares normais têm um número significativo de tipos diferentes de células, os tumores da glândula salivar podem ter origem em qualquer um deles.1 Essa diversidade celular e as características histológicas sobrepostas causam dificuldades no diagnóstico e na compreensão da patogênese desses tumores. Nos últimos anos, a avaliação molecular e a identificação de detalhes biológicos das células têm sido usadas para diagnósticos mais precisos e tratamento de tumores.3 Estudos anteriores identificaram vários marcadores moleculares responsáveis pelo desenvolvimento e pela progressão dos tumores de glândulas salivares.1,3,4 Uma melhor percepção das alterações celulares e moleculares nos tumores de glândula salivar pode fornecer uma visão mais detalhada sobre a patogênese molecular, o diagnóstico e tratamento dessas neoplasias. Vários estudos em tumores de glândulas salivares têm investigado o envolvimento de diferentes marcadores em vários aspectos da tumorigênese, tais como proliferação, apoptose, migração celular, regulação do ciclo celular e metástase.1,5,6
A adesão exata e precisa das células umas às outras e ao seu redor depende da presença e da função de diferentes moléculas de adesão celular.7 Syndecan‐1 (CD138) é um membro da família de proteoglicanos de sulfato de heparano da superfície celular que está envolvido em múltiplos eventos celulares pela ligação a vários fatores de crescimento e componentes da matriz extracelular.8 Essa proteína tem um papel essencial na homeostase epitelial, morfologia, diferenciação, proliferação e migração celular. Nos últimos anos, vários estudos sugeriram que o syndecan‐1 não apenas contribui para fenômenos biológicos celulares normais, mas também desempenha um papel em diferentes processos patológicos, inclusive tumores benignos e câncer.9 Apesar de a redução de syndecan‐1 ter sido relatada durante a transformação maligna em vários tipos de câncer, algumas malignidades, como linfoma não Hodgkin, glioma maligno e câncer de pâncreas, mostram aumento da expressão de CD138.10–13 Essas evidências exibem funções contraditórias do syndecan‐1 na patobiologia de diferentes tumores. Que seja de nosso conhecimento, há poucos estudos sobre a expressão de syndecan‐1 em tumores de glândulas salivares e há pouca informação disponível sobre seu padrão de expressão nessas lesões.14,15 O objetivo desse estudo foi avaliar e comparar a imunoexpressão do syndecan‐1 em uma variedade de tumores benignos e malignos de glândulas salivares e correlacionar sua expressão com os parâmetros clínico‐patológicos.
MétodoForam fixados em formol 133 blocos de tumores de glândulas salivares, obtidos dos arquivos do Departamento de Patologia Amir Alam, e embebidos em parafina. Essas neoplasias incluíram 30 adenomas pleomórficos, 30 tumores de Warthin, 2 adenomas basocelulares, 2 mioepiteliomas, 30 carcinomas adenoides císticos, 30 carcinomas mucoepidermoides e 9 carcinomas de células acínicas.
Dois patologistas revisaram as lâminas e os diagnósticos de todos os tumores foram confirmados. As amostras de carcinoma mucoepidermoide foram classificadas de acordo com o sistema de classificação de Brandwein16 e o carcinoma adenoide cístico foi categorizado como cribriforme, tubular e sólido com base nas características morfológicas. Os dados demográficos e clínicos de todos os pacientes, inclusive idade, sexo, localização e tamanho do tumor, metástase linfonodal e neuroinvasão, também foram recuperados.
Para a análise imuno‐histoquímica, cortes de tecido embebidos em parafina de 3 micrometros foram espalhadas em 3 lâminas revestidas com poli‐L‐lisina e subsequentemente imersas em diferentes graduações de álcool e reidratadas. A recuperação antigênica foi feita pela incubação (14min) das amostras com tampão citrato (pH=6,0) em um micro‐ondas. As secções foram tratadas com peróxido de hidrogênio a 0,3% (10min) para abolir a atividade das peroxidases endógenas e foram então expostas ao anticorpo monoclonal primário anti‐syndecan‐1 humano (clone MI15 Dako Corporation, Carpinteria, CA, EUA, diluição 1:40) à temperatura ambiente (1h). Finalmente, o sistema EnVision (Dako Cytomation, Glostrup, Dinamarca) foi usado neste estudo para revelar a coloração dos anticorpos à temperatura ambiente (30min). Os controles positivos consistiram em tecido de tonsila humana e as lâminas para controle negativo foram incubadas sem o anticorpo primário.
A percentagem de células positivas para câncer e estroma tumoral foi avaliada separadamente, como se segue: (0) negativo, (1) 1%‐10%, (2) 11%‐50% e (3)> 50%. A intensidade das células coradas foi classificada como baixa, intermediária e alta.17
A reconfirmação do diagnóstico inicial e toda a marcação imuno‐histoquímica foi feita por dois patologistas, com um microscópio de dupla observação e quaisquer divergências foram resolvidas por consenso.
Neste estudo, foram usados os testes de Spearman, Kruskal‐Wallis e U de Mann‐Whitney ajustados para comparações múltiplas e valores de p<0,05 foram considerados estatisticamente significantes.
ResultadosGlândulas salivares normais adjacentes aos tumores exibiram coloração de intensidade baixa a intermediária para syndecan‐1 em alguns tecidos ductais. Os tumores foram avaliados em relação a dois aspectos, células neoplásicas e estromais.
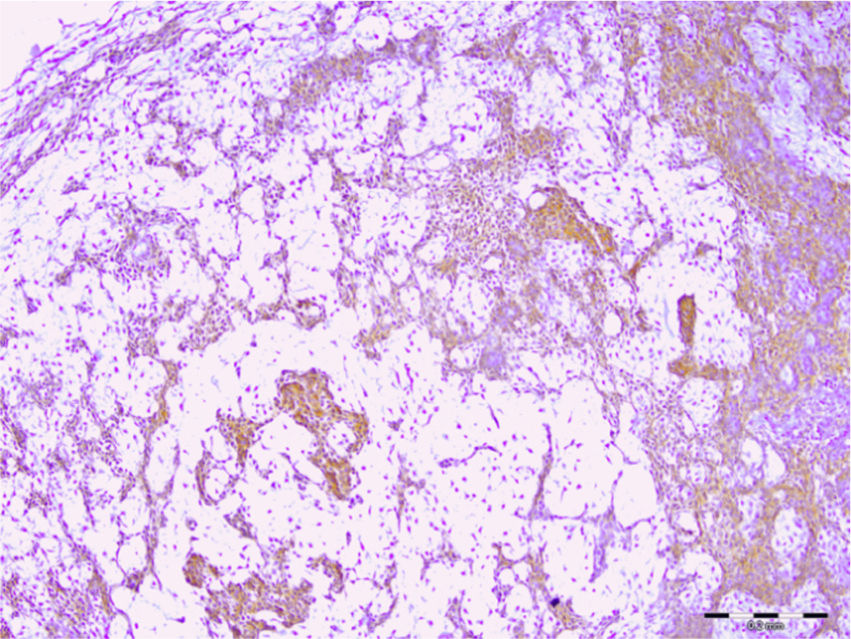
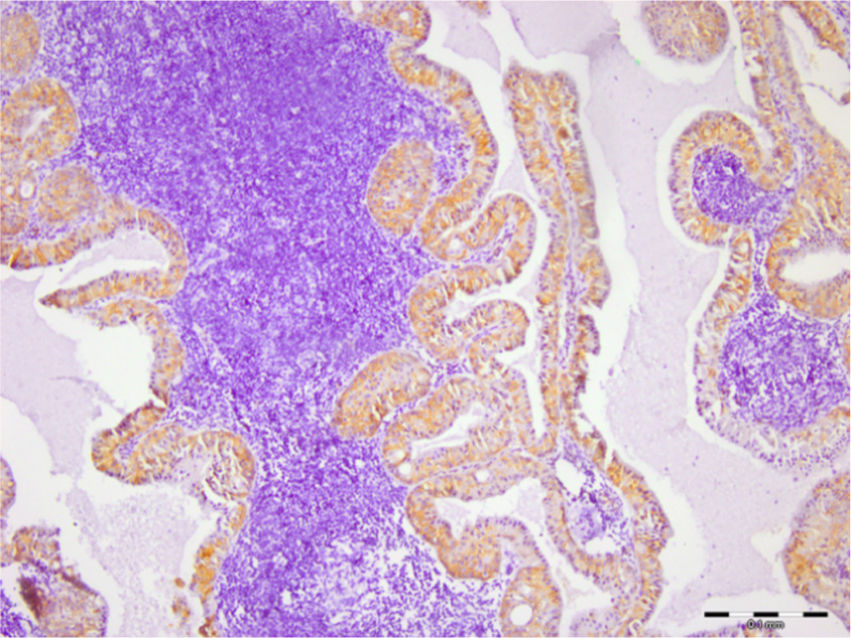
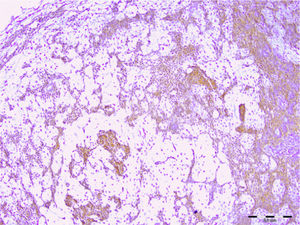
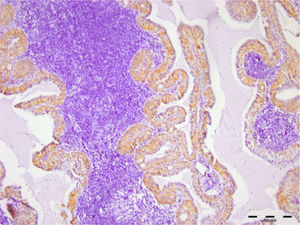
Todos (100%) dos 30 adenomas pleomórficos mostraram expressão de syndecan‐1 em células tumorais e a coloração foi localizada nos componentes citoplasmáticos e de membrana de células neoplásicas ductais e não ductais. Entretanto, 20 (67%) não apresentaram qualquer expressão dessa proteína no estroma e o restante apresentou baixo nível de imunopositividade (fig. 1). Quanto aos tumores de Warthin, a expressão de syndecan‐1 em células neoplásicas e estroma linfoide foi observada em 100% e 26% das amostras, respectivamente. A localização no citoplasma e na membrana da expressão de syndecan‐1 foi encontrada no epitélio oncocítico de duas camadas (fig. 2). Observamos alta expressão de syndecan‐1 em células tumorais em dois casos de adenoma de células basais e mioepitelioma. No entanto, a expressão estromal de CD138 nesses tumores foi baixa.
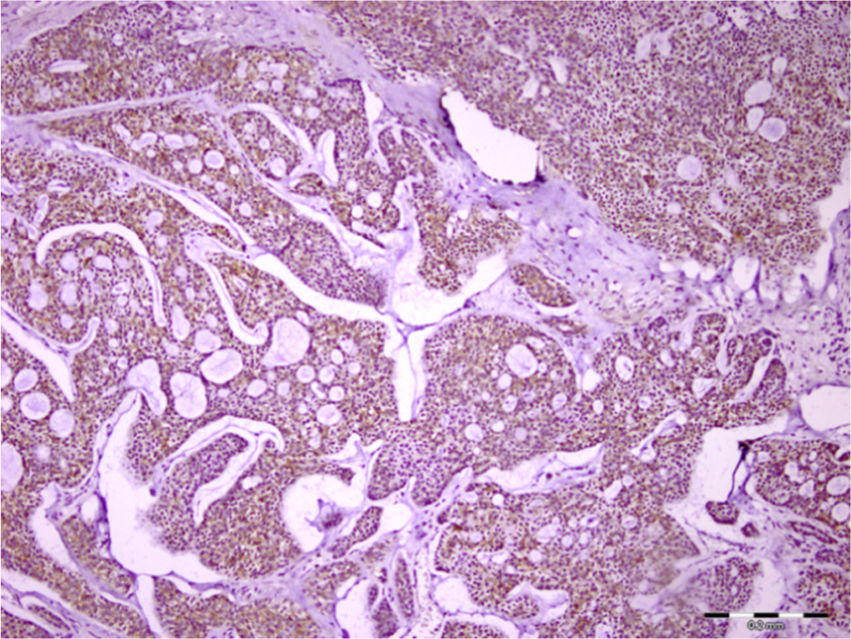
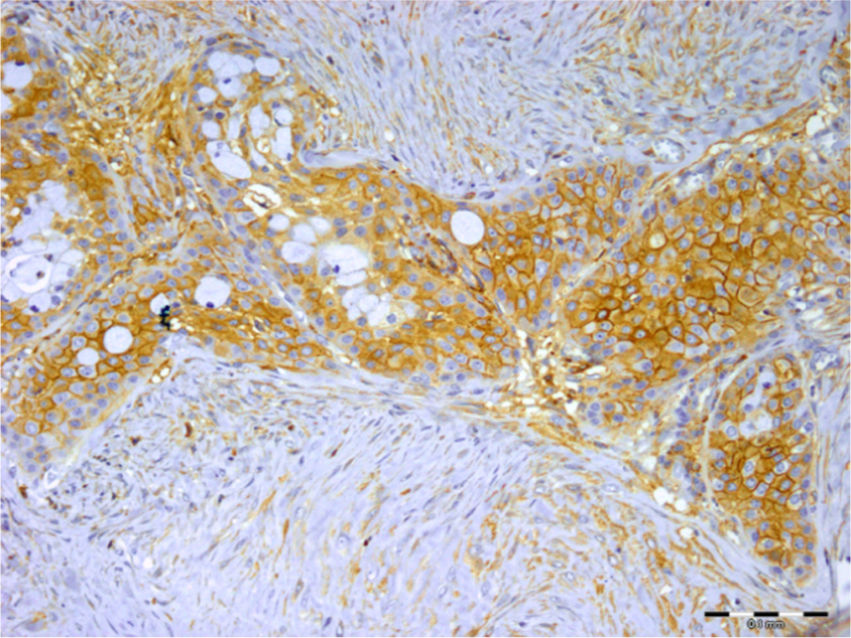
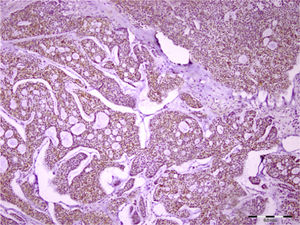
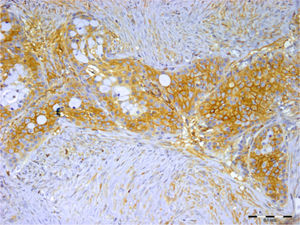
Em relação ao carcinoma adenoide cístico, 97% e 54% das amostras apresentaram imunocoloração em células tumorais e no estroma, respectivamente. Essa expressão foi mais proeminentemente vista no citoplasma da célula (fig. 3). O syndecan‐1 foi expresso nos componentes epiteliais e estromais de todos os carcinomas mucoepidermoides (100%). As células mucosas não foram coradas na maioria das amostras e a imunopositividade das células tumorais foi principalmente citoplasmática e às vezes da membrana (fig. 4). Todos os 9 (100%) casos de carcinoma de células acínicas foram positivos para syndecan‐1, tanto no estroma como nas células cancerígenas. A coloração citoplasmática foi observada na maioria das células com intensidade variável. Semelhante ao carcinoma de células acínicas, todos os três espécimes de CEC de parótida (100%) mostraram coloração para CD138. A porcentagem e a intensidade do syndecan‐1 nos componentes epitelial e estromal de todas as neoplasias estudadas são mostradas na tabela 1.
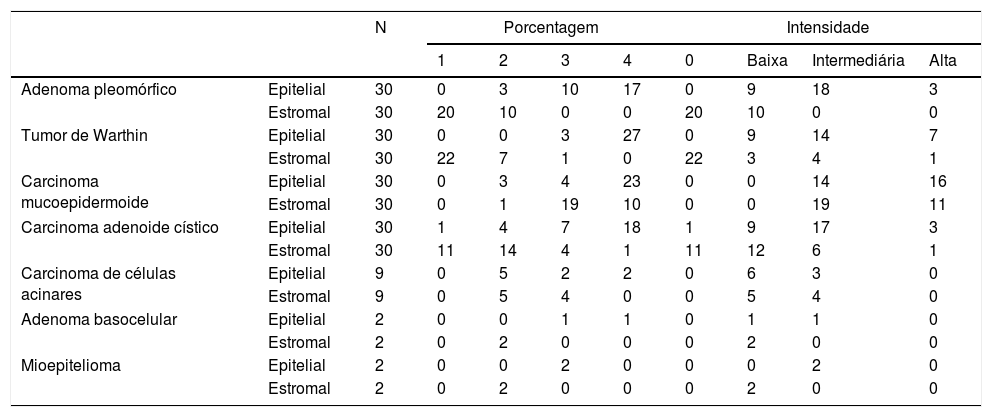
Porcentagem e intensidade do syndecan‐1 nos componentes epitelial e estromal de neoplasias salivares benignas e malignas
| N | Porcentagem | Intensidade | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 0 | Baixa | Intermediária | Alta | |||
| Adenoma pleomórfico | Epitelial | 30 | 0 | 3 | 10 | 17 | 0 | 9 | 18 | 3 |
| Estromal | 30 | 20 | 10 | 0 | 0 | 20 | 10 | 0 | 0 | |
| Tumor de Warthin | Epitelial | 30 | 0 | 0 | 3 | 27 | 0 | 9 | 14 | 7 |
| Estromal | 30 | 22 | 7 | 1 | 0 | 22 | 3 | 4 | 1 | |
| Carcinoma mucoepidermoide | Epitelial | 30 | 0 | 3 | 4 | 23 | 0 | 0 | 14 | 16 |
| Estromal | 30 | 0 | 1 | 19 | 10 | 0 | 0 | 19 | 11 | |
| Carcinoma adenoide cístico | Epitelial | 30 | 1 | 4 | 7 | 18 | 1 | 9 | 17 | 3 |
| Estromal | 30 | 11 | 14 | 4 | 1 | 11 | 12 | 6 | 1 | |
| Carcinoma de células acinares | Epitelial | 9 | 0 | 5 | 2 | 2 | 0 | 6 | 3 | 0 |
| Estromal | 9 | 0 | 5 | 4 | 0 | 0 | 5 | 4 | 0 | |
| Adenoma basocelular | Epitelial | 2 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 |
| Estromal | 2 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 | |
| Mioepitelioma | Epitelial | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 2 | 0 |
| Estromal | 2 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 | |
As análises estatísticas foram feitas apenas em lesões com tamanho de amostra suficiente, inclusive adenoma pleomórfico, tumor de Warthin, carcinoma adenoide cístico e carcinoma mucoepidermoide, e uma descrição foi fornecida para os tumores remanescentes.
O teste de Kruskal‐Wallis mostrou uma diferença significante na porcentagem e intensidade da expressão de syndecan‐1 nas células tumorais entre as lesões avaliadas (p=0,009 e p<0,001, respectivamente). A comparação pareada com o teste U de Mann‐Whitney revelou que apenas a porcentagem de CD138 das células do tumor de Warthin era significantemente maior em comparação com o adenoma pleomórfico e o carcinoma adenoide cístico (ambos, p=0,02).
Uma diferença significante também foi encontrada na intensidade de coloração e porcentagem de syndecan‐1 no estroma desses tumores (ambos, p<0,001). De acordo com as comparações pareadas (Mann‐Whitney), uma expressão significantemente menor da porcentagem de sindecam‐1 foi observada no estroma de adenoma pleomórfico em comparação ao carcinoma adenoide cístico (p=0,04) e intensidade+porcentagem de syndecan‐1 no carcinoma mucoepidermoide (ambos p<0,001). Além disso, no tumor de Warthin, a porcentagem de syndecan‐1 no estroma foi menor do que no carcinoma adenoide cístico (p=0,02) e tanto a intensidade quanto a porcentagem estavam reduzidas em comparação ao carcinoma mucoepidermoide (ambos, p<0,001). Houve uma diferença significante na porcentagem e intensidade estromais do syndecan‐1 entre o carcinoma mucoepidermoide e o carcinoma adenoide cístico (ambos, p<0,001), com maior imunorreatividade observada no primeiro.
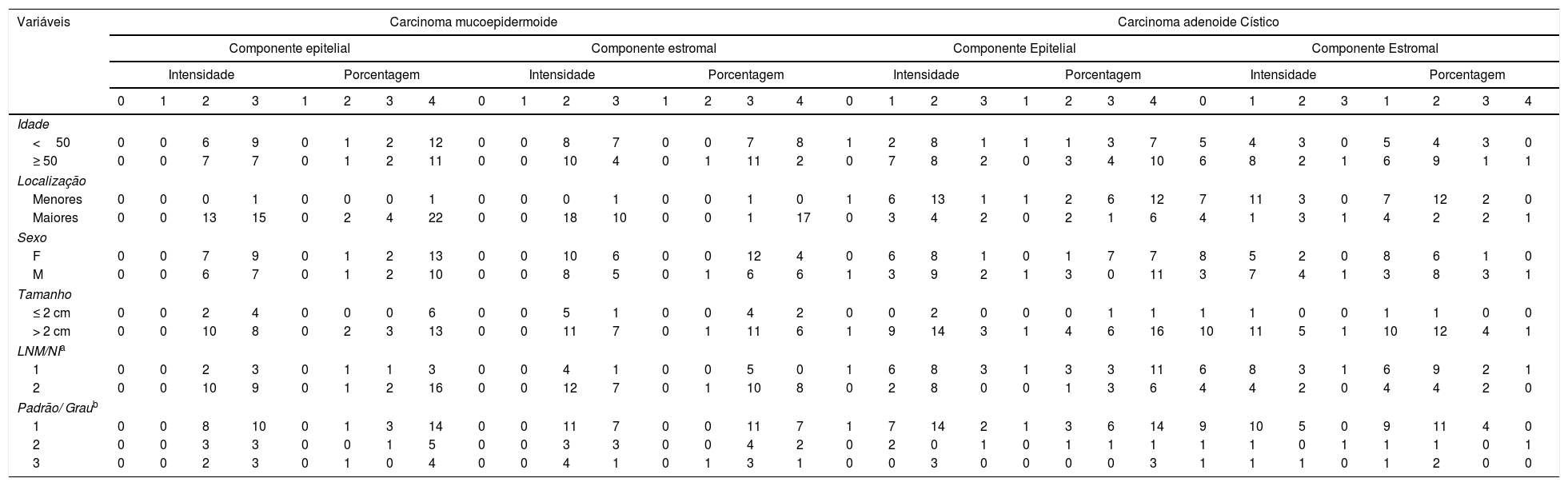
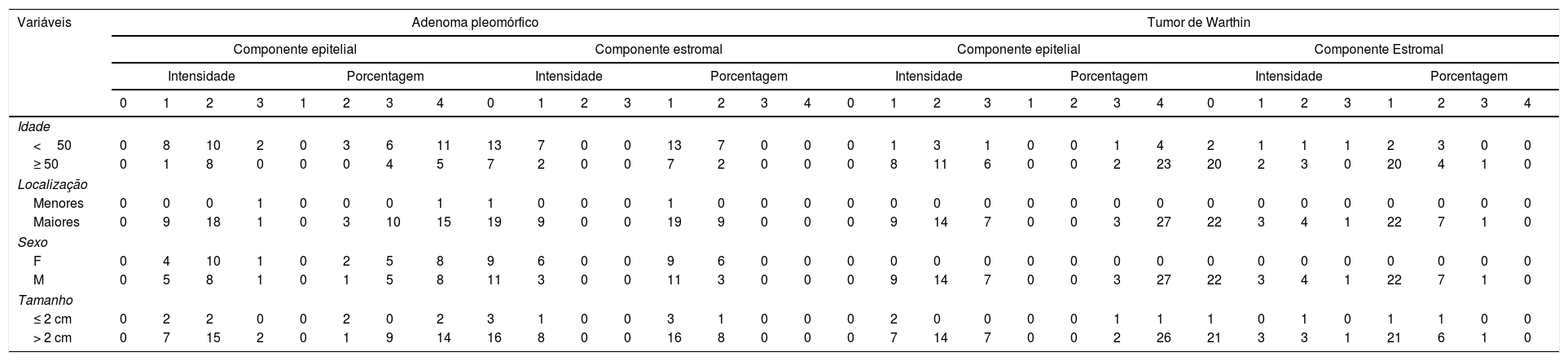
Não houve correlação entre a expressão de syndecan‐1 em células malignas e o estroma desses tumores (p=0,79). Também analisamos a associação da expressão de CD138 com fatores clínico‐patológicos, tanto nas células tumorais como no estroma das neoplasias estudadas. O teste de Spearman mostrou uma correlação negativa estatisticamente significante entre a porcentagem estromal de syndecan‐1 e a idade no grupo carcinoma mucoepidermoide (p=0,01, r=‐0,43). Também encontramos uma diferença significante na intensidade de coloração e porcentagem dessa proteína no estroma entre pacientes masculinos e femininos em amostras de carcinoma adenoide cístico (p=0,02 e p=0,03, respectivamente). Não houve correlação significante entre os outros parâmetros clínico‐patológicos e a expressão de syndecan‐1 nos tumores estudados (tabelas 2 e 3).
Expressão de Syndecan‐1 em tumores malignos de glândulas salivares de acordo com variáveis clínico‐patológicas disponíveis
| Variáveis | Carcinoma mucoepidermoide | Carcinoma adenoide Cístico | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Componente epitelial | Componente estromal | Componente Epitelial | Componente Estromal | |||||||||||||||||||||||||||||
| Intensidade | Porcentagem | Intensidade | Porcentagem | Intensidade | Porcentagem | Intensidade | Porcentagem | |||||||||||||||||||||||||
| 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | |
| Idade | ||||||||||||||||||||||||||||||||
| <50 | 0 | 0 | 6 | 9 | 0 | 1 | 2 | 12 | 0 | 0 | 8 | 7 | 0 | 0 | 7 | 8 | 1 | 2 | 8 | 1 | 1 | 1 | 3 | 7 | 5 | 4 | 3 | 0 | 5 | 4 | 3 | 0 |
| ≥ 50 | 0 | 0 | 7 | 7 | 0 | 1 | 2 | 11 | 0 | 0 | 10 | 4 | 0 | 1 | 11 | 2 | 0 | 7 | 8 | 2 | 0 | 3 | 4 | 10 | 6 | 8 | 2 | 1 | 6 | 9 | 1 | 1 |
| Localização | ||||||||||||||||||||||||||||||||
| Menores | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 6 | 13 | 1 | 1 | 2 | 6 | 12 | 7 | 11 | 3 | 0 | 7 | 12 | 2 | 0 |
| Maiores | 0 | 0 | 13 | 15 | 0 | 2 | 4 | 22 | 0 | 0 | 18 | 10 | 0 | 0 | 1 | 17 | 0 | 3 | 4 | 2 | 0 | 2 | 1 | 6 | 4 | 1 | 3 | 1 | 4 | 2 | 2 | 1 |
| Sexo | ||||||||||||||||||||||||||||||||
| F | 0 | 0 | 7 | 9 | 0 | 1 | 2 | 13 | 0 | 0 | 10 | 6 | 0 | 0 | 12 | 4 | 0 | 6 | 8 | 1 | 0 | 1 | 7 | 7 | 8 | 5 | 2 | 0 | 8 | 6 | 1 | 0 |
| M | 0 | 0 | 6 | 7 | 0 | 1 | 2 | 10 | 0 | 0 | 8 | 5 | 0 | 1 | 6 | 6 | 1 | 3 | 9 | 2 | 1 | 3 | 0 | 11 | 3 | 7 | 4 | 1 | 3 | 8 | 3 | 1 |
| Tamanho | ||||||||||||||||||||||||||||||||
| ≤ 2 cm | 0 | 0 | 2 | 4 | 0 | 0 | 0 | 6 | 0 | 0 | 5 | 1 | 0 | 0 | 4 | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 |
| > 2 cm | 0 | 0 | 10 | 8 | 0 | 2 | 3 | 13 | 0 | 0 | 11 | 7 | 0 | 1 | 11 | 6 | 1 | 9 | 14 | 3 | 1 | 4 | 6 | 16 | 10 | 11 | 5 | 1 | 10 | 12 | 4 | 1 |
| LNM/NIa | ||||||||||||||||||||||||||||||||
| 1 | 0 | 0 | 2 | 3 | 0 | 1 | 1 | 3 | 0 | 0 | 4 | 1 | 0 | 0 | 5 | 0 | 1 | 6 | 8 | 3 | 1 | 3 | 3 | 11 | 6 | 8 | 3 | 1 | 6 | 9 | 2 | 1 |
| 2 | 0 | 0 | 10 | 9 | 0 | 1 | 2 | 16 | 0 | 0 | 12 | 7 | 0 | 1 | 10 | 8 | 0 | 2 | 8 | 0 | 0 | 1 | 3 | 6 | 4 | 4 | 2 | 0 | 4 | 4 | 2 | 0 |
| Padrão/ Graub | ||||||||||||||||||||||||||||||||
| 1 | 0 | 0 | 8 | 10 | 0 | 1 | 3 | 14 | 0 | 0 | 11 | 7 | 0 | 0 | 11 | 7 | 1 | 7 | 14 | 2 | 1 | 3 | 6 | 14 | 9 | 10 | 5 | 0 | 9 | 11 | 4 | 0 |
| 2 | 0 | 0 | 3 | 3 | 0 | 0 | 1 | 5 | 0 | 0 | 3 | 3 | 0 | 0 | 4 | 2 | 0 | 2 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | 0 | 1 |
| 3 | 0 | 0 | 2 | 3 | 0 | 1 | 0 | 4 | 0 | 0 | 4 | 1 | 0 | 1 | 3 | 1 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 3 | 1 | 1 | 1 | 0 | 1 | 2 | 0 | 0 |
Imunopositividade do syndecan‐1 em tumores benignos de glândulas salivares de acordo com as variáveis clínico‐patológicas disponíveis
| Variáveis | Adenoma pleomórfico | Tumor de Warthin | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Componente epitelial | Componente estromal | Componente epitelial | Componente Estromal | |||||||||||||||||||||||||||||
| Intensidade | Porcentagem | Intensidade | Porcentagem | Intensidade | Porcentagem | Intensidade | Porcentagem | |||||||||||||||||||||||||
| 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | |
| Idade | ||||||||||||||||||||||||||||||||
| <50 | 0 | 8 | 10 | 2 | 0 | 3 | 6 | 11 | 13 | 7 | 0 | 0 | 13 | 7 | 0 | 0 | 0 | 1 | 3 | 1 | 0 | 0 | 1 | 4 | 2 | 1 | 1 | 1 | 2 | 3 | 0 | 0 |
| ≥ 50 | 0 | 1 | 8 | 0 | 0 | 0 | 4 | 5 | 7 | 2 | 0 | 0 | 7 | 2 | 0 | 0 | 0 | 8 | 11 | 6 | 0 | 0 | 2 | 23 | 20 | 2 | 3 | 0 | 20 | 4 | 1 | 0 |
| Localização | ||||||||||||||||||||||||||||||||
| Menores | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Maiores | 0 | 9 | 18 | 1 | 0 | 3 | 10 | 15 | 19 | 9 | 0 | 0 | 19 | 9 | 0 | 0 | 0 | 9 | 14 | 7 | 0 | 0 | 3 | 27 | 22 | 3 | 4 | 1 | 22 | 7 | 1 | 0 |
| Sexo | ||||||||||||||||||||||||||||||||
| F | 0 | 4 | 10 | 1 | 0 | 2 | 5 | 8 | 9 | 6 | 0 | 0 | 9 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| M | 0 | 5 | 8 | 1 | 0 | 1 | 5 | 8 | 11 | 3 | 0 | 0 | 11 | 3 | 0 | 0 | 0 | 9 | 14 | 7 | 0 | 0 | 3 | 27 | 22 | 3 | 4 | 1 | 22 | 7 | 1 | 0 |
| Tamanho | ||||||||||||||||||||||||||||||||
| ≤ 2 cm | 0 | 2 | 2 | 0 | 0 | 2 | 0 | 2 | 3 | 1 | 0 | 0 | 3 | 1 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 |
| > 2 cm | 0 | 7 | 15 | 2 | 0 | 1 | 9 | 14 | 16 | 8 | 0 | 0 | 16 | 8 | 0 | 0 | 0 | 7 | 14 | 7 | 0 | 0 | 2 | 26 | 21 | 3 | 3 | 1 | 21 | 6 | 1 | 0 |
Apesar dos muitos relatos sobre os papéis do syndecan‐1 na tumorigênese de diferentes tipos de neoplasias,9–11 a expressão e os detalhes funcionais dessa proteína nos tumores da glândula salivar não são claros. A maioria dos estudos sobre syndecan‐1 em tumores de glândulas não salivares concentrou‐se em sua expressão em células neoplásicas,18,19 mas estudos recentes sugerem que o CD138 pode ter um papel no estroma tumoral de algumas neoplasias.20,21 Que seja de nosso conhecimento, não há estudos anteriores sobre a expressão de CD138 no estroma de tumores da glândula salivar. Curiosamente, alguns estudos sobre o estroma de vários tipos de câncer mostraram um papel diferente para o syndecan‐1 no estroma em comparação ao epitélio. Em contraste com a diminuição da expressão dessa proteína em células malignas, o aumento de sua expressão no estroma está associado à invasão e metástase.20–23 No presente estudo, pela primeira vez, avaliamos a expressão de CD138 no estroma de tumores de glândulas salivares.
Estudos anteriores mostraram que a alta expressão de syndecan‐1 no estroma não é um achado comum em processos normais e não neoplásicos, exceto em casos como cicatrização de feridas e desenvolvimento de dentes.23,24 Quando ocorrem interações mesenquimais‐epiteliais no desenvolvimento dentário, a expressão dessa proteína aumenta no mesênquima e diminui no epitélio durante um período específico. Esse evento transitório parece estar relacionado ao efeito de indução do epitélio.24 A fonte da expressão de syndecan‐1 no estroma do tumor não é clara e, consequentemente, várias probabilidades foram levantadas, como, por exemplo, o ectodomínio pode ser liberado da membrana celular ou pode se originar diretamente no próprio estroma.25 Demonstramos uma diferença significativa na expressão de syndecan‐1 entre as células neoplásicas e o estroma dos tumores de glândula salivar estudados. Com base nos resultados da presente investigação, a expressão de CD138 no estroma de tumores malignos, isto é, carcinoma mucoepidermoide e carcinoma adenoide cístico, foi significantemente maior em comparação com neoplasmas benignos, inclusive adenoma pleomórfico e tumor de Warthin. Os achados do estudo de Lendorf et al.26 sobre lesões benignas e carcinomatosas da mama estavam de acordo com nosso estudo, indicaram que a expressão dessa proteína no estroma de neoplasias malignas era maior do que nos tumores benignos.
A avaliação da expressão de syndecan‐1 no estroma de alguns tumores mostrou que CD138 desempenha um papel importante na invasão e progressão do câncer e é essencial para regular a interação entre o epitélio e o estroma do tumor.20–23 Syndecan‐1 tem a capacidade de se ligar a várias proteínas, inclusive o fator de crescimento de hepatócitos (HGF, do inglês Hepatocyte Growth Factor), fator de crescimento endotelial vascular e fator de crescimento de fibroblastos‐2 e, portanto, pode potencialmente afetar o crescimento de células cancerígenas e a progressão do tumor ao estimular a angiogênese.23 Vários estudos têm sugerido que a densidade vascular média do CD105, um marcador de angiogênese, é significativamente maior em tumores malignos de glândulas salivares do que em neoplasias benignas.27,28 Curiosamente, evidências sugerem que a alta expressão de syndecan‐1 está associada a um aumento na densidade da microvasculatura.29 Isso poderia ajudar a explicar o aumento da expressão de CD138 no estroma de tumores malignos encontrado no presente estudo. Considerando o papel do syndecan‐1 na angiogênese, essa proteína pode contribuir para o aumento da angiogênese em lesões salivares malignas.
Por outro lado, Cardoso et al.27 verificaram que a densidade vascular média era significativamente maior no carcinoma mucoepidermoide em comparação com o carcinoma adenoide cístico. Curiosamente, no presente estudo, a expressão de CD138 no estroma do carcinoma mucoepidermoide foi superior à sua expressão no carcinoma adenoide cístico, o que pode ser devido ao papel dessa proteína na regulação da angiogênese entre os dois tipos de câncer.
Drexon et al.30 estudaram células de mieloma múltiplo e relataram que o CD138 desempenha um papel importante na promoção da sinalização Met através da ligação ao HGF. Eles concluíram que isso aumentaria a proliferação de células cancerígenas. Tsukinoki et al.31 enfatizaram que a ligação do HGF estromal ao c‐Met pode levar ao crescimento agressivo e à metástase de carcinomas salivares de alto grau. Considerando nosso achado da expressão aumentada de syndecan‐1 no estroma de tumores malignos de glândulas salivares, pode ser possível que um dos mecanismos pelos quais essa proteína pode ter um impacto na biologia e no prognóstico de tumores de glândulas salivares seja sua influência na sinalização de HGF e c‐MET.
Todos os tumores avaliados nesse estudo demonstraram a expressão de syndecan‐1 em células tumorais, sugeriram que o CD138 pode contribuir para a patogênese dos tumores das glândulas salivares. Não houve diferença significante na expressão dessa proteína nas células tumorais entre o adenoma pleomórfico e os tumores malignos, enquanto uma diferença significante foi observada entre o tumor de Warthin e o adenoma pleomórfico e o carcinoma adenoide cístico. Portanto, a expressão dessa proteína nas células tumorais pode não refletir claramente a diferença no comportamento biológico entre tumores benignos e malignos de glândulas salivares.
A única correlação entre sindecan‐1 e fatores clínico‐patológicos foi encontrada no carcinoma adenoide cístico, no qual tanto a intensidade quanto a percentagem foram maiores no estroma de pacientes do sexo masculino, semelhantemente aos achados de outro estudo em carcinoma colorretal.32 Também observamos que a porcentagem dessa proteína é significativamente maior no estroma de pacientes mais jovens (< 50) com carcinoma mucoepidermoide. Não há uma interpretação precisa ou uma explicação clara para essas associações, indica a necessidade de uma pesquisa mais extensa e detalhada nesse campo.
Em futuras investigações, os tumores com um pequeno tamanho de amostra neste estudo devem ser substituídos por um número suficiente das mesmas lesões, para comparações mais precisas. Por outro lado, para melhor entender o efeito dessa proteína sobre a patogênese e invasão de tumores de glândulas salivares, sugere‐se que a angiogênese e outros marcadores como o HGF e a c‐MET sejam investigados simultaneamente com o CD138.
ConclusãoSyndecan‐1 parece desempenhar um papel na patogênese dos tumores da glândula
salivar. No entanto, sua imunorreatividade no estroma dessas neoplasias, quando comparada às células tumorais, pode estar mais envolvida no comportamento biológico e na invasão desses tumores.
Aprovação éticaEste artigo não contém estudos com participantes humanos ou animais feitos por qualquer dos autores. O projeto deste estudo foi aprovado pelo Comitê de Ética do TUMS (número de aprovação IR.TUMS.DENTISTRY.REC.1396.2164; data: 30/04/2017)
FinanciamentoEste trabalho recebeu apoio financeiro do Dental Research Center, Dentistry Research Institute, Tehran University of Medical Sciences (TUMS), Teerã, Irã [número do financiamento: 96.469.14].
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Alaeddini M, Yazdani F, Etemad‐Moghadam S. Stromal and epithelial syndecan‐1 expression in benign and malignant salivary gland tumors: which is more reflective of behavior?. Braz J Otorhinolaryngol. 2021;87:171–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.