O tratamento do microcarcinoma papilífero de tireoide permanece controverso. A metástase em linfonodos centrais é comum e é uma consideração importante na seleção da estratégia de tratamento.
ObjetivoInvestigar os fatores de risco clínico‐patológicos e as características ultrassonográficas de nódulos tireoidianos para metástase em linfonodos centrais em microcarcinoma papilífero de tireoide.
MétodoForam analisados retrospectivamente os dados de 599 pacientes com microcarcinoma papilífero de tireoide submetidos à cirurgia de 2005 a 2017 em uma única instituição. Análises univariadas e multivariadas foram usadas para identificar os fatores clínico‐patológicos e as características ultrassonográficas pré‐operatórias das metástases em linfonodos centrais. Uma análise de curva ROC (receiver‐operating characteristic) foi feita para identificar a eficácia das características ultrassonográficas na previsão dessas metástases. Um nomograma baseado nos fatores de risco foi estabelecido para prever a metástase em linfonodos centrais.
ResultadosA incidência de metástase em linfonodos centrais foi de 22,4%. As análises univariadas e multivariadas sugeriram que sexo, idade, multifocalidade, invasão extratireoidiana e metástase em linfonodos laterais eram fatores de risco independentes para a metástase em linfonodos centrais. As análises univariadas e multivariadas revelaram que o formato nodular, a margem e a calcificação estavam independentemente associadas à metástase em linfonodos centrais. A análise da curva ROC mostrou que a combinação do formato, margem e calcificação apresentou excelente precisão na previsão dessas metástases. O nomograma foi desenvolvido com base nos fatores de risco identificados para predizer a metástase em linfonodos centrais e a análise do gráfico de calibração indicou o bom desempenho e a utilidade clínica do nomograma.
ConclusõesEm pacientes com microcarcinoma papilífero de tireoide, metástase em linfonodos centrais está associado ao sexo masculino, menor idade (< 45 anos), invasão extratireoidiana, multifocalidade e presença de metástase em linfonodos laterais. As características ultrassonográficas, como formato irregular, margem mal definida e calcificação, podem melhorar a eficácia da previsão de metástase em linfonodos centrais. Cirurgiões e radiologistas devem ficar mais atentos aos pacientes que apresentam esses fatores de risco. O nomograma pode ajudar a orientar a tomada de decisão cirúrgica para o microcarcinoma papilífero de tireoide.
O carcinoma de tireoide é a forma mais comum de neoplasia do sistema endócrino e sua taxa de incidência aumentou em média 4,5% ao ano entre 2007 e 2011. O carcinoma papilífero de tireoide (CPT) é o subtipo histológico mais comum de câncer de tireoide, corresponde a 80% de todas as doenças malignas da tireoide.1 De acordo com o sistema de classificação da Organização Mundial da Saúde, o microcarcinoma papilífero de tireoide (MCPT) é definido como um CPT que mede ≤ 1,0cm em sua maior dimensão.2 Nos últimos anos, o uso generalizado e o aprimoramento técnico da ultrassonografia (US) e da biópsia por punção aspirativa com agulha fina (PAAF) guiada pela US contribuíram para um aumento na taxa de diagnóstico pré‐operatório de MCPT.3,4 Alguns estudos mostraram que a porcentagem de MCPT entre todos os cânceres de tireoide na última década atingiu 39,5%, chegou a 42%.5,6
Embora o MCPT geralmente tenha um curso indolente e um excelente prognóstico, a metástase de linfonodos (MLN) está presente em 17% a 64% dos pacientes com MCPT e em 80% dos pacientes com recorrência.7,8 Muitos autores consideraram a MLN um fator de risco importante. Um grande estudo de base populacional sugeriu que o câncer de tireoide diferenciado com MLN resultou em uma taxa de mortalidade relacionada à doença 3 vezes maior.9 A metástase de linfonodos centrais (MLNC) é comum no câncer de CPT. A detecção precoce de MLNC tem um papel importante na tomada de decisão terapêutica. Para o manejo do linfonodo central (LNC), as diretrizes da American Thyroid Association recomendam que a dissecção do linfonodo central profilática (DLNCp) pode ser feita em pacientes com CPT com nódulos clinicamente negativos, particularmente naqueles com extensão extratireoidiana ou com tamanho do tumor> 4cm.10 Entretanto, como a recomendação de usar apenas duas características patológicas pode ser insuficiente para prever a MLNC subclínica, a DLNCp foi feita rotineiramente ou de acordo com a preferência pessoal do médico. Além disso, supõe‐se que a DLNCp aumente morbidades, como lesão recorrente do nervo laríngeo e hipoparatireoidismo. Assim, os cirurgiões precisam entender melhor os fatores de risco preditivos da MLNC ao decidir se devem executar a DLNC.
Atualmente, a US pré‐operatória é o método de primeira linha para avaliar a MLN em pacientes com CPT. O linfonodo metastático geralmente aparece com calcificação, necrose cística, hiperecogenicidade, formato arredondada, vascularização periférica ou mista e ausência de hilo ecogênico.11–13 Entretanto, a capacidade da US pré‐operatória de identificar MLNC é limitada devido ao fato da glândula tireoide ser sobrejacente e esses linfonodos geralmente não parecem anormais na imagem pré‐operatória ou à inspeção no momento da cirurgia. Assim, a US pode ter baixa precisão preditiva para MLNC antes da cirurgia. Além disso, a utilidade da US na determinação da MLNC no MCPT ainda é controversa.14–16 Considerando que a previsão da MLNC é importante para a potencial alteração na tomada de decisão clínica, muitos autores estudaram sua característica ultrassonográfica pré‐operatória. Atualmente, melhorar a precisão do diagnóstico da MLNC antes da cirurgia continua a ser um desafio.
Embora tenha havido inúmeras investigações que identificam os fatores clínico‐patológicos preditivos para a MLNC, os resultados são inconsistentes. Ainda não está claro se a US é uma boa escolha para a avaliação da MLNC no MCPT. Assim, a identificação de fatores clínico‐patológicos e as características ultrassonográficas do nódulo tireoidiano para predizer a MLNC provavelmente facilitarão a decisão terapêutica ideal no MCPT. Neste estudo, examinamos retrospectivamente a incidência e as características clínico‐patológicas relacionadas à MLNC em pacientes com MCPT, tentamos identificar os preditores independentes. Também avaliamos os características ultrassonográficas dos nódulos tireoidianos associados à MLNC nesses pacientes, o que pode ajudar a determinar com maior precisão o status pré‐operatório da MLNC. Além disso, estabelecemos um nomograma para prever o risco de MLNC no pré‐operatório e esses resultados podem ajudar muito na tomada de decisões em relação ao tratamento adicional.
MétodoEntre janeiro de 2005 e junho de 2017, 2.046 pacientes foram submetidos a tratamento cirúrgico da tireoide em uma única instituição. O presente estudo foi feito de acordo com a declaração de Helsinque e foi aprovado pelo comitê de ética institucional (aprovação n° 20170301, 20181207). O consentimento dos pacientes foi obtido por meio de formulários de consentimento informado.
Os critérios de inclusão foram os seguintes: 1) Pacientes sem histórico prévio de radiação e outros tumores malignos de cabeça e pescoço; 2) Pacientes submetidos à tireoidectomia e DLNC; 3) o MCPT foi confirmado pelo exame histopatológico da amostra cirúrgica; 4) Os prontuários médicos dos pacientes estavam completos. Os pacientes que apresentavam carcinoma não CPT (folicular, medular e anaplásico) e metastático de outros órgãos foram excluídos deste estudo. Pacientes com cirurgia anterior da tireoide ou da paratireoide foram excluídos. Os pacientes que não tinham sido submetidos a US do pescoço também foram excluídos. O diagnóstico de MCPT foi definido como CPT cujo tamanho máximo era ≤ 1,0cm, de acordo com os padrões da Organização Mundial de Saúde. Após aplicação dos critérios de inclusão e exclusão, foram incluídos 599 pacientes com MCPT. Foram consideradas as seguintes variáveis: idade ao diagnóstico, sexo, tireoidite de Hashimoto (TH), multifocalidade, invasão extratireoidiana, bilateralidade, tipo de cirurgia, MLNC e metástase de linfonodo lateral (MLNL).
Em nosso estudo, todos os pacientes foram submetidos a um histórico cuidadoso e exame físico completo. Todos os pacientes foram submetidos a um exame pré‐operatório por US de alta resolução, equipado com uma sonda linear de 7‐12MHz. Todos os exames de US do pescoço foram feitos por radiologistas com mais de 5 anos de experiência em imagem de tireoide. Os pacientes foram colocados na posição supina e as características da US incluíram número de nódulos, localização dos nódulos, envolvimento unilateral ou bilateral da glândula, formato, margem, ecogenicidade, conteúdo interno, calcificação, razão anteroposterior/transversal (A/T) e fluxo sanguíneo. Foram calculados valores de sensibilidade, especificidade, valor preditivo positivo (VPP), valor preditivo negativo (VPN) e precisão das características US suspeitas de MLNC. A precisão diagnóstica da previsão de MLNC foi calculada através da análise da curva ROC. A área sob a curva (AUC) foi estimada a partir da curva ROC.
O tratamento cirúrgico foi feito de acordo com as diretrizes da American Thyroid Association de 2009 em nossa instituição.17 Nosso estudo incluiu pacientes com DLNC terapêutico e DLNCp. Nos casos aqui descritos, a DLNCp foi feita em pacientes com nódulos clinicamente negativos com invasão extratireoidiana ou tamanho do tumor maior do que 4cm ou de acordo com a preferência pessoal do cirurgião. A DLNC terapêutica foi feita quando a MLNC foi detectada durante o exame pré‐ ou intraoperatório. A DLNC foi feita cranialmente à artéria superior e lobo piramidal, caudalmente à veia inominada, lateralmente às bainhas carotídeas e dorsalmente à fáscia pré‐vertebral. Atenção especial foi dada à preservação das glândulas paratireoides e do nervo laríngeo recorrente. A dissecção dos linfonodos laterais, inclusive os níveis II ‐ V, foi feita apenas nos casos com MLNL clinicamente evidente. O tratamento cirúrgico consistiu em tireoidectomia total ou quase total em 213 pacientes, lobectomia em 43 pacientes e lobectomia com istmectomia em 343 pacientes. Dissecções abrangentes do pescoço, como esvaziamento cervical radical e esvaziamento cervical modificado, foram feitas em 4 pacientes e 3 deles foram submetidos a esvaziamento cervical bilateral.
A mediana do período de seguimento foi de 32,4 meses (variação: 6,55±155,23 meses). Todos os pacientes com MCPT foram examinados em 3, 6 e 12 meses após o tratamento inicial e anualmente a partir de então, ou mais frequentemente de acordo com o curso clínico. A evolução dos pacientes foi acompanhada através de exame físico, US e TC para identificar tecido de tireoide remanescente, metástase de linfonodo e a distância.
A análise univariada foi feita com o teste do qui‐quadrado de Pearson e o teste exato de Fisher, conforme apropriado. Resultados estatisticamente significantes, obtidos da análise univariada, foram submetidos à regressão logística multivariada. Um nomograma foi construído com as variáveis no modelo de regressão logística multivariada final para prever a MLNC. A capacidade discriminativa do nomograma preditivo foi avaliada pelo índice de concordância de Harrell (índice C).18 O índice C tem um significado semelhante ao da AUC. O valor mais alto do índice C é 1, o que significa discriminação perfeita; o valor mais baixo é 0,5, o que significa discriminação aleatória. A calibração foi usada para comparar quão bem as probabilidades previstas em nosso nomograma correspondiam às probabilidades reais de MLNC. Para todas as análises, apenas valores de p <0,05 foram considerados significantes. Todas as análises estatísticas foram feitas com o pacote estatístico SPSS 16.0 (SPSS, Inc., Chicago, IL, EUA), o software de linguagem R e o pacote RMS.
ResultadosHavia 105 homens (17,5%) e 494 mulheres (82,5%; razão de 1:4,7); 284 pacientes (47,4%) com <45 anos e 315 (52,6%) com ≥ 45 anos. O tamanho médio máximo do tumor foi de 0,78±0,20cm. Verificamos que os LNC foram confirmados como positivos através da US antes da cirurgia em 105 pacientes, mas os resultados da histopatologia pós‐operatória revelaram que 27 pacientes eram positivos. A US visualizou 494 linfonodos negativos antes da cirurgia, enquanto os resultados da histopatologia pós‐cirúrgica indicaram que 107 linfonodos eram positivos (tabela 1). A sensibilidade e a especificidade da US na avaliação da MLNC foram 20,1% e 83,2%, respectivamente.
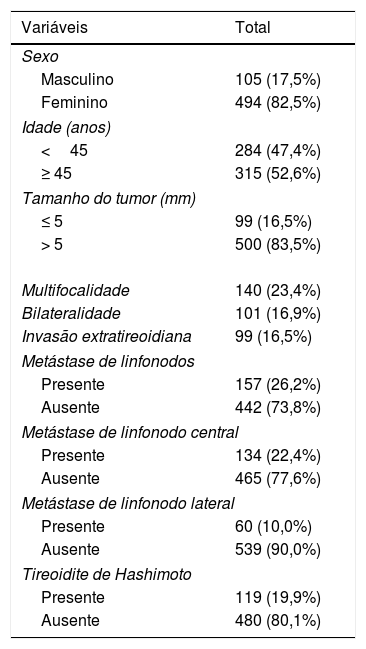
As características clínico‐patológicas dos 599 pacientes com MCPT são mostradas na tabela 2. Entre todos os pacientes, a multifocalidade foi encontrada em 140 pacientes (23,4%), bilateralidade em 101 pacientes (16,9%), invasão extratireoidiana em 99 pacientes (16,5%). TH coexistente com MCPT foi observada em 119 pacientes (19,9%). A MLNC foi identificada em 134 pacientes (22,4%), o MLNL em 60 pacientes (10%) e MLNC com MLNL em 37 pacientes (6,2%). Durante a linfadenectomia, um a 28 linfonodos foram removidos. O número de MLN variou entre 0 e 18.
Características clínico‐patológicas de 599 pacientes com MCPT
| Variáveis | Total |
|---|---|
| Sexo | |
| Masculino | 105 (17,5%) |
| Feminino | 494 (82,5%) |
| Idade (anos) | |
| <45 | 284 (47,4%) |
| ≥ 45 | 315 (52,6%) |
| Tamanho do tumor (mm) | |
| ≤ 5 | 99 (16,5%) |
| > 5 | 500 (83,5%) |
| Multifocalidade | 140 (23,4%) |
| Bilateralidade | 101 (16,9%) |
| Invasão extratireoidiana | 99 (16,5%) |
| Metástase de linfonodos | |
| Presente | 157 (26,2%) |
| Ausente | 442 (73,8%) |
| Metástase de linfonodo central | |
| Presente | 134 (22,4%) |
| Ausente | 465 (77,6%) |
| Metástase de linfonodo lateral | |
| Presente | 60 (10,0%) |
| Ausente | 539 (90,0%) |
| Tireoidite de Hashimoto | |
| Presente | 119 (19,9%) |
| Ausente | 480 (80,1%) |
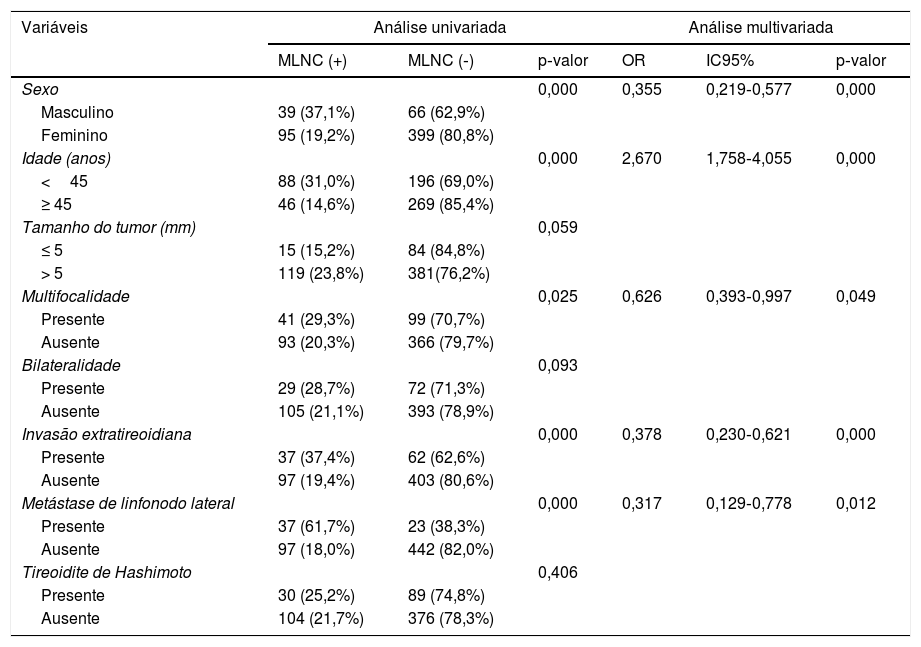
Os fatores de risco em pacientes com MCPT com MLNC são mostrados na tabela 3. Em pacientes com MCPT, sexo masculino (p=0,000), idade <45 anos (p=0,000), multifocalidade (p=0,025), invasão extratireoidiana (p=0,000) e MLNL (p=0,000) foram significativamente associados à MLNC. Resultados significantes obtidos na análise univariada foram submetidos à análise de regressão logística multivariada. Sexo masculino (OR=0,355; IC95% 0,219‐0,577; p=0,000), idade <45 anos (OR=2,67; IC95% 1,758‐4,055; p=0,000), multifocalidade (OR=0,626; IC95% 0,393‐ 0,997; p=0,049), invasão extratireoidiana (OR=0,378; IC95% 0,230±0,621; p=0,000) e MLNL (OR=0,317; IC95% 0,129±0,778; p=0,012) permaneceram como fatores de risco independentes de MLNC.
Análise univariada e multivariada para MLNC com variáveis estatisticamente significantes
| Variáveis | Análise univariada | Análise multivariada | ||||
|---|---|---|---|---|---|---|
| MLNC (+) | MLNC (‐) | p‐valor | OR | IC95% | p‐valor | |
| Sexo | 0,000 | 0,355 | 0,219‐0,577 | 0,000 | ||
| Masculino | 39 (37,1%) | 66 (62,9%) | ||||
| Feminino | 95 (19,2%) | 399 (80,8%) | ||||
| Idade (anos) | 0,000 | 2,670 | 1,758‐4,055 | 0,000 | ||
| <45 | 88 (31,0%) | 196 (69,0%) | ||||
| ≥ 45 | 46 (14,6%) | 269 (85,4%) | ||||
| Tamanho do tumor (mm) | 0,059 | |||||
| ≤ 5 | 15 (15,2%) | 84 (84,8%) | ||||
| > 5 | 119 (23,8%) | 381(76,2%) | ||||
| Multifocalidade | 0,025 | 0,626 | 0,393‐0,997 | 0,049 | ||
| Presente | 41 (29,3%) | 99 (70,7%) | ||||
| Ausente | 93 (20,3%) | 366 (79,7%) | ||||
| Bilateralidade | 0,093 | |||||
| Presente | 29 (28,7%) | 72 (71,3%) | ||||
| Ausente | 105 (21,1%) | 393 (78,9%) | ||||
| Invasão extratireoidiana | 0,000 | 0,378 | 0,230‐0,621 | 0,000 | ||
| Presente | 37 (37,4%) | 62 (62,6%) | ||||
| Ausente | 97 (19,4%) | 403 (80,6%) | ||||
| Metástase de linfonodo lateral | 0,000 | 0,317 | 0,129‐0,778 | 0,012 | ||
| Presente | 37 (61,7%) | 23 (38,3%) | ||||
| Ausente | 97 (18,0%) | 442 (82,0%) | ||||
| Tireoidite de Hashimoto | 0,406 | |||||
| Presente | 30 (25,2%) | 89 (74,8%) | ||||
| Ausente | 104 (21,7%) | 376 (78,3%) | ||||
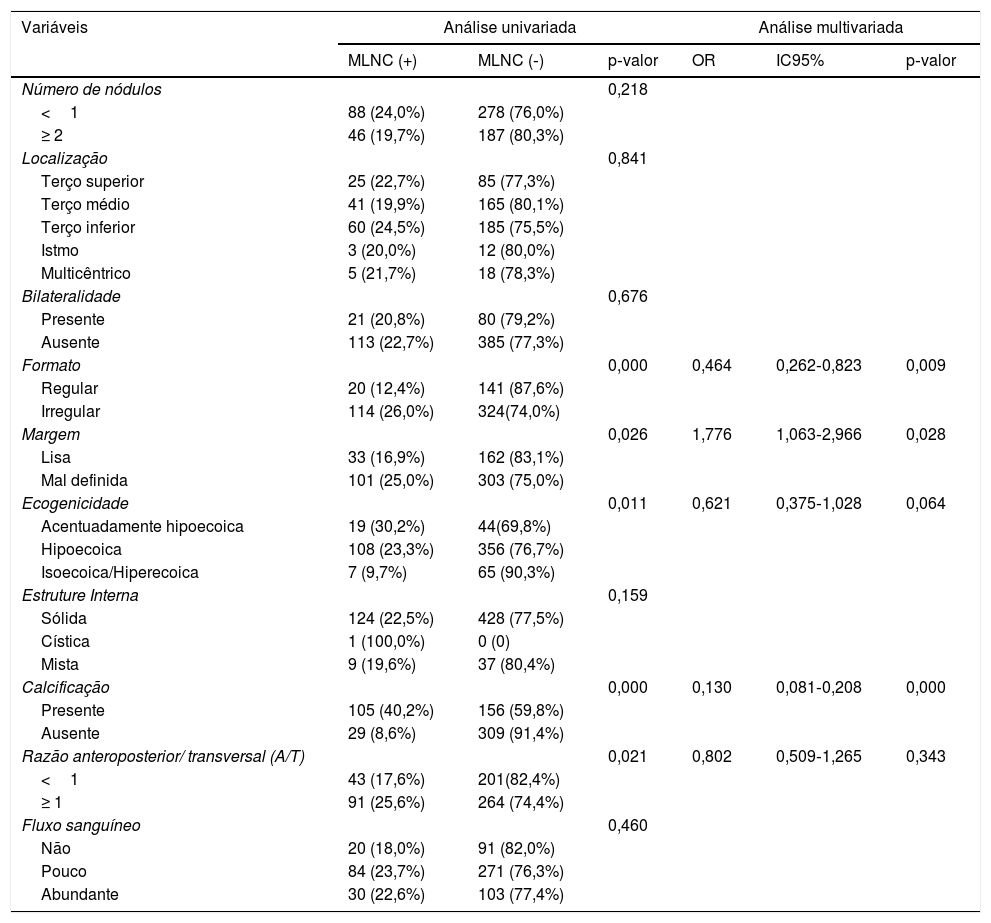
As características pré‐operatórias da US foram comparadas em pacientes com e sem MLNC, como apresentado na tabela 4. A análise univariada revelou diferenças estatísticas no formato (p=0,000), margem (p=0,026), ecogenicidade (p=0,011), calcificação (p=0,000) e razão A/T (p=0,021) entre os dois grupos. A análise multivariada mostrou que formato, margem e calcificação foram considerados fatores independentes indicativos de MLNC. A odd ratio desses fatores significativos foi 0,464 (IC 95% 0,262±0,823, p=0,009), 1,776 (IC 95% 1,063±2,966, p=0,028), 0,130 (IC 95% 0,081±0,208, p=0,000), respectivamente.
Análise univariada e multivariada das características ultrassonográficas em pacientes com MCPT e MLNC
| Variáveis | Análise univariada | Análise multivariada | ||||
|---|---|---|---|---|---|---|
| MLNC (+) | MLNC (‐) | p‐valor | OR | IC95% | p‐valor | |
| Número de nódulos | 0,218 | |||||
| <1 | 88 (24,0%) | 278 (76,0%) | ||||
| ≥ 2 | 46 (19,7%) | 187 (80,3%) | ||||
| Localização | 0,841 | |||||
| Terço superior | 25 (22,7%) | 85 (77,3%) | ||||
| Terço médio | 41 (19,9%) | 165 (80,1%) | ||||
| Terço inferior | 60 (24,5%) | 185 (75,5%) | ||||
| Istmo | 3 (20,0%) | 12 (80,0%) | ||||
| Multicêntrico | 5 (21,7%) | 18 (78,3%) | ||||
| Bilateralidade | 0,676 | |||||
| Presente | 21 (20,8%) | 80 (79,2%) | ||||
| Ausente | 113 (22,7%) | 385 (77,3%) | ||||
| Formato | 0,000 | 0,464 | 0,262‐0,823 | 0,009 | ||
| Regular | 20 (12,4%) | 141 (87,6%) | ||||
| Irregular | 114 (26,0%) | 324(74,0%) | ||||
| Margem | 0,026 | 1,776 | 1,063‐2,966 | 0,028 | ||
| Lisa | 33 (16,9%) | 162 (83,1%) | ||||
| Mal definida | 101 (25,0%) | 303 (75,0%) | ||||
| Ecogenicidade | 0,011 | 0,621 | 0,375‐1,028 | 0,064 | ||
| Acentuadamente hipoecoica | 19 (30,2%) | 44(69,8%) | ||||
| Hipoecoica | 108 (23,3%) | 356 (76,7%) | ||||
| Isoecoica/Hiperecoica | 7 (9,7%) | 65 (90,3%) | ||||
| Estruture Interna | 0,159 | |||||
| Sólida | 124 (22,5%) | 428 (77,5%) | ||||
| Cística | 1 (100,0%) | 0 (0) | ||||
| Mista | 9 (19,6%) | 37 (80,4%) | ||||
| Calcificação | 0,000 | 0,130 | 0,081‐0,208 | 0,000 | ||
| Presente | 105 (40,2%) | 156 (59,8%) | ||||
| Ausente | 29 (8,6%) | 309 (91,4%) | ||||
| Razão anteroposterior/ transversal (A/T) | 0,021 | 0,802 | 0,509‐1,265 | 0,343 | ||
| <1 | 43 (17,6%) | 201(82,4%) | ||||
| ≥ 1 | 91 (25,6%) | 264 (74,4%) | ||||
| Fluxo sanguíneo | 0,460 | |||||
| Não | 20 (18,0%) | 91 (82,0%) | ||||
| Pouco | 84 (23,7%) | 271 (76,3%) | ||||
| Abundante | 30 (22,6%) | 103 (77,4%) | ||||
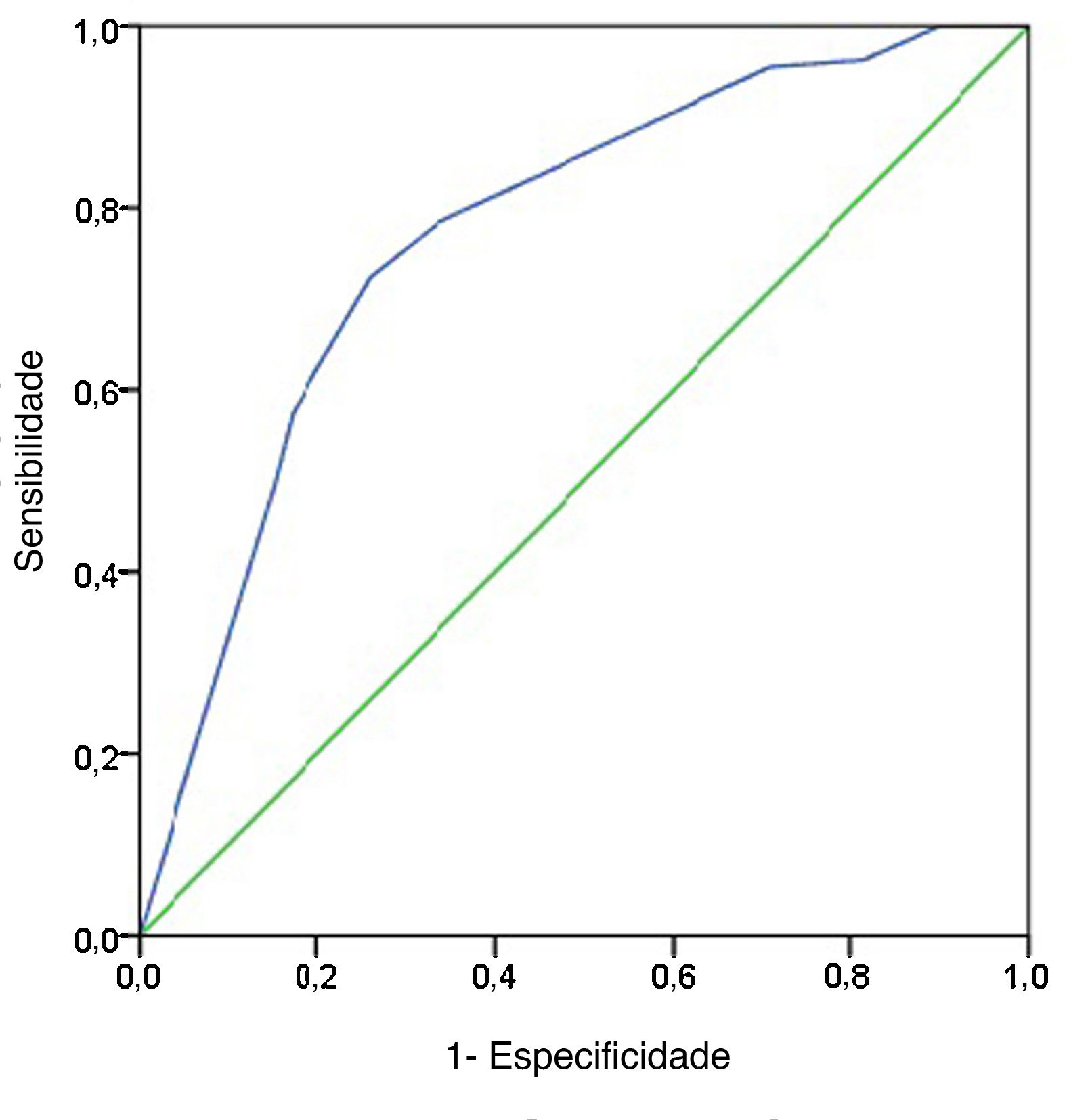
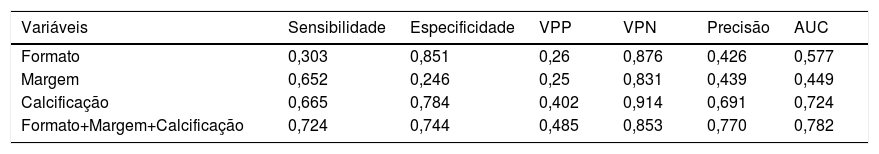
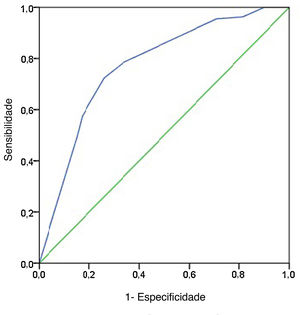
A sensibilidade, especificidade, VPP, VPN e precisão diagnóstica das características da US são mostradas na tabela 5. As respectivas sensibilidade, especificidade, VPP, VPN e precisão para predizer MLNC foram as seguintes: formato irregular, 0,303, 0,851, 0,26, 0,876 e 0,426; margem mal definida, 0,652, 0,246, 0,25, 0,831 e 0,439; calcificação 0,665, 0,784, 0,402, 0,914 e 0,691. O valor da AUC de formato e margem foi de 0,577 e 0,449, respectivamente, apesar de satisfazerem o valor de p <0,05. Como esperado, a combinação de três características da US superou aquela baseada em apenas uma característica e a combinação alcançou a AUC mais alta de 0,782 e a precisão de 0,77 (fig. 1). O índice de Youden máximo foi obtido no ponto de corte de probabilidade de 0,468, produziu uma sensibilidade de 0,724 e uma especificidade de 0,744.
Valor preditivo das características ultrassonográficas
| Variáveis | Sensibilidade | Especificidade | VPP | VPN | Precisão | AUC |
|---|---|---|---|---|---|---|
| Formato | 0,303 | 0,851 | 0,26 | 0,876 | 0,426 | 0,577 |
| Margem | 0,652 | 0,246 | 0,25 | 0,831 | 0,439 | 0,449 |
| Calcificação | 0,665 | 0,784 | 0,402 | 0,914 | 0,691 | 0,724 |
| Formato+Margem+Calcificação | 0,724 | 0,744 | 0,485 | 0,853 | 0,770 | 0,782 |
Curva ROC para previsão de características ultrassonográficas pré‐operatórias. O modelo preditivo de MLNC foi preciso e discriminador, com AUC de 0,782. Um ponto de corte para previsão de MLNC foi definido como um valor=0,468. Uma probabilidade prevista de 0,468 forneceu uma sensibilidade de 72,4% e uma especificidade de 74,4%.
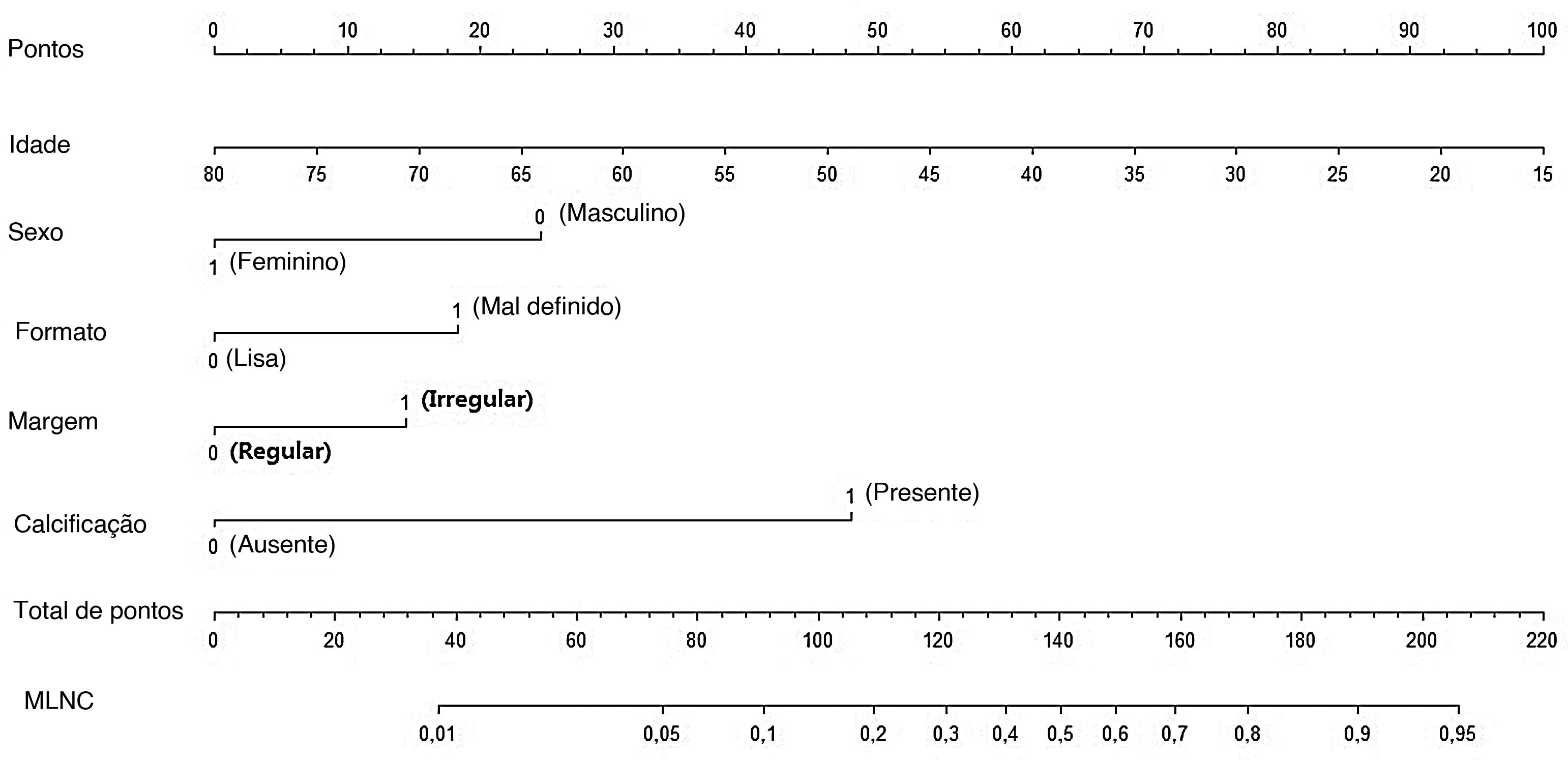
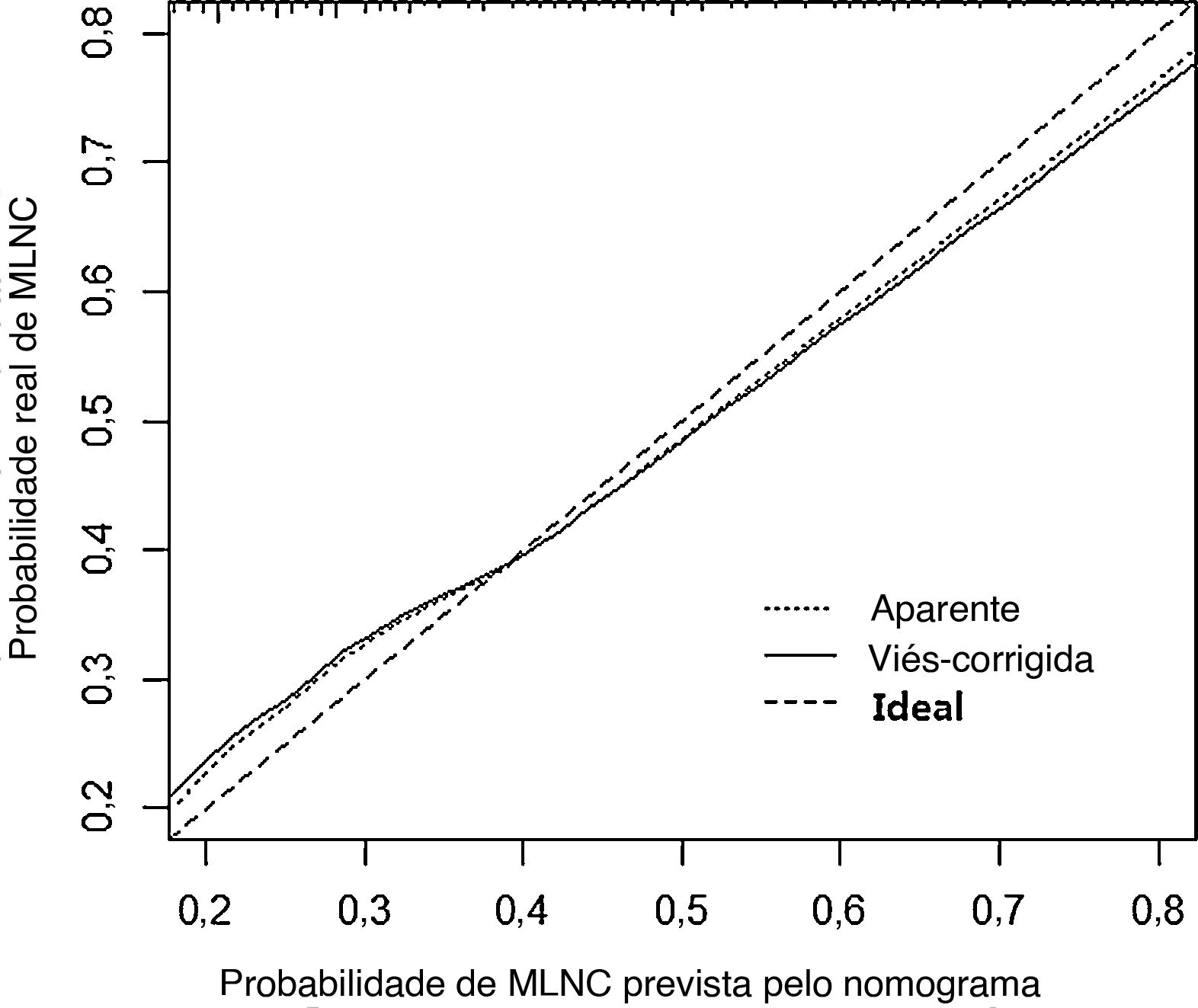
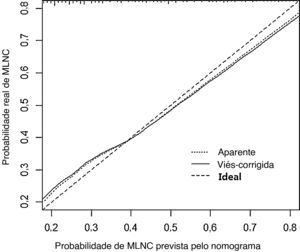
Em seguida, um nomograma preditivo que incorporou os fatores de risco significativos associados a MLNC foi construído com base no modelo de regressão logística multivariada (fig. 2). Esse nomograma integrou cinco fatores de risco (sexo, idade, formato, margem e calcificação) para auxiliar na previsão de MLNC em pacientes com MCPT antes da cirurgia. Cada nível nas variáveis recebeu um escore de acordo com a escala de pontos. Ao somar a pontuação total e localizando‐a na escala total de pontos, foi determinada uma probabilidade correspondente de MLNC de cada indivíduo. Este nomograma apresentou um bom índice C de 0,835. O gráfico de calibração também apresentou boa concordância entre a probabilidade de metástase prevista pelo nomograma e a probabilidade real de metástase de linfonodo central na figura 3 (erro absoluto médio=0,019).
A incidência relatada de CPT aumentou constantemente ao longo do tempo, predominantemente devido ao aumento da detecção de MCPT, e isso provavelmente atrairá a atenção contínua em todo o mundo. Apesar de seu excelente prognóstico geral, alguns MCPT podem ser agressivos e, portanto, também letais, devido a metástases distantes. Alguns estudos relataram que a taxa de mortalidade nos primeiros 10 anos após a cirurgia é <1% e a recorrência locorregional da doença no mesmo período é esperada em 5% dos pacientes.19,20 Assim como o CPT, o MCPT tem uma frequência relativamente alta de MLNC e o número de MLNC pode afetar o prognóstico desses pacientes. A prevalência de MLNC variou entre 13,0% e 64,1% em estudos anteriores.21–25 Concluímos que o motivo pode ser a heterogeneidade na técnica cirúrgica, especialmente no cenário de DLNC, no qual a extensão da cirurgia pode variar. Em nosso estudo, a incidência de MLNC no MCPT foi de 22,4%, o que estava de acordo com relatos anteriores. A MLNC é um importante fator de risco de recorrência e geralmente não é detectada clinicamente em pacientes. Assim, a identificação de fatores preditivos associados à MLNC pode orientar estratégias cirúrgicas apropriadas para o paciente.
Constatamos que o MCPT apresentou uma taxa mais alta em pacientes do sexo feminino (82,5%) e a taxa de MLNC é maior em pacientes do sexo masculino (37,1%). Os resultados demonstraram que o sexo masculino foi um fator preditivo independente de MLNC. Concordamos com a explicação de que isso pode estar associado à flutuação do hormônios sexuais durante o ciclo menstrual e a gravidez em mulheres.26 Para os pacientes do sexo masculino, a taxa metabólica basal normalmente mais alta pode incitar uma proliferação hiperativa de células tumorais e levar a mais metástases. Relatos anteriores indicaram a multifocalidade como um fator de risco independente para a MLNC e testamos essa questão neste estudo. A incidência de MLNC em pacientes com MCPT multifocal foi de 29,3% em comparação com 20,3% em pacientes com doença unifocal. Verificamos que a multifocalidade estava associada a um risco significativamente aumentado de MLNC. Ainda não se sabe se a ocorrência de novo de tumores distintos ou de múltiplos focos no CPT se origina de um único tumor intratireoidiano. Algumas evidências sugerem que os focos não contíguos do tumor se originam de precursores independentes.27 O estudo de Jovanovic descobriu que 83% dos múltiplos focos no MCPT apresentavam alterações genéticas consistentes com uma origem monoclonal baseada na alelotipagem genômica, indicaram que múltiplos focos e derivados monoclonais se desenvolveram através da metástase intratireoidiana a partir de um tumor primário.28
A idade é considerada um importante fator prognóstico para sobrevida em pacientes com CPT>1cm; no entanto, seu valor prognóstico no MCPT é incerto, com resultados inconsistentes.29–31 O sistema AJCC/UICC TNM usa a idade de 45 anos como ponto de corte para pacientes em estágio inicial.32 Neste estudo, observamos que a taxa de MLNC foi maior em pacientes <45 anos do que naqueles com idade ≥ 45 anos (31,0% vs. 14,6%) e a idade foi um preditor independente de MLNC nas análises univariada e multivariada. Concluímos que em pacientes mais jovens provavelmente têm características mais agressivas do que em pacientes mais velhos. Na prática clínica, uma avaliação pré‐operatória cuidadosa do status dos linfonodos deve ser seguida em pacientes jovens e a estratégia de tratamento para pacientes jovens pode ser diferente daquela nos pacientes mais com mais idade. Por exemplo, a DLNC pode ser melhor para pacientes mais jovens, enquanto a observação pode ser melhor para pacientes mais idosos.
Sabe‐se que o risco de MLNC aumenta com o tamanho do tumor. Estudos anteriores sugeriram que o tamanho do tumor é um preditor independente de MLNC,5,23,30,31 mas o ponto de corte do tamanho foi diferente em vários estudos. Embora o valor do ponto de corte ideal para o limiar de tamanho do MCPT ainda seja incerto, a maioria dos estudos usa 0,5cm como limiar de tamanho e investigou a agressividade do MCPT. Eles propuseram que o MCPT> 0,5cm estava mais significativamente associado ao MLNC do que aqueles com tamanho <0,5cm. O resultado deste estudo mostrou que um número maior de MLNC podia ser encontrado em MCPT> 0,5cm; no entanto, isso não alcançou significância estatística na análise univariada. A taxa de invasão extratireoidiana para MCPT varia muito em diferentes estudos (2% a 21%).24,32 A diferença na incidência pode ser explicada por diferentes critérios diagnósticos. Alguns estudos consideraram a invasão extratireoidiana apenas quando há invasão macroscópica em estruturas extratireoidianas, enquanto outros incluíram ambas invasão microscópica e extratireoidiana extensa. Em nosso estudo, a invasão extratireoidiana foi demonstrada como um fator clínico‐patológico independente para predizer a MLNC. Embora não possamos analisar separadamente os dois subtipos de invasão extratireoidiana, alguns estudos demonstraram que os diferentes subtipos podem representar um valor preditivo semelhante para a MLNC no MCPT.4,7
Sabe‐se que a ocorrência de TH é maior em pacientes com CPT.1 Alguns estudos anteriores relataram que a coexistência de TH e MCPT estava correlacionada com a MLN.33,34 No entanto, em um relato de MCPT, So et al. descobriram que 24,9% dos pacientes com MCPT tinham TH e não houve associação entre TH e MLN.29 Kim et al. também relataram que a TH não afetou a frequência do MLN no MCPT.33 Neste estudo, a taxa de TH foi de 19,9% nos pacientes com MCPT e a taxa de MLNC foi de 25,2% no grupo com TH, que foi maior em comparação com o grupo sem TH (21,7%). Entretanto, não houve associação entre TH e MLNC neste estudo. Atualmente, o efeito da coexistência de TH nos resultados prognósticos do MCPT ainda não está claro.
Atualmente, a ultrassonografia é amplamente usada para avaliar a MLNC em pacientes com MCPT, tanto no estadiamento inicial quanto durante a vigilância subsequente após a tireoidectomia. No entanto, a US tem uma capacidade diagnóstica deficiente para detectar MLNC porque é afetada por gases, ossos e glândulas. Alguns estudos abordaram a grande variabilidade de sensibilidade (10,9% a 94%) e especificidade (69% a 90%) da US na detecção de MLNC.35–38 Em nosso estudo, a US apresentou alta especificidade (83,2%) e baixa sensibilidade (20,1%) no diagnóstico de MLNC, semelhante a estudos anteriores. A alta taxa de MLNC e a baixa sensibilidade da US tornam difícil investigar quais fatores estão associados à MLNC. Estudos anteriores identificaram algumas características típicas da US de MLN no CPT, inclusive microcalcificação, componente cístico intranodal, formato redondo ou mais alto do que largo e borda irregular. Resultados semelhantes foram encontrados neste estudo e revelaram que formato, margem, ecogenicidade, calcificação e razão A/T foram fatores de risco na análise univariada. Entretanto, a análise multivariada demonstrou que apenas o formato, a margem e calcificação eram fatores independentes.
O número de nódulos primários é um dos fatores usados para avaliar o prognóstico do MCPT. No entanto, nossos resultados mostraram que os nódulos multifocais não estavam significativamente relacionados à MLNC. Isso pode ter sido devido à alta incidência e imagens enganosas da US de nódulos benignos da tireoide. Com base nos resultados patológicos, descobrimos que a multifocalidade aumentou o risco de MLNC. Assim, se todos os pacientes com tumores multifocais fossem submetidos a US e PAAF guiada por US no pré‐operatório, isso poderia melhorar a avaliação das lesões e esse achado poderia ter sido diferente. Alguns estudos relataram que a incidência de MLNC estava relacionada à localização do MCPT.23,39 Nossos resultados mostraram que o nódulo localizado no polo inferior da glândula tireoide apresentou uma taxa maior de MLNC. Cremos que as células tumorais da região centro‐inferior da glândula tireoide podem apresentar maior probabilidade de serem transportadas para o sulco tráqueo‐esofágico nos nódulos linfáticos centrais devido à natureza do sistema de drenagem linfática da glândula tireoide.
As calcificações nos linfonodos metastáticos são o acúmulo focal de sais de cálcio e parte do mecanismo pode ser a rápida proliferação de células tumorais e hiperplasia dos tecidos cancerosos.36 Neste estudo, a presença de calcificação foi considerada um sinal típico que sugeria envolvimento de linfonodos cervicais. Rosario et al. propuseram que a calcificação apresentava especificidade e valor preditivo positivo de 100%, pois não era observada em qualquer linfonodo normal ou reativo.40 Na Diretriz da ATA de 2015, a microcalcificação foi considerada um dos sinais altamente específicos e importantes achados ultrassonográficos de nódulos malignos suspeitos. Além disso, um autor relatou que a vascularização densa estava associada à alta velocidade do fluxo sanguíneo e estava relacionada ao rápido crescimento tumoral nutrido por sangue abundante de novos vasos, levou a maiores áreas de contato para câncer e vasos linfáticos, que podem resultar em MLN.16 Entretanto, o fluxo sanguíneo em nosso estudo não foi um fator preditor para a MLNC.
A avaliação por US depende do operador e nenhuma característica única é adequadamente sensível à detecção de MLNC no MCPT. Embora muitos estudos tenham descrito características US pré‐operativas do MCPT e tenham identificado vários fatores preditivos, poucos integraram todos os fatores de risco para previsão de MLNC. Neste estudo, verificamos que a combinação de três características da avaliação US (formato, margem e calcificação) apresentou desempenho superior na previsão da MLNC em comparação com outro fator único. A sensibilidade, especificidade e precisão aumentaram, respectivamente, para 72,4%, 74,4% e 77,0%. Com a curva ROC, identificou‐se 0,468 como valor de corte para a previsão de MLNC com VPP de 48,5% e VPN de 85,3%. Além disso, também desenvolvemos um nomograma com base nos fatores de risco usados, porque um nomograma pode incluir todas essas variáveis e fornecer uma estimativa individual de risco metastático para cada paciente. Tem sido relatado que o nomograma é útil para lidar com dilemas no câncer de mama, mas seu uso foi raramente relatado na previsão de risco de MLNC em pacientes com MCPT.41 Para usar esse nomograma, o valor de um paciente com MCPT foi localizado no eixo variável correspondente e uma linha vertical foi traçada para cima para obter o número total de pontos. Todos os pontos foram então somados e a soma foi localizada no eixo de risco do MLNC. Assim, foi possível obter a probabilidade estimada de MLNC em todos os pacientes com MCPT. Nosso nomograma mostrou uma boa capacidade discriminativa, com um índice C de 0,835. Consideramos que é uma ferramenta confiável para ajudar os médicos a decidir se devem executar a DLNC em pacientes com MCPT.
Reconhecemos que existem várias limitações em nosso estudo. Primeiro, é um estudo retrospectivo focado nos dados de um único centro, o que pode ter resultado em viés de seleção. Segundo, o tamanho da amostra não foi grande o suficiente, com apenas 599 pacientes identificados em última análise. São necessários estudos com maiores tamanhos de amostra para confirmar o nosso modelo preditivo. Simultaneamente, a duração média do seguimento de 44,28 meses parece ser curta, considerando o curso natural do câncer de tireoide, e isso pode ter aumentado a incerteza estatística. Por fim, o nomograma precisa de validação adicional em uma grande coorte prospectiva de pacientes com MCPT.
ConclusãoOs fatores clínico‐patológicos de sexo masculino, idade mais jovem (< 45 anos), multifocalidade, invasão extratireoidiana e MLNL são fatores de risco independentes que predizem a MLNC. Concluímos que a MLNC pode estar intimamente associada às características na US, inclusive formato irregular, margem mal definida e calcificação, sugeriu que os MCPT com essa aparência na US provavelmente apresentam maior risco de MLNC. Os profissionais médicos devem prestar mais atenção aos pacientes que têm esses preditores. Geramos um modelo de nomograma para prever o risco de MLNC em pacientes com MCPT. Ele incorporou cinco variáveis independentes e mostrou boa precisão preditiva. A avaliação pré‐operatória e a DLNCp podem ser indicados quando os pacientes apresentam um escore alto no nomograma.
FinanciamentoEste estudo foi apoiado pelo Natural Science Foundation of Liaoning Province (No.201602450, No.20180530038).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Jiwang L, Yahong L, Kai L, Bo H, Yuejiao Z, Haotian W, et al. Clinicopathologic factors and preoperative ultrasonographic characteristics for predicting central lymph node metastasis in papillary thyroid microcarcinoma: a single center retrospective study. Braz J Otorhinolaryngol. 2022;88:36–45.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.