Introdução: Prevenir ou reverter a perda auditiva é um desafio na doença de Ménière. A betahis-tina, um agonista de histamina, tem sido testada no controle de vertigem em pacientes com doença de Ménière, mas sua eficácia em problemas de audição ainda não é conhecida.
Objetivo: Analisar o efeito da betahistina na função auditiva em pacientes com doença de Ménière não tratados previamente, e definir possíveis contribuintes a esse respeito.
Método: Um total de 200 pacientes sem tratamento prévio, e com diagnóstico definido de doença de Ménière unilateral, recebeu beta-histina por via oral (dose inicial de 16 mg três vezes ao dia; dose de manutenção de 24-48 mg por dia, em doses divididas). Alterações dolimiar auditivo antes e após seis meses de tratamento foram documentadas. Considerou-se como perda auditiva uma média do nível de audição > 25 dB NA em cinco frequências.
Resultados: A média de duração da doença foi de 3,37 anos. Seis meses após o tratamento, a média do limiar auditivo diminuiu em 6,35 dB, em comparação com o valor da linha de base (p < 0,001). Tanto a idade dos pacientes quanto a duração da doença apresentaram correlação negativa com a melhora da função auditiva. A perda auditiva após o tratamento foi independentemente associada à idade, ao nível inicial de audição e à cronicidade da doença. Os pontos de corte ótimos correspondentes para prever uma perda auditiva persistente seis meses após o tratamento foram 47 anos, 38 dB HL e 1,4 ano, respectivamente.
Conclusão: A betahistina oral foi significantemente eficaz na prevenção/reversão da deterioração auditiva em pacientes com doença de Ménière. Idade, nível de audição na admissão e duração da doença foram fatores preditivos independentes da condição auditiva após o tratamento.
Introduction: Preventing or reversing hearing loss is challenging in Ménière’s disease. Betahistine, as a histamine agonist, has been tried in controlling vertigo in patients with Ménière’s disease, but its effectiveness on hearing problems is not known.
Objective: To examine the effect of betahistine on hearing function in not-previously-treated patients with Ménière’s disease and to define possible contributors in this regard.
Methods: A total of 200 not-previously-treated patients with definite unilateral Ménière’s disease received betahistine by mouth (initial dose, 16 mg three times a day; maintenance dose, 24-48 mg daily in divided doses). Changes in indicators of hearing status before and six months after treatment were documented. Hearing loss was considered as the mean hearing level >25 dB HL at five frequencies.
Results: The mean duration of disease was 3.37 years. Six months after treatment the mean hearing level decreased by 6.35 dB compared to that at the baseline (p < 0.001). Both patients’ age and the duration of disease correlated negatively with the improvement in hearing function. Post treatment hearing loss was independently associated with age, the initial hearing level and the chronicity of disease. The corresponding optimal cut-off points for predicating a persistent hearing loss 6 months after treatment were 47 years, 38 dB HL, and 1.4 years, respectively.
Conclusion: Oral betahistine was significantly effective in preventing/reversing hearing deterioration in patients with Ménière’s disease. Age, the hearing level on admission, and the disease duration were independent predictors of hearing status after treatment.
Introdução
Descrita pela primeira vez em 1861 por Prosper Ménière, a doença de Ménière, ou hidropisia endolinfática idiopática, é um distúrbio da orelha interna. A pressão elevada na endolinfa pode causar quatro sintomas: (1) perda auditiva neurossensorial flutuante; (2) vertigem episódica ocasional; (3) zumbido; e (4) plenitude auricular.1
O padrão audiométrico da perda auditiva na doença de Ménière varia com o tempo. Embora a perda auditiva esteja limitada a baixas frequências nas fases iniciais, as frequências médias e altas também são envolvidas na progressão da doença. Tratamentos adequados, entretanto, podem evitar ou, pelo menos, retardar a perda de audição na doença de Ménière, especialmente quando iniciados logo após o início dos sintomas.2
Como a doença é uma condição crônica que se desenvolve ao longo de um período de tempo bastante longo, a análise de séries temporais é necessária para avaliar a eficácia do tratamento e estimar o prognóstico.3
A beta-histina (Serc) é um agonista da histamina considerado eficaz no tratamento sintomático da doença de Ménière. Embora o mecanismo exato de ação não seja conhecido, acredita-se que ela atue aumentando o fluxo sanguíneo para a estria vascular coclear e/ou prevenindo a atividade dos núcleos vestibulares.4,5
Até o momento, alguns estudos tentaram testar a utilidade real desse medicamento na doença de Ménière, mas, como a maioria deles exibe falha metodológica, não tem sido possível chegar a uma conclusão definitiva. Por essa razão a beta-histina ainda não foi aprovada pelo FDA (órgão americano que fiscaliza e autoriza o comércio de alimentos e medicamentos) para ser usada em pacientes com doença de Ménière.6
Apesar disso, Smith et al.7 relataram que 94% dos otorrinolaringologistas no Reino Unido prescrevem beta-histina a seus pacientes com Ménière. Relatos similares de países sul-americanos estão disponíveis.8 No melhor entendimento dos autores, entretanto, a eficácia da beta-histina para prevenir ou melhorar a perda auditiva em pacientes com doença de Ménière ainda não foi comprovada. Portanto, este estudo buscou avaliar o efeito da terapia com beta-histina sobre a função auditiva em pacientes sem tratamento prévio para a doença de Ménière e definir possíveis contribuintes relacionados.
Método
Pacientes
No total, 200 pacientes com doença de Ménière definida e não tratados previamente foram consecutivamente recrutados de uma clínica de ensino entre 2011 e 2013. O Comitê de Ética de uma universidade local aprovou este estudo (nº 5/4/6629), e a assinatura do termo de consentimento informado foi obtida dos participantes.
Indivíduos com possível/provável doença de Ménière, envolvimento bilateral, cirurgia otológica prévia ou doenças sistêmicas subjacentes foram excluídos.
O diagnóstico e a classificação da doença de Ménière foram feitos de acordo com as diretrizes fornecidas pela Academia Americana de Otorrinolaringologia –Cirurgia de Cabeça e Pescoço (American Academy of Otolaryngology – Head and Neck Surgery).9
Cada paciente foi submetido a otoscopia e audiometria em estado de repouso, sem ataque vertiginoso, no início do estudo e seis meses após o tratamento.
Audiometria
Um audiômetro padrão (Amplivox 270; Amplivox, Oxfordshire, Inglaterra) foi usado para medir os limiares auditivos. A média de quatro tons foi calculada do pior audiograma em quatro frequências (500, 1.000, 2.000 e 3.000 Hz), durante o intervalo de três meses antes e seis meses depois do tratamento.9 Perda auditiva foi definida como a média do nível de audição em cinco frequências (250, 500, 1.000, 2.000, e 4.000 Hz) > 25 dB HL.10
Tratamento
Os pacientes receberam dicloridrato de beta-histina (Beta-serc, 8 mg por comprimido, Abbott, Illinois, EUA) por via oral: inicialmente, 16 mg três vezes por dia, com alimentos, e uma dose de manutenção de 24-48 mg por dia, em doses divididas para o controle dos sintomas.11,12
Recomendações dietéticas gerais, como baixa ingestão de sódio, foram feitas, mas nenhum outro medicamento, exceto beta-histina, foi permitido durante o período do estudo.
Medidas do resultado
Melhora no nível de audição seis meses após o tratamento (IHL6): Nível inicial de audição – nível de audição seis meses após o tratamento.
Melhora da audição: IHL6 > 0
Perda auditiva: Média do nível de audição seis meses após o tratamento > 25 dB HL.10
Análise estatística
O programa estatístico SPSS versão 19.0 (IBM Corporation, Nova York, EUA) foi usado para análise estatística. A distribuição dos dados numéricos foi testada usando o método de Kolmogorov-Smirnov. Os dados numéricos foram apresentados como média ± desvio padrão ou média [erro padrão da média, EPM]. Tabelas de contingência (teste do Qui-quadrado de Pearson), teste de McNemar, teste t de amostras independentes, teste t de amostras pareadas, teste-U independente de Mann-Whitney e o teste de postos com sinais de Wilcoxon foram usados, quando apropriado. O coeficiente de Spearman (rho)/coeficiente de Pearson (r) foi calculado para investigar as correlações entre as variáveis. Um modelo de regressão linear/análise de regressão logística descendente em etapas foi usado na construção de uma análise multivariada. A curva das características de operação do receptor (curva ROC) foi desenhada para determinar as áreas sob a curva e os valores de corte ideais. O nível de significância foi determinado em p ≤ 0,05.
Resultados
As variáveis de estudo, incluindo informações demográficas e dados gerais no momento da admissão, estão resumidas na tabela 1.
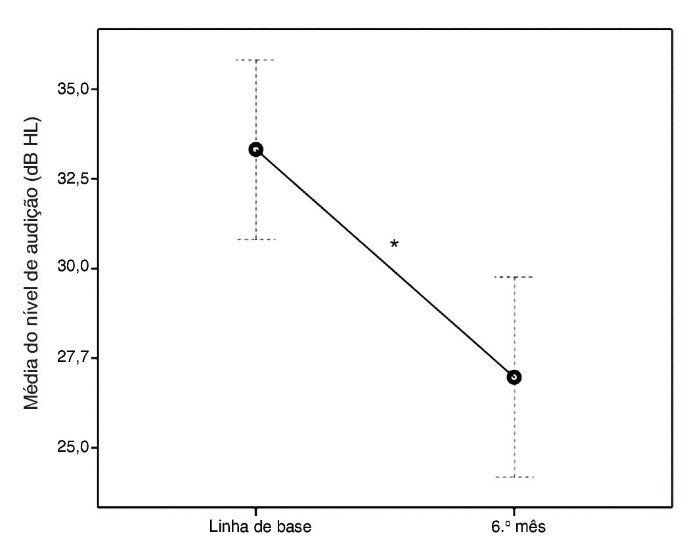
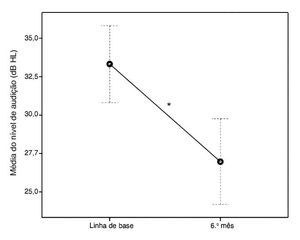
Seis meses após o tratamento, a média do limiar auditivo caiu significantemente a 26,97 dB NA (EPM, 1,42; percentagem de diminuição, 19,06%; teste de Wilcoxon p < 0,001) (fig. 1).
Figura 1. Alterações na média dos níveis de audição na linha de base e seis meses após o tratamento. As barras de erro representam o intervalo de confiança de 95%. * p ≤ 0,05 é estatisticamente significativo.
A média de IHL6 foi de 6,35 dB (EPM, 0,75), indicando uma melhora da audição em 60 pacientes (30%) no desfecho final.
Seis meses após o tratamento, a manutenção da perda auditiva foi observada em 90 pacientes, indicando uma redução de 30,23% pelo tratamento (teste de McNemar p < 0,001).
Contribuintes para a função auditiva após tratamento
IHL6
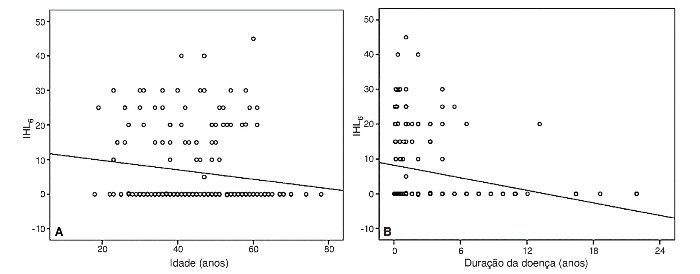
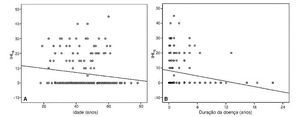
A média do IHL6 foi de 6,99 dB (EPM, 0,08) nas mulheres, e de 5,07 dB (EPM, 0,14) nos homens (teste-U de Mann-Whitney p = 0,23). Uma correlação inversa significante foi observada entre a idade e o IHL6 (Pearson r = –0,16, p = 0,03) (fig. 2A), indicando uma correlação negativa entre o aumento da idade e a melhora na função auditiva após o tratamento. Não houve correlação significante entre o IHL6 e o nível de audição do início do estudo (rho de Spearman = 0,09, p = 0,21), enquanto uma correlação negativa significante foi observada entre o IHL6 e a duração da doença (rho de Spearman = –0,31, p < 0,001) (fig. 2B).
Figura 2. Gráficos de dispersão simples representando correlações inversas entre a idade e a melhora dos pacientes no nível de audição seis meses após o tratamento (IHL6) (A), e entre a duração da doença e o IHL6 (B).
Em um modelo de regressão linear, tanto a idade quanto o tempo de doença foram independentemente associados ao IHL6 (p = 0,05 e 0,002, respectivamente).
Melhora da audição
As taxas de melhora da audição após o tratamento foram semelhantes para homens e mulheres (25,4% vs. 32,3%, respectivamente; teste do Qui-quadrado, p = 0,31). Os pacientes com melhora da audição, no entanto, eram significantemente mais jovens (41,60 ± 11,46 anos vs. 46,86 ± 12,14 anos; teste t de amostras independentes, p = 0,01). A média de duração da doença foi significantemente menor nos casos com melhora da audição que nos casos sem nenhuma alteração ou deterioração da função auditiva em seis meses após o tratamento (1,71 [0,28] anos vs. 3.26 [0,39] anos; teste-U de Mann-Whitney, p < 0,001). A média inicial do nível de audição foi de 33,75 dB NA (EPM, 1,31) nos pacientes com melhora auditiva e 33,14 dB NA (EPM, 1,72) no restante (teste-U de Mann-Whitney, p = 0,79).
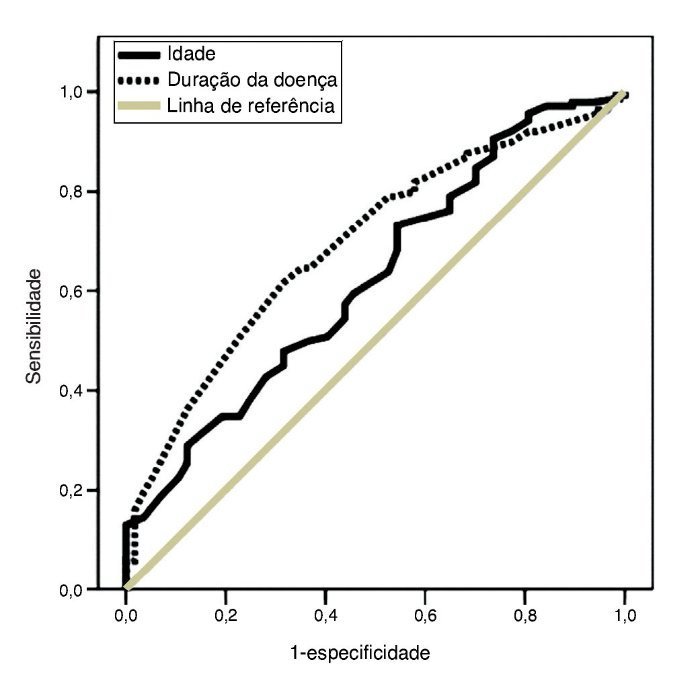
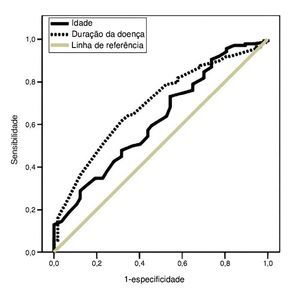
Na análise multivariada, tanto a duração da doença quanto a idade foram fatores independentes e determinantes de melhora auditiva pós-tratamento (p = 0,01, Exp(B) = 0,96 e p = 0,002, Exp(B) = 1,00, respectivamente). Com áreas sob as curvas ROC de 0,62 (p = 0,01) e 0,69 (p < 0,001), os pontos de corte ideais relacionados foram 44 (sensibilidade: 57,3%, especificidade: 56,1%) e 1,4 (sensibilidade: 63,5%, especificidade: 68%), respectivamente (fig. 3).
Figura 3. Curvas das características de operação do receptor (curvas ROC) da idade e duração da doença dos pacientes para prever função auditiva desfavorável seis meses após o tratamento. Área sob a curva: 0,62 para a idade e 0,69 para a duração da doença (p = 0,01 e < 0,001, respectivamente).
Perda auditiva persistente
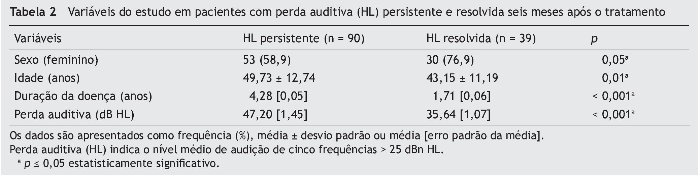
As variáveis em relação à perda auditiva persistente após o tratamento estão resumidas na tabela 2. Consequentemente, idade avançada (teste t de amostras independentes, p = 0,01), sexo masculino (teste do Qui-quadrado, I = 0,05), doença mais crônica (teste-U de Mann-Whitney, p < 0,001) e um nível de audição inicial elevado (teste-U de Mann-Whitney, p < 0,001) foram significantemente associados à perda auditiva persistente após o tratamento.
Na análise multivariada, com exceção do sexo (p = 0,11, Exp(B) = 2,41), todas as demais variáveis, incluindo idade (p = 0,01, Exp(B) = 1,06), cronicidade da doença (p = 0,01, Exp(B) = 1,00) e nível de audição no início do estudo (p < 0,001, Exp(B) = 1,10), foram consideradas contribuintes independentes para a função auditiva pós-tratamento.
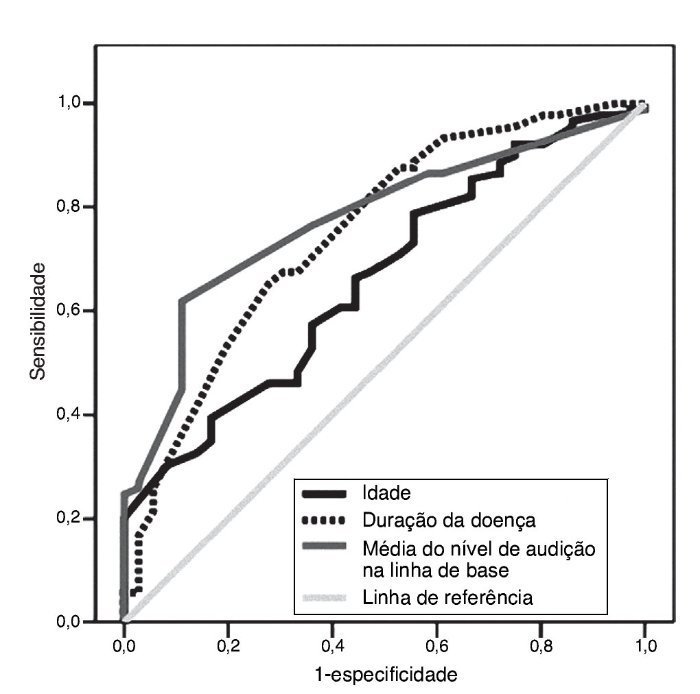
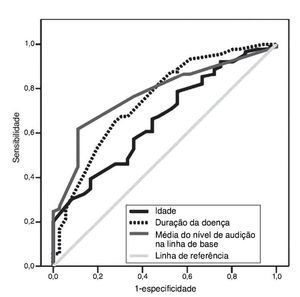
As curvas ROC relacionadas a idade, cronicidade da doença e nível inicial de audição são mostradas na fig. 4. Com áreas sob as curvas ROC de 0,66 (p = 0,01), 0,75 (p < 0,001) e 0,76 (p < 0,001), os pontos de corte ideais foram 47 (sensibilidade: 60,7%, especificidade: 58,3%), 1,4 (sensibilidade: 67,4%, especificidade: 69,4%) e 38 (sensibilidade: 76,4%, especificidade: 63,9%), respectivamente.
Figura 4. Curvas das características de operação do receptor (curvas ROC) de idade, nível de audição na linha de base e duração da doença dos pacientes para prever perda auditiva persistente seis meses após o tratamento. Área sob a curva: 0,66 para idade, 0,76 para o nível de audição na linha de base e 0,75 para a duração da doença (p = 0,01, < 0,001 e < 0,001, respectivamente).
Discussão
Embora exista uma grande variedade de sintomas que surgem no curso da doença de Ménière, a perda auditiva é, geralmente, considerada uma consequência inevitável.13 Em contraste com a noção antiquada da “história natural”, que sugere que intervenções cirúrgica e farmacológica não podem alterar a deterioração auditiva na doença de Ménière,14-16 o diagnóstico e o tratamento precoces podem impedir de forma notável a sua progressão.17 Uma média de 6,35 dB na melhora do nível de audição seis meses após a administração de beta-histina, no presente estudo, apoia esse fato.
Neste estudo, idade mais jovem e menor tempo de doença foram dois preditivos independentes de melhora auditiva pós-tratamento. Da mesma forma, em um estudo sobre audiometria tonal em 300 pacientes com doença de Ménière, Paparella et al.18 observaram que a duração da doença era um importante fator prognóstico em relação às alterações na função auditiva. Em outra série retrospectiva, Katsarkas19 examinou 475 pacientes que sofriam de doença de Ménière e observou que, apesar das variações da perda auditiva de caso para caso, ao longo do tempo, a deficiência auditiva correlacionou de forma significante com o tempo transcorrido desde o início da doença. Em um estudo retrospectivo com 243 pacientes com doença de Ménière, conduzido por Havia et al.,20 doença prolongada esteve associada à deterioração da função auditiva. Em um estudo recente conduzido por Sato et al.,21 potenciais fatores relacionados ao prognóstico de perda auditiva foram examinados retrospectivamente em um grupo de 36 pacientes com doença de Ménière unilateral. Os autores relataram que o intervalo desde o início da doença até a consulta inicial foi, em média, significantemente maior nos pacientes com problemas de audição. Do mesmo modo, uma correlação similar foi sugerida entre a idade e a deficiência auditiva em pacientes com a doença de Ménière.22,23 De acordo com nossa pesquisa, entretanto, este é o primeiro estudo que relata um papel independente da idade na determinação da função auditiva e a sua capacidade de resposta ao tratamento médico com beta-histina na doença de Ménière.
Considerando o efeito do tratamento na perda auditiva (isto é, a média do nível de audição de cinco frequências > 25 dB HL), a porcentagem de pacientes afetados com esse problema diminuiu significantemente de 64,5% no início do estudo para 45% no resultado final (p < 0,001). Além da idade e da duração da doença, o nível de audição (em análise multivariada) e o sexo (em análise univariada) foram outros fatores preditivos.
Em termos de prognóstico da audição, uma capacidade auditiva comprometida na consulta inicial pode prever uma condição futura desfavorável em pacientes com doença de Ménière.21 Sato et al.21 também observaram que os níveis de audição nas consultas iniciais foram significantemente piores em pacientes com prognóstico ruim que em pacientes com prognóstico bom.
Lesões cocleares e do oitavo nervo craniano foram sugeridas como causas plausíveis da doença de Ménière por alguns pesquisadores. A preservação relativa das células ciliadas nos mesmos pontos de lesão corrobora ainda mais a teoria de neurotoxicidade nesses pacientes. Verificou-se que a deterioração do nervo possivelmente independe da gravidade da hidropisia.24 Isso pode explicar a heterogeneidade encontrada neste estudo em relação ao papel prognóstico do nível de audição inicial, o qual foi significantemente associado à perda auditiva persistente, mas não ao grau de melhora na função auditiva após o tratamento. Isso significa que as alterações estruturais, e não as funcionais, acompanham a perda de audição permanente que não respondem adequadamente a tratamentos clínicos. A presença de perda auditiva pode ser indicativo de tais alterações estruturais em pacientes com doença de Ménière.18
Em um estudo semelhante, que tentou identificar os fatores associados à capacidade de resposta ao tratamento clínico da doença de Ménière, Devaiah e Ato25 estudaram 29 pacientes. Eles observaram que a terapia medicamentosa agressiva (restrição de sódio e tratamento diurético nessa série) pode impedir a progressão da doença em termos de perda auditiva, em pessoas com doença menos grave.
No presente trabalho, os autores tentaram definir pontos de corte para a idade, a perda auditiva inicial e a duração da doença. Usando a análise da curva ROC, os valores correspondentes foram 47 (sensibilidade: 60,7%, especificidade: 58,3%), 38 (sensibilidade: 76,4%, especificidade: 63,9%) e 1,4 (sensibilidade: 67,4%, especificidade: 69,4%), respectivamente.
Em um estudo realizado por Kotimaki et al.,23 os prontuários de 205 pacientes com diagnóstico definitivo da doença de Ménière foram revisados retrospectivamente. Semelhantemente aos nossos achados, eles mostraram que tanto a idade quanto o tempo de doença estão associados à deficiência auditiva, com deterioração na média de tons puros nas frequências de 0,5 a 4 kHz de, aproximadamente, 1 dB por ano, devido à duração da doença, e em cerca de 0,5 dB por ano, como consequência do envelhecimento. Nesse estudo, a idade de 50 anos foi relatada como um determinante do papel da duração da doença em afetar a perda auditiva. Embora a idade de 47 anos, no presente estudo, tenha sido associada à perda auditiva persistente após o tratamento, independentemente da duração da doença, o valor relatado por eles é próximo do nosso.
Essa diferença relacionada ao gênero pode explicar nosso achado em relação ao efeito do sexo do indivíduo sobre a capacidade de resposta da perda auditiva ao tratamento clínico. Contudo, estudos adicionais são necessários para se chegar a uma conclusão a esse respeito.23
No presente estudo, excluímos os pacientes com doença bilateral, porque a bilateralidade foi sugerida como um fator preditivo de mau prognóstico da audição em pacientes com doença de Ménière,1,18 e poderia interferir no objetivo principal desta pesquisa.
Outra limitação foi o período relativamente curto de acompanhamento da condição auditiva após o tratamento (seis meses). Um tempo mais longo de acompanhamento pode ser necessário nesse contexto.26
Neste estudo, os pacientes recrutados haviam sido recentemente diagnosticados com a doença de Ménière. Registros médicos e declarações dos pacientes foram os únicos documentos nos quais nos baseamos para avaliar a história e os possíveis tratamentos anteriores. Isso pode diminuir a confiabilidade dos dados utilizados nesta pesquisa.
Apesar das significantes melhoras auditivas detectadas no presente estudo, essas alterações podem não ser clinicamente vantajosas. Devemos reconhecer que não foi possível verificar se os pacientes estavam em período intercrises, quando a audição é geralmente melhor. Isso poderia acontecer em pacientes com perdas leves e, dessa forma, a obtenção de resultados clínicos uniformes poderia ser negativamente afetada.
A última limitação foi que somente os resultados de um tratamento clínico conservador (i.e, beta-histina), não consensualmente aceito, foram considerados neste estudo. Essa abordagem foi escolhida porque os tratamentos não farmacológicos são diversificados, e seus resultados variam de forma significativa entre os estudos.14-16 Além disso, como mencionado anteriormente, em países como o Reino Unido e outros da América do Sul, essa medicação é amplamente utilizada no tratamento sintomático da doença de Ménière.7,8
Conclusão
Com base nos resultados deste estudo, pode se concluir que beta-histina oral é eficaz na prevenção/correção de problemas auditivos em pacientes com doença de Ménière. A idade e a duração da doença contribuíram de forma independente para a eficácia do medicamento nesse contexto. O gênero e o nível de audição inicial também podem desempenhar um papel nesse sentido.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 10 de fevereiro de 2015;
aceito em 26 de agosto de 2015
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.08.021
☆ Como citar este artigo: Seyed Tootoonchi SJ, Ghiasi S, Shadara P, Samani SM, Fouladi DF. Hearing function after betahistine therapy in patients with Ménière’s disease. Braz J Otorhinolaryngol. 2016;82:500-6.
* Autor para correspondência.
E-mail:Medicorelax@yahoo.com (D.F. Fouladi).