O carcinoma espinocelular (CEC) é a neoplasia mais frequente em cabeça e pescoço e cavidade oral. Ele é o sexto câncer sólido mais comum e afeta mais de 900.000 pessoas em todo o mundo a cada ano. O carcinoma espinocelular oral (CECO) é o maior subgrupo de CECCP, causa anualmente 7.400 mortes nos EUA.1 Devido à alta prevalência e agressividade, o CECCP tem sido estudado por várias técnicas moleculares e citogenéticas. Os desequilíbrios cromossômicos relatados com mais frequência no CECCP são: 3p, 4, 5q, 8p, 9p, 11, 13q e 18q (perdas) e 3q25‐26, 5p, 8q24, 9q22‐34, 11q13, 14q24, 16p, 19p, 20q24 e 22q (ganhos).1
O componente carcinomatoso do ex‐adenoma pleomórfico (EXAP) engloba uma variedade de tipos histológicos de tumor, tais como adenocarcinoma, carcinoma mioepitelial, carcinoma epitelial‐mioepitelial, carcinoma sarcomatoide e carcinoma do ducto salivar.2 Muitos estudos epidemiológicos sobre a incidência do EXAP mostraram poucos ou nenhum caso com um componente carcinomatoso.
Apesar de haver relatos de numerosas alterações cromossômicas em CEC de outros locais, não há relato de desequilíbrios cromossômicos especificamente para o carcinoma espinocelular, ex‐adenoma pleomórfico (CEC‐EXAP). O objetivo deste estudo foi identificar alterações cromossômicas associadas ao CEC‐EXAP e compará‐las com dados de literatura sobre o CECCP.
Relato de casoDados clinicopatológicosO caso foi encaminhado ao nosso departamento para avaliação histopatológica. O sexo e a idade do paciente são desconhecidos. O paciente apresentou‐se com um tumor em glândula parótida que havia sido notado havia dez anos. O tumor foi ressecado cirurgicamente e o exame histológico mostrou áreas de adenoma pleomórfico (AP) e CEC que surgiam no AP (fig. 1). As células tumorais apresentavam formação de pérolas de queratina e invadiam os tecidos adjacentes à glândula parótida. A neoplasia foi classificada como um CEC‐EXAP francamente invasivo. O paciente desenvolveu metástase a distância nos pulmões, mas a informação sobre o acompanhamento não estava disponível.
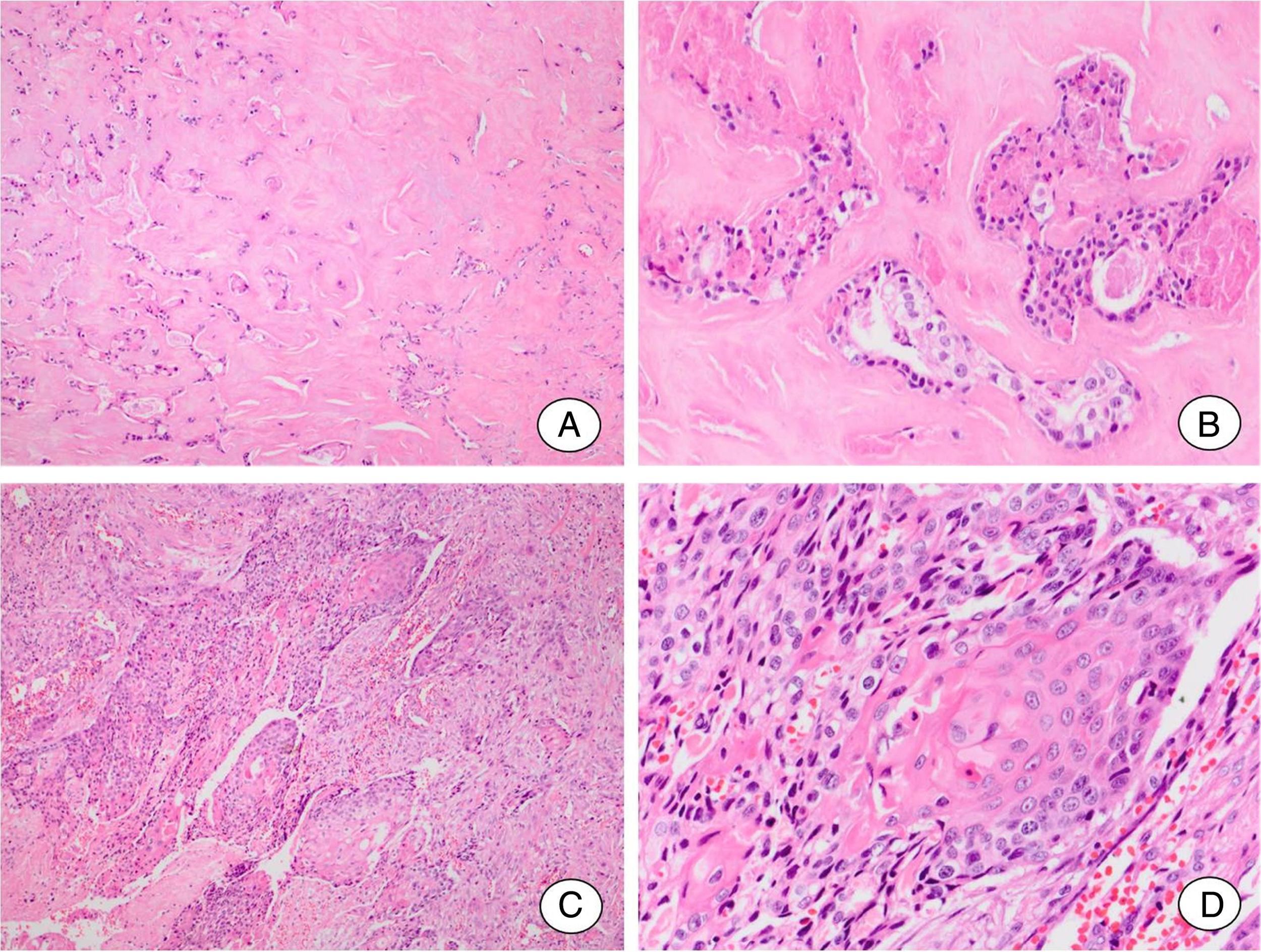
Carcinoma espinocelular ex‐adenoma pleomórfico. (A, B) Adenoma pleomórfico residual. A, Área de adenoma pleomórfico mostra extensa hialinização do estroma. B, Poucas estruturas ductais revestidas por células sem características atípicas podem ser vistas. (C, D) Componente carcinomatoso. C, Um carcinoma espinocelular francamente invasivo é o componente maligno do tumor. D, Detalhe do componente maligno mostra ilhas formadas por células com diferenciação escamosa.
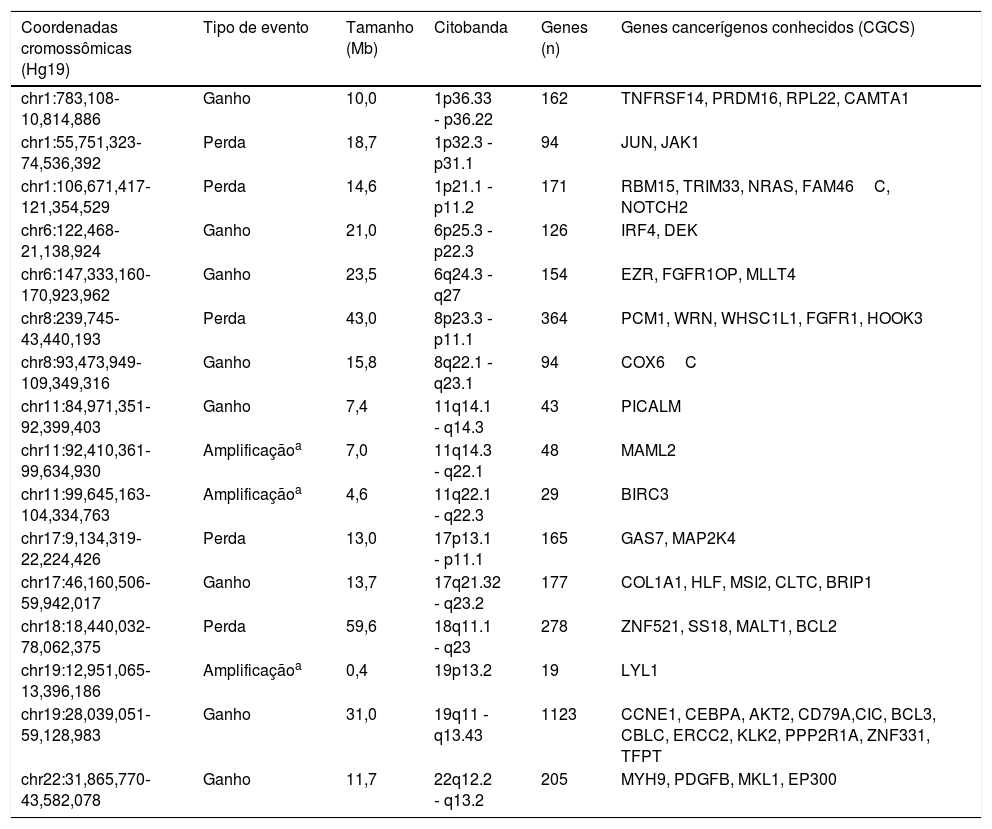
As alterações somáticas do número de cópias detectadas na amostra do CEC‐EXAP são detalhadas na tabela 1, bem como os genes conhecidos afetados pelo câncer, de acordo com o Cancer Gene Census Sanger (https://www.sanger.ac.uk/research/projects/cancergenome/census.html).
Alterações do número de cópias somáticas detectadas por array‐CGH em um caso de CEC‐EXAP
| Coordenadas cromossômicas (Hg19) | Tipo de evento | Tamanho (Mb) | Citobanda | Genes (n) | Genes cancerígenos conhecidos (CGCS) |
|---|---|---|---|---|---|
| chr1:783,108‐10,814,886 | Ganho | 10,0 | 1p36.33 ‐ p36.22 | 162 | TNFRSF14, PRDM16, RPL22, CAMTA1 |
| chr1:55,751,323‐74,536,392 | Perda | 18,7 | 1p32.3 ‐ p31.1 | 94 | JUN, JAK1 |
| chr1:106,671,417‐121,354,529 | Perda | 14,6 | 1p21.1 ‐ p11.2 | 171 | RBM15, TRIM33, NRAS, FAM46C, NOTCH2 |
| chr6:122,468‐21,138,924 | Ganho | 21,0 | 6p25.3 ‐ p22.3 | 126 | IRF4, DEK |
| chr6:147,333,160‐170,923,962 | Ganho | 23,5 | 6q24.3 ‐ q27 | 154 | EZR, FGFR1OP, MLLT4 |
| chr8:239,745‐43,440,193 | Perda | 43,0 | 8p23.3 ‐ p11.1 | 364 | PCM1, WRN, WHSC1L1, FGFR1, HOOK3 |
| chr8:93,473,949‐109,349,316 | Ganho | 15,8 | 8q22.1 ‐ q23.1 | 94 | COX6C |
| chr11:84,971,351‐92,399,403 | Ganho | 7,4 | 11q14.1 ‐ q14.3 | 43 | PICALM |
| chr11:92,410,361‐99,634,930 | Amplificaçãoa | 7,0 | 11q14.3 ‐ q22.1 | 48 | MAML2 |
| chr11:99,645,163‐104,334,763 | Amplificaçãoa | 4,6 | 11q22.1 ‐ q22.3 | 29 | BIRC3 |
| chr17:9,134,319‐22,224,426 | Perda | 13,0 | 17p13.1 ‐ p11.1 | 165 | GAS7, MAP2K4 |
| chr17:46,160,506‐59,942,017 | Ganho | 13,7 | 17q21.32 ‐ q23.2 | 177 | COL1A1, HLF, MSI2, CLTC, BRIP1 |
| chr18:18,440,032‐78,062,375 | Perda | 59,6 | 18q11.1 ‐ q23 | 278 | ZNF521, SS18, MALT1, BCL2 |
| chr19:12,951,065‐13,396,186 | Amplificaçãoa | 0,4 | 19p13.2 | 19 | LYL1 |
| chr19:28,039,051‐59,128,983 | Ganho | 31,0 | 19q11 ‐ q13.43 | 1123 | CCNE1, CEBPA, AKT2, CD79A,CIC, BCL3, CBLC, ERCC2, KLK2, PPP2R1A, ZNF331, TFPT |
| chr22:31,865,770‐43,582,078 | Ganho | 11,7 | 22q12.2 ‐ q13.2 | 205 | MYH9, PDGFB, MKL1, EP300 |
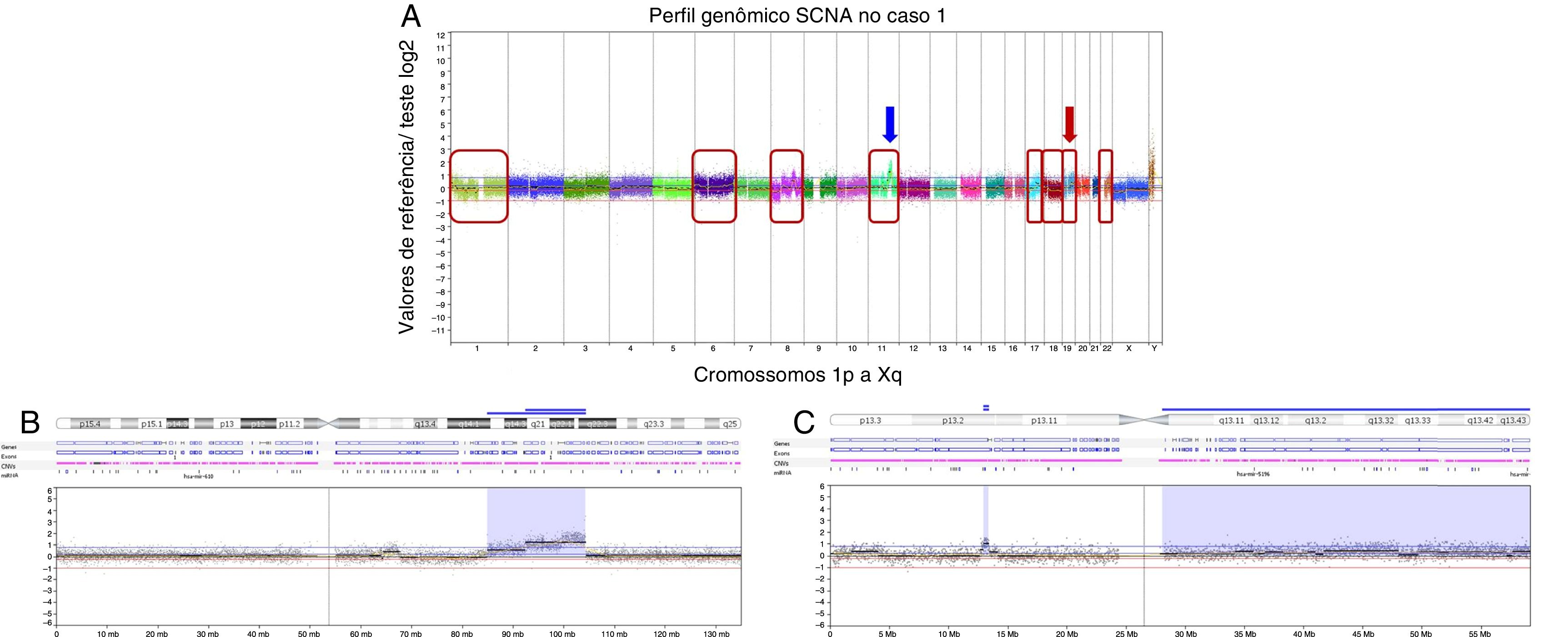
O presente caso exibiu um padrão genômico complexo, com várias alterações do número de cópias. As perdas foram detectadas em 1p, 8p, 17p e 18q e os ganhos foram identificados em 1p, 6, 8q, 11q, 17q, 19q e 22q (fig. 2A).
Alterações do numero de cópias detectadas por array‐CGH no caso de CEC‐EXAP. A, Perfil genômico de array‐CGH exibe todas as alterações do número de cópias identificadas neste caso. O eixo x representa sondas ordenadas de acordo com as posições genômicas dos cromossomos 1p a Xq (cada cromossomo é marcado com uma cor diferente). O eixo y indica os valores de referência/teste log2 (ganhos e perdas genômicas estão agrupados acima ou abaixo da linha de base 0, respectivamente; imagens adaptadas do software Nexus Copy Number 7.0, Biodiscovery). O quadro vermelho indica cromossomos que abrigam rearranjos genômicos de perdas ou ganhos: 1, 6, 8, 11, 17, 18, 19 e 22. As setas mostram as regiões de ampliações genômicas nos cromossomos 11 e 19. B, Perfil de array‐CGH do cromossomo 11 mostra em detalhe as duas regiões com alto ganho de número de cópias (amplificações): em 11q14q22.1 (7 Mb) e em 11q22.1‐q22.3 (4,6 Mb) (seta azul em A). C, Perfil de array‐CGH do cromossomo 19 exibe uma região de amplificação genômica em 19p13.2 (0,4 Mb) (seta vermelha em A).
Três regiões que exibiam alterações com alto número de cópias (amplificações) foram detectadas em 11q14.3q22.1, 11q22.1q22.3 (fig. 2B) e 19p13.2 (fig. 2C). Entre outros genes, essas amplificações envolvem os genes conhecidos do câncer, MAML2, BIRC3 e LYL1.
DiscussãoMariano et al. (2013)2 relataram um caso de CEC‐EXAP (2,6%) em 38 casos de EXAP da população brasileira. De acordo com nossa pesquisa, foram descritos somente casos esporádicos que mostravam CEC como o componente maligno de EXAP e enfatizavam as características clínicas e morfológicas.
O CEC origina‐se a partir do componente epitelial do AP e de lesões que surgem das glândulas salivares menores e é importante demonstrar que não há continuidade dos nichos do CEC com a mucosa bucal. No presente caso, áreas de AP residual foram associadas a um CEC amplamente invasivo de tecidos moles em torno da glândula parótida. Metástases distantes foram observadas em nosso caso. Isso sugere que o CEC pertence ao grupo de EXAP agressivo. Propôs‐se que o EXAP seja, na verdade, uma categoria de tumores, e não um único tumor, pois os carcinomas tanto agressivos quanto indolentes podem surgir de um AP.
Agressividade local, taxa elevada de recidivas precoces e taxa reduzida de cinco anos de sobrevida não superior a 50% são aspectos clínicos característicos do CEC. O CECO causa 7.400 mortes nos EUA a cada ano.1 Portanto, durante as duas últimas décadas, abordagens de triagem do genoma, como a hibridização genômica comparativa (CGH) do cromossoma, foram aplicadas para descobrir a base molecular da carcinogênese desse tumor.
Um perfil genômico complexo das alterações do número de cópias do CECCP foi descrito na literatura, inclusive perdas em 3p, 4, 5q, 8p, 9p, 11, 13q e 18q e ganhos em 3q25q26, 5p, 8q24, 9q22q34, 11q13, 14q24, 16p, 19q, 20q24 e 22q.1 O presente caso também mostrou um perfil genômico complexo com várias alterações do número de cópias, mas com um padrão diferente em comparação com o CECCP, provavelmente devido à linhagem celular distinta. Curiosamente, existem várias regiões discretas de perda em 3p no CECCP.1,3 Embora as investigações citogenéticas tenham sugerido que a perda em 3p seja uma alteração genômica importante no CECCP, nosso caso não apresentou essa alteração. Contudo, algumas semelhanças entre CECCP e nosso caso foram encontradas, como perdas em 8p23 e 18q11 e ganhos em 8q22.1, 19q e 22q. Essas alterações podem ser específicas da diferenciação das células escamosas e contribuir para o comportamento agressivo.3
Sugeriu‐se que, em CECCP, os ganhos em 3q26 e 11q13 e deleções em 8p23 e 22q poderiam ser marcadores valiosos de doença agressiva.1 A perda em 8p23 no presente caso envolve genes importantes relacionados ao câncer, como PCM1, WRN, WHSCILI, FGFR1 e HOOK3. Por outro lado, sugeriu‐se que ganhos cromossômicos em 1q e 16q, bem como perdas cromossômicas em 18q, representam marcadores prognósticos em CECCP.1,3 Também encontramos perda em 18q que envolveu genes relacionados ao câncer, como ZNF521, SS18, MALT1 e BCL2. Além disso, observamos em nossa amostra um ganho em 8q22.1q23.1. Nesse intervalo genômico, o gene YWHAZ foi mapeado, um proto‐oncogene candidato do CECCP.
Também identificamos novos achados não relatados anteriormente para o CECCP, tais como perdas em 1p32, 1p21 e 17p13.1 e ganhos em 1p36.33, 6p25.3, 6q24, 11q14 e 17q21.32. A perda em 1p32 está associada ao desenvolvimento do carcinoma adenoide cístico1 e 1p36 é frequentemente deletado em cânceres humanos. Entre essas regiões de desequilíbrio, a perda em 1p21.1 parece particularmente interessante, porque envolve vários genes relacionados ao câncer.1 A sobre‐expressão do gene DEK (6p25.3) está associada ao adenocarcinoma gástrico e de mama,4 bem como o EZRIN desempenha um papel em adenocarcinoma colorretal, pancreático, gástrico e outros.5
Vale destacar que detectamos três ampliações genômicas que envolviam as regiões em 11q14.3q22.1, 11q22.1q22.3 e 19p13.2. Essas amplificações podem abrigar genes relevantes que estimulam a carcinogênese e MAML2, BIRC3 e LYL1 são genes conhecidos do câncer mapeados nessas regiões.
MAML2 (11q14.3q22.1) (Mastermind‐like 2) desempenha um papel como coativador transcricional para o receptor de Notch e foi relatado como rearranjado com CRTC1 e CRTC3 em carcinomas mucoepidermoides.6 Em nosso caso, o diagnóstico de carcinoma mucoepidermoide que surge em um AP foi descartado no exame histológico, pois o componente maligno não continha células mucosas. MAML2‐CRTC1 e MAML2‐CRTC3 não foram encontrados em carcinoma adenoescamoso, CEC ou qualquer outro carcinoma da glândula salivar.6 MAML2 amplificado induz a transcrição do gene HES‐1 (um gene alvo de Notch), que regula a expressão de fatores de transcrição específicos do tecido que influenciam a linhagem e outros eventos. Essa amplificação é descrita com baixa frequência em cânceres de vários locais, mas não em CECCP.
Outro gene amplificado, BIRC3 (Baculoviral IAP Repeat Containing 3), codifica um membro da família de proteínas inibidoras de apoptose (IAP). A amplificação que envolve o BIRC3 foi detectada em câncer pancreático, osteossarcoma, leucemia mieloide aguda, carcinoma mamário, câncer do pulmão, câncer cervical e CEC.7 Verificou‐se que BIRC3 pode aumentar a sobrevida de células cancerígenas e a progressão do câncer. Isso sugere que os tratamentos que visam ao produto desse gene podem oferecer opções terapêuticas úteis. O gene LYL1 (Lymphoblastic Leukemia associated hematopoiesis regulator 1) representa um fator básico de transcrição hélice‐alça‐hélice que codifica uma proteína com influência na maturação dos vasos sanguíneos e na hematopoiese.8 Acreditamos que a amplificação do LYL1 em tumores de glândulas salivares pode contribuir para a oncogênese.
Há relatos de que tanto AP quanto EXAP têm anormalidades cromossômicas altamente específicas relacionadas aos genes PLAG1 e HMGA2. Rearranjos desses genes (rearranjos em 8q12 afetam o gene PLAG1 e rearranjos em 12q14‐15 afetam o gene HMGA2) foram implicados na gênese do AP e EXAP. No entanto, embora essas alterações cromossômicas sejam frequentes nesses tumores, elas não são detectadas em todos eles.9 No presente caso, não encontramos amplificação dos genes PLAG1 ou HMGA2. Isso sugere que o tumor provavelmente pertence àqueles que não têm essa alteração cariotípica.
ConclusãoO CEC‐EXAP mostrou um padrão complexo de alterações do número de cópias que tem algumas semelhanças com o do CECCP. É provável que essas anormalidades cromossômicas possam estar envolvidas no desenvolvimento do fenótipo escamoso e no comportamento agressivo do CEC‐EXAP. No entanto, ampliações genômicas de genes cancerígenos conhecidos, como LYL1, BIRC3 e MAML2, detectados apenas no CEC‐EXAP, podem ter importância para o processo de transformação maligna do AP. Essas últimas alterações podem ser marcadores clinicamente relevantes para o diagnóstico de CEC‐EXAP.
FinanciamentoProcesso Fapesp: 2011/23204‐5 e Processo Fapesp: 2011/23366‐5.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mariano FV, Saccomani LF, Giovanetti K, Del Negro A, Kowalski LP, Krepischi AC, et al. Genomic profile of a squamous cell carcinoma ex pleomorphic adenoma compared to a head and neck squamous cell carcinoma. Braz J Otorhinolaryngol. 2018;84:393–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.