Increased body mass index is known to be associated with the high prevalence of differentiated thyroid cancers; however data on its impact on survival outcome after thyroidectomy and adjuvant therapy is scanty.
ObjectiveWe aimed to evaluate the impact of body mass index on overall survival and disease free survival rates in patients with differentiated thyroid cancers.
MethodsBetween 2000 and 2011, 209 patients with differentiated thyroid cancers (papillary, follicular, hurthle cell) were treated with thyroidectomy followed by adjuvant radioactive iodine‐131 therapy and thyroid‐stimulating hormone suppression. Based on body mass index, patients were divided into five groups; (a) <18.5kg/m2 (underweight); (b) 18.5–25kg/m2 (normal weight); (c) 26–30kg/m2 (overweight); (d) 31–40kg/m2 (obese) and (e) >40kg/m2 (morbid obese). Various demographic, clinical and treatment characteristics and related toxicity and outcomes (overall survival, and disease free survival) were analyzed and compared.
ResultsMedian follow up period was 5.2years (0.6–10). Mean body mass index was 31.3kg/m2 (17–72); body mass index 31–40kg/m2 was predominant (89 patients, 42.6%) followed by 26–30kg/m2 seen in 58 patients (27.8%). A total of 18 locoregional recurrences (8.6%) and 12 distant metastasis (5.7%) were seen. The 10 year disease free survival and overall survival rates were 83.1% and 58.0% respectively. No significant impact of body mass index on overall survival or disease free survival rates was found (p=0.081). Similarly, multivariate analysis showed that body mass index was not an independent prognostic factor for overall survival and disease free survival.
ConclusionAlthough body mass index can increase the risk of thyroid cancer, it has no impact on treatment outcome; however, further trials are warranted.
Sabe‐se que o aumento do índice de massa corpórea está associado à alta prevalência de câncer diferenciado de tireoide; entretanto, os dados sobre seu impacto no desfecho de sobrevivência após tireoidectomia e terapia adjuvante são escassos.
ObjetivoObjetivou-se avaliar o impacto do índice de massa corpórea nas taxas de sobrevida global e sobrevida livre de doença em pacientes com câncer diferenciado de tireoide.
MétodoEntre 2000 e 2011, 209 pacientes com câncer diferenciado de tireoide (papilar/folicular/de células de Hurthle) foram tratados através de tireoidectomia, seguida de tratamento com iodo radioativo-131 adjuvante e supressão de hormônio estimulante da tireoide. Com base no índice de massa corpórea, os pacientes foram divididos em cinco grupos; (a) < 18,5kg/m2 (baixo peso); (b) 18,5‐25kg/m2 (peso normal); (c) 26‐30kg/m2 (sobrepeso); (d) 31‐40kg/m2 (obesos) e (e)>40kg/m2 (obesos mórbidos). Várias características demográficas, clínicas e de tratamento e toxicidade associada e desfechos (sobrevida global e sobrevida livre de doença) foram analisadas e comparadas.
ResultadosO período médio de acompanhamento foi de 5,2 anos (0,6‐10). O índice de massa corpórea médio foi de 31,3kg/m2 (17‐72); o índice de massa corpórea de 31‐40kg/m2 foi predominante (89 pacientes, 42,6%), seguido por 26‐30kg/m2, observado em 58 pacientes (27,8%). Observaram‐se 18 recidivas locorregionais (8,6%) e 12 metástases distantes (5,7%). As taxas de sobrevida livre de doença e sobrevida global de 10 anos foram de 83,1% e 58,0%, respectivamente. Não foi encontrado impacto significativo do índice de massa corpórea nas taxas de sobrevida global ou sobrevida livre de doença (p=0,081).Da mesma forma, a análise multivariada mostrou que o índice de massa corpórea não foi um fator prognóstico independente para sobrevida global e sobrevida livre de doença.
ConclusãoEmbora o índice de massa corpórea possa aumentar o risco de câncer de tireoide, ele não tem impacto no resultado do tratamento; contudo, outros estudos são necessários.
A prevalência do índice de massa corpórea (IMC)>30kg/m2 que denota sobrepeso e obesidade aumentou em todo o mundo durante a década passada e os dados demonstraram que 35% dos americanos são obesos.1,2 No Reino da Arábia Saudita, o IMC está aumentando em ambos os sexos e em todas as idades, com uma prevalência global de 44%.3,4 A obesidade é um fator de risco bem conhecido para vários tipos de neoplasias, inclusive carcinoma endometrial, carcinoma colorretal e carcinoma de mama.5,6 Dados recentes mostraram a correlação do aumento do IMC com carcinoma diferenciado de tireoide (CDT).7 Uma revisão recente mostrou que pacientes com obesidade mórbida (IMC>35kg/m2) apresentaram tumores significativamente maiores do que pacientes com IMC<35kg/m2.8Da mesma forma, outro estudo da Coreia do Sul não só relatou uma maior incidência de CDT em mulheres obesas, mas também a correlação de CDT com uma maior média de circunferência da cintura, proporção de gordura e pressão arterial.9
Embora exista a relação causal entre o IMC e o CDT, o seu impacto nos desfechos do tratamento, inclusive as taxas de sobrevida livre de doenças (SLD) e sobrevida global (SG) após a tireoidectomia e o tratamento adjuvante com iodo radioativo I‐131 (RAI) e a supressão de TSH, não é bem conhecido.
O objetivo do presente estudo foi avaliar o impacto do IMC sobre o controle loco‐regional (CLR), Controle de metástase distante (CMD), SLD e SG e perfil de toxicidade em pacientes sauditas com CDT tratados com tireoidectomia e terapia adjuvante com RAI.
MétodoApós a aprovação formal do comitê ético institucional, os prontuários de 209 pacientes com CDT, tratados em nosso hospital de julho de 2000 a dezembro de 2011, foram revisados com um sistema de banco de dados computacional.
Dados demográficos, clinicopatológicos e radiológicosForam analisados os dados demográficos e clínicos, inclusive a idade no momento do diagnóstico, o sexo e a sintomatologia. Diferentes características histopatológicas, inclusive o tamanho do tumor, as variantes histopatológicas, a multifocalidade, o estadiamento do tumor, o linfonodo e a metástase (TNM) foram registrados. Os dados foram coletados de diferentes modalidades de exames de imagem, inclusive ultrassonografia (US) cervical, cintilografia de corpo inteiro (CCI) com I131, tomografia computadorizada de pescoço e tórax e tomografia de emissão de pósitrons com fluoro‐deoxiglicose (FDG‐PET). Foram também registrados dados relativos a diferentes modalidades de tratamento, inclusive tireoidectomia,+‐ esvaziamento cervical, ablação adjuvante com iodo radioativo 131 (RAI) e suas doses em milicuries (mCi).
Cálculo do IMCPara fins de estudo, cada paciente foi categorizado de acordo com o IMC. A altura e o peso foram medidos no momento do exame com protocolos institucionais e o IMC foi calculado com a fórmula do peso em quilogramas dividido pelo quadrado da altura em metros (kg/m2). O IMC foi então categorizado em cinco grupos da seguinte forma: baixo peso com IMC<18,5kg/m2; peso normal com IMC de 18,5‐25kg/m2; sobrepeso com IMC de 25‐30kg/m2; obesos com IMC de 31‐40kg/m2 e obesos mórbidos com IMC acima de 40kg/m2.
Análise estatísticaOs endpoints primários foram as taxas de SLD e SG. Os indicadores secundários foram a análise comparativa de diferentes características clinicopatológicas do CDT de acordo com as categorias de IMC, CLR e CMD. A recorrência local (RL) foi definida como a duração entre a data da cirurgia e a data da doença detectável clinicamente ou radiologicamente no leito da tireoide e/ou nos gânglios linfáticos cervicais nos exames por imagem (US, CCI, TC e FDG‐PET) após a avaliação de níveis altos de tiroglobulina (TG). A metástase distante (MD) foi definida como a duração entre a data da cirurgia e a data da doença documentada fora do pescoço após a avaliação de nível elevado de TG. A SLD foi definida como a duração entre a data da cirurgia e a data do reaparecimento/recorrência documentados da doença, a morte por câncer e/ou o último seguimento. A SG foi definida como a duração entre a data da cirurgia e a data da morte do doente ou o último seguimento.
Os testes de qui‐quadrado ou t de Student foram usados para determinar as diferenças em várias variáveis clínicas. As probabilidades das taxas de CLR, CMD, SLD e SG foram demonstradas pelo método de Kaplan‐Meier e a comparação para várias curvas de sobrevida foi feita com o teste de log rank. Todas as análises estatísticas foram feitas com o programa de computador SPSS, versão 16.0.
ResultadosAs características do paciente são mostradas na tabela 1. Houve 209 pacientes, 165 (79,0%) do sexo feminino e 44 (21,0%) do masculino. O tipo clássico foi o mais predominante em 162 (77,5%). A multifocalidade foi observada em 80 (38,3%), EET (extensão extratireoidiana) estava presente em 41 (19,6%) e ILV (invasão linfovascular) em 39 (18,6%). As margens cirúrgicas eram positivas em apenas 21 (10,1%). Metástase linfonodal foi observada em 54 (25,8%). O tecido tireoidiano de fundo era normal em 64 (30,6%), multinodular em 68 (32,6%), linfocítico em 45 (21,5%) e de Hashimoto em 32 (15,3%). Foram submetidos 189 casos (90,4%) à tireoidectomia parcial ou total e os restantes 20 (9,6%) foram submetidos à lobectomia. O esvaziamento cervical central foi feito em 58 (27,7%) pacientes. A tireoidectomia parcial ou total foi feita na maioria dos pacientes com carcinoma papilífero clássico da tireoide. Aqueles que tinham sido encaminhados de outro hospital para esse centro terciário, após serem submetidos à lobectomia, foram tratados por tireoidectomia total. A lobectomia foi reservada apenas para aqueles indivíduos cujo tumor estava restrito a apenas um lobo e que não tinham evidência de metástase intratireoideana. O esvaziamento cervical central foi feito em pacientes com linfonodos aumentados no momento da cirurgia ou identificados na ultrassonografia cervical.
Características dos pacientes
| Variável | Coorte inteira ‐ n (%) |
|---|---|
| Total de pacientes | 209 |
| Idade (anos) | 41,1 (16–78) SD ±11,6 |
| ≤ 45 anos | 127 (60,7) |
| ≥ 45 anos | 82 (39,3) |
| Gênero | |
| Feminino | 165 (79,0) |
| Masculino | 44 (21,0) |
| Proporção mulheres:homens | 3,8 |
| Tipo de cirurgia | |
| Tireoidectomia parcial ou total | 189 (90,4) |
| Lobectomia | 20 (9,6) |
| Cirurgia de linfonodos | |
| Esvaziamento cervical central | 58 (27,7) |
| Esvaziamento cervical lateral | 28 (13,4) |
| Amostragem | 19 (9,1) |
| Nenhuma | 104 (49,7) |
| Tamanho médio (cm) | 2,3 (0,1–10,0)±12,4 |
| Variantes histopatológicas | |
| Clássico | 162 (77,5) |
| Folicular | 19 (9,1) |
| Célula de Hurthle | 6 (2,8) |
| Célula alta | 21 (10,1) |
| Esclerosante | 1 (0,5) |
| Multifocal | |
| Sim | 80 (38,3) |
| Não | 129 (61,7) |
| EET | |
| Sim | 41 (19,6) |
| Não | 168 (80,4) |
| ILV | |
| Sim | 39 (18,6) |
| Não | 170 (81,4) |
| Margens cirúrgicas | |
| Positivas | 21 (10,1) |
| Negativas | 188 (89,9) |
| Metástase linfonodal | |
| Sim | 54 (25,8) |
| Não | 183 (87,6) |
| Tecido tireoidiano de fundo | |
| Normal | 64 (30,6) |
| Bócio multinodular | 68 (32,6) |
| Tireoidite linfocítica | 45 (21,5) |
| Tireoidite de Hashimoto | 32 (15,3) |
| Metástases distantes na apresentação | 5 (2,4) |
| Estadiamento AJCC | |
| I | 107 (51,2) |
| II | 36 (17,2) |
| III | 53 (25,4) |
| IV A | 10 (4,8) |
| IV B | – |
| IVC | 3 (1,4) |
| TG média pós‐operatória (ng/mL) | 1,39 (0,1–42,890) |
| IMC (kg/m2) | 31,2 (17–72) |
| Grupos de IMC | |
| < 18,6 | 3 (1,4) |
| 18,6‐25 | 43 (20,6) |
| 26‐30 | 58 (27,8) |
| 31‐40 | 89 (42,6) |
| >40 | 16 (7,7) |
| Dose de RAI | |
| Não | 53 (25,4) |
| 30 mCi | 64 (30,6) |
| 100 mCi | 45 (21,5) |
| 150‐200 mCi | 47 (22,5) |
| RT cervical | 12 (5,7) |
AJCC, American Joint Commission on Cancer; DP, desvio padrão; EET, extensão extratireoidiana; ILV, invasão linfovascular; IMC, índice de massa corpórea; mCi, milicurie; n, número; RAI, iodo radioativo; RT, radioterapia; TG, tiroglobulina.
As taxas de complicações pós‐tireoidectomia foram mínimas; quatro pacientes (1,9%) apresentaram hipocalcemia permanente e não houve correlação com IMC (p=0,063). Em geral, a ablação com RAI foi bem tolerada sem quaisquer efeitos secundários de Grau 3 ou 4; entretanto, observaram‐se complicações agudas e tardias (Grau‐3/4) em 16 pacientes (7,66%) sem associação com IMC (p=0,71).
Desfechos do tratamentoO período médio de acompanhamento foi de 5,2 anos (intervalo: 0,6‐10). Para toda a coorte, as taxas de CLR e CMD de cinco anos foram de 91,4% e 94,3%, respectivamente. Foram observadas 18 RLs (8,6%); dois com IMC de 18,6‐25kg/m2, nove com IMC de 26‐30kg/m2, quatro com IMC 31‐40kg/m2 e três com IMC>40kg/m2 (p=0,051). As RLs foram tratadas com cirurgia; esvaziamento cervical lateral (10 pacientes); tireoidectomia (quatro) e excisão (quatro) seguida de ablação por RAI (14). Do mesmo modo, observaram‐se 12 MD (5,7%); seis com IMC de 26‐30kg/m2, três com IMC de 31‐40kg/m2 e três com IMC>40kg/m2 (p=0,062). As MDs foram tratadas com ablação por RAI e irradiação paliativa (um paciente).
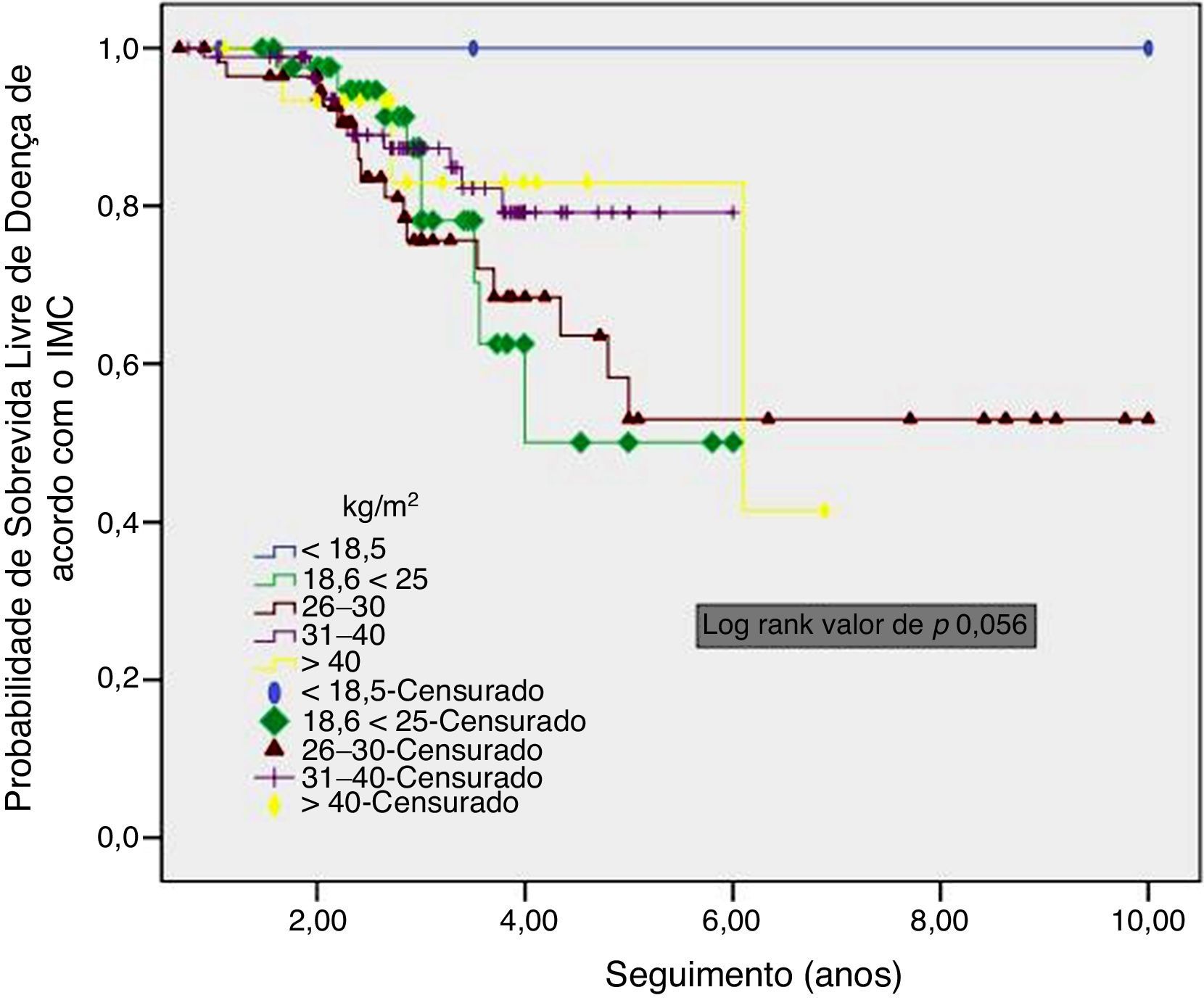
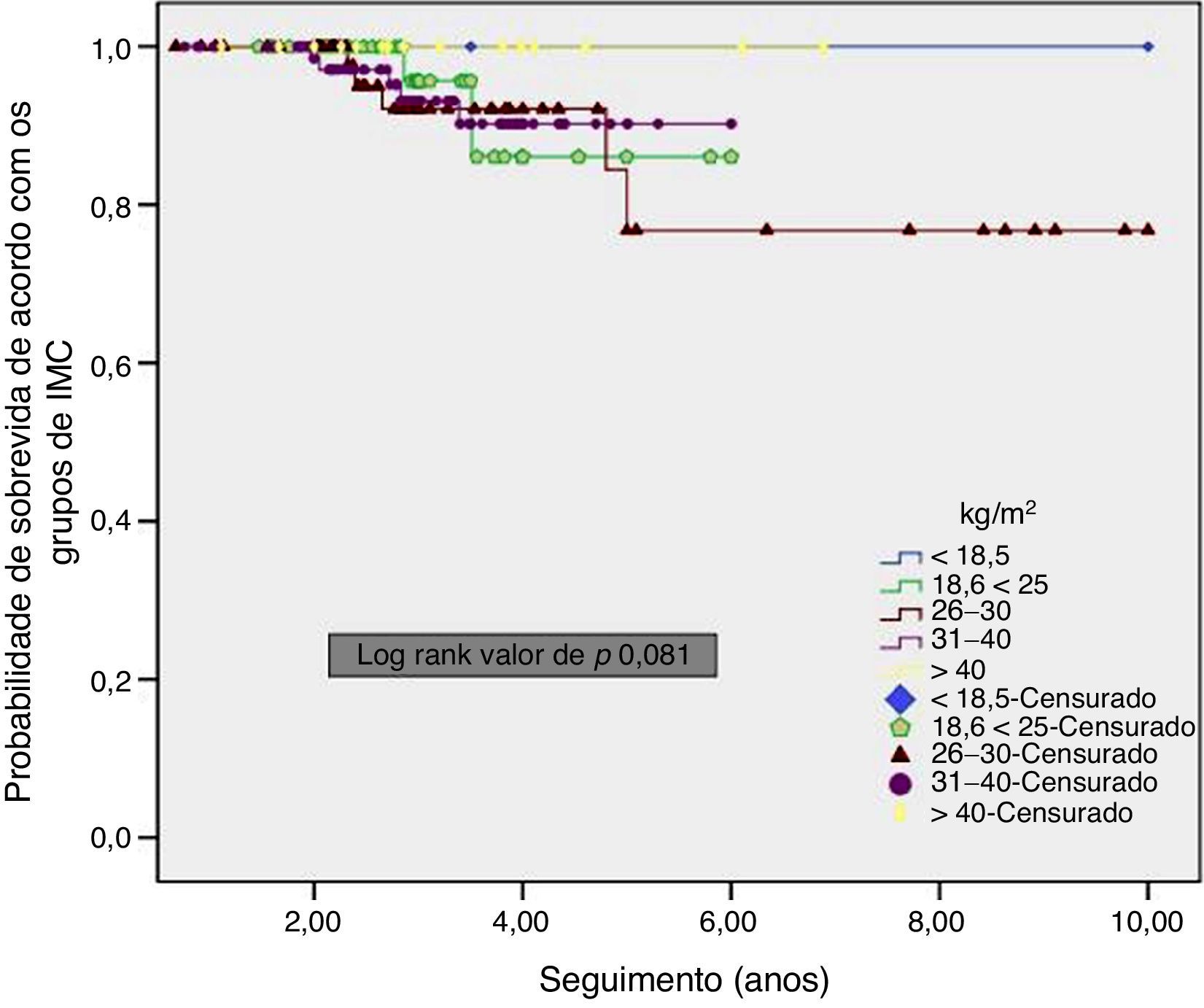
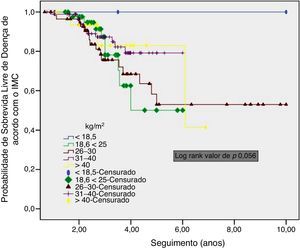
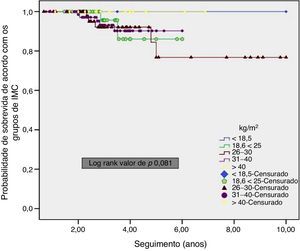
A taxa de SLD global de cinco anos foi de 92,8%. Além disso, a SLD para os pacientes com IMC de 18,6‐25kg/m2 foi pior do que para aqueles com IMC de 26‐30kg/m2 e 31‐40kg/m2, embora a diferença não tenha sido significativa (p=0,056) (fig. 1). A taxa geral de SG de cinco anos foi de 94,1%. Não houve diferença significativa entre os grupos de IMC (p=0,081) (fig. 2).
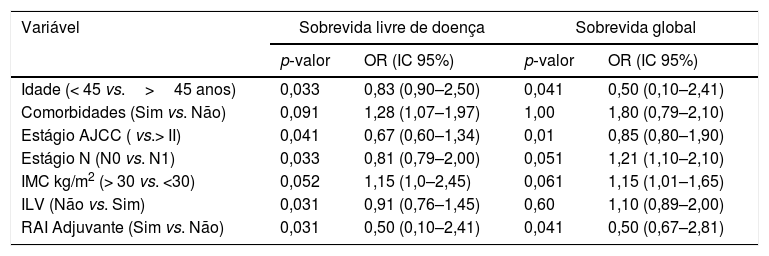
Na análise multivariada, os fatores prognósticos importantes para SLD e SG foram idade, estadiamento AJCC, envolvimento linfonodal, LVSI e terapia com RAI adjuvante. O IMC não foi identificado como um importante fator prognóstico independente (tabela 2).
Análise multivariada de variáveis da sobrevida livre de doença e sobrevida global
| Variável | Sobrevida livre de doença | Sobrevida global | ||
|---|---|---|---|---|
| p‐valor | OR (IC 95%) | p‐valor | OR (IC 95%) | |
| Idade (< 45 vs.>45 anos) | 0,033 | 0,83 (0,90–2,50) | 0,041 | 0,50 (0,10–2,41) |
| Comorbidades (Sim vs. Não) | 0,091 | 1,28 (1,07–1,97) | 1,00 | 1,80 (0,79–2,10) |
| Estágio AJCC ( vs.> II) | 0,041 | 0,67 (0,60–1,34) | 0,01 | 0,85 (0,80–1,90) |
| Estágio N (N0 vs. N1) | 0,033 | 0,81 (0,79–2,00) | 0,051 | 1,21 (1,10–2,10) |
| IMC kg/m2 (> 30 vs. <30) | 0,052 | 1,15 (1,0–2,45) | 0,061 | 1,15 (1,01–1,65) |
| ILV (Não vs. Sim) | 0,031 | 0,91 (0,76–1,45) | 0,60 | 1,10 (0,89–2,00) |
| RAI Adjuvante (Sim vs. Não) | 0,031 | 0,50 (0,10–2,41) | 0,041 | 0,50 (0,67–2,81) |
AJCC, American Joint Commission on Cancer; IC 95%, intervalo de confiança de 95%; ILV, invasão linfovascular; IMC, índice de massa corpórea; N, nódulo; OR, odds ratio; RAI, iodo radioativo.
A obesidade é uma das questões de saúde endêmicas nos países desenvolvidos. É um fator de risco conhecido para várias doenças e para o obeso há um risco aumentado de desenvolvimento de câncer endometrial, de próstata, mama, pâncreas e tireoide.10 Em nosso estudo, tentamos identificar a correlação entre o IMC e as taxas de sobrevida em pacientes com CDT. Que seja de nosso conhecimento, este é o primeiro estudo a mencionar o impacto do IMC sobre o prognóstico dos pacientes com CDT.
Nossos achados sugerem que o IMC não tem um impacto na SG de pacientes com CDT tratados cirurgicamente. Embora nossos resultados tenham demonstrado que a SLD no paciente com baixo peso foi pior do que nos grupos normal e acima do peso, esse dado não alcançou significância estatística. Além disso, as análises univariadas e multivariadas mostraram idade e estadiamento da AJCC como fator prognóstico independente para SLD e SG. Também o estágio N da doença, a invasão linfovascular e o iodo radioativo adjuvante foram significativamente associados com a SLD nas análises univariada e multivariada (tabela 2).
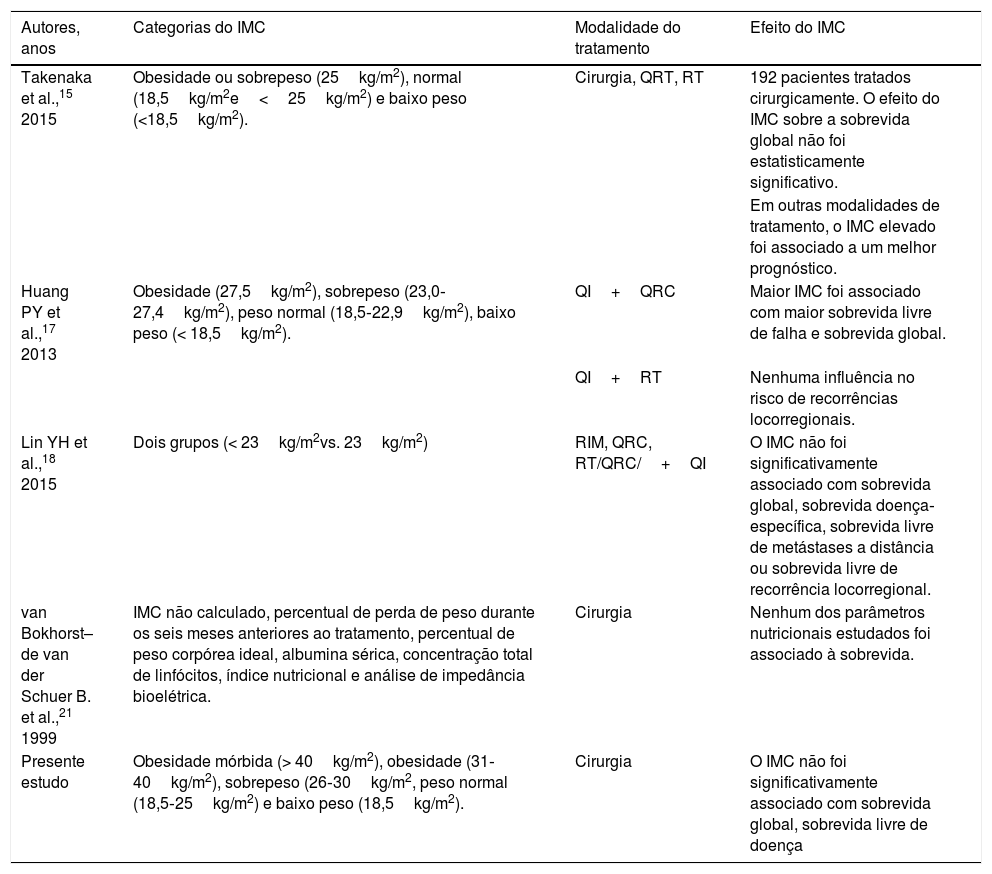
O impacto do IMC sobre os resultados de sobrevida tem sido estudado em várias lesões malignas, como câncer de mama e gástrico.11–13 No entanto, poucos estudos avaliaram o IMC e a obesidade como um fator prognóstico em neoplasias de cabeça e pescoço.14 Takenaka et al. identificaram o IMC pré‐tratamento como um fator prognóstico independente para a sobrevida de pacientes com carcinoma epidermoide de cabeça e pescoço (CECP) tratados com quimiorradioterapia; em seu estudo, a população foi dividida em três grupos: baixo peso (18,5kg/m2<IMC), peso normal (18,5‐25kg/m2) e sobrepeso (25kg/m2>IMC), observou‐se que os pacientes com sobrepeso apresentaram o prognóstico mais favorável e os pacientes com baixo peso, o pior.15 Similarmente, os estudos de Shen et al.16 e Huang et al.17 verificaram que um IMC alto estava fortemente associado com melhor sobrevida global, sobrevivência doença‐específica e sobrevida livre de falha. Os dados de ambos os estudos sugeriram o IMC como um fator prognóstico independente em pacientes com carcinoma nasofaríngeo (CNF). No entanto, o estudo de Lin et al.18 não revelou qualquer associação entre o IMC pré‐tratamento e a sobrevida global, sobrevivência doença‐específica, sobrevida livre de metástases a distância ou sobrevida locorregional livre em pacientes com CNF (tabela 3).
Resumo do efeito do IMC nos pacientes com câncer de cabeça e pescoço
| Autores, anos | Categorias do IMC | Modalidade do tratamento | Efeito do IMC |
|---|---|---|---|
| Takenaka et al.,15 2015 | Obesidade ou sobrepeso (25kg/m2), normal (18,5kg/m2e<25kg/m2) e baixo peso (<18,5kg/m2). | Cirurgia, QRT, RT | 192 pacientes tratados cirurgicamente. O efeito do IMC sobre a sobrevida global não foi estatisticamente significativo. |
| Em outras modalidades de tratamento, o IMC elevado foi associado a um melhor prognóstico. | |||
| Huang PY et al.,17 2013 | Obesidade (27,5kg/m2), sobrepeso (23,0‐27,4kg/m2), peso normal (18,5‐22,9kg/m2), baixo peso (< 18,5kg/m2). | QI+QRC | Maior IMC foi associado com maior sobrevida livre de falha e sobrevida global. |
| QI+RT | Nenhuma influência no risco de recorrências locorregionais. | ||
| Lin YH et al.,18 2015 | Dois grupos (< 23kg/m2vs. 23kg/m2) | RIM, QRC, RT/QRC/+QI | O IMC não foi significativamente associado com sobrevida global, sobrevida doença‐específica, sobrevida livre de metástases a distância ou sobrevida livre de recorrência locorregional. |
| van Bokhorst–de van der Schuer B. et al.,21 1999 | IMC não calculado, percentual de perda de peso durante os seis meses anteriores ao tratamento, percentual de peso corpórea ideal, albumina sérica, concentração total de linfócitos, índice nutricional e análise de impedância bioelétrica. | Cirurgia | Nenhum dos parâmetros nutricionais estudados foi associado à sobrevida. |
| Presente estudo | Obesidade mórbida (> 40kg/m2), obesidade (31‐40kg/m2), sobrepeso (26‐30kg/m2, peso normal (18,5‐25kg/m2) e baixo peso (18,5kg/m2). | Cirurgia | O IMC não foi significativamente associado com sobrevida global, sobrevida livre de doença |
IMC, índice de massa corpórea; QI, quimioterapia de indução; QRC, quimiorradioterapia concomitante; QRT, quimiorradioterapia; RIM, radioterapia de intensidade modulada; RT, radioterapia.
Vários estudos sugerem, tal como em nossos achados, que outros fatores de risco, tais como idade e estágio tumoral,15 envolvimento nodal, variantes histopatológicas agressivas, multifocalidade, EET, ILV e RAI adjuvante, sejam preditores clinicopatológicos mais importantes do que o IMC no CDT.19,20
Takenaka et al.15 inferiram que diferentes modalidades de tratamento influenciam o impacto do IMC sobre o prognóstico. Isso pode explicar a disparidade entre os resultados de diferentes estudos, inclusive o nosso estudo. Um pequeno número de estudos discutiu o IMC como um fator prognóstico em neoplasias de cabeça e pescoço tratadas por cirurgia. Um estudo de Takenaka et al.15 e outro de van Bokhorst‐de van der Schuer et al.,21 que analisaram 192 e 64 pacientes respectivamente, com neoplasias de cabeça e pescoço tratadas cirurgicamente, concluíram que o impacto do IMC no prognóstico não foi estatisticamente significativo, embora a SG tenha sido significativamente melhor nos pacientes com IMC pré‐tratamento maior do que os submetidos à quimiorradioterapia e radioterapia. Além disso, o IMC não apareceu como um fator prognóstico independente no resultado do modelo de riscos proporcionais de Cox em pacientes tratados cirurgicamente.15
Diversas razões foram demonstradas nos estudos que mostraram um impacto positivo do IMC na sobrevivência de pacientes com neoplasias de cabeça e pescoço. Em primeiro lugar, a modalidade de tratamento, os pacientes com neoplasias malignas de cabeça e pescoço tratados por quimioterapia e/ou radiação tiveram prognóstico mais favorável quando estavam em um grupo com IMC elevado; porém, essa relação não foi observada em pacientes tratados cirurgicamente.15,17 Em segundo lugar, a caquexia no câncer é um desafio conhecido no tratamento de pacientes com tumores malignos, como câncer pancreático, gástrico e cabeça e pescoço.17,22 A caquexia pode diminuir a resposta ao tratamento e afetar a capacidade do sistema imunológico de combater infecções, o que leva à morte.17,22 Em nosso estudo, as possíveis razões para os achados não significantes foram: o tratamento, feito por cirurgia e ablação por RAI, com uma taxa de 94,1% em cinco anos de SG, e a caquexia no câncer, que não foi observada no grupo de estudo. Adicionalmente, em nossa coorte, as complicações pós‐tireoidectomia foram mínimas e os pacientes toleraram a ablação por RAI adjuvante muito bem, com mínima toxicidade.
Nosso estudo teve várias limitações; primeiro, a natureza retrospectiva e segundo, o pequeno tamanho da amostra, de 209 pacientes. Além desses dois, nossa população de estudo é composta principalmente de indivíduos descendentes de populações do Oriente Médio ou da Ásia e estudos adicionais em outras populações são necessários.
ConclusãoEmbora seja de conhecimento geral de que o IMC aumenta o risco de câncer de tireoide, e é um forte fator prognóstico nos cânceres de cabeça e pescoço associados à caquexia e tratados com quimiorradioterapia ou radioterapia, ele não é um forte preditor do desfecho do tratamento em pacientes com CDT.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Al‐Ammar Y, Al‐Mansour B, Al‐Rashood O, Tunio MA, Islam T, Al‐Asiri M, et al. Impact of body mass index on survival outcome in patients with differentiated thyroid cancer. Braz J Otorhinolaryngol. 2018;84:220–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.