Os potenciais auditivos de tronco encefálico evocados eletricamente fornecem informações clínicas confiáveis que auxiliam no processo de reabilitação auditiva de usuários de implante coclear.
ObjetivoInvestigar o registro intraoperatório dos potenciais auditivos de tronco encefálico evocados eletricamente em usuários do feixe de eletrodos Evo® e sua correlação com os níveis comportamentais e desempenho auditivo dos indivíduos.
MétodoEstudo retrospectivo. Os potenciais auditivos de tronco encefálico intraoperatórios foram registrados em usuários adultos de implante coclear com feixe de eletrodos Evo®. As latências e amplitudes da onda V e os intervalos interpico III–V foram registrados em três diferentes eletrodos e comparados às pontuações de reconhecimento de sentenças após 6 meses de uso do implante coclear. Os limiares dos eABRs foram comparados aos níveis comportamentais dos indivíduos na ativação do processador de som.
ResultadosOs limiares do eABR foram significativamente correlacionados aos níveis comportamentais T e C e registrados em níveis de estimulação elétrica audíveis em todos os indivíduos. Houve uma correlação significativa entre o intervalo interpico III–V no eletrodo apical e a pontuação de reconhecimento de sentenças dos indivíduos.
ConclusõesO eABR intraoperatório pode ser usado para estabelecer níveis audíveis de estimulação elétrica na ativação do processador sonoro em usuários de implante coclear‐Evo® e pode auxiliar os profissionais no planejamento de ações visando melhorar o desempenho auditivo nesses pacientes.
O implante coclear tornou‐se a opção mais viável para o tratamento de pessoas com perda auditiva neurossensorial severa a profunda que não se beneficiam de aparelhos auditivos convencionais. Nesses casos, os implantes cocleares (ICs) podem efetivamente estimular o sistema auditivo através dos pulsos elétricos, promovendo a percepção auditiva e possibilitando o desenvolvimento de outras habilidades perceptuais auditivas para o usuário.
Vários avanços tecnológicos ocorreram no campo do implante coclear na última década e, embora muitos estudos tenham mostrado melhoria dos resultados de percepção da fala em pacientes que usam sistemas de IC atuais, há uma variabilidade considerável no desempenho auditivo com o uso do dispositivo.1,2 Além disso, características como posicionamento dos eletrodos, sobrevivência neural e a saúde neural de pacientes implantados influenciam a quantidade de carga elétrica necessária para evocar uma percepção auditiva entre eles.3 Assim, determinar os níveis psicofísicos ideais de estimulação elétrica durante a adaptação do processador de som, com base em medidas comportamentais, principalmente para crianças pequenas ou pacientes com necessidades especiais, ainda é um desafio para os audiologistas.
Assim, o uso de medidas objetivas que pudessem fornecer informações clínicas confiáveis sobre essas questões em usuários de IC tem sido cada vez mais estudado na literatura. Muitos estudos foram realizados para identificar medidas objetivas que pudessem determinar os níveis de estimulação elétrica para o mapa inicial dos usuários de IC,3,4 até mesmo durante a cirurgia do IC.5 Medidas objetivas mais comumente usadas durante a cirurgia de IC, como o potencial de ação composto eletricamente evocado (eCAP, do inglês electrically evoked compound action potential) até agora não forneceram correlações estatisticamente significativas para uso na predição dos níveis de programação T e C para todos os pacientes.6,7 Assim, em relação ao desempenho auditivo com o IC, medidas objetivas mais centrais, como os potenciais evocados auditivos corticais, têm sido fortemente correlacionadas a ele. 8 Entretanto, essa medida depende da colaboração do paciente, torna‐se difícil em crianças ou pacientes com necessidades especiais. Além disso, essa medida precisa ser registrada com o paciente acordado, não pode ser feita no período intraoperatório.
Os potenciais auditivos do tronco encefálico eletricamente evocados (eABR, do inglês electrically evoked auditory brainstem response) é de interesse em relação a essa questão, pois é uma medida objetiva da funcionalidade e da responsividade da via neural a partir da cóclea ao núcleo coclear, bem como às estruturas mais centrais. Ela permite a avaliação de componentes síncronos críticos da codificação neural9 e, de acordo com esses autores, a sobrevivência e a atividade neurais síncrona podem contribuir para o desempenho do IC. Os eABRs também podem ser registrados no período intraoperatório10 e facilmente adotados na rotina clínica.
Estudos anteriores demonstraram correlações significativas entre a morfologia e a presença da onda V e os resultados da percepção da fala.9,11–15 Outros estudos compararam as latências e amplitudes das ondas do eABR e os resultados auditivos em usuários de IC, mas com resultados controversos. Brown et al.11 encontraram correlações fracas ou ausentes entre a percepção da fala e os limiares de eABR ou latências e amplitudes da onda V. Esses resultados foram posteriormente corroborados por Firszt et al.9 e Lundin et al.15 Em contraste, Gallégo et al.16,17 estudaram 17 adultos implantados com o sistema Digisonic DX10 CI e verificaram que as latências absolutas da onda V e os intervalos interpico II‐V e III‐V estavam positivamente correlacionados com as pontuações de reconhecimento de fonemas; a análise de regressão múltipla stepwise que envolve todas as variáveis eABR indicou que o intervalo interpico III‐V foi um poderoso preditor das pontuações de reconhecimento da fala. Embora Gallégo et al.16,17 tenham encontrado uma forte correlação entre os intervalos interpico III‐V e os resultados de percepção da fala em usuários do Digisonic DX10, eles avaliaram apenas registros de eABR pós‐operatórios. É importante determinar se esses resultados podem ser replicados na etapa intraoperatória em usuários do feixe de eletrodos Evo®, já que isso poderia auxiliar os profissionais no planejamento de ações futuras visando à melhoria do desempenho auditivo desses pacientes.
A correlação entre os registros de eABR pós‐operatório e os níveis de estimulação determinados comportalmentalmente em usuários de IC também foi investigada na literatura. Alguns estudos demonstraram que os limiares do eABR pós‐operatórios e os limiares comportamentais (níveis T) estavam significativamente correlacionados,18–20 inclusive em usuários de Digisonic SP.3 Alguns estudos compararam os limiares de eABR registrados na sala de cirurgia e os níveis comportamentais em indivíduos implantados com outros sistemas de IC e observaram que os limiares de eABR intraoperatórios eram consistentemente mais altos do que os limiares comportamentais pós‐operatórios e próximos aos níveis de conforto.21,22 No nosso conhecimento, não há estudos que correlacionem os limiares de eABR registrados na sala de cirurgia e os limiares comportamentais obtidos em usuários do feixe de eletrodos de implante coclear Evo®. Nesse sistema de implante coclear, ao contrário de outras tecnologias de implante, um modo de estimulação multi‐mode associado a pulsos elétricos pseudomonofásicos modulados por duração, com descarga capacitiva, compõe o padrão de estimulação elétrica. Undurraga et al.23 relataram que a forma de pulso e as estratégias de processamento de sinal têm um impacto significativo nas medidas objetivas e, então, o estudo da correlação entre os limiares de eABRs intraoperatórios e os níveis de estimulação determinados comportalmentalmente pode fornecer informações valiosas para o primeiro ajuste do processador de som nesses pacientes.
Assim, este estudo teve como objetivo investigar registros intraoperatórios de eABR em usuários de feixe de eletrodos Evo® em diferentes localizações de eletrodos e sua correlação com níveis comportamentais e desempenho auditivo em indivíduos implantados com esse dispositivo.
MétodoO presente estudo foi conduzido em um centro brasileiro de implante coclear, de 2018 a 2020. Indivíduos com perda auditiva neurossensorial de grau severo a profundo de origem pós‐lingual, que apresentaram benefício limitado com o uso de próteses auditivas (pontuações de reconhecimento de sentenças <50% na melhor orelha com amplificação) e que se submeteram à cirurgia de implante coclear com o feixe de eletrodos Evo® foram incluídos no estudo. Foram excluídas crianças com idades até 12 anos e indivíduos com distúrbios cognitivos ou centrais e neuropatia auditiva. O estudo foi aprovado pelo comitê de ética (sob número 422/2017).
Vinte e um indivíduos (9 mulheres e 12 homens) entre 14 e 81 anos (média=47,74±17,98 anos) foram incluídos no estudo. A tabela 1 demonstra suas características demográficas. A privação auditiva compreendeu o tempo sem prótese auditiva antes da cirurgia do IC e a duração da perda auditiva compreendeu o tempo entre o primeiro diagnóstico de perda auditiva e a cirurgia do IC. O tempo de uso do IC compreendeu o tempo entre a ativação do IC e o dia em que os testes de percepção de fala foram obtidos.
Características demográficas dos indivíduos
| Indivíduo | Sexo | Orelha implantada | Idade no momento doIC (a) | Privação auditiva (a) | Duração da perda auditiva (a) | Tempo de uso do IC (a) | Etiologia |
|---|---|---|---|---|---|---|---|
| 1 | M | D | 65,3 | 18,2 | 28,1 | 0,6 | Genética |
| 2 | M | D | 75,2 | 2,3 | 6,5 | 0,6 | Desconhecida |
| 3 | F | D | 14,0 | 4,1 | 5,6 | 0,8 | Desconhecida |
| 4 | F | D | 57,8 | 17,8 | 22,6 | 0,7 | Desconhecida |
| 5 | F | D | 57,5 | 2,1 | 11,0 | 0,6 | Otite Crônica |
| 6 | M | E | 39,5 | 1,1 | 3,2 | 0,6 | Colesteatoma |
| 7 | F | E | 60,1 | 4,7 | 5,0 | 0,8 | Desconhecida |
| 8 | M | D | 55,7 | 20,0 | 26,1 | 0,8 | Desconhecida |
| 9 | M | D | 46,0 | 0,1 | 30,0 | 0,6 | Genética |
| 10 | F | E | 53,5 | 10,3 | 28,1 | 0,6 | Desconhecida |
| 11 | F | E | 23,7 | 0,1 | 14,9 | 0,7 | Desconhecida |
| 12 | M | D | 49,0 | 0,9 | 5,0 | 0,6 | Otite Crônica |
| 13 | M | D | 67,8 | 2,8 | 40,2 | 0,6 | Colesteatoma |
| 14 | F | D | 35,0 | 1,0 | 2,1 | 0,6 | Desconhecida |
| 15 | M | D | 26,7 | 0,5 | 1,1 | 0,7 | Meningite |
| 16 | F | D | 58,7 | 1,6 | 2,0 | 0,6 | Desconhecida |
| 17 | M | D | 32,2 | 1,3 | 20,8 | 0,8 | Desconhecida |
| 18 | F | E | 45,4 | 3,1 | 3,3 | 0,6 | Desconhecida |
| 19 | M | D | 31,8 | 1,0 | 1,9 | 0,8 | Meningite |
| 20 | M | D | 80,9 | 0,9 | 10,0 | 0,6 | Ototoxicidade |
| 21 | M | E | 26,7 | 0,5 | 1,1 | 0,6 | Meningite |
Sexo: Feminino (F), Masculino (M); Orelha implantada: direita (D), esquerda (E); a, anos
Os potenciais auditivos do tronco cerebral evocados eletricamente no período intraoperatório foram registrados em todos os indivíduos submetidos à cirurgia de IC com o dispositivo Digisonic® Evo (Oticon Medical, Dinamarca). Os registros foram obtidos na sala de cirurgia no momento da cirurgia do IC, com os indivíduos reclinados em uma maca, sob anestesia geral, imediatamente após a inserção do feixe de eletrodos no interior da cóclea. Os estímulos elétricos foram produzidos pelo implante, com a interface USB Digistim e o sistema de software Digistim, versão 1.9.15 (Oticon Medical, Dinamarca). O estímulo usado para as medidas de eABR foi um pulso pseudomonofásico de 70μs/70 CU (1,56mA) com descarga capacitiva apresentada a uma taxa de 21Hz. Os eABRs foram registrados no equipamento Eclipse EP25 (Interacoustics A/S, Middelfart, Dinamarca) e com o software Otoaccess versão 7.0 (Interacoustics A/S, Middelfart, Dinamarca). O sistema de registro tinha uma média de 1200 varreduras e foi filtrado por um filtro passa‐baixa a 1500Hz e um filtro passa‐alta a 33Hz / 6 oct. Um nível de rejeição de artefatos de 40μV e janela de tempo de registro de 12ms foram usados. Os estímulos foram sincronizados com o sistema de registro através de um cabo de sincronia confeccionado para permitir a média síncrona. Eletrodos de contato foram colocados no vértice (positivo), mastoide contralateral (referência) e músculo bucinador ipsilateral (terra). Os valores de impedância dos eletrodos de registro variaram entre 0 e 3 Ohms.
Três eletrodos intracocleares diferentes foram testados: eletrodos apicais, médios e basais (representando 500Hz, 1000Hz e 2000Hz na programação do processador de fala ou MAPA do indivíduo). Essas frequências são alocadas, respectivamente, aos eletrodos 18, 14 e 9 no feixe de eletrodos Evo®. O feixe de eletrodos Evo® é composto por 20 eletrodos ativos de banda completa, 24mm de comprimento de inserção e está associado a baixos níveis de traumas intracocleares.24
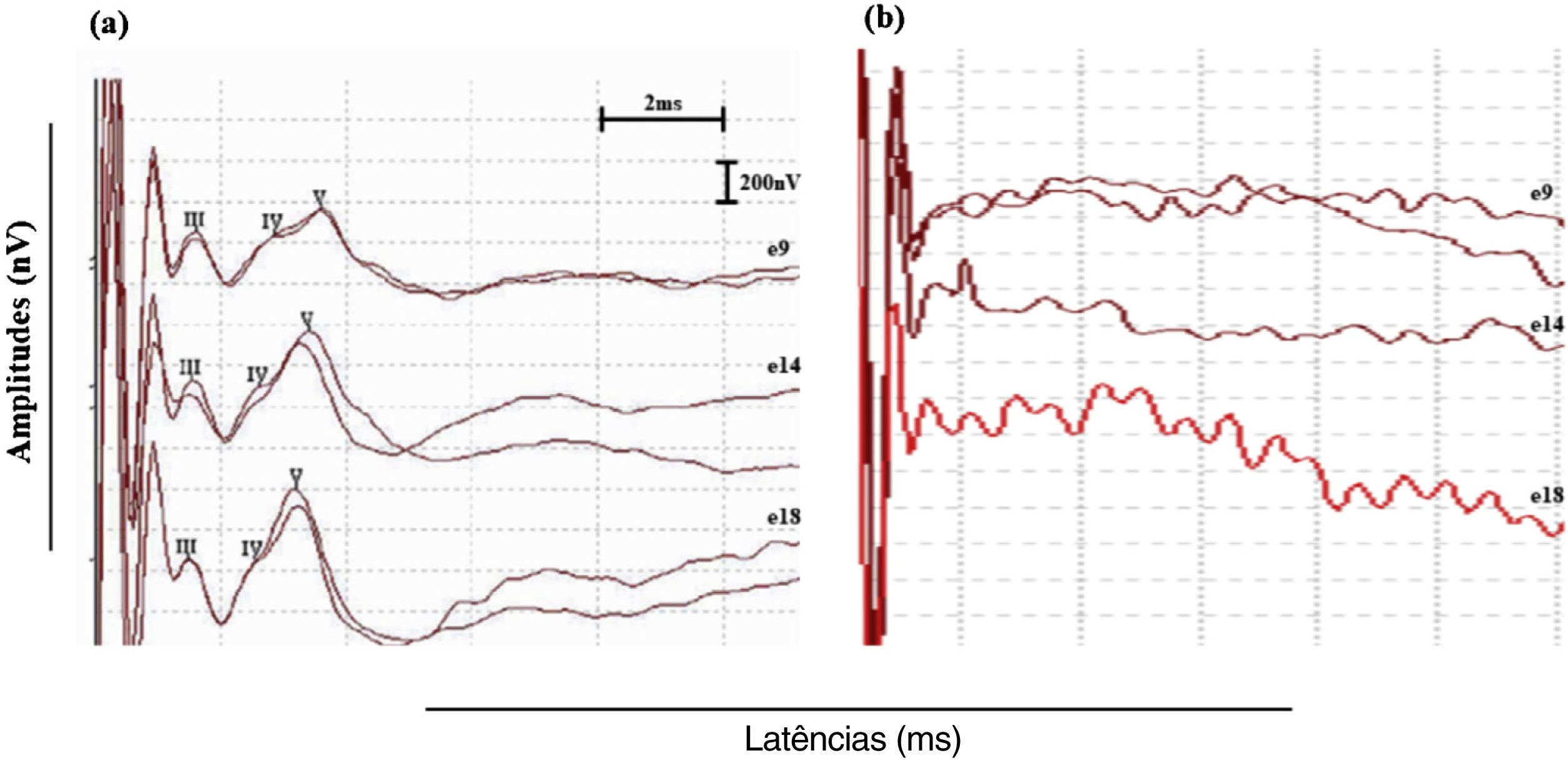
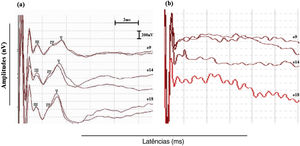
A identificação da onda foi definida de acordo com os critérios morfológicos propostos por Picton et al.,25 como uma série de picos positivos que ocorre aproximadamente entre 1 e 4 milissegundos (ms) e a latência da onda V ocorre em aproximadamente 3,5 a 4,0ms. A onda I não é registrada porque está embutida no artefato de estímulo.26 Os registros de eABR foram classificados como “eABRs positivos” quando a onda V pôde ser registrada em duas repetições da mesma condição de estímulo nos três eletrodos testados (fig. 1a) e como “eABRs negativos” quando a onda V não pôde ser identificada em ambas as repetições de estímulos em um ou mais dos eletrodos testados (eABRs ausentes) (fig. 1b). A amplitude de pico a vale, medida em μV de cada pico de eABR registrado, foi analisada.
(a) Registros de eABR intraoperatórios típicos classificados como eABRs positivos. A onda V foi registrada em duas repetições da mesma condição de estímulo nos três eletrodos testados (eletrodos 9, 14 e 18). (b) eABRs negativos registrados no indivíduo # 21. A onda V não pode ser identificada em ambas as repetições de estímulos em um ou mais eletrodos testados.
Para os indivíduos com registros de “eABR positivo”, as amplitudes da onda V, latências e intervalos interpico III‐V foram registrados e comparados entre os diferentes locais dos eletrodos e com as pontuações de reconhecimento de sentenças obtidas dos indivíduos após 6 meses de uso do IC.
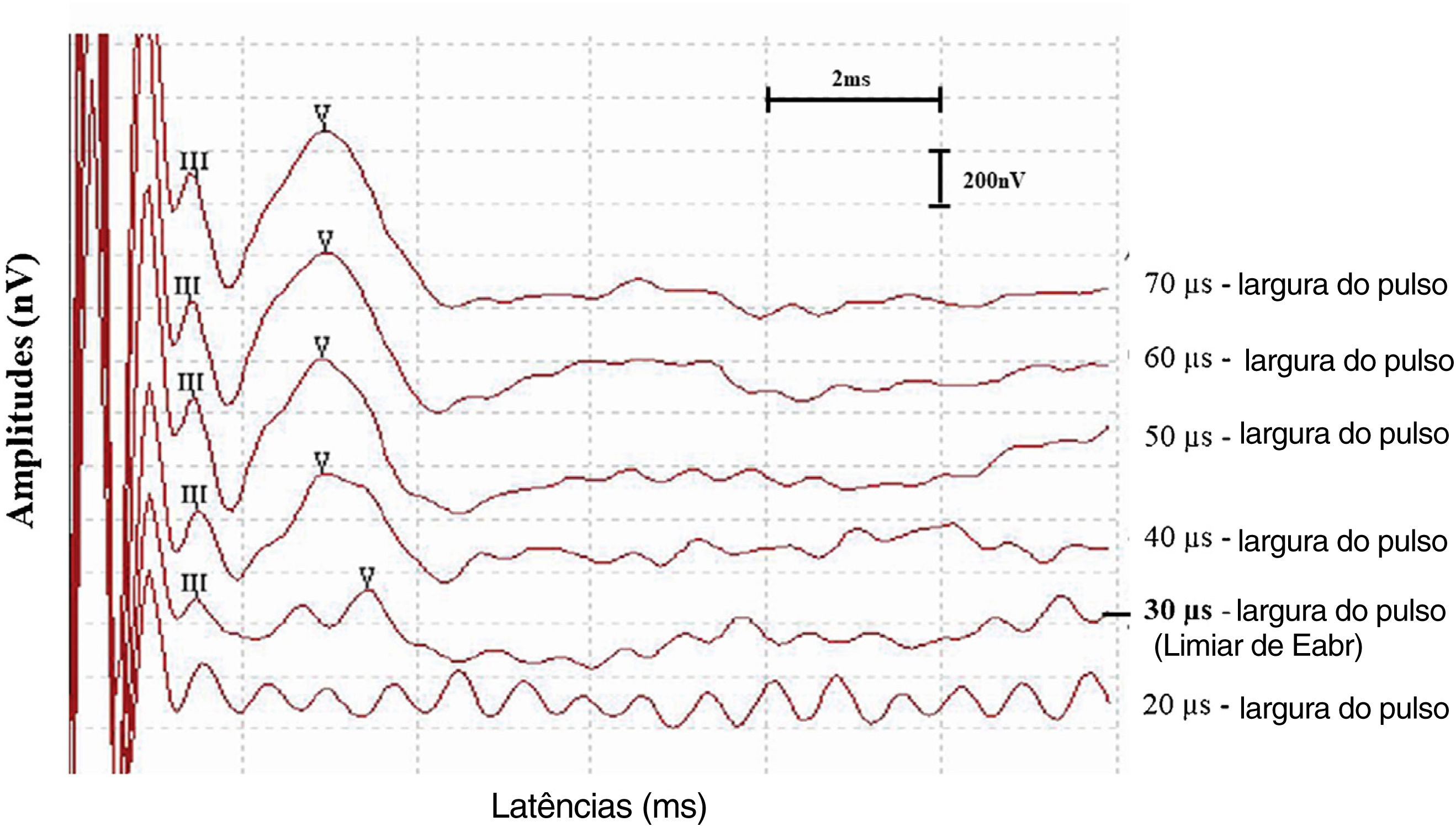
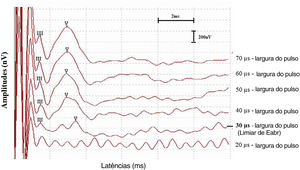
Além disso, os limiares do eABR também foram registrados para esses indivíduos e comparados aos seus níveis C e T determinados comportalmentalmente na ativação do processador de som. Para atingir os limiares de eABR dos indivíduos, a largura de pulso foi diminuída em etapas de 10μs até um ponto onde a onda V não pôde mais ser identificada. Em seguida, o limiar de eABR foi definido como a menor largura de pulso onde a onda V foi identificada (fig. 2).
Limiares determinados pelo comportamento (níveis T e C)Todos os indivíduos receberam um processador de fala Saphyr Neo Collection um mês após a cirurgia de IC. Uma taxa de estimulação fixa de 500Hz e uma amplitude fixa de 70 unidades computacionais (UC=1,56mA) foram adotadas no mapa padrão do indivíduo. O modo de estimulação multi‐mode27 e os pulsos elétricos pseudomonofásicos modulados por duração com descarga passiva compuseram o padrão de estimulação elétrica usado pelo IC. Nesse modo de estimulação, a corrente elétrica flui simultaneamente de um eletrodo dentro da cóclea para todos os eletrodos intracocleares restantes e para um eletrodo extracoclear e esse padrão de estimulação também foi adotado para os registros de eABR. A única diferença entre os estímulos Digistim usados para registrar os eABRs e no processador de som foi a taxa de estimulação. O primeiro estimula em 21Hz, o segundo estimula em 500Hz.
Oito máximas espectrais foram selecionadas na estratégia de codificação de voz Crystalis XDP para todos os participantes. Essa estratégia corresponde a uma extração espectral multibanda associada a uma função de compressão multibanda (XDP). Um número pré‐selecionado de eletrodos foi estimulado por um quadro de aquisição de modo que a estimulação elétrica tonotópica dos eletrodos relacionada à maior energia do som de entrada seja feita.
Os limiares comportamentais e níveis máximos de conforto foram obtidos em todos os indivíduos com uma escala de loudness por um audiologista treinado no software de programação do processador de som (Digimap SP, versão 4.0.7, Oticon Medical, Dinamarca). Para determinar o nível T, a largura de pulso foi aumentada em intervalos de 2μs e os indivíduos foram instruídos a indicar na escala de loudness quando começassem a perceber uma sensação auditiva. Para obter o nível C, os indivíduos foram instruídos a indicar na escala de loudness quando o som era confortável. Esse procedimento foi feito para obter níveis reproduzíveis de T e C para cada eletrodo ativo inserido na cóclea e usado para criar o MAPA dos indivíduos.
Percepção de falaUm teste de reconhecimento de sentenças28 foi usado para avaliar o reconhecimento de fala em conjunto aberto (open‐set) do indivíduo em silêncio após 6 meses de uso do IC. O teste foi composto por 60 frases que foram distribuídas em seis listas de dez sentenças balanceadas foneticamente com até sete palavras. Palavras com significado léxico e semântico, como substantivos, adjetivos, verbos, advérbios e numerais, foram consideradas palavras‐chave e receberam uma pontuação com valor 2. Palavras com significado gramatical, como artigos, preposições, conjunções, pronomes e interjeições receberam uma pontuação com valor 1. Como as listas de sentenças eram compostas por diferentes números de palavras, variando de quatro a sete palavras e de três a quatro palavras‐chave, uma pontuação, total foi multiplicada por um valor de correção, expresso em porcentagem. Esse valor variou de acordo com a lista, de 1,11% a 1,20%, a fim de atingir pontuação máxima de 100%. As listas mostraram resultados equivalentes e conteúdo fonético semelhante em estudos anteriores.29,30
As sentenças foram projetadas em campo livre por meio de um alto‐falante posicionado à frente dos indivíduos (0° azimute), a um metro de distância, a um nível de pressão sonora (dB NPS) de 65 decibéis. O resultado foi expresso como índice de reconhecimento de fala (IRF), que correspondeu ao número de palavras repetidas corretamente em cada frase, multiplicado pelo valor de correção e expresso em porcentagem. A pontuação do IRF variou de 0 (por desempenho) a 100% (melhor desempenho).
Análise estatísticaAs amplitudes, latências e os intervalos interpico III‐V da onda V dos eABRs registrados nos eletrodos apical, medial e basal foram comparados utilizando a análise de variância (Anova). O coeficiente de correlação de Pearson foi adotado para investigar associações entre eABRs intraoperatórios e limiares psicofísicos dos indivíduos e pontuações de IRF obtidas após 6 meses de uso do IC. Os resultados foram expressos em coeficientes de correlação (r) e intervalos de confiança (intervalo de confiança 95%=limite inferior; limite superior). Foi adotado um nível de significância de 5%.
ResultadoseABRs positivos foram registrados em 20 de 21 indivíduos durante a cirurgia de IC. Para um indivíduo (#21), o registro foi classificado como eABR negativo, uma vez que a onda V não pôde ser identificada em duas repetições do mesmo estímulo para os três eletrodos testados. Para todos os indivíduos, as ondas I e II não puderam ser registradas devido à presença de artefato de estímulo.
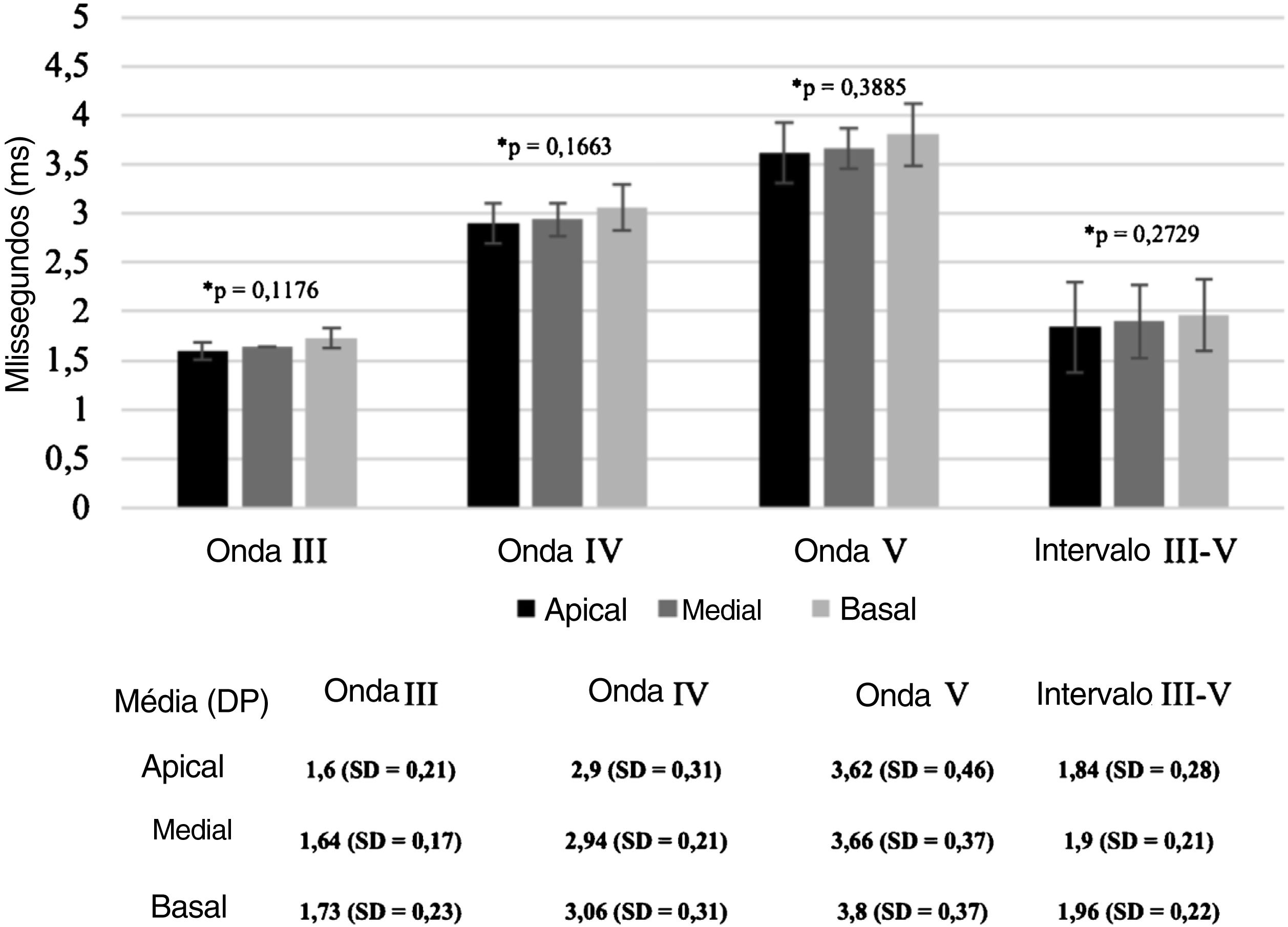
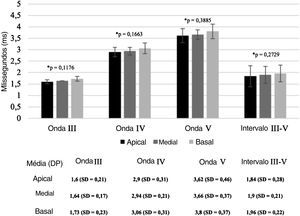
A figura 3 demonstra as latências médias das ondas e os intervalos interpico III‐V registrados nos eletrodos apical, medial e basal. Embora as latências absolutas das ondas e os intervalos interpico III‐V fossem maiores no eletrodo basal (e9) em comparação com os eletrodos medial (e14) e apical (e19), a análise de variância (Anova) mostrou que essas diferenças não foram significativas (p=0,3885, p=0,1663, p=0,1176 e p=0,2729, para as ondas V, IV, III e intervalo interpico III‐V, respectivamente).
Latências médias das ondas e intervalo interpico III‐V registrados nos eletrodos apical, medial e basal, durante a cirurgia de IC. As barras indicam o desvio‐padrão. A análise de variância (Anova) demonstrou que não há diferenças significativas entre as latências das ondas nas três regiões diferentes da cóclea (p > 0,05).
As amplitudes médias da onda V foram, respectivamente, 0,346μV (DP=±0,21μV), 0,322μV (DP=±0,25μV) e 0,251μV (DP=±0,24μV), para os eletrodos apicais, mediais e basais. As amplitudes da onda V foram maiores no eletrodo apical em comparação com os eletrodos medial e basal, mas a análise de variância (Anova) mostrou que essa diferença não foi significativa (p=0,4156).
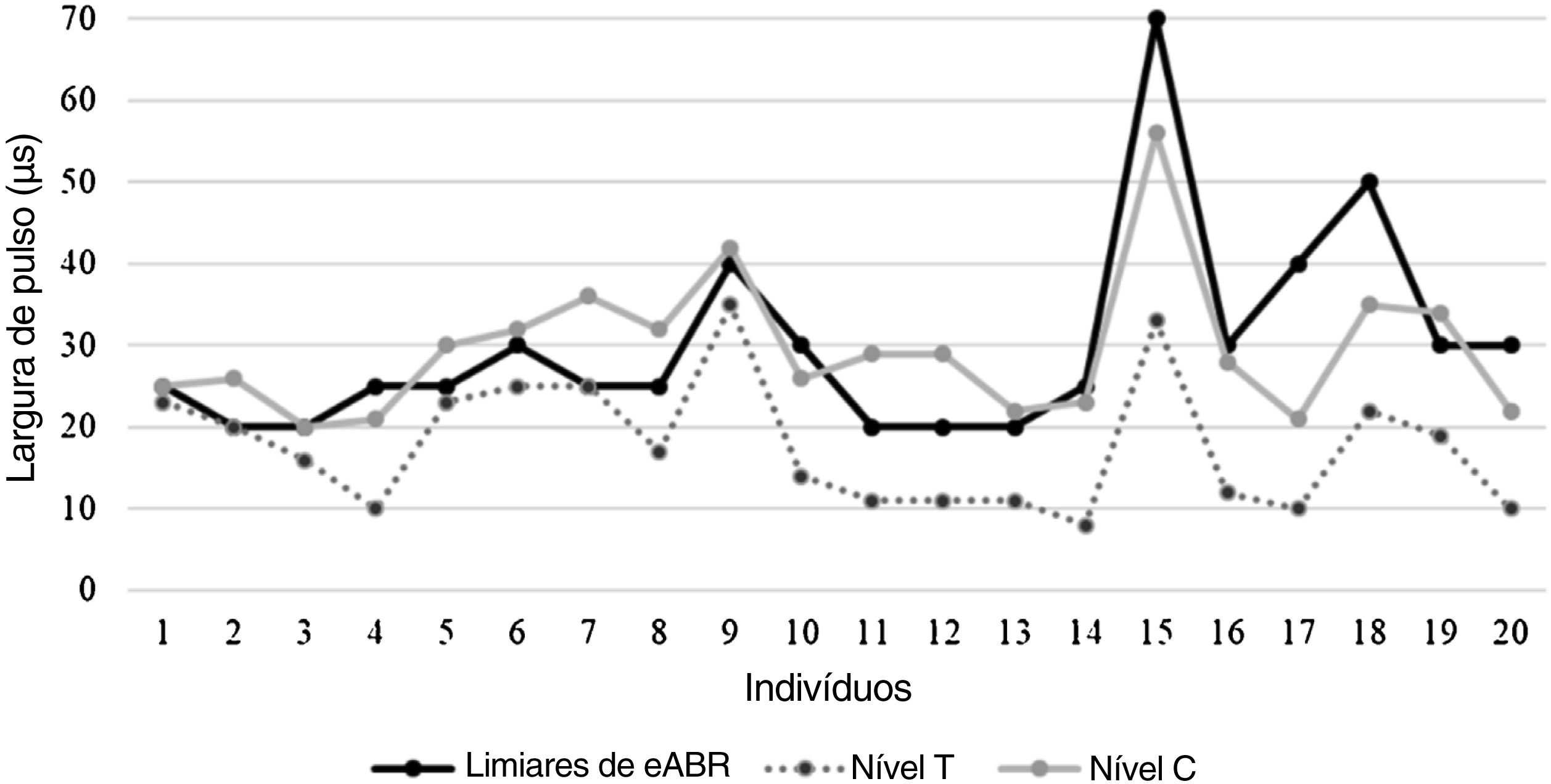
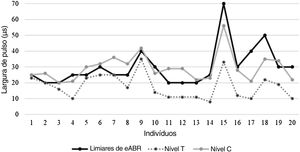
Os limiares de eABR obtidos de indivíduos durante a cirurgia de IC variaram de 20 a 70μs (média=30,00±12,25μs). Os níveis médios de T e C determinados de maneira comportamental nos indivíduos durante a ativação do processador de som foram 17,75 (DP=±7,87μs) e 29,45 (DP=±8,59μs), respectivamente. O coeficiente de correlação de Pearson revelou que eles estavam correlacionados (tabela 2). A média do limiar do eABR estava próximo ao nível de conforto médio dos indivíduos e mostrou uma correlação mais forte com os níveis‐C em comparação com os níveis‐T; entretanto, houve uma variabilidade considerável nos limiares individuais de eABR dos sujeitos. Para oito indivíduos, os limiares de eABR foram registrados dentro da área dinâmica elétrica, entre os níveis T e C (70% da área dinâmica, perto dos níveis C), 2 indivíduos apresentaram valores iguais dos limiaresdo eABR e níveis C, oito indivíduos apresentaram limiares de eABR em valores superiores aos dos níveis C (média de 8,5μs de duração do pulso acima dos níveis C) e 2 indivíduos apresentaram valores iguais de limiares do eABR e níveis T. Apesar da variabilidade, os limiares de eABR foram registrados em níveis elétricos audíveis em todos os indivíduos incluídos neste estudo. A figura 4 mostra a comparação entre os limiares do eABR e os níveis comportamentais entre os indivíduos. O indivíduo #21 foi excluído da análise por apresentar eABRs negativos.
Comparação entre os limiares de eABR intraoperatórios e os níveis psicofísicos dos indivíduos na ativação do processador de som
Nível comportamental, níveis determinados pelo comportamento dos indivíduos na ativação do processador de som; r, Coeficiente de correlação; IC de 95%, Intervalo de confiança de 95%=limite inferior; superior.
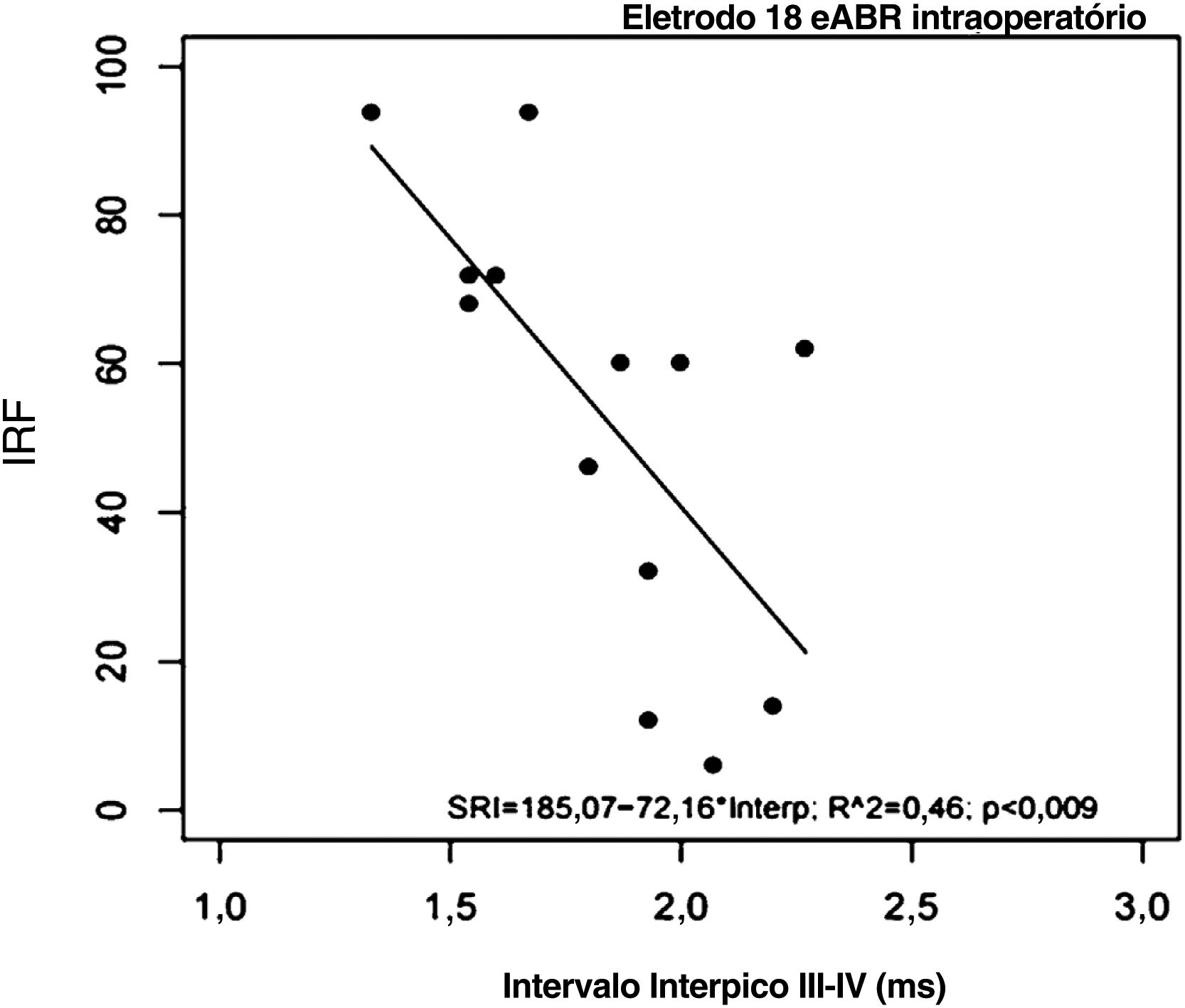
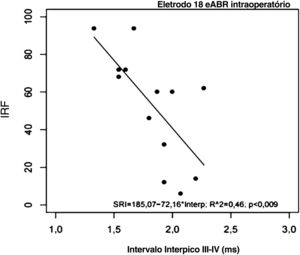
Todos os 21 indivíduos completaram o teste de reconhecimento de sentenças em conjunto aberto após 6 meses de uso do IC. Suas pontuações de IRF variaram de 2% a 94% (mediana=60%; média=51,52±31,06%). A tabela 3 demonstra as pontuações individuais do IRF entre os indivíduos. O indivíduo #21 apresentou eABRs negativos nos três eletrodos testados (eABRs ausentes) e a menor pontuação de IRF em comparação ao grupo (IRF=2%; tabela 3). O coeficiente de correlação de Pearson revelou uma correlação significativa e negativa entre as pontuações de IRF e os intervalos interpico III‐V intraoperatórios registrados no eletrodo 18 (tabela 4; fig. 5). Não houve correlação entre as pontuações de IRF e os intervalos interpico III‐V registrados nos eletrodos 9 e 14, e entre as pontuações de IRF e as latências e amplitudes da onda V registradas nos eletrodos 18,14 e 9 (tabela 4).
Comparação entre as amplitudes da onda V, latências e intervalos interpico III‐V registrados durante a cirurgia de implante coclear e pontuações de reconhecimento de sentenças dos indivíduos após seis meses de uso do implante coclear
| Eletrodo | r | IC95% | |
|---|---|---|---|
| Intervalo Interpico III–V (μs) | 18 | ‐0,69 | ‐0,9; ‐0,22a |
| 14 | ‐0,58 | ‐0,86; ‐0,049 | |
| 9 | ‐0,078 | ‐0,58; 0,47 | |
| Latência da Onda V (μs) | 18 | ‐0,46 | ‐0,75; ‐0,016 |
| 14 | ‐0,41 | ‐0,72; 0,035 | |
| 9 | ‐0,22 | ‐0,6; 0,25 | |
| Amplitude da Onda V (nV) | 18 | 0,57 | 0,19; 0,081 |
| 14 | 0,47 | 0,035; 0,76 | |
| 9 | 0,41 | ‐0,035; 0,72 |
Eletrodo: eletrodo intra‐coclear selecionado para teste e‐ABR; r, Coeficiente de correlação, IC95%, intervalo de confiança, 95% = inferior.
O primeiro objetivo deste estudo foi investigar os eABRs intraoperatórios registrados em três eletrodos correspondentes às bandas com frequências centradas em 500Hz, 1000Hz e 2000Hz, alocadas, respectivamente, aos eletrodos e18, e14 e e9, no feixe de eletrodos Evo®. Os registros de eABR demonstraram morfologia semelhante nas diferentes localizações da cóclea. A onda V foi a mais robusta e registrada com frequência, seguida pelas ondas III e IV, respectivamente. As ondas I e II não puderam ser registradas devido à presença de artefato de estímulo. Esses achados estão de acordo com estudos prévios em usuários adultos de IC,18,26,31 incluindo a geração anterior de usuários Digisonic, DX10.16,17,32,33
As latências e amplitudes das ondas do eABR também foram semelhantes nas diferentes localizações da cóclea. Embora as latências e os intervalos interpico III‐V tenham sido mais curtos e as amplitudes da onda V maiores no eletrodo apical em comparação com os eletrodos medial e basal, as diferenças não foram significativas e apresentaram desvio‐padrão semelhante entre eles. Resultados semelhantes foram relatados por Firszt et al.9 para amplitudes de eABR pós‐operatórias em 11 usuários adultos de implante coclear Clarion. Os autores encontraram latências da onda V significativamente maiores para o eletrodo basal em comparação com os eletrodos medial e apical; entretanto, os resultados são controversos na literatura e outro estudo não encontrou diferenças significativas nas latências das ondas nas diferentes regiões da cóclea em usuários de outros sistemas de IC.26 Não há estudos publicados que comparem a latência da onda V nas diferentes regiões da cóclea para usuários do feixe de eletrodos Evo®. Supõe‐se que a amplitude da onda V está relacionada à sincronia das respostas das fibras do nervo auditivo para a estimulação elétrica9 e que a latência da onda V está relacionada à transmissão de atividade entre as sinapses neurais.34 Os resultados de nosso estudo sugerem que esses recursos podem ser ativados imediatamente após o implante do feixe de eletrodos Evo® dentro da cóclea e não há diferenças entre eles, independentemente da posição do eletrodo.
Os limiares de eABR intraoperatórios foram significativamente correlacionados com os níveis de T e C dos sujeitos, determinados de forma comportamental, durante a ativação do processador de som, e foram registrados em níveis de estimulação elétrica audíveis para todos os usuários de eletrodos Evo® incluídos neste estudo. O limiar médio de eABR intraoperatório foi registrado próximo ao nível C, a um valor mais alto do que o relatado anteriormente por Guenser et al.3 para eABR pós‐operatório em usuários de eletrodos Evo®, apesar da considerável variabilidade nos limiares individuais de eABR dos sujeitos.
Esses resultados estão de acordo com estudos anteriores que compararam limiares de eABR intraoperatório e limiares psicofísicos em outros sistemas de IC. Shallop et al.21 estudaram a relação entre os limiares de eABR obtidos de 11 usuários do dispositivo Nucleus na sala de cirurgia e as subsequentes medidas comportamentais do limiar e níveis de máximo conforto. Em 12 adultos e 14 crianças com o IC Nucleus, os limiares de eABR foram fortemente correlacionados com os níveis T e C e foram registrados em níveis de estimulação audível para todos os indivíduos. Entre os indivíduos para os quais as medidas de eABR intraoperatórias e pós‐operatórias foram obtidas, os limiares de eABR intraoperatórios foram consistentemente mais elevados do que os limiares pós‐operatórios.22 Após a cirurgia de IC, ocorre variação na carga fornecida aos eletrodos intracocleares, atribuível a fatores como cicatrização e redução da interface entre o eletrodo e o tecido neural, mudanças de gradiente eletroquímico dentro da cóclea e reorganização e adaptação do nervo auditivo que se torna mais condutivo à estimulação elétrica ao longo do tempo.35,36 Portanto, os limiares de eABR intraoperatórios seriam registrados em valores mais altos em comparação com os limiares pós‐operatórios, devido à necessidade de maior estimulação para evocar um potencial de ação registrável do tronco cerebral neste momento.
Os resultados deste estudo demonstraram que os limiares de eABR intraoperatório não podem ser usados para prever os níveis T ou C, mas podem ser usados para estabelecer um nível audível para usuários de eletrodos Evo®. Não há estudos anteriores que compararam os limiares de eABR intraoperatório e limiares determinados de maneira comportamental em usuários de Evo® e essa informação é relevante para a programação do processador de som durante sua ativação. Na ativação do processador de som, os níveis de estimulação são atualmente determinados através de medidas comportamentais, com base na resposta dos usuários do IC. Em crianças pequenas ou pacientes com necessidades especiais, bem como em pacientes recém‐implantados e aqueles sem experiência anterior com estimulação elétrica promovida pelo implante coclear, a determinação dos níveis psicofísicos ideais de estimulação elétrica ainda é um desafio. Além disso, o uso de registros de eABR intraoperatório tem a vantagem de ser obtido em indivíduos sob anestesia geral, minimizando a interferência de artefatos musculares que poderiam dificultar a mensuração.
Houve uma correlação significativa entre o eABR intraoperatório e a percepção de fala dos usuários de Evo® após 6 meses de uso do dispositivo. Os intervalos interpico III‐V registrados no eletrodo apical (eletrodo 18) foram negativamente correlacionados com as pontuações de reconhecimento de sentenças dos indivíduos. Isso sugere que os intervalos interpico III‐V mais longos na região apical da cóclea (500Hz) podem estar relacionados ao desempenho auditivo inferior com o uso do IC em curto prazo. Nossos resultados são consistentes com os de Gallégo et al.16,17 para eABRs pós‐operatórios em usuários do dispositivo Digisonic DX10. De acordo com os autores, esses achados poderiam ser explicados pela influência do processamento de decodificação a partir do nível do núcleo coclear e da degeneração do sistema auditivo. A degeneração do sistema auditivo indica desmielinização, o que poderia aumentar o tempo de propagação dos impulsos nervosos entre o núcleo coclear e o colículo inferior, reduzindo assim o desempenho da inteligibilidade de fala. De acordo com os autores, quanto maior o intervalo interpico III‐V, pior a inteligibilidade de fala.16 Lundin et al.15 também encontraram correlações significativas entre os resultados de percepção da fala em usuários de IC e as características de eABR apenas para os eletrodos na região de baixa frequência da cóclea. Gordon et al.37 relataram que humanos com perda auditiva têm populações maiores de células do gânglio espiral no ápice coclear (região de frequencias graves) do que na base coclear (região de frequencias agudas) e que a percepção da fala pode depender da codificação da via auditiva, que é baseada na sobrevivência e na e atividade neurais síncronas; isso poderia explicar nossos resultados no eletrodo apical.
Um indivíduo apresentou eABRs ausentes (eABR negativo) e também apresentou o pior desempenho percepção de fala em comparação ao grupo após 6 meses de uso do IC. O indivíduo #21 tinha perda auditiva causada por meningite e isso pode explicar a baixa pontuação de percepção de fala obtidas por esse indivíduo em nosso estudo. Sabe‐se que a meningite afeta a cóclea e o sistema nervoso central, apesar da inserção completa dos eletrodso.38–41
Achados semelhantes foram relatados anteriormente na literatura. Lundin et al.15 realizaram um estudo retrospectivo com 74 adultos e quatro crianças com anormalidades cocleares graves que receberam ICs entre 2011 e 2013 e relataram que a ausência de eABRs intraoperatórios prediz resultados inferiores de percepção de fala no pós‐operatório. Firszt et al.9 estudaram 11 indivíduos adultos que receberam o dispositivo de IC Clarion e demonstraram que indivíduos sem reconhecimento de fala em conjunto aberto demonstraram morfologia alterada ou eABRs ausentes e indivíduos com maiores pontuações de reconhecimento em conjunto aberto demonstraram a presença de eABRs. Yamazaki et al.42 estudaram 19 crianças com deficiência do nervo coclear submetidas a implante coclear e teste de eABR intraoperatório e demonstraram que a presença ou ausência de registros de eABR foi significativamente associada ao desempenho auditivo pós‐operatório. Esses autores demonstraram que a categoria média de desempenho auditivo em indivíduos com eABRs presentes foi significativamente maior do que a categoria principal de desempenho auditivo em indivíduos com eABRs ausentes.
Portanto, os resultados deste estudo podem auxiliar os profissionais no planejamento de ações futuras com o objetivo de melhorar o desempenho auditivo de usuários de IC, como acompanhamento regular, terapia fonoaudiológica mais intensiva ou aconselhamento aos cuidadores, uma vez que o intervalo interpico III‐V mais longo ou um eABR intraoperatório ausente pode sugerir desempenho auditivo inferior em usuários de IC em curto prazo.
Por fim, este estudo foi realizado com um tamanho amostral pequeno (n=21), porém foi possível detectar associações estatisticamente significativas entre eABRs, intervalos interpico III‐V e as pontuações de reconhecimento de sentenças dos indivíduos em curto prazo, com o coeficiente de correlação de Pearson com nível de significância de 5%. Investigações futuras com um número maior de indivíduos são necessárias para explorar esses resultados também em longo prazo. Além disso, embora o limiar médio de eABR tenha sido registrado próximo ao nível C médio dos pacientes, encontramos uma variabilidade considerável nos limiares de eABR individuais dos sujeitos e, em alguns casos, os limiares de eABR excederam os níveis de máximo conforto dos indivíduos (média de 8,5μs de duração de pulso). Esses resultados podem auxiliar o profissional a estabelecer níveis audíveis para a primeira adaptação do processador de fala em usuários dos eletrodos Evo®, associados a medidas comportamentais que garantam que esses níveis não sejam desconfortáveis para os usuários.
ConclusãoA medida do eABR intraoperatório provou ser uma ferramenta eficaz para uso clínico em usuários de IC com feixe de eletrodos Evo®. Os limiares do eABR intraoperatórios podem ser usados para estabelecer níveis audíveis para ajustar o processador de som em usuários do dispositivo Evo® e um intervalo interpico III‐V maior ou eABRs intraoperatórios ausentes podem estar relacionados ao desempenho auditivo inferior de usuários de IC em curto prazo. Isso poderia auxiliar os profissionais a planejarem ações futuras com o objetivo de melhorar o desempenho auditivo de usuários de IC.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Daniel F, Reis AC, Massuda ET, Amaral MS, Hoen M, Gnansia D, et al. Clinical implications of intraoperative eABRs to the Evo®‐CI electrode array recipients. Braz J Otorhinolaryngol. 2022;88:S108–S117.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.