Reactive hyperplastic lesions develop in response to a chronic injury simulating an exuberant tissue repair response. They represent some of the most common oral lesions including inflammatory fibrous hyperplasia, oral pyogenic granuloma, giant cell fibroma, peripheral ossifying fibroma, and peripheral giant cell lesions.
ObjectiveThe incidence of those lesions was investigated in an oral pathology service, and the clinical characteristics, associated etiological factors, concordance between the clinical and histopathological diagnostic was determined.
MethodsA total of 2400 patient records were screened from 2006 to 2016. Clinical features were recorded from biopsy reports and patients’ files.
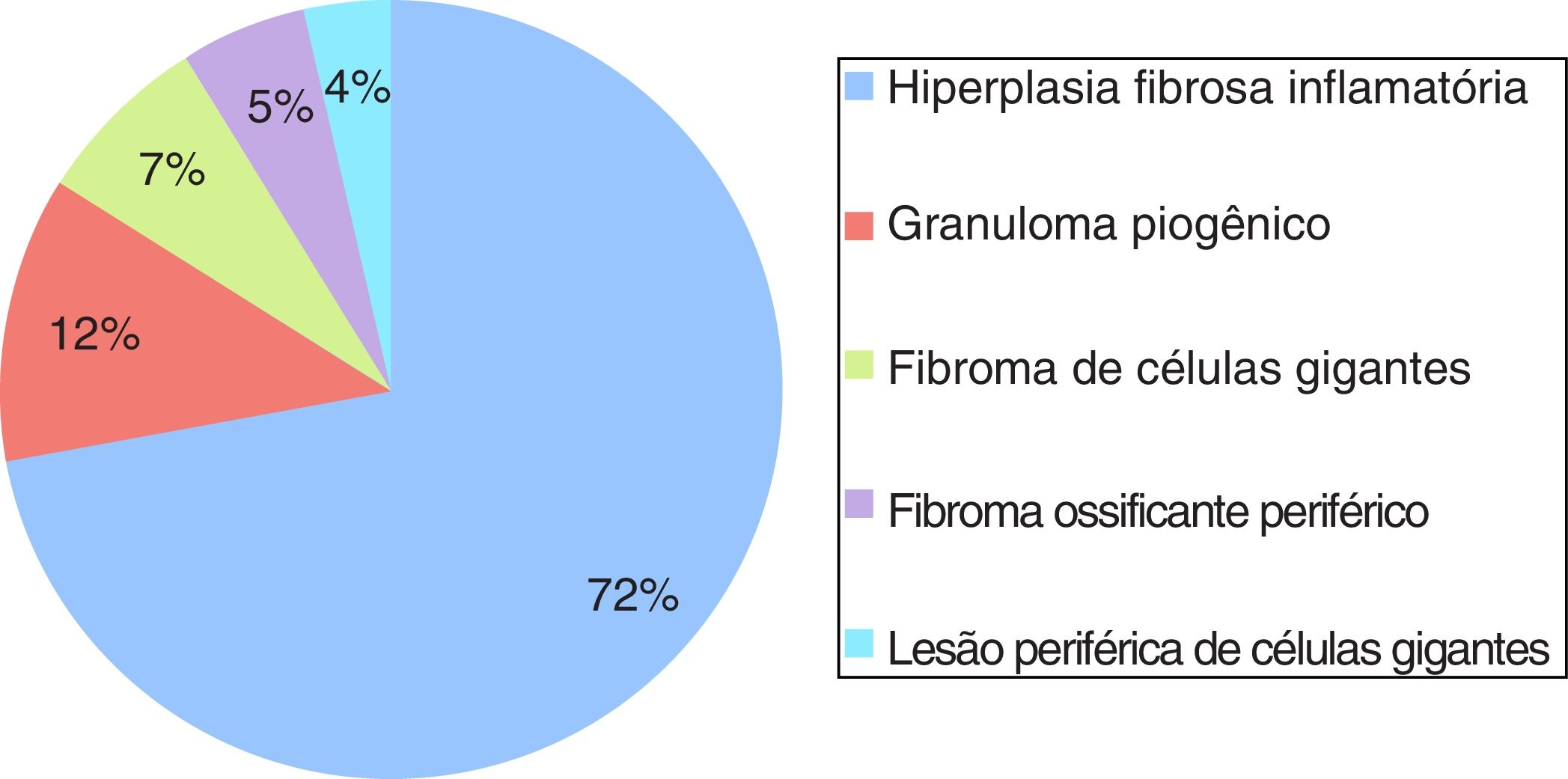
ResultsA total of 534 cases of reactive hyperplastic lesions were retrieved and retrospectively studied, representing 22.25% of all diagnoses. The most frequent lesion was inflammatory fibrous hyperplasia (72.09%), followed by oral pyogenic granuloma (11.79%), giant cell fibroma (7.30%), peripheral ossifying fibroma (5.24%), and peripheral giant cell lesions (3.55%). Females were predominantly affected (74.19%), the gingiva and alveolar ridge were the predominant anatomical site (32.89%), and chronic traumatism was presented as the main etiological factor. The age widely ranges from the 1st decade of life to the 7th. Clinically, the reactive hyperplastic lesions consisted of small lesions (0.5–2cm) and shared a strong likeness in color to the oral mucosa. The concordance between the clinical and histopathological diagnostic was high (82.5%).
ConclusionReactive hyperplastic lesions had a high incidence among oral pathologies. The understanding of their clinical features helps to achieve a clearer clinical and etiological diagnosis, and the knowledge of factors related to their development. This may contribute to adequate treatment and positive prognosis.
As lesões hiperplásicas reativas se desenvolvem em resposta a uma lesão crônica que estimula uma resposta acentuada de reparo tecidual. Elas representam uma das lesões orais mais comuns, inclusive hiperplasia fibrosa inflamatória, granuloma piogênico oral, fibroma de células gigantes, fibroma periférico ossificante e lesão periférica de células gigantes.
ObjetivoA incidência dessas lesões foi investigada em um serviço de patologia bucal e as características clínicas, os fatores etiológicos associados e a concordância entre os diagnósticos clínico e histopatológico foram determinados.
MétodoForam selecionados 2.400 registros de pacientes entre 2006 e 2016. As características clínicas foram registradas a partir de laudos de biópsia e dos prontuários dos pacientes.
ResultadosUm total de 534 casos de lesões hiperplásicas reativas foram recuperados e retrospectivamente estudados, representando 22,25% de todos os diagnósticos. A lesão mais frequente foi hiperplasia fibrosa inflamatória (72,09%), seguida por granuloma piogênico oral (11,79%), fibroma de células gigantes, (7,30%), fibroma periférico ossificante (5,24%) e lesão periférica de células gigantes (3,55%). O sexo feminino foi predominante (74,19%), a gengiva e a crista alveolar foram o local anatômico predominante (32,89%) e o traumatismo crônico foi demonstrado como o principal fator etiológico. A idade variou desde a 1ª década de vida até a 7ª. Clinicamente, as LHR consistiram em pequenas lesões (0,5 a 2cm) que apresentaram uma forte semelhança de cor com a mucosa oral. A concordância entre o diagnóstico clínico e histopatológico foi alta (82,5%).
ConclusãoAs lesões hiperplásicas reativas apresentaram alta incidência entre as patologias bucais. A compreensão das características clínicas ajuda na realização de um diagnóstico clínico e etiológico mais claro, bem como determinar os fatores relacionados ao seu desenvolvimento. Dessa forma contribui para um tratamento adequado e um prognóstico positivo.
As lesões hiperplásicas reativas (LHR) da cavidade oral podem se desenvolver devido a uma irritação crônica de baixa intensidade que estimula uma resposta acentuada de reparo tecidual. Essa resposta acentuada produz um crescimento dos tecidos moles semelhante a um grupo diversificado de processos patológicos. Consequentemente, essa resposta representa um desafio diagnóstico, já que um crescimento pode ser característica de apenas uma variação de estruturas anatômicas normais, processos inflamatórios, cistos, anomalias de desenvolvimento e neoplasias.1
O grupo das LHR é composto por hiperplasia fibrosa inflamatória (HFI), granuloma piogênico oral (GPO), fibroma de células gigantes (FCG), fibroma ossificante periférico (FOP) e lesão periférica de células gigantes (LPCG). Todas elas compartilham uma aparência clínica semelhante à mucosa oral e representam as lesões orais mais comuns, exclusive cáries, doença periodontal e lesões inflamatórias periapicais.1
A aparência clínica das LHR é caracterizada por crescimento tecidual, de consistência fibrosa ou flácida, cor avermelhada, séssil ou pedunculada, pode ocorrer em múltiplos sítios intraorais. Geralmente, a gengiva é a região mais afetada por estar exposta a biofilmes, cálculos, impacto de alimentos, restaurações ou próteses mal adaptadas e fatores iatrogênicos. Os pacientes podem relatar ausência de sintomas ou sintomas que variam de dor leve a sangramento. Achados radiográficos são usualmente ausentes; no entanto, em casos raros de grandes lesões, pode se observar reabsorção óssea alveolar localizada.2 O diagnóstico diferencial inclui hemangioma, sarcoma de Kaposi, angiomatose bacilar, angiossarcoma e linfoma não Hodgkin.3
Exames histopatológicos dos espécimes cirúrgicos de biópsias orais são necessários para confirmar o diagnóstico clínico e fornecer um diagnóstico definitivo. Isso é feito com a intenção de estabelecer um tratamento adequado, evitar a recorrência das lesões. Desse modo, o objetivo deste estudo foi investigar a incidência de HFI, GPO, FCG, FOP e LPCG diagnosticadas em um serviço de diagnóstico oral‐anatomopatológico de referência, bem como analisar os dados demográficos associados e a concordância entre os diagnósticos clínicos e histopatológicos.
MétodoEste estudo retrospectivo foi aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos na Universidade Federal de Santa Catarina sob o número 1.097.375. Todos os casos de LHR foram recuperados dos registros do Laboratório de Patologia Oral, de 2006 a 2016. Foram considerados os casos nos quais o diagnóstico histopatológico foi HFI, GPO, FCG, FOP ou LPCG. Informações do perfil de cada caso foram obtidas a partir dos laudos de biópsia e registros de pacientes, foram coletados os seguintes parâmetros: sexo do paciente, idade e grupo étnico; e dados relacionados às lesões, como tamanho, cor, localização e etiologia. Os casos foram agrupados e registrados de forma consecutiva para evitar qualquer viés de seleção. Além disso, foi avaliada a concordância entre os diagnósticos histopatológicos e clínicos emitidos pelo dentista. Por fim, os dados coletados foram inseridos em uma planilha Microsoft Excel® (Microsoft Corporation, Redmond, EUA) e o software foi usado para fazer a análise estatística descritiva com todos os dados coletados.
Revisão da literaturaFoi feita uma revisão da literatura para recuperar estudos sobre LHR sem restrição de ano de publicação ou idioma. Os critérios de inclusão foram estudos retrospectivos e séries de casos que incluíram pelo menos 100 casos de LHR. Os critérios de exclusão foram os estudos sem textos completos disponíveis. Foi feita uma busca eletrônica nas bases de dados Latin American and Caribbean Health Sciences (Lilacs) e PubMed (incluindo MedLine) em abril de 2017 e atualizada em janeiro de 2018. As seguintes combinações de palavras‐chave resumem a pesquisa: reactive hyperplastic lesions OR reactive lesions OR reactive gingival lesions OR oral pyogenic granuloma OR peripheral ossifying fibroma OR giant cell fibroma OR peripheral giant cell granulomas OR inflammatory fibrous hyperplasia. Todas as referências foram gerenciadas e os achados duplicados foram removidos pelo software gerenciador de referência (Endnote X7, Thompson Reuters, Nova York, NY). A seleção dos estudos foi feita em duas fases. Na fase 1, os títulos/resumos que preenchiam os critérios de elegibilidade foram selecionados. Se um título/resumo fornecesse informações insuficientes para uma decisão sobre a sua inclusão/exclusão, o texto completo era obtido para avaliação na fase 2. Aqueles que preencheram os critérios de elegibilidade também foram incluídos.
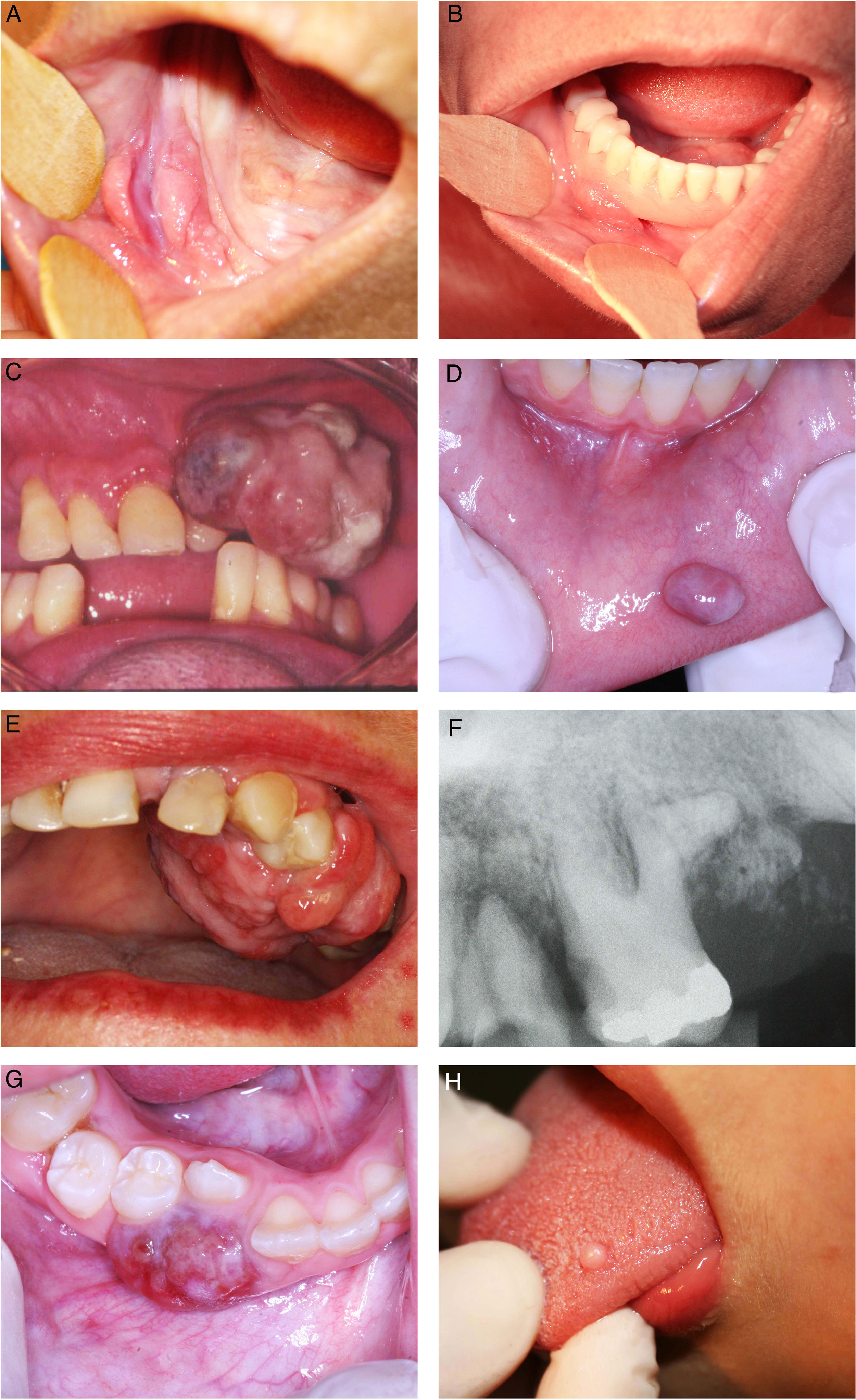
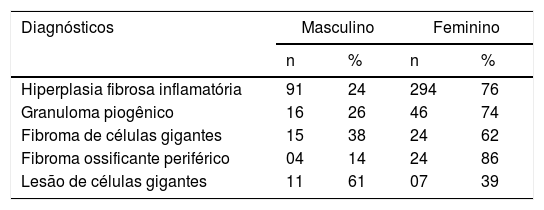
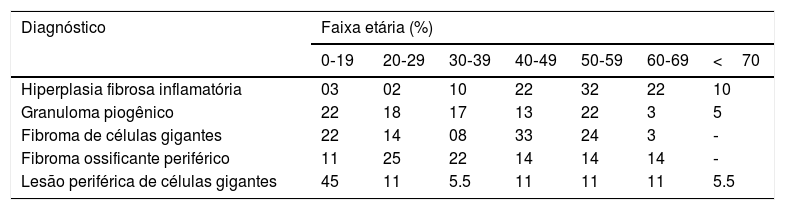
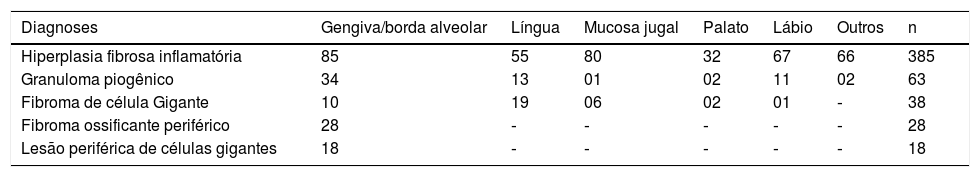
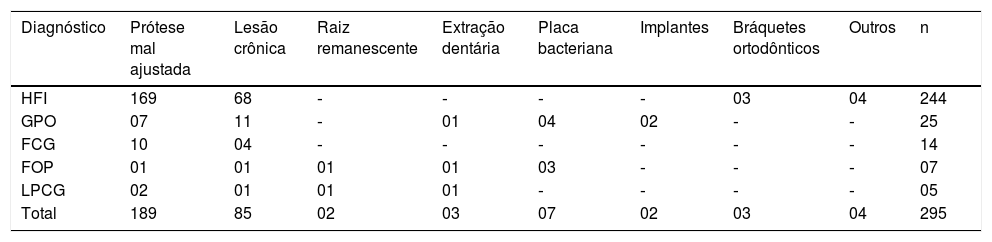
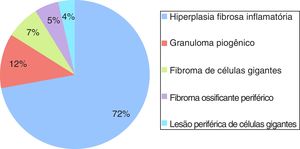
ResultadosDurante o período de 10 anos, 2.400 casos de lesões orais foram biopsiados e examinados histologicamente no laboratório de patologia oral. Desse total, 534 foram diagnosticados como LHR, com uma incidência de 22,25%. A figura 1 ilustra a incidência geral de lesões registradas quanto ao tipo histológico. Esses casos ocorreram com maior frequência no sexo feminino (74,19%), com exceção da LPCG, a qual constituiu o único grupo de lesões com maior incidência (61%) no sexo masculino (tabela 1). Entre as mulheres afetadas, 11,11% dos casos de GPO estavam relacionados a gestantes. A idade dos pacientes variou de forma significativa (tabela 2). A localização anatômica preferencial foi a crista alveolar e a mucosa jugal (tabela 3). As lesões registradas eram geralmente nodulares, com tamanhos que variaram de 0,5cm a 2cm, assemelharam‐se à cor da mucosa ou levemente roxo‐avermelhadas (fig. 2). Em todos os casos, o principal fator etiológico foram próteses mal ajustadas (fig. 2B), exclusive o FOP, que apresentou a placa bacteriana como principal fator relatado (tabela 4).
Distribuição de acordo com a idade dos pacientes
| Diagnóstico | Faixa etária (%) | ||||||
|---|---|---|---|---|---|---|---|
| 0‐19 | 20‐29 | 30‐39 | 40‐49 | 50‐59 | 60‐69 | <70 | |
| Hiperplasia fibrosa inflamatória | 03 | 02 | 10 | 22 | 32 | 22 | 10 |
| Granuloma piogênico | 22 | 18 | 17 | 13 | 22 | 3 | 5 |
| Fibroma de células gigantes | 22 | 14 | 08 | 33 | 24 | 3 | ‐ |
| Fibroma ossificante periférico | 11 | 25 | 22 | 14 | 14 | 14 | ‐ |
| Lesão periférica de células gigantes | 45 | 11 | 5.5 | 11 | 11 | 11 | 5.5 |
Distribuição de acordo com a localização predominante da lesão
| Diagnoses | Gengiva/borda alveolar | Língua | Mucosa jugal | Palato | Lábio | Outros | n |
|---|---|---|---|---|---|---|---|
| Hiperplasia fibrosa inflamatória | 85 | 55 | 80 | 32 | 67 | 66 | 385 |
| Granuloma piogênico | 34 | 13 | 01 | 02 | 11 | 02 | 63 |
| Fibroma de célula Gigante | 10 | 19 | 06 | 02 | 01 | ‐ | 38 |
| Fibroma ossificante periférico | 28 | ‐ | ‐ | ‐ | ‐ | ‐ | 28 |
| Lesão periférica de células gigantes | 18 | ‐ | ‐ | ‐ | ‐ | ‐ | 18 |
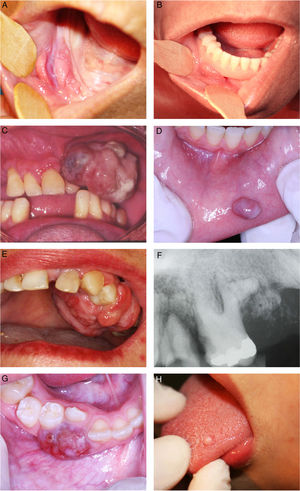
(A) Hiperplasia fibrosa inflamatória; (B) prótese mal ajustada sobre a hiperplasia fibrosa inflamatória; (C) Granuloma piogênico no rebordo alveolar; (D) Granuloma piogênico oral no lábio inferior; (E) Fibroma ossificante periférico; (F) Radiografia periapical do fibroma ossificante periférico; (G) Lesões de células gigantes periféricas; (H) Fibroma de células gigantes.
Distribuição de acordo com o fator etiológico
| Diagnóstico | Prótese mal ajustada | Lesão crônica | Raiz remanescente | Extração dentária | Placa bacteriana | Implantes | Bráquetes ortodônticos | Outros | n |
|---|---|---|---|---|---|---|---|---|---|
| HFI | 169 | 68 | ‐ | ‐ | ‐ | ‐ | 03 | 04 | 244 |
| GPO | 07 | 11 | ‐ | 01 | 04 | 02 | ‐ | ‐ | 25 |
| FCG | 10 | 04 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | 14 |
| FOP | 01 | 01 | 01 | 01 | 03 | ‐ | ‐ | ‐ | 07 |
| LPCG | 02 | 01 | 01 | 01 | ‐ | ‐ | ‐ | ‐ | 05 |
| Total | 189 | 85 | 02 | 03 | 07 | 02 | 03 | 04 | 295 |
FCG, fibroma de células gigantes; FOP, fibroma ossificante periférico; GPO, granuloma piogênico oral; HFI, hiperplasia fibrosa inflamatória; LPCG, lesão periférica de células gigantes.
A lesão mais frequentemente observada neste estudo retrospectivo foi a HFI, representou 72% dos casos diagnosticados. A HFI ocorreu principalmente em mulheres com média de 50 anos, com variação de 19 a 90, com maior incidência evidente durante nas 6ª (32,4%), 5ª (22,2%) e 7ª (22,2%) décadas de vida. A localização anatômica preferencial foram a crista alveolar (22,0%) e a mucosa jugal (20,7%). O tamanho da lesão variou de menor do que 0,5cm (25,3%), 0,5±1,0cm (30,14%) e 1,0‐1,9cm (22,58%). Os principais fatores etiológicos correspondentes foram próteses mal ajustadas (68,6%), seguido de trauma crônico (27,6%).
Os demais casos incluíram GPO (12%), seguido de FCG (7%), FOP (5%) e LPCG (4%). Em relação ao GPO, o sexo feminino foi o mais acometido (74,2%), com maior incidência observada durante a 1ª (21,6%), 2ª (21,6%), 3ª (18,3%) e 6ª (21,6%) décadas de vida. Desses casos, 11,6% estavam relacionados a gestantes e 8,3% eram recorrências. A localização anatômica preferencial foi a crista alveolar (53,9%) e os lábios (20,6%). O tamanho da lesão variou de menor do que 0,5cm (14,7%), 0,5‐1,0cm (32,3%) e 1,0‐1,9cm (38,2%). O principal fator etiológico correspondente foi o trauma crônico (44%), seguido pelas próteses mal ajustadas (28%).
O FGC ocorreu principalmente no sexo feminino (61,5%), com maior incidência durante as 4ª (32,4%), 5ª (24,3%), 1ª (21,6%) e 2ª (21,6%) décadas de vida. A localização anatômica preferencial foi a língua (50%). O tamanho da lesão predominante foi menor do que 0,5cm (51,7%). O principal fator etiológico correspondente foram as próteses mal ajustadas (71,4%), seguido de trauma crônico (28,5%).
O FOP afetou principalmente o sexo feminino (85,7%) durante a 3ª (25,0%) e a 4ª (21,4%) décadas de vida. Todas as lesões registradas estavam localizadas na gengiva e na borda alveolar. O tamanho da lesão mais comum foi de 1,0‐1,9cm (29,4%). A placa bacteriana foi o fator etiológico mais frequentemente relatado (27,2%).
As LPCG apresentaram maior incidência no sexo masculino (61,1%), na 1ª e 2ª décadas de vida (45,0%). Todos esses casos ocorreram na crista gengival e alveolar com o tamanho mais frequente entre 1cm e 1,9cm (33,3%). Próteses mal ajustadas (40%) foram o principal fator etiológico envolvido, seguido de trauma crônico (20%).
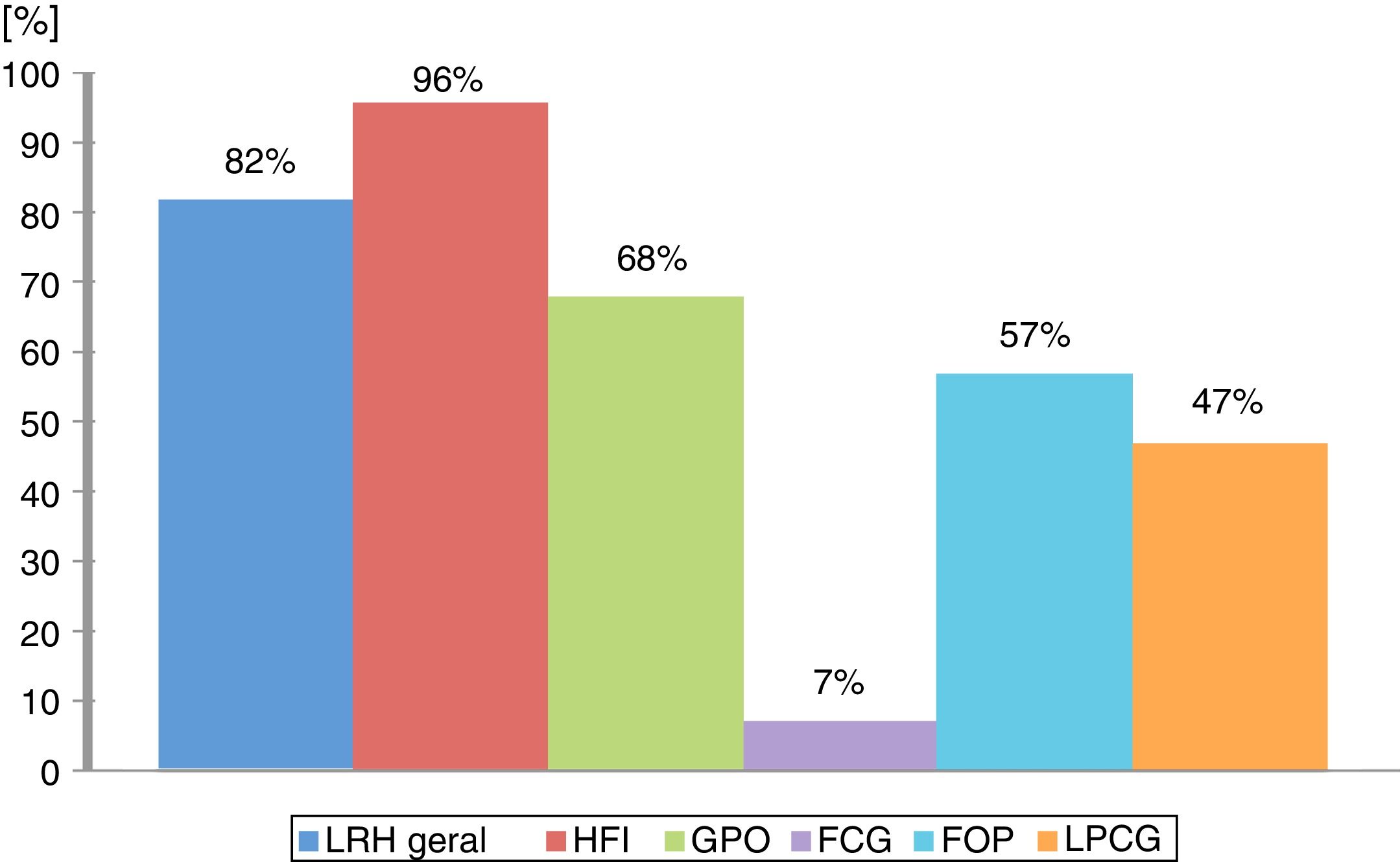
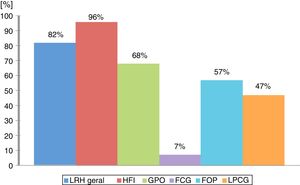
Em geral, a concordância entre os diagnósticos clínicos e histopatológicos foi alta; 370 de 385 das LHR receberam o mesmo diagnóstico a partir do exame clínico e do exame histopatológico. No entanto, essa concordância variou amplamente de acordo com o tipo de lesão; a maior concordância foi observada nas lesões de HFI (96%), enquanto o FCG (7%) apresentou a menor concordância (fig. 3). Informações detalhadas sobre características histopatológicas podem ser encontradas na figura 4. Todos os dados demográficos detalhados estão mostrados nas tabelas 1‐4.
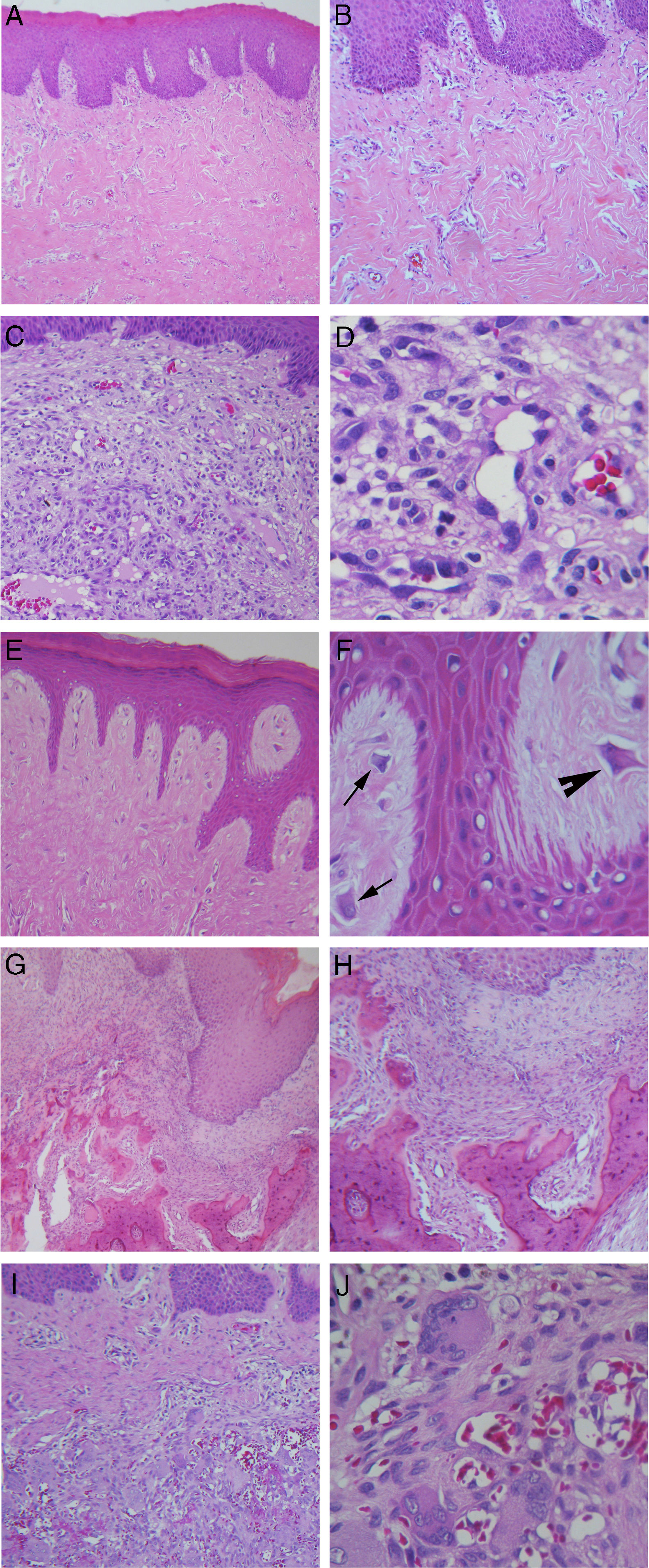
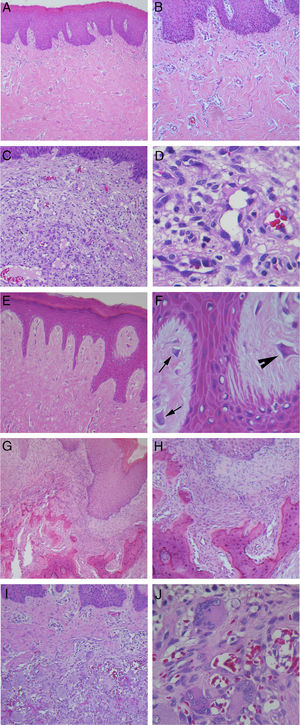
Coloração com hematoxilina e eosina. (A) Hiperplasia fibrosa inflamatória (40×); (B) Maior aumento do mesmo caso mostrando densos feixes de fibras colágenas (100×); (C) Granuloma piogênico oral (100 x); (D) Maior aumento do mesmo caso mostrando grande quantidade de células endoteliais e vasos sanguíneos neoformados (400×); (E) Fibroma de células gigantes, com projeções epiteliais finas e longas (100×); (F) Maior aumento do mesmo caso mostrando a presença de fibroblastos com morfologia estrelada (seta) e multinucleados (cabeça de seta) (400×); (G) Fibroma ossificante periférico, com produto mineralizado no tecido conjuntivo (40×); (H) Maior aumento do mesmo caso demonstrando formação de trabéculas ósseas irregulares (100×); (I) Lesões de células gigantes periféricas (100×); (J) Maior aumento do mesmo caso com grande quantidade de células gigantes multinucleadas associadas a áreas hemorrágicas (400×).
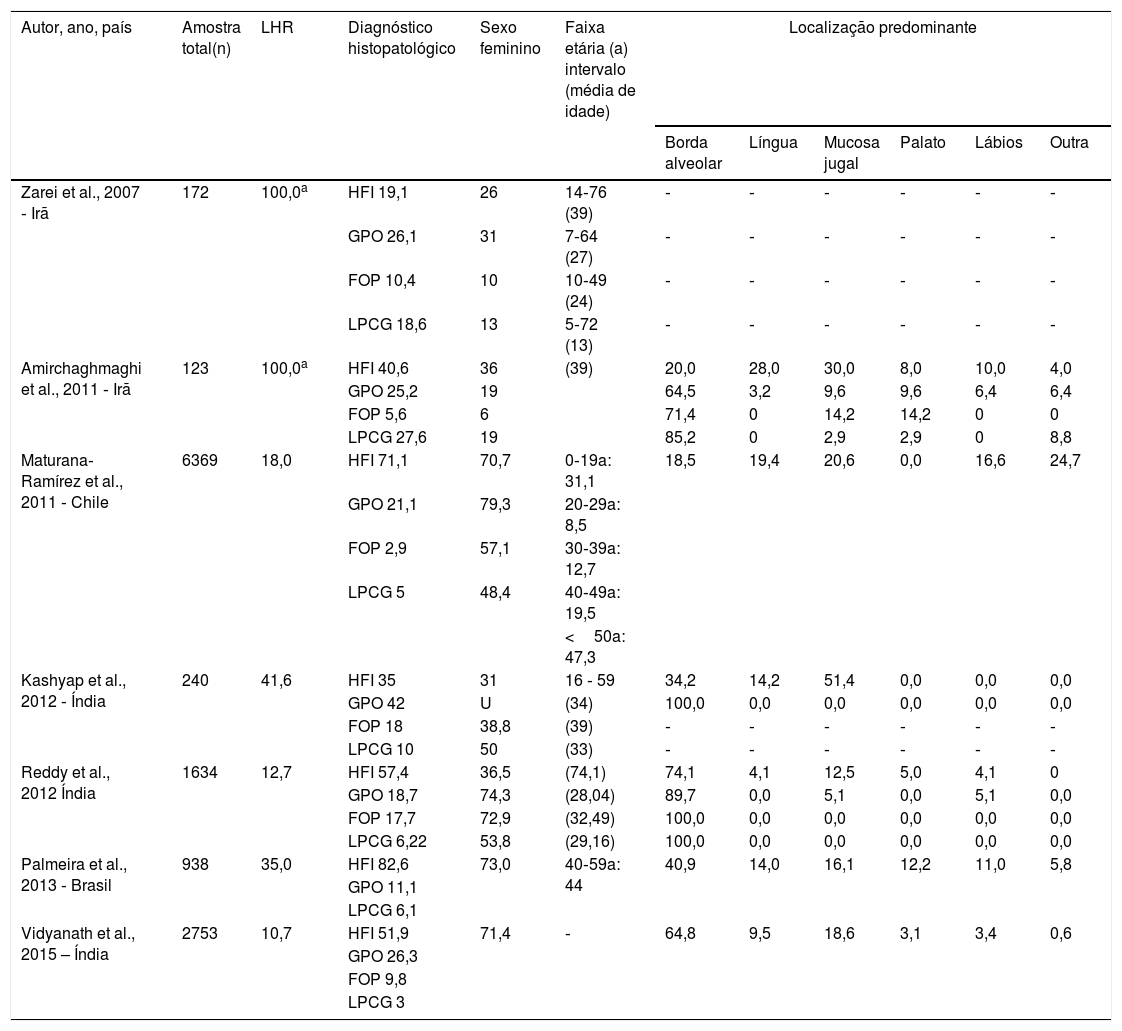
A revisão da literatura encontrou 369 citações em bases de dados eletrônicas. Posteriormente, os critérios de inclusão e exclusão foram aplicados durante uma avaliação abrangente de títulos e resumos, o que possibilitou a seleção de 47 estudos para leitura de texto completo. Por último, sete estudos de longo prazo que utilizaram uma metodologia similar à do presente estudo foram resumidos na tabela 5, inclusive 12.229 lesões orais revisadas a partir de laudos de biópsia com 2.285 LHR, com uma prevalência geral de 18,6%. Esses estudos foram conduzidos em vários continentes: Irã (123 casos),4,5 Chile (1.146 casos),6 Índia (773 casos)7–9 e Brasil (243 casos).10 Quatro artigos mostraram que as LHR acometeram mais pacientes mulheres na terceira década de vida. Em relação à localização, a crista alveolar foi o local mais frequente, seguido pela mucosa jugal e língua; menos frequentemente citados foram o palato e o lábio (tabela 5). Até o momento, nenhuma revisão sistemática ou metanálise sobre esse tema foi identificada.
Resultados em longo prazo das lesões hiperplásicas reativas registradas na literatura. Os dados são percentuais (%), salvo indicação em contrário
| Autor, ano, país | Amostra total(n) | LHR | Diagnóstico histopatológico | Sexo feminino | Faixa etária (a) intervalo (média de idade) | Localização predominante | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Borda alveolar | Língua | Mucosa jugal | Palato | Lábios | Outra | ||||||
| Zarei et al., 2007 ‐ Irã | 172 | 100,0a | HFI 19,1 | 26 | 14‐76 (39) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| GPO 26,1 | 31 | 7‐64 (27) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | |||
| FOP 10,4 | 10 | 10‐49 (24) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | |||
| LPCG 18,6 | 13 | 5‐72 (13) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | |||
| Amirchaghmaghi et al., 2011 ‐ Irã | 123 | 100,0a | HFI 40,6 | 36 | (39) | 20,0 | 28,0 | 30,0 | 8,0 | 10,0 | 4,0 |
| GPO 25,2 | 19 | 64,5 | 3,2 | 9,6 | 9,6 | 6,4 | 6,4 | ||||
| FOP 5,6 | 6 | 71,4 | 0 | 14,2 | 14,2 | 0 | 0 | ||||
| LPCG 27,6 | 19 | 85,2 | 0 | 2,9 | 2,9 | 0 | 8,8 | ||||
| Maturana‐Ramírez et al., 2011 ‐ Chile | 6369 | 18,0 | HFI 71,1 | 70,7 | 0‐19a: 31,1 | 18,5 | 19,4 | 20,6 | 0,0 | 16,6 | 24,7 |
| GPO 21,1 | 79,3 | 20‐29a: 8,5 | |||||||||
| FOP 2,9 | 57,1 | 30‐39a: 12,7 | |||||||||
| LPCG 5 | 48,4 | 40‐49a: 19,5 | |||||||||
| <50a: 47,3 | |||||||||||
| Kashyap et al., 2012 ‐ Índia | 240 | 41,6 | HFI 35 | 31 | 16 ‐ 59 | 34,2 | 14,2 | 51,4 | 0,0 | 0,0 | 0,0 |
| GPO 42 | U | (34) | 100,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | |||
| FOP 18 | 38,8 | (39) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | |||
| LPCG 10 | 50 | (33) | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | |||
| Reddy et al., 2012 Índia | 1634 | 12,7 | HFI 57,4 | 36,5 | (74,1) | 74,1 | 4,1 | 12,5 | 5,0 | 4,1 | 0 |
| GPO 18,7 | 74,3 | (28,04) | 89,7 | 0,0 | 5,1 | 0,0 | 5,1 | 0,0 | |||
| FOP 17,7 | 72,9 | (32,49) | 100,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | |||
| LPCG 6,22 | 53,8 | (29,16) | 100,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | |||
| Palmeira et al., 2013 ‐ Brasil | 938 | 35,0 | HFI 82,6 | 73,0 | 40‐59a: 44 | 40,9 | 14,0 | 16,1 | 12,2 | 11,0 | 5,8 |
| GPO 11,1 | |||||||||||
| LPCG 6,1 | |||||||||||
| Vidyanath et al., 2015 – Índia | 2753 | 10,7 | HFI 51,9 | 71,4 | ‐ | 64,8 | 9,5 | 18,6 | 3,1 | 3,4 | 0,6 |
| GPO 26,3 | |||||||||||
| FOP 9,8 | |||||||||||
| LPCG 3 | |||||||||||
–, informação não relatada; a, anos; FCG, fibroma de células gigantes; FOP, fibroma ossificante periférico; GPO, granuloma piogênico oral; HFI, hiperplasia fibrosa inflamatória; LPCG, lesão periférica de células gigantes; U, informações pouco claras relatadas.
Nossos achados mostram que as LHR apresentaram alta incidência entre as doenças bucais. Dos 2.400 laudos de biópsias e registros de pacientes pesquisados, 534 diziam respeito à LHR (22,25%). Esse número está dentro da variação encontrada na literatura, de 10,7%9 a 41,6%.7 A HFI foi a lesão mais frequentemente encontrada em nosso estudo (72% do total de LHR) e também foi a lesão mais comumente biopsiada da gengiva/crista alveolar, mucosa jugal, lábios e língua. Esses resultados estão mais próximos dos encontrados por Maturana‐Ramírez et al. (71,1%)6 e Palmeira et al., (82,6%).10 Entretanto, Zarei et al. (2007)4 e Kashyap et al. (2012)7 relataram que o GPO foi a lesão mais frequente e a HFI a segunda, com uma prevalência de 19,1% e 35,0%, respectivamente. A maior incidência de HFI foi observada durante a 5ª, 6ª e 7ª décadas de vida, em concordância com todos os estudos revisados, o que provavelmente está relacionado ao uso de prótese oral. Estudos anteriores atribuíram o desenvolvimento da HFI ao uso prolongado de uma prótese removível ou em más condições de uso, o que ocasiona dano constante aos tecidos bucais.11–13 Notavelmente, no presente estudo, mais de dois terços dos casos de HFI apresentaram uma prótese mal ajustada como fator etiológico.
O GPO foi a segunda lesão mais frequente (12%), igualmente para Palmeira et al. (11,1%),10 Reddy et al. (18,7%),8 Maturana‐Ramírez et al. (21,1%)6 e Vidyanath et al. (26,3%).9 Essa lesão representa um distúrbio da mucosa oral, que geralmente aparece como uma resposta inflamatória com características similares ao granuloma. Essa é a origem do nome, apesar de não representar histologicamente um granuloma verdadeiro.3 Consistentemente com outros estudos, o GPO pode estar relacionado a alterações hormonais, especificamente com os efeitos vasculares dos hormônios femininos. Dessa forma, uma maior incidência de GPO é esperada em mulheres, como o presente estudo mostrou, em conformidade com Maturana‐Ramirez et al. (2011),6 Reddy et al. (2012)8 e Palmeira et al. (2013).10 Além disso, este estudo revelou que 11,11% dos casos de GPO estavam relacionados a gestantes, o que reforça essa teoria. A localização predominante do GPO foi a gengiva/borda alveolar, o que está em conformidade com os achados de Torrão et al. (1999),14 Bertoja et al. (2007),12 Amirchaghmaghi et al. (2011),5 Kashyap et al. (2012),7 Reddy et al. (2012),8 Palmeira et al. (2013)10 e Vidyanath et al. (2015).9 A cor em comum entre as lesões foi avermelhada (69,23%), o que poderia ser explicado pela constituição histológica típica de um tecido de granulação altamente vascularizado, cheio de vasos sanguíneos. Em relação à concordância entre os diagnósticos clínicos e histopatológicos, foi encontrada uma discordância de 31,7%, similar aos estudos de Tatli et al. (2013)15 e Vaz et al. (2011).16
O FCG ficou em terceiro lugar entre as LHR (7%), composto principalmente por lesões menores do que 0,5cm. Os estudos agrupados na tabela 5, que relataram a prevalência de LHR em um grande grupo de casos pesquisados, não citaram o FCG em seus resultados. Assim, para essa doença, estudos específicos precisaram ser avaliados a fim de revisar suas características clínico‐patológicas. Isso pode estar ligado ao fato de que o FCG demonstrou uma menor taxa de concordância entre os diagnósticos clínicos e histopatológicos em nosso estudo, o que pode indicar que o FCG é uma lesão menos conhecida entre os profissionais de saúde. Clinicamente, o FCG pode assemelhar‐se a outros crescimentos fibrosos, como o fibroma de irritação, e pode frequentemente ser diagnosticado como HFI,17 que é a LHR mais comum e provavelmente a mais lembrada pelos clínicos. Uma maior incidência também foi encontrada entre as mulheres na 4ª década de vida, o que corrobora os achados de Weathers e Callihan (1974)18 e Sabarinath et al. (2012)19 Em nosso estudo o FCG diferenciou‐se das demais LHR, já que a língua foi o local mais acometido. Um consenso sobre a etiologia e patogênese do FGC permanece incerto. A hipótese mais aceita para sua origem é uma resposta ao trauma ou à inflamação crônica recorrente,20 caracterizada por alterações funcionais nas células fibroblásticas, enquanto outras células assumiriam a síntese de colágeno.21 Em contraste, alguns autores definiram o FCG como uma neoplasia benigna não associada a fatores traumáticos.22 Neste estudo, todos os casos de FGC foram relacionados ao trauma crônico, envolveram principalmente próteses mal ajustadas como fator etiológico, e quatro deles estavam relacionados à lesão crônica sem registro de motivo específico.
O FOP é responsável por 5,2% de todas as LHR deste estudo, relatadas principalmente em mulheres na 3ª e 4ª décadas de vida. As frequências descritas em outros estudos variaram de 2,9% no Chile6 a 18,0% na Índia,7 onde a predominância também foi em mulheres na 3ª e 4ª décadas de vida. O FOP tem sido relatado como um crescimento gengival anormal solitário comum, com origem na gengiva, periósteo ou ligamento periodontal.23,24 Neste estudo, todas as lesões de FOP estavam restritas à gengiva e sulco alveolar, da mesma forma que no estudo de Reddy et al. (2012).8 No entanto, as lesões do tipo FOP já haviam sido encontradas no palato e mucosa jugal.5 Provavelmente, a proliferação tecidual excessiva da irritação gengival por má higiene oral como um fator precipitante.4 Em relação à concordância entre os diagnósticos clínicos e histopatológicos, encontrou‐se uma concordância moderada de 57%.
A LPCG constituiu o único grupo de lesões com maior incidência no sexo masculino, o que corroborou os estudos de Kfir & Hansen (1980),25 Zarei et al. (2007)4 e Amirchaghmaghi et al. (2011).5 Outros estudos relataram a ocorrência da LPCG igualmente distribuída por gênero,7,8 embora já tenha sido relatada maior incidência entre mulheres.12,26 No presente estudo, a 1ª e a 2ª décadas de vida tiveram a maior incidência de casos, demonstraram uma tendência de a lesão ser encontrada em pessoas mais jovens; o que não foi apoiado pelos estudos revisados. Em nossos registros, a LPCG foi caracterizada por múltiplos e pequenos nódulos púrpuras avermelhados (mais da metade dos casos) a azulados localizados ao longo somente dos locais gengivais. Essa pigmentação tipicamente roxo‐azulada é devida à presença de hemossiderina, que pode ser observada pela abundante hemorragia por toda a lesão. Em relação à concordância entre os diagnósticos clínicos e histopatológicos, encontrou‐se uma concordância de 47,36% semelhante ao estudo de Seife et al. (2010).27
A maior parte das LHR resultou de uma resposta acentuada à irritação e ao trauma local. Diversos fatores irritantes locais foram descritos; o presente estudo identificou próteses mal adaptadas, lesão crônica, raiz remanescente, extração dentária, placa bacteriana, implantes e bráquetes ortodônticos como potenciais fatores etiológicos. Em geral, as LHR foram em sua maioria nodulares, com tamanho que variou de 0,5cm a 2cm, assemelharam‐se à cor da mucosa ou ligeiramente roxo‐avermelhadas, afetaram principalmente mulheres caucasianas em sua a 5ª e 6ª décadas de vida. Embora o maior número de biópsias de mucosas em mulheres possa estar relacionado a um viés cultural,11 esses achados também foram encontrados em outros países, como a Índia8,9 e o Chile.6
ConclusãoAs LHR apresentaram uma alta incidência entre as doenças orais. A compreensão de suas características clínicas ajuda a fornecer um diagnóstico definitivo claro, bem como encontrar os fatores etiológicos relacionados ao seu desenvolvimento, o que contribui para oferecer tratamento adequado e prognóstico positivo sem recorrência. A concordância entre os diagnósticos clínicos e histopatológicos foi alta para as lesões HFI, moderada para GPO, FOP, LPCG e muito baixa para FCG, o que pode mostrar que os profissionais de saúde não estavam familiarizados com as LHR em geral e, especialmente, com o FCG.
FinanciamentoEste estudo foi financiado em parte pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil – (CAPES). Código de financiamento 001.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Dutra KL, Longo L, Grando LJ, Rivero ER. Incidence of reactive hyperplastic lesions in the oral cavity: a 10 year retrospective study in Santa Catarina, Brazil. Braz J Otorhinolaryngol. 2019;85:399–407.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.