The types of allergic rhinitis are roughly classified based on the causative antigens, disease types, predilection time, and symptom severity.
ObjectiveTo examine the clinical typing and individualized treatment approach for allergic rhinitis and to determine the optimal treatment method for this disease using various drug combination therapies.
MethodsA total of 108 participants with allergic rhinitis were divided into three groups based on symptoms. Subsequently, each group was further categorized into four subgroups based on the medications received. The efficacy of the treatments was evaluated using the visual analog scale VAS scores of the total and individual nasal symptoms, decline index of the symptom score, histamine and leukotriene levels, and mRNA and protein expression levels of histamine 1 and cysteinyl leukotriene 1 receptors.
ResultsLoratadine+mometasone furoate and loratadine+mometasone furoate+montelukast significantly improved the sneezing symptom and reduced the histamine levels compared with the other combination therapies (p<0.05). Meanwhile, montelukast+mometasone furoate and montelukast+mometasone furoate+loratadine considerably improved the nasal obstruction symptom and decreased the leukotriene D4 levels compared with the other combination therapies (p<0.05).
ConclusionClinical symptom evaluation combined with experimental detection of histamine and leukotriene levels can be an objective and accurate method to clinically classify the allergic rhinitis types. Furthermore, individualized treatment based on allergic rhinitis classification can result in a good treatment efficacy.
A rinite alérgica é basicamente classificada de acordo com os antígenos causadores, tipos de doença, peridiocidade e gravidade dos sintomas.
ObjetivoAvaliar os tipos clínicos e a abordagem terapêutica individualizada para cada tipo de rinite alérgica e determinar o método de tratamento ideal utilizando várias terapias de combinação de fármacos.
MétodoUm total de 108 participantes com rinite alérgica foram divididos em três grupos com base nos sintomas. Posteriormente, cada grupo foi subsequentemente categorizado em quatro subgrupos com base nos medicamentos recebidos. A eficácia dos tratamentos foi avaliada utilizando os escores da escala visual analógica EVA dos sintomas nasais totais e individualmente, índice de declínio do escore de sintomas, níveis de histamina e leucotrienos e níveis de expressão de mRNA e proteína dos receptores de histamina 1 e cisteinil‐leucotrieno 1.
ResultadosAs associações entre loratadina+furoato de mometasona, assim como a de loratadina+furoato de mometasona+montelucaste melhoraram significativamente o sintoma de espirros e reduziram os níveis de histamina em comparação às outras terapias combinadas (p<0,05). Por outro lado, a associação montelucaste+furoato de mometasona, assim como a associação montelucaste+furoato de mometasone+loratadina melhoraram consideravelmente o sintoma de obstrução nasal e diminuíram os níveis de leucotrieno D4 em comparação com as outras combinações (p<0,05).
ConclusãoA avaliação clínica dos sintomas combinada com a detecção experimental dos níveis de histamina e leucotrieno pode ser um método objetivo e preciso para classificar clinicamente os tipos de rinite alérgica. Além disso, o tratamento individualizado baseado na classificação da rinite alérgica pode resultar no aumento da eficácia do tratamento.
O desenvolvimento da rinite alérgica (RA) envolve principalmente células T‐helper de um padrão tipo 2 de hiperfunção das células da mucosa,1,2 o que resulta em inflamação crônica da mucosa nasal causada pela liberação de vários mediadores inflamatórios, principalmente histamina e leucotrieno.3 Pesquisas recentes demonstraram que a liberação de leucotrieno ocorre nas fases inicial e tardia das respostas de hipersensibilidade.4 Esse achado levou a mudanças no conceito de tratamento da RA, verificou‐se que os efeitos do tratamento com antileucotrieno eram comparáveis àqueles dos anti‐histamínicos e corticosteroides intranasais. Em geral, o manejo efetivo da RA consiste em evitar o alérgeno, aumentar a conscientização e a educação do paciente, farmacoterapia e imunoterapia específica para alérgenos, entre outras.5 Atualmente, os medicamentos usados para controlar clinicamente a RA são classificados em três tipos principais: anti‐histamínicos de segunda geração, antileucotrienos e corticosteroides intranasais. Várias investigações e metanálises analisaram o efeito de diferentes combinações com esses três medicamentos na RA e seus resultados mostraram que as combinações de fármacos foram mais eficazes do que a terapia com medicamento único.6–10 Entretanto, o desenvolvimento e a avaliação desses métodos de tratamento ainda são baseados nos relatos subjetivos dos participantes sobre os sintomas nasais e a qualidade de vida. Além disso, poucos índices laboratoriais objetivos foram usados em combinação com as avaliações subjetivas dos participantes das várias pesquisas. No presente estudo, objetivamos classificar os pacientes com RA em vários grupos, depende dos sintomas nasais primários e da detecção quantitativa dos níveis de mediadores inflamatórios (histamina e leucotrieno D4) liberados durante as reações de hipersensibilidade no sangue periférico e nas secreções nasais para apresentar de maneira objetiva as respostas práticas in vivo e in vitro de participantes individuais. Além disso, foi nossa intenção projetar vários métodos de tratamento com combinações de fármacos e determinar sua eficácia através da comparação entre a melhoria dos sintomas nasais pré e pós‐terapia e sua relação com as alterações encontradas nos níveis de histamina e leucotrieno D4, bem como níveis de mRNA e expressão proteica dos receptores de histamina 1 (H1) e cisteinil‐leucotrieno‐1 (CysLT1). Os resultados deste estudo servirão de base para a investigação de novas abordagens para o tratamento individualizado da RA.
Material e métodoPopulação do estudo e parâmetros clínicosOs pacientes com RA foram recrutados do ambulatório do Hospital Zhujiang, Southern Medical University (Guangzhou, China) de janeiro de 2014 a junho de 2015. Os participantes foram selecionados através da história clínica e avaliações de sintomas alérgicos com base nos critérios de inclusão e exclusão, padronizados de acordo com uma diretriz relatada anteriormente.11
Os critérios de inclusão foram os seguintes: 1) Idade de 18‐65 anos, com história de RA havia pelo menos um ano; 2) Pelo menos três dos quatro principais sintomas (espirros, secreção nasal clara, obstrução nasal e prurido nasal), esses sintomas deveriam ter um tempo cumulativo > 0,5‐1h de duração por dia para os participantes com RA perene (RAP); 3) Edema e obstrução da mucosa nasal (ou até mesmo das pálpebras); e 4) Reação positiva a pelo menos um dos testes alérgicos de punctura cutânea, com um escore no índice de teste de alergia cutânea que não superior a ++ ou +++.
Os critérios de exclusão foram os seguintes: 1) Existência de infecção do trato respiratório e rinossinusite suborbital infecciosa; 2) Presença de asma alérgica, com ataque asmático nos últimos 5 anos; 3) Existência de rinite não alérgica (a condição na qual o alérgeno causador não foi confirmado, por exemplo, rinite vasomotora); 4) Presença de desvio grave do septo nasal ou pólipos nasais; 5) uso de anti‐histamínico (por exemplo, loratadina) ou descontinuação de corticosteroide num período < 4 semanas; 6) descontinuação de astemizol havia < 6 semanas e descontinuação de outros medicamentos anti‐histamínicos havia menos de uma semana; 7) tempo de descontinuação < 1 semana para anti‐histamínicos administrados via nasal, sprays nasais de glicocorticoides ou medicamentos administrados através de gotas nasais; e 8) Uso de antibióticos macrolídeos e/ou agentes antifúngicos imidazólicos.
O protocolo do estudo foi aprovado pelo comitê de ética do Zhujiang Hospital, Southern Medical University, e todos os participantes forneceram consentimento informado por escrito. Além disso, este estudo foi conduzido de acordo com os regulamentos do comitê de ética em pesquisa clínica e da World Medical Association e os princípios da Declaração de Helsinque (Registro Clínico número: 2013‐EBYHK‐004).
Características da população estudada e agrupamento de tratamentoForam incluídos neste estudo 108 participantes (62 homens e 46 mulheres) com média de 37 anos. Trinta e seis participantes (20 homens e 16 mulheres) com uma média de 36 anos foram submetidos a avaliação física no centro de exame do Hospital Zhujiang, os quais foi então incluídos como controles saudáveis.
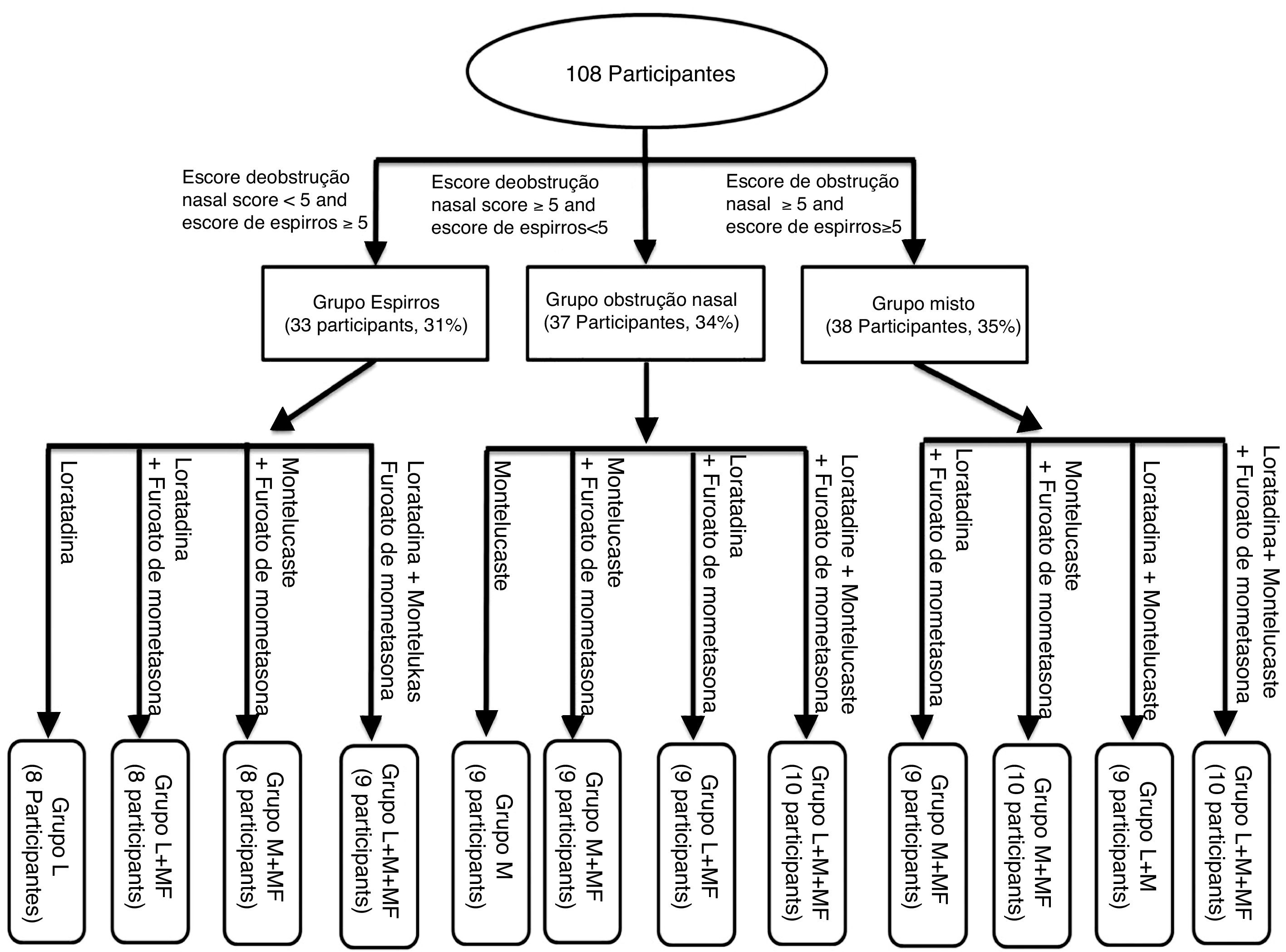
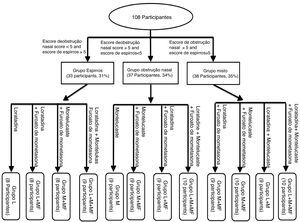
Os escores de espirros e obstrução nasal de todos os participantes foram obtidos, os quais foram usados para o agrupamento do tratamento, usaram‐se ‐se os escores da escala visual analógica (EVA) que são baseados na gravidade dos sintomas (tabela 1). Como mostrado na figura 1, todos os participantes foram classificados em três grupos, com base no escore da EVA dos sintomas, combinado com os níveis de histamina e leucotrieno D4. Os 108 participantes foram divididos em grupo de espirros (33 participantes, 31%), de obstrução nasal (37 participantes, 34%) e misto (38 participantes, 35%). Posteriormente, os três grupos de sintomas foram subdivididos em quatro subgrupos, baseados nos medicamentos que receberam.
Escores da EVA dos sintomas nasal individualizados, baseados na gravidade dos sintomas
| Sintoma | Domínio | Escala |
|---|---|---|
| Espirrosa | Sem sintoma | 0 (sem sintoma) |
| 3∼5 | 1–2 (leve) | |
| 6∼10 | 3–6 (moderada) | |
| ≥ 11 | 7–10 (grave) | |
| Obstrução nasal | Sem sintoma | 0 (sem sintoma) |
| Consciente, mas sem tornar‐se incômodo | 1–2 (leve) | |
| Intermitente ou alternado | 3–6 (moderada) | |
| Quase 100% respiração oral | 7–10 (grave) |
Neste estudo, os pacientes com RA usaram loratadina, montelucaste e furoato de mometasona. Os participantes receberam aleatoriamente 10mg de loratadina e montelucaste (uma dose por dia) e 50 μg de furoato de mometasona (uma dose do spray em cada narina, uma vez ao dia).
Determinação dos níveis de histamina e leucotrieno D4O sangue venoso e as secreções nasais dos participantes com RA e dos controles saudáveis foram obtidos para determinar os níveis de histamina e leucotrieno D4, usou‐se ensaio imunoenzimático (ELISA) tipo duplo sanduíche. O kit ELISA foi adquirido da Shanghai BlueGene Biotech Co., Ltd. (Xangai, China) e os ensaios foram feitos de acordo com as instruções do fabricante cp um sistema Synergy HT Multimode Reader (BioTek, Winooski, VT, EUA).
Expressão gênica e proteica de receptores de H1 e CysLT1As amostras da mucosa das conchas nasais dos participantes com RA e daqueles que foram submetidos a cirurgia do septo nasal, que foram incluídos como controles saudáveis, foram examinadas para caracterizar as expressões gênica e proteica dos receptores de H1 e CysLT1. Foi feita uma reação de polimerase em cadeia fluorescente quantitativa (QF‐PCR) em tempo real para analisar a expressão de mRNA dos receptores de H1 e CysLT1. Todos os oligonucleotídeos purificados através de cromatografia líquida de alta performance foram quimicamente sintetizados pela Invitrogen Biotechnology Co. Ltd. (Xangai, China). Os primers F1 (CCTGGATACCGCAGCTAGGA) e R1 (GCGGCGCAATACGAATGCCCC) foram usados para a amplificação de 18SrRNA (GenBank ID: NR 003286) como referência interna. Enquanto isso, os primers F2 (TACGGAGTGAGCGGAAGC) e R2 (GCAGGTAGAGGATGTTCATAGG) foram usados para a amplificação de HRH1 (GenBank ID: NM 000861.3). Além disso, os primers F3 (GCCATGAGCTTTTTCCGGTG) e R3 (TGATTGTCTTGTGGGGGCTC) foram usados para a amplificação de CysLT1 (GenBank ID: AF 119711.1). O sistema de reação de transcrição reversa para a síntese de cDNA foi preparado com base nas instruções do fabricante para o uso do GoScript® Reverse Transcription System. A reação de polimerase em cadeia quantitativa (qPCR) foi feita com o sistema ABI7500 qPCR Thermocycle Instrument em tempo real (ABI, Vernon, CA, EUA), com o cDNA como template do FastStart Universal SYBR Green Master (Rox) (Roche, Indianapolis, IN, EUA) e β‐actina como controle, de acordo com as instruções do fabricante. Os valores médios do limiar do ciclo (CT, do inglês cycle threshold) para as três reações de PCR foram determinados e calculados como fold change sobre as amostras de controle, usou‐se o método ΔCT comparativo para calcular as alterações no nível de expressão gênica.
A expressão proteica dos receptores de H1 e CysLT1 foi avaliada através de ensaio de Western blotting. Além disso, uma análise semiquantitativa de quimiluminescência (QL) foi feita com o software Image Lab após uma varredura em escala de cinza do filme de raios‐X. A QL média para três casos foi determinada e calculada como a QL relativa sobre as amostras de controle para calcular as mudanças no nível de expressão da proteína. A expressão proteica dos receptores de H1 e CysLT1 foi quantificada através de comparações com β‐actina e γ‐tubulina, respectivamente.
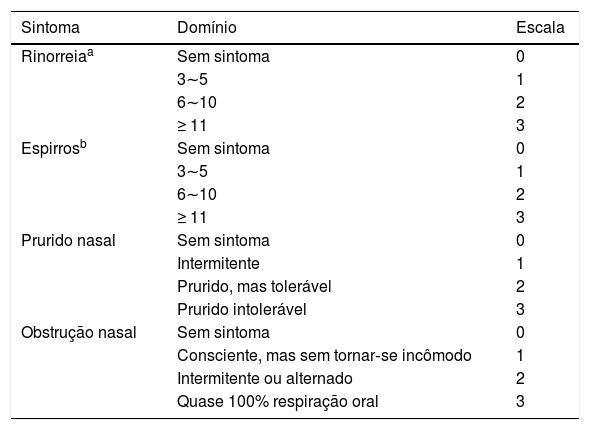
Avaliação do tratamento clínicoO escore total de sintomas nasais (TNSS, do inglês Total Nasal Symptom Score) foi calculado como a soma dos escores dos quatro sintomas nasais (rinorreia, prurido nasal, obstrução nasal e espirros), que foram avaliados através de uma escala Likert de quatro pontos com base na gravidade dos sintomas (tabela 2), de acordo com o protocolo de um estudo anterior.11 Os escores dos sintomas nasais individuais foram registrados nos ambulatórios e por contato telefônico com os participantes, feitos no dia da consulta e 2, 4 e 8 semanas após a terapia medicamentosa. O índice de redução do escore de sintomas nasais totais (TNSSRI), o índice de redução (IR) do escore de espirros e o IR do escore de obstrução nasal foram usados para avaliar a eficácia do tratamento clínico, onde IR = (escore pré‐tratamento ‐ escore pós‐tratamento)/escore pré‐tratamento. Além disso, os níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais, juntamente com as alterações nos níveis de expressão de mRNA e proteína dos receptores de H1 e CysLT1 nas amostras da mucosa das conchas nasais, foram usados para avaliar o efeito clínico curativo.
Escala de avaliação baseada na gravidade dos sintomas
| Sintoma | Domínio | Escala |
|---|---|---|
| Rinorreiaa | Sem sintoma | 0 |
| 3∼5 | 1 | |
| 6∼10 | 2 | |
| ≥ 11 | 3 | |
| Espirrosb | Sem sintoma | 0 |
| 3∼5 | 1 | |
| 6∼10 | 2 | |
| ≥ 11 | 3 | |
| Prurido nasal | Sem sintoma | 0 |
| Intermitente | 1 | |
| Prurido, mas tolerável | 2 | |
| Prurido intolerável | 3 | |
| Obstrução nasal | Sem sintoma | 0 |
| Consciente, mas sem tornar‐se incômodo | 1 | |
| Intermitente ou alternado | 2 | |
| Quase 100% respiração oral | 3 |
As correlações entre o escore de sintomas nasais isolados (escores de espirros e obstrução nasal) e os níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais foram avaliadas pelo teste de correlação de Pearson. Um teste t para amostras independentes foi feito para determinar o IR do escore de sintomas nasais isoladamente e os níveis de histamina e leucotrieno D4 antes e após o tratamento e avaliar a validade dos efeitos pré e pós‐medicação para cada grupo. Além disso, um teste t de amostras pareadas foi feito para calcular o TNSSRI dos participantes com RA após 2, 4 e 8 semanas de tratamento. Um valor de p < 0,05 foi considerado estatisticamente significante. Todos os dados foram apresentados como Ā ± S, onde Ā e S referem‐se ao valor médio e desvio‐padrão da média, respectivamente. Todas as análises estatísticas foram feitas com o software SPSS versão 19.0 (IBM Co., Armonk, NY, EUA).
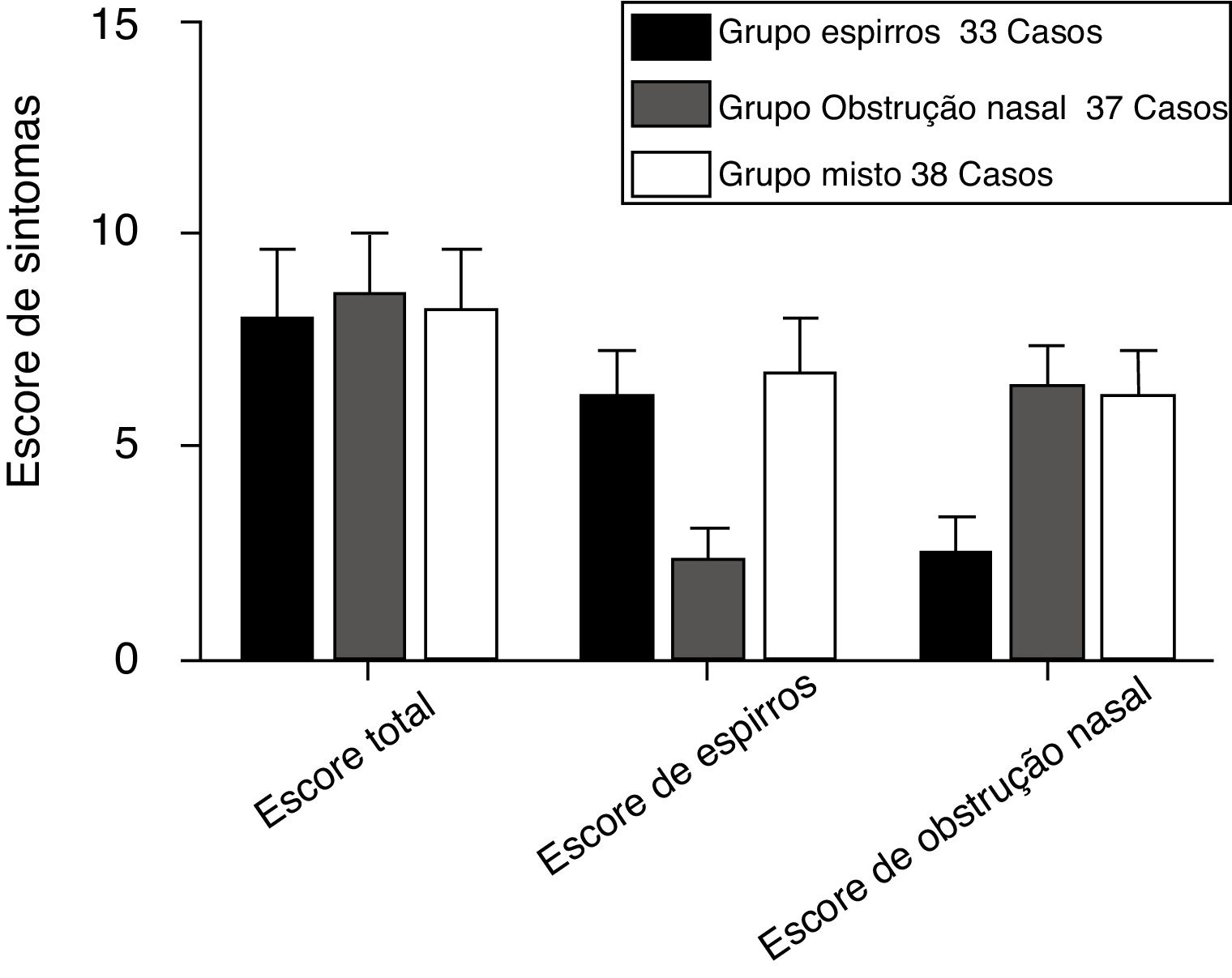
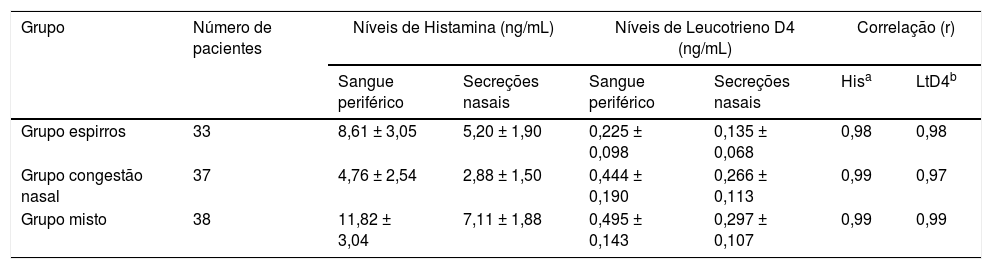
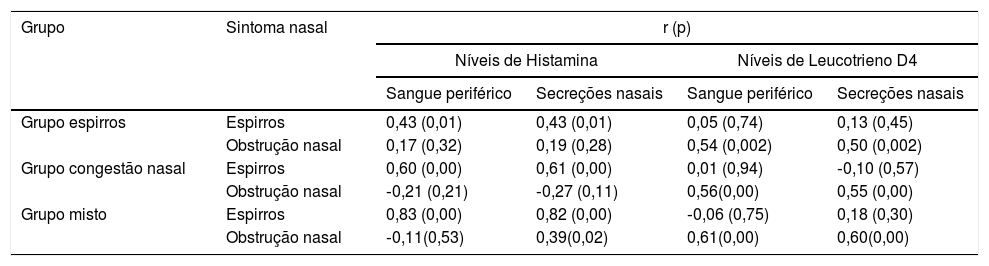
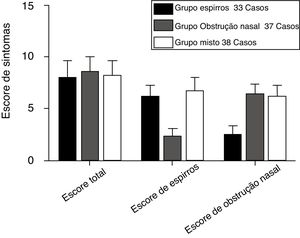
ResultadosCaracterísticas clínicas de participantes com RA segundo os três grupos de sintomas antes do tratamentoA figura 2 apresenta o estado clínico da RA dos participantes dos grupos espirros (n = 33), obstrução nasal (n = 37) e misto (n = 38) antes do tratamento, de acordo com os escores TNSS, espirros e obstrução nasal. Os parâmetros do TNSS dos três grupos de sintomas não foram estatisticamente significantes (p > 0,05). Os grupos espirros e misto apresentaram escores de espirros significantemente mais elevados do que o grupo com obstrução nasal (p < 0,05). O grupo com obstrução nasal e o grupo o misto tiveram escores de obstrução nasal significantemente mais elevados do que o grupo espirros (p < 0,05). A tabela 3 apresenta os níveis médios de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais dos participantes com RA dos três grupos. O TNSS e os níveis de histamina e leucotrieno D4 dos três grupos de sintomas mostraram correlações acentuadamente positivas (p < 0,001). A tabela 4 apresenta as correlações entre os escores de sintomas nasais isoladamente e os níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais. Uma relação positiva foi observada entre os escores da EVA de espirros e os níveis de histamina no sangue periférico e nas secreções nasais dos participantes com RA dos grupos espirros, obstrução nasal e grupo misto (r = 0,43/0,43, 0,60/0,61 e 0,83/0,82, respectivamente, p < 0,05). De maneira similar, correlações altamente positivas também foram encontradas entre o escore da EVA de obstrução nasal e os níveis de leucotrieno D4 dos grupos espirros, obstrução nasal e misto (r = 0,54/0,50, 0,56/0,55 e 0,61/0,60, respectivamente; p < 0,05).
Níveis de histamina e leucotrieno D4 no sangue periférico e secreções nasais de participantes com RA do grupo espirros (n = 33), grupo nasal (n = 37) e grupo misto (n = 38) antes do tratamento e correlações do escore total de sintomas nasais e níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais
| Grupo | Número de pacientes | Níveis de Histamina (ng/mL) | Níveis de Leucotrieno D4 (ng/mL) | Correlação (r) | |||
|---|---|---|---|---|---|---|---|
| Sangue periférico | Secreções nasais | Sangue periférico | Secreções nasais | Hisa | LtD4b | ||
| Grupo espirros | 33 | 8,61 ± 3,05 | 5,20 ± 1,90 | 0,225 ± 0,098 | 0,135 ± 0,068 | 0,98 | 0,98 |
| Grupo congestão nasal | 37 | 4,76 ± 2,54 | 2,88 ± 1,50 | 0,444 ± 0,190 | 0,266 ± 0,113 | 0,99 | 0,97 |
| Grupo misto | 38 | 11,82 ± 3,04 | 7,11 ± 1,88 | 0,495 ± 0,143 | 0,297 ± 0,107 | 0,99 | 0,99 |
Correlações entre os escores de cada sintoma nasal isoladamente e os níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais
| Grupo | Sintoma nasal | r (p) | |||
|---|---|---|---|---|---|
| Níveis de Histamina | Níveis de Leucotrieno D4 | ||||
| Sangue periférico | Secreções nasais | Sangue periférico | Secreções nasais | ||
| Grupo espirros | Espirros | 0,43 (0,01) | 0,43 (0,01) | 0,05 (0,74) | 0,13 (0,45) |
| Obstrução nasal | 0,17 (0,32) | 0,19 (0,28) | 0,54 (0,002) | 0,50 (0,002) | |
| Grupo congestão nasal | Espirros | 0,60 (0,00) | 0,61 (0,00) | 0,01 (0,94) | ‐0,10 (0,57) |
| Obstrução nasal | ‐0,21 (0,21) | ‐0,27 (0,11) | 0,56(0,00) | 0,55 (0,00) | |
| Grupo misto | Espirros | 0,83 (0,00) | 0,82 (0,00) | ‐0,06 (0,75) | 0,18 (0,30) |
| Obstrução nasal | ‐0,11(0,53) | 0,39(0,02) | 0,61(0,00) | 0,60(0,00) | |
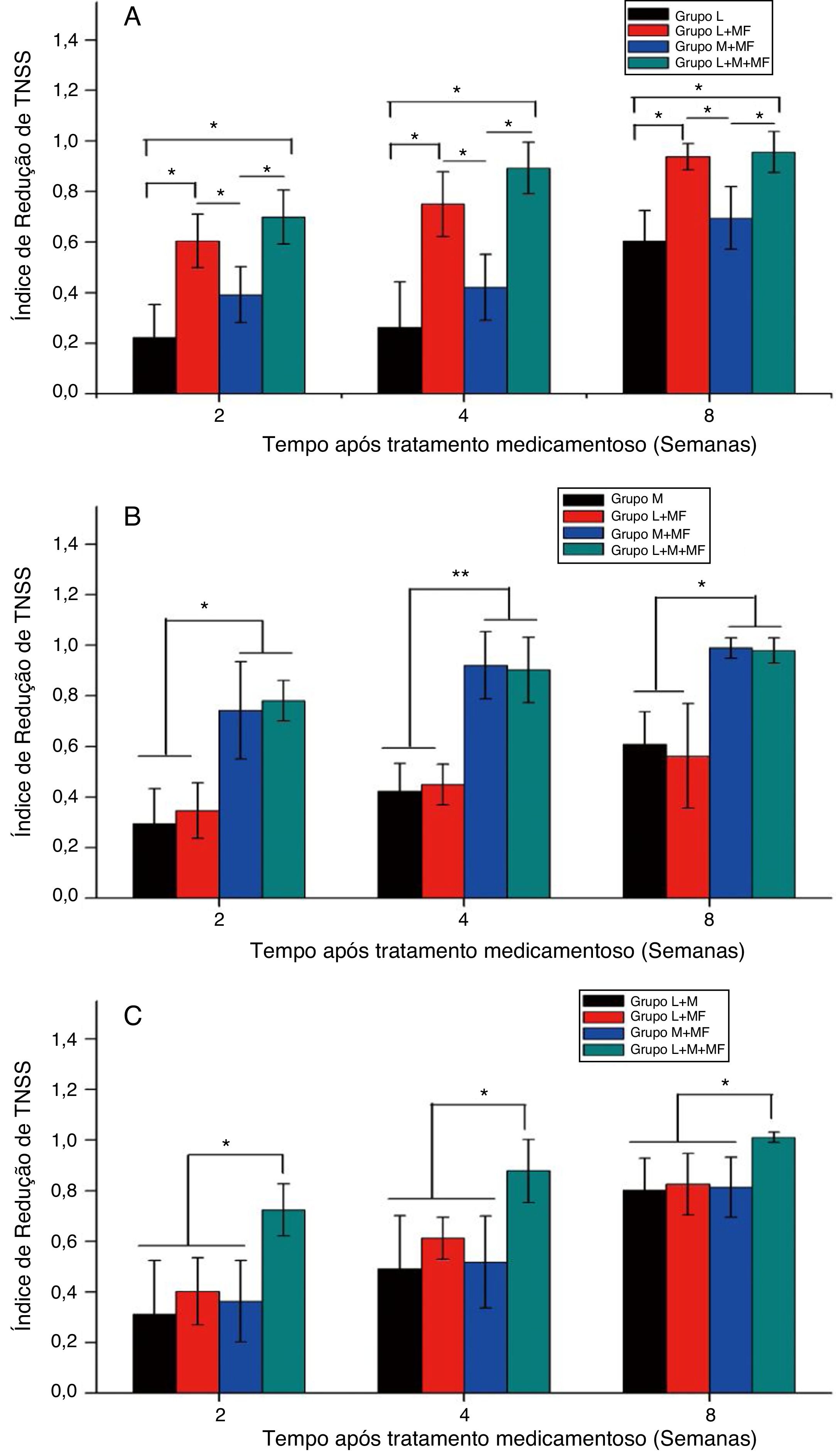
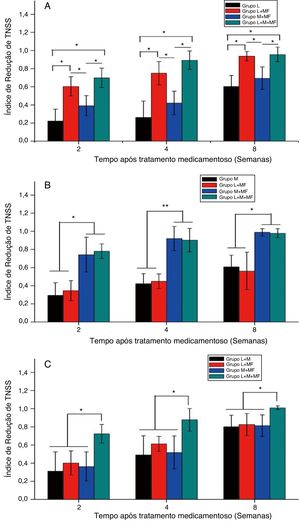
A figura 3 mostra o TNSSRI após o tratamento dos grupos espirros, obstrução nasal e misto. Para o grupo espirros (fig. 3A), as combinações loratadina + furoato de mometasona e loratadina + montelucaste + furoato de mometasona mostraram um TNSS significativamente menor do que a monoterapia com loratadina e a terapia combinada de montelucaste + furoato de mometasona após um período específico de administração da medicação (p < 0,05). Para o grupo com obstrução nasal (fig. 3B), ambas as terapias combinadas de montelucaste + furoato de mometasona e loratadina + montelucaste + furoato de mometasona resultaram em um TNSS significantemente menor do que a monoterapia com montelucaste e a terapia combinada de loratadina + furoato de mometasona (p < 0,05). Já para o grupo misto (fig. 3C), a terapia combinada de loratadina + montelucaste + furoato de mometasona resultou em um TNSS significantemente menor do que as terapias combinadas de loratadina + montelucaste, loratadina + furoato de mometasona e montelucaste + furoato de mometasona (p < 0,05).
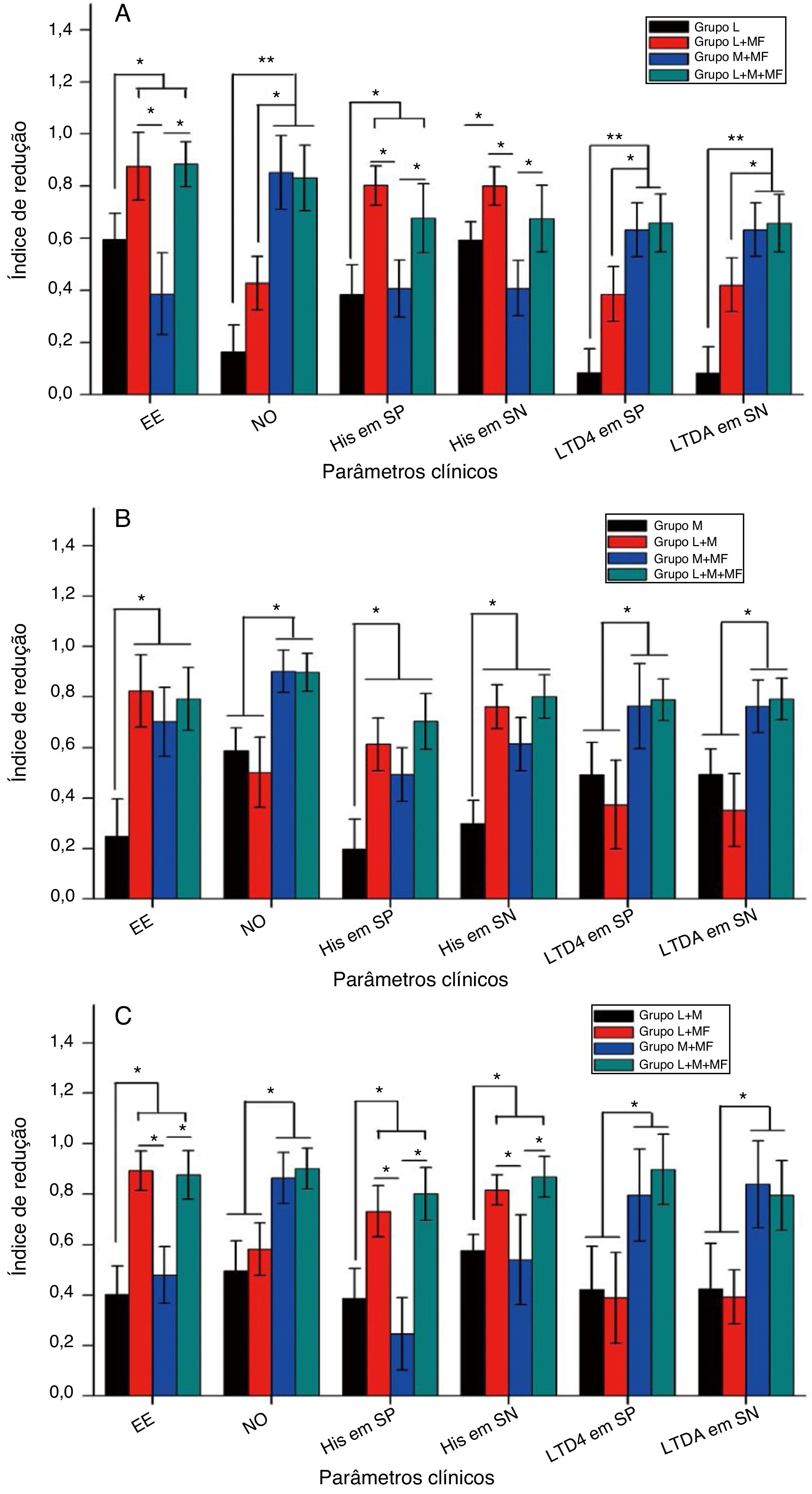
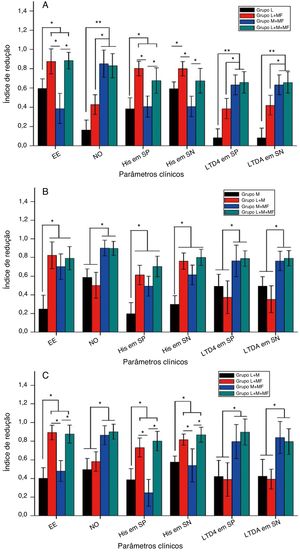
A figura 4 mostra o IR dos vários parâmetros clínicos, como os escores de espirros e obstrução nasal e os níveis de histamina e leucotrieno D4 no sangue periférico e nas secreções nasais, após o tratamento dos grupos espirros, obstrução nasal e misto. Resumidamente, para o grupo espirros (fig. 4A), as terapias combinadas de loratadina + furoato de mometasona e de loratadina + montelucaste + furoato de mometasona melhoraram significantemente o sintoma de espirro e reduziram os níveis de histamina no sangue periférico e nas secreções nasais em comparação com a monoterapia de loratadina (p < 0,05) e terapia combinada de montelucaste + furoato de mometasona (p < 0,05). Além disso, ambas as terapias combinadas, montelucaste + furoato de mometasona e loratadina + montelucaste + furoato de mometasona, melhoraram significantemente os sintomas de obstrução nasal e diminuíram os níveis de leucotrieno D4 no sangue periférico e nas secreções nasais em comparação com a monoterapia com loratadina (p < 0,01) e terapia combinada de loratadina + furoato de mometasona (p < 0,05). Para o grupo com obstrução nasal (fig. 4B), as terapias combinadas de loratadina + furoato de mometasona, de montelucaste + furoato de mometasona e de loratadina + montelucaste + furoato de mometasona melhoraram significantemente o sintoma espirros e reduziram os níveis de histamina no sangue periférico e nas secreções nasais em comparação à monoterapia com loratadina (p < 0,05). Além disso, ambas as terapias combinadas, montelucaste + furoato de mometasona, e loratadina + montelucaste + furoato de mometasona melhoraram significantemente o sintoma obstrução nasal e reduziram os níveis de leucotrieno D4 no sangue periférico e nas secreções nasais em comparação à monoterapia com montelucaste (p < 0,05) e terapia combinada de loratadina + furoato de mometasona (p < 0,05). Para o grupo misto (fig. 4C), ambas as terapias combinadas de loratadina + furoato de mometasona e de loratadina + montelucaste + furoato de mometasona melhoraram significantemente o sintoma espirros e reduziram os níveis de histamina no sangue periférico e secreções nasais em comparação às terapias combinadas de loratadina + montelucaste e de montelucaste + furoato de mometasona (p < 0,05). Além disso, as terapias combinadas de montelucaste + furoato de mometasona e de loratadina + montelucaste + furoato de mometasona melhoraram significantemente o sintoma obstrução nasal e diminuíram os níveis de leucotrieno D4 no sangue periférico e nas secreções nasais em comparação com as terapias combinadas de loratadina + montelucaste e de loratadina + furoato de mometasona (p < 0,05).
Índice de redução do escore de espirros, obstrução nasal e níveis de histamina e leucotrieno D4 no sangue periférico e secreções nasais de pacientes com RA para (A) grupo espirros, (B) grupo obstrução nasal e (C) grupo misto após 4 semanas de medicação. EE, escore de espirros; ON, escore de obstrução nasal; His em SP, nível de histamina no sangue periférico, His em SN, nível de histamina nas secreções nasais, LTD4 em SP, nível de leucotrieno D4 no sangue periférico; LTD4 em SN, significa nível de leucotrieno D4 nas secreções nasais.
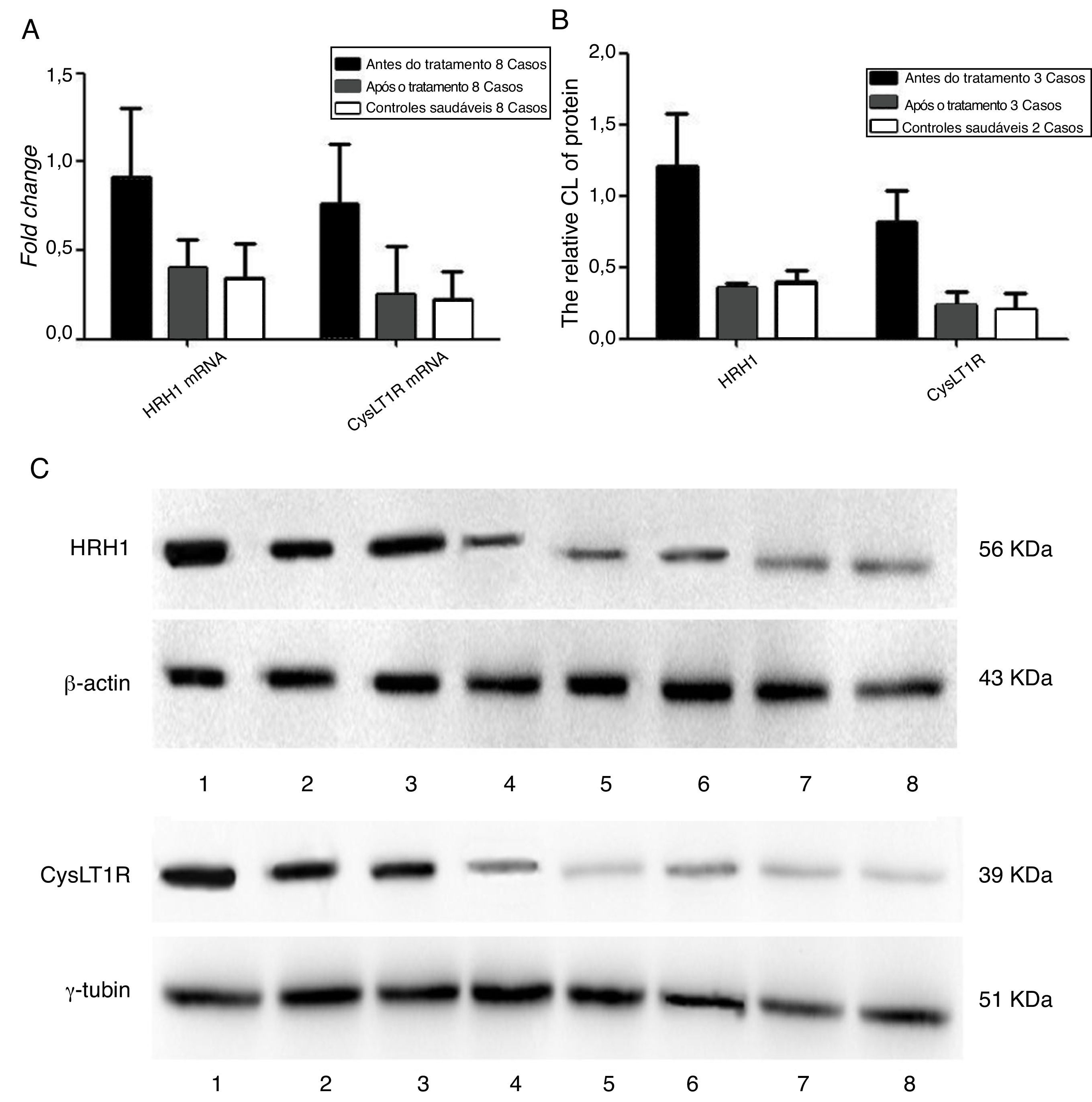
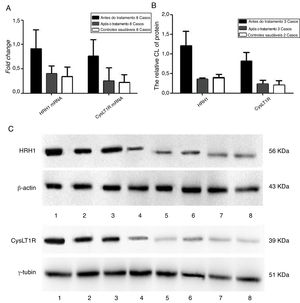
A figura 5 apresenta as mudanças nos níveis de expressão gênica e proteica antes e após a medicação. Os participantes com RA tiveram níveis significantemente mais baixos de expressão de RNAm e proteína dos receptores de H1 e CysLT1 após a terapia medicamentosa do que antes do tratamento (p < 0,05), embora não tenha havido diferença estatisticamente significante (p > 0,05) entre os participantes e controles saudáveis.
Detecção da expressão gênica e dos níveis de expressão proteica dos receptores de histamina H1 e leucotrieno CysLT1 de participantes antes e após a medicação. A, Quantificação dos níveis de mRNA dos receptores de histamina H1 e leucotrieno CysLT1 analisados por qPCR. B, Quantificação dos níveis de proteína dos receptores de histamina H1 e leucotrieno CysLT1 analisados por Western Blot. C, Imagens de Western Blot das proteínas de histamina H1, leucotrieno CysLT1 e controle. Antes do tratamento: faixas 1, 2, 3; pós‐tratamento: faixas 4, 5, 6 e controle saudável: Faixas 7, 8. β‐actina e γ‐tubulina foram respectivamente usados como controle para os receptores de histamina H1 e leucotrieno CysLT1 em qPCR e Western Blot.
O principal método de classificação da RA é baseado nos sintomas clínicos subjetivos relatados pelos pacientes com RA, como sintomas nasais e qualidade de vida. A RA é classicamente subdividida em RA sazonal (RAS), RAP e RA mista,12 embora novas classificações, isto é, RA persistente e intermitente, tenham sido propostas mais recentemente.13 Essas classificações desempenharam um papel significativo no desenvolvimento de abordagem de tratamento e prevenção de RA. No entanto, elas se focam principalmente em sintomas nasais subjetivos relatados por pacientes com RA, sem considerar as mudanças nos principais níveis de mediadores inflamatórios. Assim, a gravidade da doença e seu efeito na qualidade de vida dos pacientes com RA não são interpretados objetivamente. Uma caracterização clínica nova, mais precisa e objetiva para RA é necessária para o desenvolvimento de um tratamento efetivo, economicamente viável e individualizado. A RA foi reclassificada como leve/moderada‐severa e intermitente/persistente, depende da duração dos sintomas, com base nas diretrizes “Rinite alérgica e seu impacto na asma” (ARIA, do inglês Allergic Rhinitis and Its Impact on Asthma)5 e aquelas desenvolvidas na China (edição de 2009).14 Esse método de classificação leva em consideração o início dos sintomas e a gravidade da doença, o que reflete de perto os sintomas reais vivenciados pelos pacientes. Recentemente, a diretriz Practical Guideline for the Management of Allergic Rhinitis, desenvolvida no Japão15 reclassificou a RA em dois tipos, espirros e obstrução nasal, com base nos principais sintomas nasais experimentados por pacientes com RA, depende dos mediadores alérgicos, o que pode ser mais apropriado ao se determinar a escolha do tratamento clínico.
Em uma tentativa de fornecer uma nova opção de tratamento, economicamente viável e individualizada para pacientes com RA, primeiro combinamos a avaliação do principal sintoma nasal com a detecção experimental das alterações nos níveis de histamina e leucotrieno D4 e as expressões dos receptores de H1 e LT1 para explorar o papel da caracterização clínica em tipos e tratamento individualizado da RA. Neste estudo, dividimos todos os participantes em três grupos, com base nos resultados da avaliação dos sintomas nasais e nos níveis de histamina e leucotrieno D4.
Nossa classificação dependia da combinação da avaliação do sintoma nasal e detecção experimental dos níveis de histamina e leucotrieno D4 para refletir as alterações nos sintomas reais dos participantes, o que é uma abordagem mais razoável e eficaz na determinação do medicamento apropriado a ser usado do que os métodos anteriores empregados.
A histamina e o leucotrieno D4 são os principais mediadores inflamatórios envolvidos na patogênese da RA. Em um estudo de Vadas et al.16 que avaliou 41 participantes que experimentaram reações alérgicas agudas, que variaram de Grau 1 (menos grave) a Grau 3 (mais grave), a proporção de participantes com níveis elevados de histamina aumentou de acordo com o aumento do grau de reação alérgica. Um resultado semelhante foi verificado em um estudo de Mayer et al.,17 que demonstrou que os níveis altamente elevados de histamina podem servir como um sinal para o desenvolvimento de anafilaxia fatal. Alterações nos níveis de leucotrienos durante reações alérgicas foram semelhantes às da histamina. Além disso, existem evidências óbvias que sugerem que os níveis de leucotrienos estão aumentados em pacientes com RA após exposição a alérgeno.18–20 Nossos resultados mostraram que os níveis de histamina e leucotrieno D4 no sangue periférico e secreções nasais de participantes com RA de todos os grupos foram consistentemente mais altos do que aqueles de controles saudáveis. Além disso, os níveis de histamina e leucotrieno D4 estão altamente associados às alterações nos sintomas espirros e obstrução nasal, o que é consistente com os resultados de estudos anteriores.18,21,22 A elevação do nível de histamina pode ser a causa do aumento da vasodilatação e da permeabilidade vascular das glândulas da mucosa nasal, o que resulta em espirros. Por outro lado, o aumento do nível de leucotrieno D4 pode resultar na dilatação, hiperemia e edema da mucosa nasal, que levam à obstrução nasal.
De acordo com as diretrizes ARIA5 e aquelas desenvolvidas na China (edição de 2009),14 os agentes terapêuticos para RA são classificados em seis categorias: anti‐histamínicos, esteroides nasais, antagonistas dos receptores de leucotrienos, agentes anticolinérgicos, estabilizadores de mastócitos e descongestionantes nasais. De todos esses agentes terapêuticos, os anti‐histamínicos de segunda geração (loratadina) e os esteroides nasais são os medicamentos clássicos de primeira linha para o tratamento da RA. Recentemente, os antagonistas dos receptores de leucotrienos (montelucaste) ganharam atenção crescente na pesquisa clínica devido ao seu efeito sobre a patogênese da RA.23,24 Atualmente, muitas terapias combinadas, que incluem loratadina, montelucaste e esteroides nasais, têm sido propostas e seus efeitos curativos clínicos específicos na RA foram avaliados.6,10,25–27 Nossos resultados sugeriram que a loratadina e sua combinação com outros fármacos claramente melhoraram o sintoma de espirros e reduziram significativamente os níveis de histamina, enquanto o montelucaste e sua combinação com outros fármacos obviamente melhoraram o sintoma de obstrução nasal e diminuíram significativamente os níveis de leucotrieno D4. Nossos resultados estão de acordo com a recente diretriz de prática clínica para RA, a qual recomenda o uso de anti‐histamínicos de segunda geração com menor efeito sedativo colateral no tratamento de pacientes com RA e prurido nasal e espirros como sintomas primários.28 O uso de terapia combinada também é recomendado para que um efeito de bloqueio “abrangente” seja alcançado, tanto quanto possível.
A histamina e o leucotrieno são considerados os principais mediadores inflamatórios com múltiplos efeitos fisiológicos, que resultam da ligação de seus receptores.17,29 Os receptores de histamina são classificados em quatro subtipos, a saber, H1, H2, H3 e H4, que são membros da família de receptores acoplados a proteína G (GPCR, do inglês G‐Protein Coupled Receptor).30 Um estudo feito por Akdis et al.31 mostrou que os receptores de H1 são mais críticos na mediação da liberação de histamina na doença alérgica. Os receptores de Cisteinil‐leucotrieno (CysLts) têm três ligantes endógenos, ou seja, Leucotrieno C4, D4 e E4 (LTE4), que também pertencem à família GPCR e são classificados em dois tipos (CysLT1 e Cisteinil‐leucotrieno 2 [CysLT2]) com base na sua sensibilidade aos antagonistas seletivos para CysLT1.32 Estudos anteriores demonstraram que os CysLts têm um papel evidente na ocorrência de condições fisiopatológicas, como asma, RA e outras alergias nasais.21,33,34 Um estudo de Figueroa et al.35 sobre a expressão de mRNA e proteica dos receptores de CysLT1 e CysLT2 em células inflamatórias de lavado nasal coletadas dos participantes durante a RAS demonstrou que as células positivas para o receptor de CysLT1 eram altamente relacionadas com o desenvolvimento de inflamação, o que indica o potencial dos antagonistas de CysLT no tratamento de RA e asma. Em nosso estudo, os participantes com RA apresentaram níveis mais altos de expressão gênica e proteica dos receptores de H1 e CysLT1 do que os controles saudáveis. Além disso, reduções significativas nos níveis de mRNA e proteína dos receptores de H1 e CysLT1 foram observadas após 4 semanas de tratamento com anti‐histamínicos e antileucotrienos, o que é consistente com as mudanças nos níveis dos mediadores relevantes. Notavelmente, os níveis de expressão gênica e proteica dos participantes com RA não foram estatisticamente diferentes (p > 0,05) daqueles de controles saudáveis após a terapia medicamentosa. Todos esses dados sugerem a eficácia das terapias combinadas, que melhoraram significativamente os sintomas nasais dos participantes com RA.
ConclusãoA avaliação clínica dos sintomas combinada com a detecção experimental dos níveis de histamina e leucotrieno é um método mais objetivo e preciso para classificar clinicamente a RA do que as abordagens anteriores. Além disso, nossos resultados demonstraram que o uso de terapias combinadas é eficaz e esse achado abre novas estratégias para o tratamento individualizado da RA.
FinanciamentoEste trabalho recebeu apoio através de doações do Programa de Ciência e Tecnologia do Programa da Província de Guangdong (S2011010003947).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores gostariam de agradecer aos clínicos que deram apoio e cuidados aos participantes e aos participantes que doaram seu tempo, amostras de sangue e tecido.
Estes dois autores contribuiram de forma igual para este estudo.
Como citar este artigo: Shen C, Chen F, Wang H, Zhang X, Li G, Wen Z. Individualized treatment for allergic rhinitis based on key nasal clinical manifestations combined with histamine and leukotriene D4 levels. Braz J Otorhinolaryngol. 2020;86:63–73.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.