Obstructive sleep apnea, a common disease, is usually complicated by insulin resistance and type 2 diabetes mellitus. Adipokine is considered to play an important role in the development of insulin resistance and type 2 diabetes mellitus in obstructive sleep apnea.
ObjectiveTo assess whether secreted frizzled‐related protein 5, a new adipokine, is involved in untreated obstructive sleep apnea patients.
MethodsSeventy‐six subjects with obstructive sleep apnea and thirty‐three control subjects without obstructive sleep apnea were recruited and matched in terms of body mass index and age. The fasting secreted frizzled‐related protein 5 plasma concentration was tested using ELISA. In addition, the correlation between secreted frizzled‐related protein 5 and the homeostasis model assessment of insulin resistance was obtained. Multiple linear regression analysis models with stepwise selection were performed to determine the independent associations between various factors and secreted frizzled‐related protein 5.
ResultsPlasma secreted frizzled‐related protein 5 levels were significantly lower in the obstructive sleep apnea group than in the control group (obstructive sleep apnea group: 28.44±13.25ng/L; control group: 34.16±13.51ng/L; p=0.023). In addition, secreted frizzled‐related protein 5 was negatively correlated with homeostasis model assessment of insulin resistance but positively correlated with the mean and lowest oxygen saturation with or without adjusting for age, gender, body mass index, neck circumference, waist circumference and waist‐to‐hip ratio. The multiple linear regression analysis showed there was an independent negative association between secreted frizzled‐related protein 5 and homeostasis model assessment of insulin resistance.
ConclusionSecreted frizzled‐related protein 5 was involved in obstructive sleep apnea and the decrease in secreted frizzled‐related protein 5 was directly proportional to the severity of obstructive sleep apnea. There was an independent negative correlation between homeostasis model assessment of insulin resistance and secreted frizzled‐related protein 5 in the obstructive sleep apnea group. Secreted frizzled‐related protein 5 might be a therapeutic target for insulin resistance in obstructive sleep apnea.
A apneia obstrutiva do sono, uma doença comum, é geralmente complicada com resistência à insulina e diabetes melito tipo 2. Acredita‐se que a adipocina possa ter um papel importante no desenvolvimento de resistência à insulina e diabetes melito tipo 2 na apneia obstrutiva do sono.
ObjetivoAvaliar se a proteína secretada relacionada ao receptor frizzled‐5, uma nova adipocina, está envolvida em pacientes com apneia obstrutiva do sono não tratada.
MétodoForam recrutados 76 indivíduos com apneia obstrutiva do sono e 33 indivíduos controle sem apneia obstrutiva do sono e pareados em relação a índice de massa corporal e idade. A concentração plasmática de proteína secretada relacionada ao receptor frizzled‐5 foi testada em jejum com o teste Elisa. Além disso, obteve‐se correlação entre a proteína secretada relacionada ao receptor frizzled‐5 e o modelo de avaliação da homeostase de resistência à insulina. Modelos de análise de regressão linear múltipla com seleção stepwise foram feitos para determinar as associações independentes entre vários fatores e a proteína secretada relacionada ao receptor frizzled‐5.
ResultadosOs níveis plasmáticos de proteína secretada relacionada ao receptor frizzled‐5 foram significativamente menores no grupo com apneia obstrutiva do sono do que no grupo controle (grupo com apneia obstrutiva do sono: 28,44±13,25 ng/L; grupo controle: 34,16±13,51 ng/L; p=0,023). Além disso, a proteína secretada relacionada ao receptor frizzled‐5 foi correlacionada negativamente com o modelo de avaliação da homeostase de resistência à insulina, mas se correlacionou positivamente com a média e a saturação mínima de oxigênio com ou sem ajuste para idade, gênero, índice de massa corporal, circunferência do pescoço, circunferência da cintura e relação cintura‐quadril. A análise de regressão linear múltipla mostrou que houve uma associação negativa independente entre a proteína secretada relacionada ao receptor frizzled‐5 e o modelo de avaliação da homeostase de resistência à insulina.
ConclusõesA proteína secretada relacionada ao receptor frizzled‐5 esteve envolvida na apneia obstrutiva do sono e sua diminuição foi diretamente proporcional à gravidade da apneia obstrutiva do sono. Houve uma correlação negativa independente entre o modelo de avaliação da homeostase de resistência à insulina e a proteína secretada relacionada ao receptor frizzled‐5 no grupo da apneia obstrutiva do sono. A proteína secretada relacionada ao receptor frizzled‐5 pode ser um alvo terapêutico para a resistência à insulina na apneia obstrutiva do sono.
A apneia obstrutiva do sono (AOS) é um distúrbio respiratório comum. Sua prevalência é alta, com média de 22% em homens e 17% em mulheres.1 A AOS é caracterizada pela interrupção repetitiva da respiração devido à obstrução das vias aéreas durante o sono, leva à hipoxemia e distúrbios do sono.2 Estudos mostraram associação entre AOS e distúrbios metabólicos, como resistência à insulina (RI), e diabetes tipo 2 (DM2).3–5 Os exatos mecanismos subjacentes a essa associação permanecem obscuros. No entanto, considera‐se que o tecido adiposo desempenhe um papel importante no desenvolvimento de RI e DM2 na AOS.6
O tecido adiposo não é apenas um tecido de armazenamento de energia, mas também um órgão endócrino que secreta várias adipocinas.7 Há evidências crescentes de que anormalidades da adipocina estão envolvidas na AOS.8–10 Por ser uma adipocina, a proteína secretada relacionada ao receptor frizzled‐5 (Sfrp5) é altamente expressa no tecido adiposo branco.11–14 A Sfrp5 está associada a RI, DM2 e doenças arteriais coronarianas, representa até mesmo um potencial alvo terapêutico para a homeostase anormal da glicose.11,15–18 Além disso, a expressão do Sfrp5 é downregulada em condições de estresse oxidativo,19 que estão frequentemente presentes na AOS durante o sono devido à hipóxia intermitente.20 Assim, especulamos que as mudanças na Sfrp5 poderiam estar envolvidas na AOS e estar associadas à RI na AOS. A avaliação dessa associação pode contribuir para identificar os mecanismos de RI na AOS e, portanto, é crucial para a prevenção dos riscos de RI e DM2 na AOS.
MétodoIndivíduosTodos os indivíduos foram recrutados no laboratório do sono do Departamento de Medicina Respiratória, do Departamento de Medicina Otorrinolaringológica ou no Centro de Exame de Saúde do Beijing Friendship Hospital de março de 2016 a abril de 2017. O critério de inclusão foi a idade de 18 a 70 anos. Os critérios de exclusão foram doenças metabólicas, alérgicas, cardiovasculares, cerebrovasculares, renais ou hepáticas, distúrbios psiquiátricos, doenças infecciosas dos pulmões, distúrbios do sono além da AOS, gravidez e tratamento prévio para AOS. O estudo foi aprovado pelo comitê de ética do Beijing Friendship Hospital e o consentimento livre e informado foi obtido de todos os participantes. O número do código de ética é 2016‐P2‐003‐02.
Todos os indivíduos foram submetidos a um exame físico completo antes de ser submetidos à polissonografia (PSG). A circunferência do pescoço (CP), circunferência da cintura (CC), relação cintura‐quadril (RCQ) e índice de massa corporal [IMC, peso(altura)2] foram medidos. Além disso, os indivíduos foram classificados como obesos e não obesos.21 O escore de sonolência de Epworth (ESE) foi calculado para avaliar o nível de sonolência diurna.
PSGTodos os indivíduos foram submetidos à PSG durante a noite com um sistema de aquisição de dados do sono (Homlogic N7000, Austrália). Resumidamente, os parâmetros registrados foram eletroencefalogramas de derivações aplicadas em C4‐M1, C3‐M2, O2‐M1, O1‐M2, F4‐M1 e F3‐M2, fluxo respiratório detectado por um receptor de pressão de fluxo, movimentos respiratórios detectados por bandas torácica e abdominal, saturação de oxigênio detectada por um oxímetro de pulso, eletro‐oculogramas e eletromiografia de queixo e tibial anterior. A apneia foi definida como uma redução da amplitude > 90% do fluxo aéreo nasal por pelo menos 10s. A hipopneia foi definida como uma redução da amplitude > 30% do fluxo aéreo associada à dessaturação da oxi‐hemoglobina de 3% ou mais ou associada ao despertar. Todos os registros da PSG foram analisados por dois especialistas. Os indivíduos normais foram definidos como aqueles com Índice de Apneia/Hipopneia (IAH) < 5 e os indivíduos com AOS foram definidos como aqueles com IAH ≥ 5.
Testes sanguíneosAmostras de sangue venoso foram obtidas de todos os indivíduos na manhã após a PSG e após jejum durante a noite. O plasma foi extraído por centrifugação a 1.000g/min durante 20 minutos e armazenado a ‐80°C até os exames serem feitos. Os níveis plasmáticos de Sfrp5 foram avaliados com um kit Elisa (ShinnyBIO, Shanghai, China). Todos os outros testes sanguíneos (triglicérides [TG], colesterol total [CT], lipoproteína de baixa densidade [LDL], lipoproteína de alta densidade [HDL], proteína C‐reativa de alta sensibilidade [PCR‐hs], glicemia de jejum, insulina de jejum) foram concluídos pelo Beijing Friendship Hospital. A sensibilidade à insulina foi avaliada com o modelo de avaliação da homeostase de resistência à insulina (HOMA‐IR) = (glicemia de jejum [mmoL/L] * insulina de jejum [UI/mL])/22,5.22
Análise estatísticaOs dados são apresentados como a média ± desvio‐padrão para variáveis contínuas e o número para variáveis categóricas. Testes de Kolmogorov‐Smirnov de uma amostra foram feitos para determinar se as variáveis independentes apresentavam distribuição normal. Comparações de grupos independentes foram feitas com o teste t de Student para amostras independentes ou o teste U de Mann‐Whitney, baseado na distribuição de normalidade. As variáveis categóricas foram comparadas com o teste do qui‐quadrado. Correlações lineares foram analisadas pelo coeficiente de correlação de Pearson. Uma análise de regressão linear múltipla com seleção stepwise foi usada para determinar associações entre vários fatores e Sfrp5. O valor de p < 0,05 foi considerado para indicar significância. As análises estatísticas dos dados foram feitas no software SPSS 17.0.
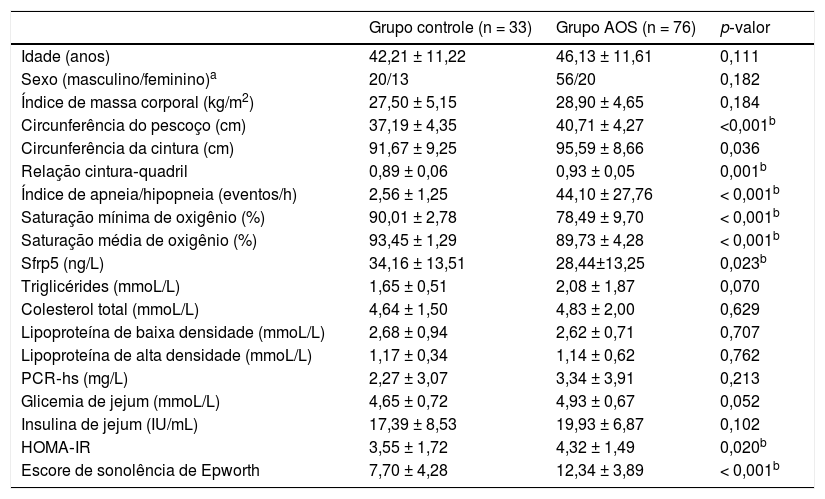
ResultadosCento e nove indivíduos foram divididos em dois grupos: grupo AOS (n = 76; idade: 46,13 ± 11,61 anos; masculino/feminino: 56/20) e grupo controle (n = 33; idade: 42,21 ± 11,22 anos; masculino/feminino: 20/13). De acordo com o IAH, o grupo AOS foi dividido em três subgrupos: AOS leve (5 ≤ IAH < 15), AOS moderado (15 ≤ IAH < 30), AOS grave (IAH ≥ 30). Todas as características basais e os resultados dos testes sanguíneos dos indivíduos são apresentados nas tabelas 1 e 2.
Dados demográficos, perfis de sono e mensurações no sangue basais dos grupos controle e AOS
| Grupo controle (n = 33) | Grupo AOS (n = 76) | p‐valor | |
|---|---|---|---|
| Idade (anos) | 42,21 ± 11,22 | 46,13 ± 11,61 | 0,111 |
| Sexo (masculino/feminino)a | 20/13 | 56/20 | 0,182 |
| Índice de massa corporal (kg/m2) | 27,50 ± 5,15 | 28,90 ± 4,65 | 0,184 |
| Circunferência do pescoço (cm) | 37,19 ± 4,35 | 40,71 ± 4,27 | <0,001b |
| Circunferência da cintura (cm) | 91,67 ± 9,25 | 95,59 ± 8,66 | 0,036 |
| Relação cintura‐quadril | 0,89 ± 0,06 | 0,93 ± 0,05 | 0,001b |
| Índice de apneia/hipopneia (eventos/h) | 2,56 ± 1,25 | 44,10 ± 27,76 | < 0,001b |
| Saturação mínima de oxigênio (%) | 90,01 ± 2,78 | 78,49 ± 9,70 | < 0,001b |
| Saturação média de oxigênio (%) | 93,45 ± 1,29 | 89,73 ± 4,28 | < 0,001b |
| Sfrp5 (ng/L) | 34,16 ± 13,51 | 28,44±13,25 | 0,023b |
| Triglicérides (mmoL/L) | 1,65 ± 0,51 | 2,08 ± 1,87 | 0,070 |
| Colesterol total (mmoL/L) | 4,64 ± 1,50 | 4,83 ± 2,00 | 0,629 |
| Lipoproteína de baixa densidade (mmoL/L) | 2,68 ± 0,94 | 2,62 ± 0,71 | 0,707 |
| Lipoproteína de alta densidade (mmoL/L) | 1,17 ± 0,34 | 1,14 ± 0,62 | 0,762 |
| PCR‐hs (mg/L) | 2,27 ± 3,07 | 3,34 ± 3,91 | 0,213 |
| Glicemia de jejum (mmoL/L) | 4,65 ± 0,72 | 4,93 ± 0,67 | 0,052 |
| Insulina de jejum (IU/mL) | 17,39 ± 8,53 | 19,93 ± 6,87 | 0,102 |
| HOMA‐IR | 3,55 ± 1,72 | 4,32 ± 1,49 | 0,020b |
| Escore de sonolência de Epworth | 7,70 ± 4,28 | 12,34 ± 3,89 | < 0,001b |
Os valores são indicados como média ± desvio‐padrão.
HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; PCR‐hs, proteína C‐reativa de alta sensibilidade; Sfrp5, Proteína secretada relacionada ao receptor frizzled‐5.
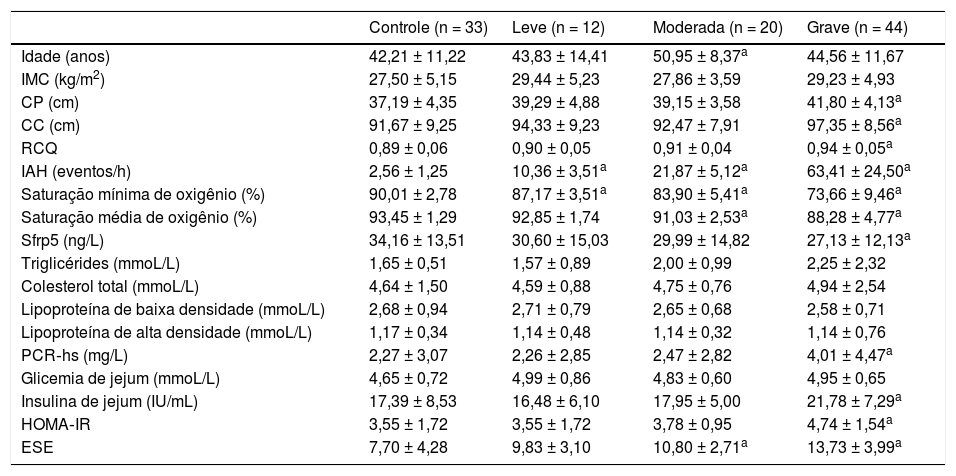
Dados demográficos, perfis de sono e mensurações no sangue basais do grupo controle e subgrupos de AOS
| Controle (n = 33) | Leve (n = 12) | Moderada (n = 20) | Grave (n = 44) | |
|---|---|---|---|---|
| Idade (anos) | 42,21 ± 11,22 | 43,83 ± 14,41 | 50,95 ± 8,37a | 44,56 ± 11,67 |
| IMC (kg/m2) | 27,50 ± 5,15 | 29,44 ± 5,23 | 27,86 ± 3,59 | 29,23 ± 4,93 |
| CP (cm) | 37,19 ± 4,35 | 39,29 ± 4,88 | 39,15 ± 3,58 | 41,80 ± 4,13a |
| CC (cm) | 91,67 ± 9,25 | 94,33 ± 9,23 | 92,47 ± 7,91 | 97,35 ± 8,56a |
| RCQ | 0,89 ± 0,06 | 0,90 ± 0,05 | 0,91 ± 0,04 | 0,94 ± 0,05a |
| IAH (eventos/h) | 2,56 ± 1,25 | 10,36 ± 3,51a | 21,87 ± 5,12a | 63,41 ± 24,50a |
| Saturação mínima de oxigênio (%) | 90,01 ± 2,78 | 87,17 ± 3,51a | 83,90 ± 5,41a | 73,66 ± 9,46a |
| Saturação média de oxigênio (%) | 93,45 ± 1,29 | 92,85 ± 1,74 | 91,03 ± 2,53a | 88,28 ± 4,77a |
| Sfrp5 (ng/L) | 34,16 ± 13,51 | 30,60 ± 15,03 | 29,99 ± 14,82 | 27,13 ± 12,13a |
| Triglicérides (mmoL/L) | 1,65 ± 0,51 | 1,57 ± 0,89 | 2,00 ± 0,99 | 2,25 ± 2,32 |
| Colesterol total (mmoL/L) | 4,64 ± 1,50 | 4,59 ± 0,88 | 4,75 ± 0,76 | 4,94 ± 2,54 |
| Lipoproteína de baixa densidade (mmoL/L) | 2,68 ± 0,94 | 2,71 ± 0,79 | 2,65 ± 0,68 | 2,58 ± 0,71 |
| Lipoproteína de alta densidade (mmoL/L) | 1,17 ± 0,34 | 1,14 ± 0,48 | 1,14 ± 0,32 | 1,14 ± 0,76 |
| PCR‐hs (mg/L) | 2,27 ± 3,07 | 2,26 ± 2,85 | 2,47 ± 2,82 | 4,01 ± 4,47a |
| Glicemia de jejum (mmoL/L) | 4,65 ± 0,72 | 4,99 ± 0,86 | 4,83 ± 0,60 | 4,95 ± 0,65 |
| Insulina de jejum (IU/mL) | 17,39 ± 8,53 | 16,48 ± 6,10 | 17,95 ± 5,00 | 21,78 ± 7,29a |
| HOMA‐IR | 3,55 ± 1,72 | 3,55 ± 1,72 | 3,78 ± 0,95 | 4,74 ± 1,54a |
| ESE | 7,70 ± 4,28 | 9,83 ± 3,10 | 10,80 ± 2,71a | 13,73 ± 3,99a |
Os valores são indicados como média ± desvio‐padrão.
CC, circunferência da cintura; CP, circunferência do pescoço; ESE, escore de sonolência de Epworth; HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; IAH, índice de apneia/hipopneia; IMC, índice de massa corporal; PCR‐hs, proteína C‐reativa de alta sensibilidade; RCQ, relação cintura‐quadril; Sfrp5, Proteína secretada relacionada ao receptor frizzled‐5.
Houve diferença significante nos níveis de Sfrp5 entre os grupos controle e AOS (grupo AOS: 28,44 ± 13,25 ng/L; grupo controle: 34,16 ± 13,51 ng/L; p = 0,023). As concentrações de Sfrp5 foram significantemente menores no grupo AOS grave do que no grupo controle (tabela 2).
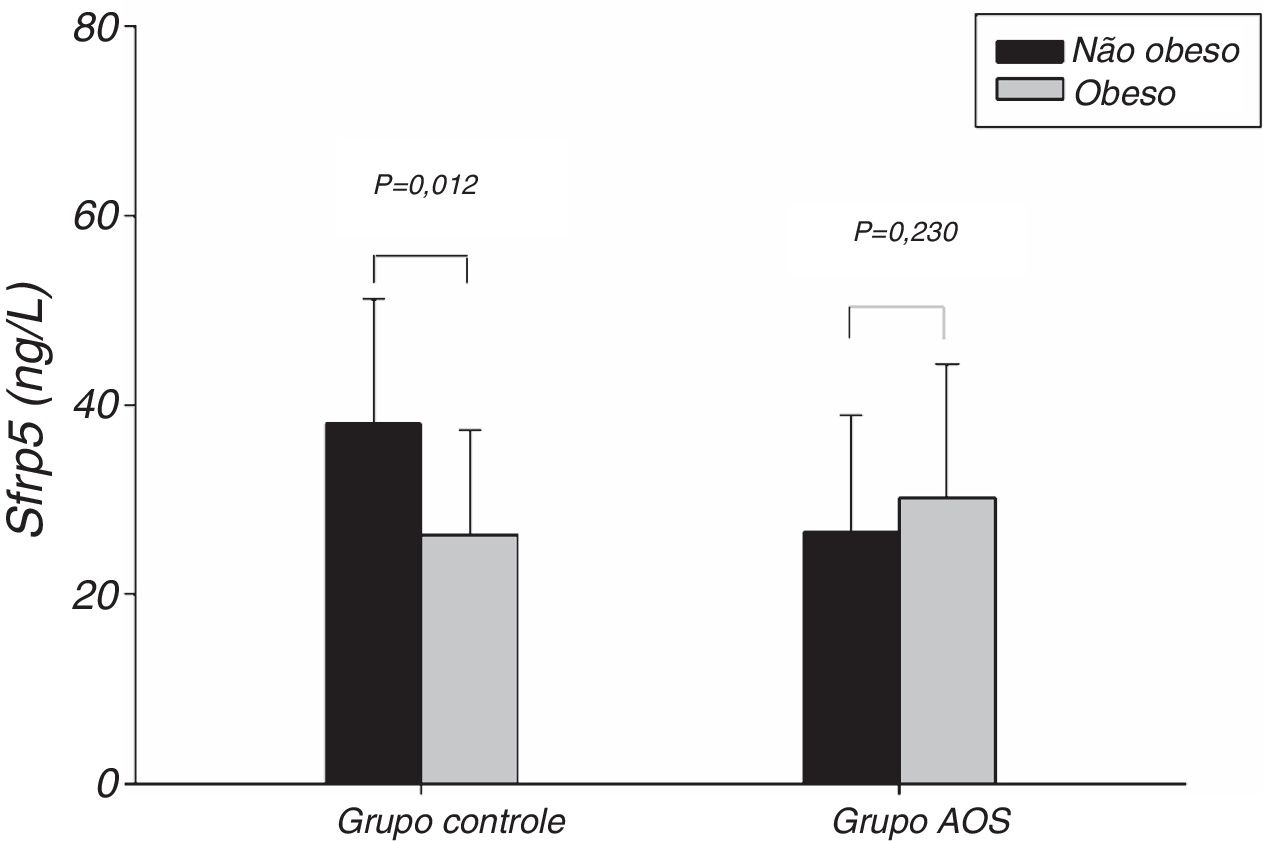
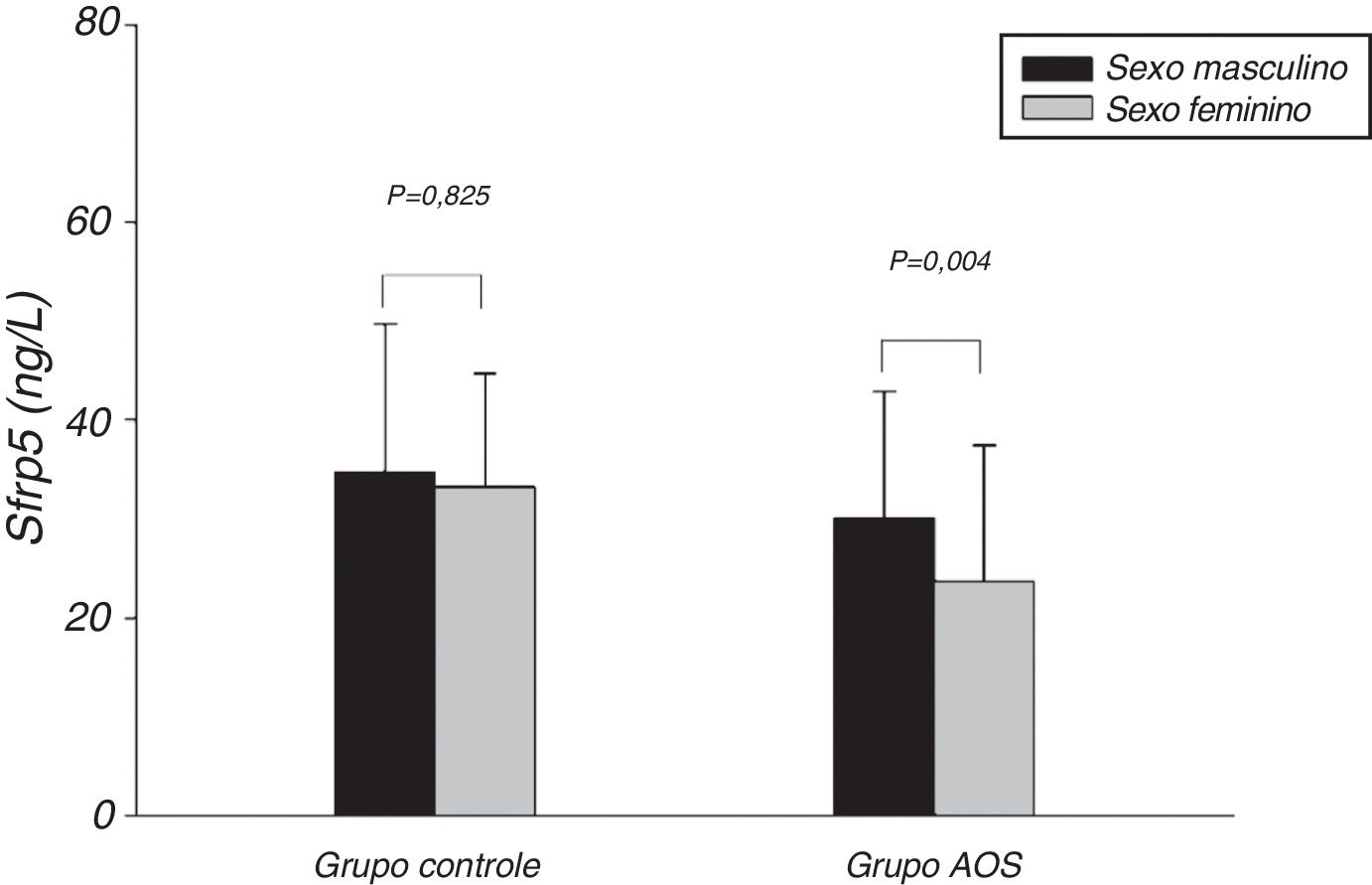
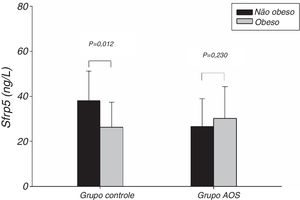
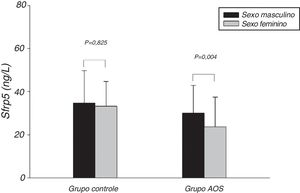
A figura 1 mostra que o nível de Sfrp5 no grupo controle foi significantemente menor nos indivíduos obesos do que naqueles não obesos. Além disso, não houve diferença nos níveis de Sfrp5 entre os sexos masculino e feminino no grupo controle (fig. 2).
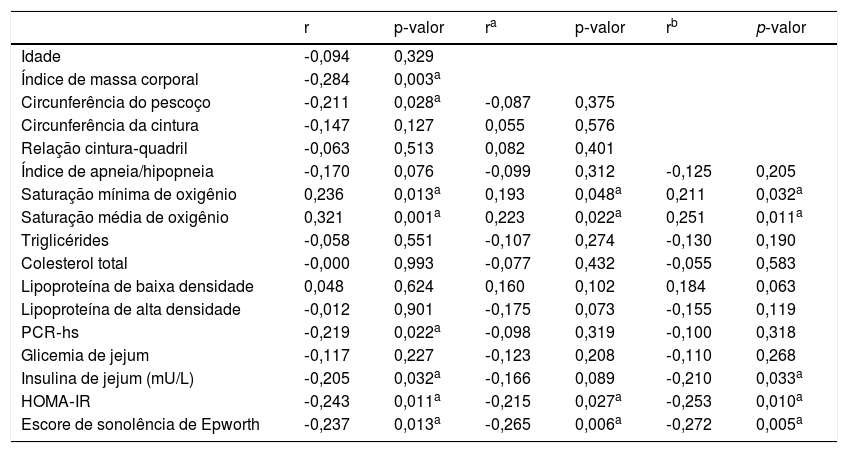
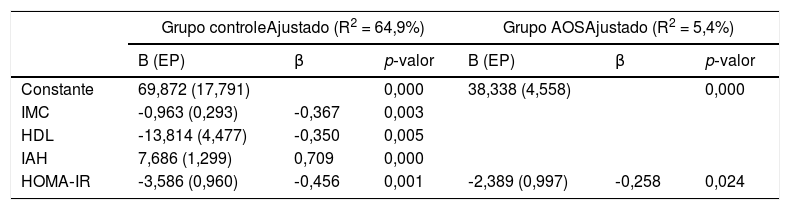
A análise de correlação mostrou que os níveis de Sfrp5 estavam correlacionados negativamente com o IMC, ESSE, PCR‐hs, HOMA‐IR, mas positivamente com os níveis mínimo e médio de saturação de oxigênio. Após ajuste para idade, sexo, IMC, CP, CC e RCQ, a Sfrp5 ainda estava negativamente correlacionada com o HOMA‐IR e o ESE (tabela 3). A análise de regressão linear múltipla mostrou que houve uma correção negativa independente entre HOMA‐IR e Sfrp5 no grupo AOS (tabela 4).
Correlações de Spearman entre Sfrp5 e os outros fatores
| r | p‐valor | ra | p‐valor | rb | p‐valor | |
|---|---|---|---|---|---|---|
| Idade | ‐0,094 | 0,329 | ||||
| Índice de massa corporal | ‐0,284 | 0,003a | ||||
| Circunferência do pescoço | ‐0,211 | 0,028a | ‐0,087 | 0,375 | ||
| Circunferência da cintura | ‐0,147 | 0,127 | 0,055 | 0,576 | ||
| Relação cintura‐quadril | ‐0,063 | 0,513 | 0,082 | 0,401 | ||
| Índice de apneia/hipopneia | ‐0,170 | 0,076 | ‐0,099 | 0,312 | ‐0,125 | 0,205 |
| Saturação mínima de oxigênio | 0,236 | 0,013a | 0,193 | 0,048a | 0,211 | 0,032a |
| Saturação média de oxigênio | 0,321 | 0,001a | 0,223 | 0,022a | 0,251 | 0,011a |
| Triglicérides | ‐0,058 | 0,551 | ‐0,107 | 0,274 | ‐0,130 | 0,190 |
| Colesterol total | ‐0,000 | 0,993 | ‐0,077 | 0,432 | ‐0,055 | 0,583 |
| Lipoproteína de baixa densidade | 0,048 | 0,624 | 0,160 | 0,102 | 0,184 | 0,063 |
| Lipoproteína de alta densidade | ‐0,012 | 0,901 | ‐0,175 | 0,073 | ‐0,155 | 0,119 |
| PCR‐hs | ‐0,219 | 0,022a | ‐0,098 | 0,319 | ‐0,100 | 0,318 |
| Glicemia de jejum | ‐0,117 | 0,227 | ‐0,123 | 0,208 | ‐0,110 | 0,268 |
| Insulina de jejum (mU/L) | ‐0,205 | 0,032a | ‐0,166 | 0,089 | ‐0,210 | 0,033a |
| HOMA‐IR | ‐0,243 | 0,011a | ‐0,215 | 0,027a | ‐0,253 | 0,010a |
| Escore de sonolência de Epworth | ‐0,237 | 0,013a | ‐0,265 | 0,006a | ‐0,272 | 0,005a |
Ajustado por idade, sexo, índice de massa corporal; Circunferência do pescoço; Circunferência da cintura; Relação cintura‐quadril.
HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; PCR‐hs, proteína C reativa de alta sensibilidade; Sfrp5, Proteína secretada relacionada ao receptor frizzled‐5.
* p < 0,05, diferença estatisticamente significante.
Modelos de regressão múltipla stepwise dos níveis de Sfrp5 nos grupos controle e AOS
| Grupo controleAjustado (R2 = 64,9%) | Grupo AOSAjustado (R2 = 5,4%) | |||||
|---|---|---|---|---|---|---|
| B (EP) | β | p‐valor | B (EP) | β | p‐valor | |
| Constante | 69,872 (17,791) | 0,000 | 38,338 (4,558) | 0,000 | ||
| IMC | ‐0,963 (0,293) | ‐0,367 | 0,003 | |||
| HDL | ‐13,814 (4,477) | ‐0,350 | 0,005 | |||
| IAH | 7,686 (1,299) | 0,709 | 0,000 | |||
| HOMA‐IR | ‐3,586 (0,960) | ‐0,456 | 0,001 | ‐2,389 (0,997) | ‐0,258 | 0,024 |
HDL, lipoproteína de alta densidade; HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; IAH, índice de apneia/hipopneia; IMC, índice de massa corporal.
Variáveis independentes consideradas: idade, sexo, IMC, escore de sonolência de Epworth (ESE), IAH, proteína C‐reativa de alta sensibilidade (PCR‐hs), HOMA‐IR, triglicérides (TG), colesterol total (CT), lipoproteína de baixa densidade (LDL), lipoproteína de alta densidade (HDL).
O presente estudo mostrou que as concentrações de Sfrp5 estavam significantemente diminuídas em AOS. Além disso, a Sfrp5 estava positivamente correlacionada com as saturações mínimas e médias de oxigênio, com ou sem ajustes para idade, sexo, IMC, CP, CC e RCQ. Esses resultados sugerem que a Sfrp5 pode estar envolvida no processo fisiopatológico da AOS. Estudos anteriores relataram que a hipóxia poderia induzir necrose em adipócitos 3T3‐L123 e aumentar a morte de adipócitos no tecido adiposo de indivíduos obesos.24 Mais importante, a expressão de Sfrp5 era downregulada sob estresse oxidativo.19 Indiscutivelmente, a hipóxia seguida por estresse oxidativo ocorre com frequência durante o sono25 na AOS. Parece que a redução na Sfrp5 circulante pode ser resultado da morte dos adipócitos e do estresse oxidativo causado pela hipóxia na AOS. Entretanto, Zhang26 sugeriu que os níveis de Sfrp5 de pacientes com AOS não diferiam daqueles de indivíduos sem AOS. No estudo de Zhang, os indivíduos tinham AOS grave, cujo IAH era menor que aquele do grupo com AOS grave no presente estudo. É importante ressaltar que o estudo de Zhang, diferentemente do presente estudo, não incluiu mulheres. Além disso, o presente estudo mostrou que as concentrações de Sfrp5 em mulheres foram menores do que as dos homens no grupo AOS (fig. 2). Até certo ponto, as discrepâncias entre esses estudos podem ser devidas às diferentes características clínicas dos estudos.
Um estudo mostrou que a expressão de Sfrp5 estava diminuída no tecido adiposo de camundongos obesos.11 Outros estudos14,15,27 sugeriram que havia uma concentração significativamente menor de Sfrp5 circulante em condições de obesidade do que em condições de peso normal. No presente estudo, os níveis plasmáticos de Sfrp5 foram significativamente menores em indivíduos obesos do que em indivíduos com peso normal e a Sfrp5 foi negativamente correlacionada com o IMC. Além disso, a análise de regressão linear múltipla mostrou que o IMC foi um preditor independente do nível de Sfrp5 no grupo controle. Especulamos que a expressão de Sfrp5 pode estar reduzida em humanos obesos, embora essa hipótese precise ser verificada em estudos futuros.
Poe ser uma adipocina anti‐inflamatória, a Sfrp5 inibe o acúmulo de macrófagos ativados no tecido adiposo por meio da regulação não canônica da via de sinalização da JNK para melhorar a intolerância à glicose em modelos de obesidade e DM2 em camundongos.11 Estudos relataram que a Sfrp5 é inversamente correlacionada com o HOMA‐IR em indivíduos obesos com tolerância normal à glicose ou com DM2.12,15,18 Também encontramos uma correlação negativa significante mesmo quando os fatores de confusão idade, sexo, IMC, CP e RCQ foram eliminados. Ainda mais importante, a análise de regressão linear múltipla mostrou uma associação negativa independente entre Sfrp5 e RI no grupo AOS. A suposição para essa correlação negativa é que a diminuição dos níveis de Sfrp5 pode atenuar seus efeitos anti‐inflamatórios no tecido adiposo na AOS.
Alguns estudos sugeriram que os níveis de adipocinas podem estar correlacionados com o sexo.28,29 No entanto, não encontramos diferenças nos níveis plasmáticos de Sfrp5 entre mulheres e homens no grupo controle. De acordo com nossos achados, estudos anteriores também não encontraram uma associação entre os níveis séricos de Sfrp5 e o sexo dos indivíduos.15–17
A principal limitação do presente estudo foi o fato de que foi um projeto caso‐controle, sem randomização, cegamento ou controle por placebo.
ConclusãoSfrp5 esteve envolvida na AOS e a diminuição da Sfrp5 foi diretamente proporcional à gravidade da AOS. Houve uma correlação negativa independente entre HOMA‐IR e Sfrp5 no grupo OSA. A Sfrp5 pode ser um alvo terapêutico para RI na OSA.
FinanciamentoNatural Science Foundation of Beijing Municipality (CN) (No. 7142046), National Natural Science Foundation of China (No.81560589), Teaching and Reform Program of Kunming Medical University (NO. 2016‐JY‐Y‐43) e Yunnan Provincial Department of Education (ZD2015009, 2017zzx201). Os financiadores não tiveram qualquer papel no desenho do estudo, coleta e análise de dados, decisão de publicar o estudo ou preparação do manuscrito.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sun S, Zhai H, Zhu M, Wen P, He X, Wang H. Insulin resistance is associated with Sfrp5 in obstructive sleep apnea. Braz J Otorhinolaryngol. 2019;85:739–45.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.