Fine needle aspiration biopsy is a valuable tool in preoperative evaluation of head and neck tumors. However, its accuracy in management of salivary gland tumors is debatable.
ObjectiveWe aimed to investigate the efficacy and the accuracy of fine needle aspiration biopsy in parotid gland tumors.
MethodsPatients who underwent parotidectomy between January 2008 and June 2017 due to parotid gland tumor were examined retrospectively. Patients with both preoperative fine needle aspiration biopsy and postoperative surgical pathologies were included. Preoperative fine needle aspiration biopsy was categorized as benign, malignant or suspicious for malignancy. Surgical pathology was grouped as benign or malignant. Surgical pathology was compared with fine needle aspiration biopsy, and sensitivity, specificity, accuracy and agreement between both tests were investigated.
Results217 cases were evaluated and 23 cases were excluded because the fine needle aspiration biopsy diagnosis was non‐diagnostic or unavailable. 194 cases were included. The mean age of the patients was 47.5±15.88 (7–82). There were 157 benign, 37 malignant cases in fine needle aspiration biopsy, 165 benign and 29 malignant cases in surgical pathology. The most common benign tumor was pleomorphic adenoma (43.3%), and malignant tumor was mucoepidermoid carcinoma (4.13%). The diagnostic accuracy for fine needle aspiration biopsy when detecting malignancy was 86.52%. Sensitivity and specificity were 68.96% and 89.63% respectively. Positive predictive value was 54.05% and negative predictive value was 94.23%. There was moderate agreement between fine needle aspiration biopsy and surgical pathology (κ=0.52). The sensitivity was 54.54% in tumors less than 2cm while 77.77% in larger tumors. In tumors extending to the deep lobe, sensitivity was 80%.
ConclusionFine needle aspiration biopsy is an important diagnostic tool for evaluating parotid gland tumors. It is more accurate in detecting benign tumors. In tumors greater than 2cm and extending to the deep lobe, the sensitivity of fine needle aspiration biopsy is high. The use of fine needle aspiration biopsy in conjunction with clinical and radiological evaluation may help to reduce false positive and false negative results.
A punção aspirativa com agulha fina é uma ferramenta valiosa na avaliação pré‐operatória de tumores de cabeça e pescoço. No entanto, sua precisão no tratamento de tumores de glândulas salivares é discutível.
ObjetivoNosso objetivo foi investigar a eficácia e precisão da punção aspirativa com agulha fina nos tumores da glândula parótida.
MétodoPacientes submetidos à parotidectomia entre janeiro de 2008 e junho de 2017 por tumor de glândula parótida foram examinados retrospectivamente. Foram incluídos pacientes com punção aspirativa com agulha fina pré‐operatória e histopatologia cirúrgica pós‐operatória. A punção aspirativa com agulha fina pré‐operatória foi categorizada como benigna, maligna ou com suspeita de malignidade. O histopatológico cirúrgico foi agrupado como benigno ou maligno. Os exames histopatológicos foram comparados com a punção aspirativa com agulha fina e a sensibilidade, especificidade, acurácia e concordância entre os dois testes foram investigadas.
ResultadosForam avaliados 217 casos e excluídos 23 porque o diagnóstico da punção aspirativa com agulha fina não foi conclusivo ou estava indisponível. Portanto, foram incluídos 194 casos. A média de idade dos pacientes foi de 47,5±15,88 (7–82). Havia 157 casos benignos, 37 malignos na punção aspirativa com agulha fina e 165 benignos e 29 malignos na histopatologia. O tumor benigno mais comum foi o adenoma pleomórfico (43,3%) e o tumor maligno mais comum foi o carcinoma mucoepidermoide (4,13%). A acurácia diagnóstica da punção aspirativa com agulha fina na detecção de malignidade foi de 86,52%. A sensibilidade e especificidade foram de 68,96% e 89,63%, respectivamente. O valor preditivo positivo foi de 54,05% e o valor preditivo negativo foi de 94,23%. Houve concordância moderada entre a punção aspirativa com agulha fina e histopatológico (κ=0,52). A sensibilidade foi 54,54% em tumores menores do que 2cm e 77,77% em tumores maiores. Nos tumores que se estendiam até o lobo profundo, a sensibilidade foi de 80%.
ConclusãoA punção aspirativa com agulha fina é uma importante ferramenta diagnóstica na avaliação dos tumores da glândula parótida. É mais precisa na detecção de tumores benignos. Em tumores maiores do que 2cm que se estendem até o lobo profundo, a sensibilidade da punção aspirativa com agulha fina é alta. O uso dessa ferramenta em conjunto com a avaliação clínica e radiológica pode ajudar a reduzir os resultados falso‐positivos e falso‐negativos.
Os principais tumores da glândula salivar são responsáveis por 3% dos cânceres de cabeça e pescoço.1 Tumores benignos são mais comuns do que tumores malignos. Cerca de 80% são originários da glândula parótida, enquanto tumores submandibulares e sublinguais são menos comuns. O adenoma pleomórfico é geralmente benigno e o carcinoma mucoepidermoide é o tumor maligno mais comum. Algumas doenças sistêmicas, como cânceres metastáticos, condições inflamatórias e linfomas, também podem causar lesões tumorais nas glândulas parótidas.1,2
A punção aspirativa com agulha fina (PAAF) é uma ferramenta valiosa na avaliação pré‐operatória do câncer de cabeça e pescoço. A PAAF é usada há mais de 40 anos para lesões na glândula parótida.2 A PAAF é aceita pela maioria dos médicos como sendo superior ao exame físico e de imagem no diagnóstico diferencial de tumores malignos e benignos; no entanto, alguns médicos sentem‐se inseguros quanto à sua utilidade. A diferenciação benigna e maligna pré‐operatória dos tumores da glândula parótida pode ser útil tanto para o planejamento cirúrgico quanto para o aconselhamento ao paciente.
Neste estudo, o objetivo foi investigar a eficácia diagnóstica e precisão da PAAF nos tumores da glândula parótida e os fatores que as afetam.
MétodoEntre janeiro de 2008 e junho de 2017, foram examinados retrospectivamente em nosso departamento 217 casos submetidos a parotidectomia por tumores da glândula parótida. Casos em que a PAAF ou os diagnósticos histopatológicos finais estavam indisponíveis ou não eram conclusivos foram excluídos. Dados sobre idade, sexo, lado, extensão até o lobo profundo, tamanho do tumor medido pela ultrassonografia, diagnóstico da PAAF pré‐operatória e diagnóstico histopatológico final foram registrados.
A PAAF é feita ambulatorialmente com agulha calibre 23 e seringa de 10cc, sem anestesia local. A agulha é inserida a partir de um único ponto e movida em 4–5 direções através do tumor, sem ser retirada. Depois de obter amostras suficientes, a agulha é removida e destacada da seringa. O aspirado é pulverizado em pelo menos 3-4 lâminas de vidro, esfregado, fixado em álcool e enviado para o laboratório de patologia.
O diagnóstico da PAAF pré‐operatória foi classificado em benigno, suspeito de malignidade ou maligno. Se possível, os subtipos eram registrados. O diagnóstico histopatológico final foi agrupado em benigno e maligno e a tipagem foi registrada. Os diagnósticos da PAAF malignos e suspeitos de malignidade e o diagnóstico histopatológico final de malignidade foram categorizados como positivos e os resultados benignos como negativos.
Os casos foram classificados como verdadeiros negativos (PAAF e diagnóstico histopatológico final benigno), falsos positivos (diagnóstico da PAAF maligno, diagnóstico histopatológico final benigno), verdadeiros positivos (diagnóstico da PAAF e diagnóstico histopatológico final malignos) e falsos negativos (diagnóstico da PAAF benigno, diagnóstico histopatológico final maligno). A sensibilidade, especificidade, o valor preditivo negativo, valor preditivo positivo, a acurácia e concordância entre os dois testes foram investigados pela comparação entre a PAAF e o diagnóstico histopatológico final.
A análise de regressão logística multinomial foi feita para investigar possíveis efeitos da idade, sexo, lado do tumor, envolvimento do lobo profundo e tamanho de acordo com a ultrassonografia, nos resultados verdadeiros positivos, verdadeiros negativos, falsos positivos e falsos negativos. Os casos foram agrupados de acordo com os parâmetros considerados significantes e, em seguida, a sensibilidade, especificidade, o valor preditivo negativo e positivo e a acurácia foram investigados para cada grupo (verdadeiro positivo, verdadeiro negativo, falso positivo, falso negativo, tamanho do tumor e extensão ao lobo profundo).
Nosso estudo foi conduzido com a aprovação do Comitê de Ética do Haseki Training and Research Hospital (14.09.2017/549). Nosso estudo foi feito em concordância com o Código de Ética da Associação Médica Mundial (Declaração de Helsinque). O consentimento informado foi obtido de todos os pacientes participantes do estudo.
ResultadosDos 217 pacientes retrospectivamente investigados, 23 foram excluídos devido a resultados da PAAF não disponíveis ou não conclusivos; 194 casos foram examinados retrospectivamente. A idade dos pacientes era de 47,5 ± 15,88 (7‐82). Entre os pacientes, 88 (45,36%) eram do sexo feminino e 106 (54,64%) do masculino; 100 casos estavam localizados na glândula parótida direita (51,54%) e 94 na glândula parótida esquerda (48,46%); 166 tumores estavam no lobo superficial e o envolvimento do lobo profundo estava presente em 28 casos. O tamanho do tumor variou de 2,76 ± 1,22 (1,1‐9,5) cm.
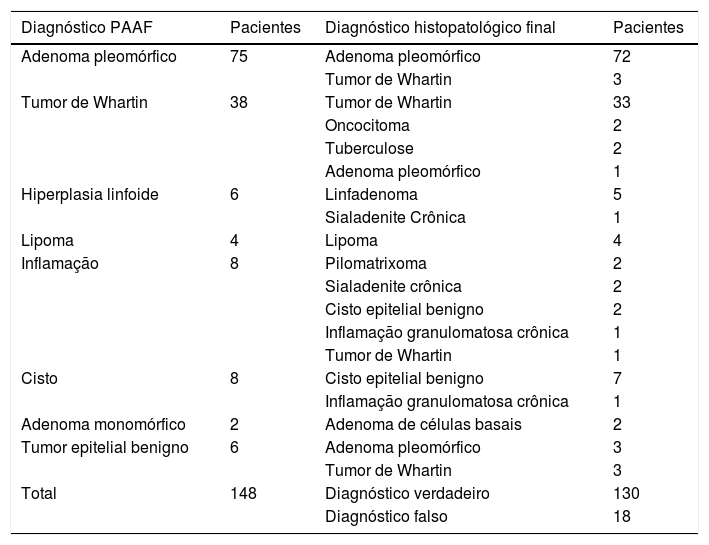
Havia 157 casos benignos, 37 suspeitos de malignidade e malignos na PAAF e o diagnóstico histopatológico final mostrou 165 casos benignos e 29 malignos. A lesão benigna mais comum foi o adenoma pleomórfico (43,3%); o tumor maligno mais comum foi o carcinoma mucoepidermoide (4,13%). Os casos verdadeiros negativos, falsos positivos, verdadeiros positivos e falsos negativos são mostrados nas tabelas 1‐4.
Diagnóstico da PAAF e histopatológico final de casos verdadeiramente negativos
| Diagnóstico PAAF | Pacientes | Diagnóstico histopatológico final | Pacientes |
|---|---|---|---|
| Adenoma pleomórfico | 75 | Adenoma pleomórfico | 72 |
| Tumor de Whartin | 3 | ||
| Tumor de Whartin | 38 | Tumor de Whartin | 33 |
| Oncocitoma | 2 | ||
| Tuberculose | 2 | ||
| Adenoma pleomórfico | 1 | ||
| Hiperplasia linfoide | 6 | Linfadenoma | 5 |
| Sialadenite Crônica | 1 | ||
| Lipoma | 4 | Lipoma | 4 |
| Inflamação | 8 | Pilomatrixoma | 2 |
| Sialadenite crônica | 2 | ||
| Cisto epitelial benigno | 2 | ||
| Inflamação granulomatosa crônica | 1 | ||
| Tumor de Whartin | 1 | ||
| Cisto | 8 | Cisto epitelial benigno | 7 |
| Inflamação granulomatosa crônica | 1 | ||
| Adenoma monomórfico | 2 | Adenoma de células basais | 2 |
| Tumor epitelial benigno | 6 | Adenoma pleomórfico | 3 |
| Tumor de Whartin | 3 | ||
| Total | 148 | Diagnóstico verdadeiro | 130 |
| Diagnóstico falso | 18 |
PAAF, Punção Aspirativa com Agulha Fina.
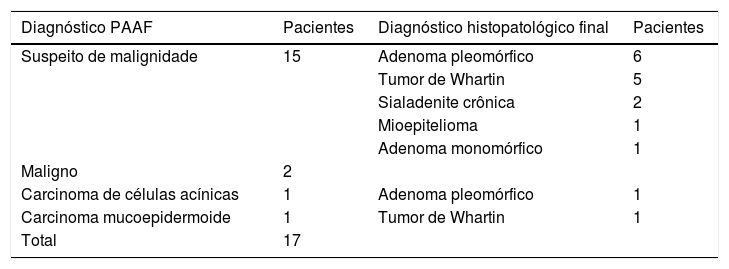
Diagnóstico da PAAF e diagnóstico histopatológico final de casos falsos positivos
| Diagnóstico PAAF | Pacientes | Diagnóstico histopatológico final | Pacientes |
|---|---|---|---|
| Suspeito de malignidade | 15 | Adenoma pleomórfico | 6 |
| Tumor de Whartin | 5 | ||
| Sialadenite crônica | 2 | ||
| Mioepitelioma | 1 | ||
| Adenoma monomórfico | 1 | ||
| Maligno | 2 | ||
| Carcinoma de células acínicas | 1 | Adenoma pleomórfico | 1 |
| Carcinoma mucoepidermoide | 1 | Tumor de Whartin | 1 |
| Total | 17 |
PAAF, Punção Aspirativa com Agulha Fina.
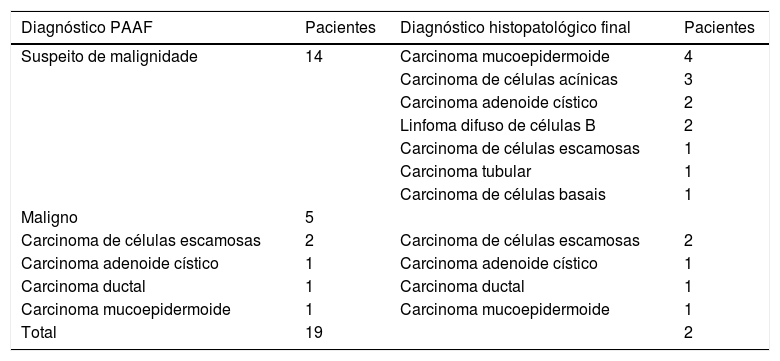
Diagnóstico da PAAF e histopatológico final de casos verdadeiramente positivos
| Diagnóstico PAAF | Pacientes | Diagnóstico histopatológico final | Pacientes |
|---|---|---|---|
| Suspeito de malignidade | 14 | Carcinoma mucoepidermoide | 4 |
| Carcinoma de células acínicas | 3 | ||
| Carcinoma adenoide cístico | 2 | ||
| Linfoma difuso de células B | 2 | ||
| Carcinoma de células escamosas | 1 | ||
| Carcinoma tubular | 1 | ||
| Carcinoma de células basais | 1 | ||
| Maligno | 5 | ||
| Carcinoma de células escamosas | 2 | Carcinoma de células escamosas | 2 |
| Carcinoma adenoide cístico | 1 | Carcinoma adenoide cístico | 1 |
| Carcinoma ductal | 1 | Carcinoma ductal | 1 |
| Carcinoma mucoepidermoide | 1 | Carcinoma mucoepidermoide | 1 |
| Total | 19 | 2 |
PAAF, Punção Aspirativa com Agulha Fina.
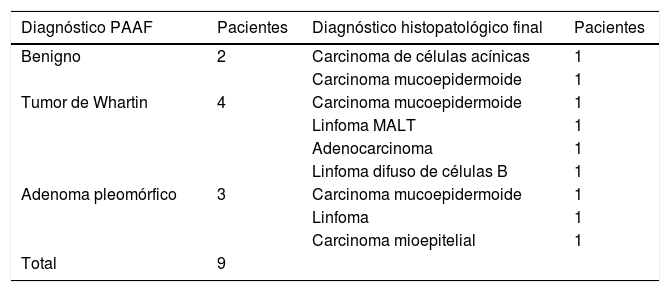
Diagnóstico da PAAF e histopatológico final de casos falsos negativos
| Diagnóstico PAAF | Pacientes | Diagnóstico histopatológico final | Pacientes |
|---|---|---|---|
| Benigno | 2 | Carcinoma de células acínicas | 1 |
| Carcinoma mucoepidermoide | 1 | ||
| Tumor de Whartin | 4 | Carcinoma mucoepidermoide | 1 |
| Linfoma MALT | 1 | ||
| Adenocarcinoma | 1 | ||
| Linfoma difuso de células B | 1 | ||
| Adenoma pleomórfico | 3 | Carcinoma mucoepidermoide | 1 |
| Linfoma | 1 | ||
| Carcinoma mioepitelial | 1 | ||
| Total | 9 |
Linfoma MALT, Linfoma de tecido linfoide associado a mucosa (do inglês Mucosa‐Associated Lymphoid Tissue); PAAF, Punção Aspirativa com Agulha Fina.
Para detecção da malignidade, a acurácia diagnóstica, sensibilidade e especificidade da PAAF foram de 86,52%, 68,96% e 89,63%, respectivamente. O valor preditivo positivo (VPP) foi de 54,05%, e o valor preditivo negativo (VPN) de 94,23%. Houve concordância moderada entre o diagnóstico da PAAF e o diagnóstico histopatológico final (κ = 0,52).
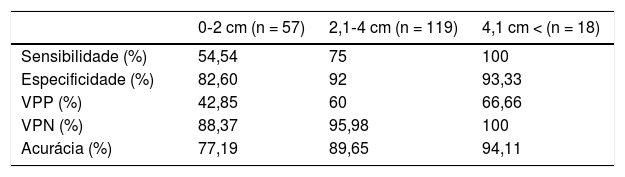
Em tumores com menos de 2cm, a sensibilidade foi de 54,54%, enquanto nos maiores foi de 77,77%. Nos tumores que se estendiam até o lobo profundo, a sensibilidade foi de 80%. A concordância entre a PAAF e o diagnóstico histopatológico final foi correlacionada com o tamanho do tumor (p = 0,0) e envolvimento do lobo profundo (p = 0,004). A eficácia da PAAF de acordo com o envolvimento do lobo profundo e o tamanho do tumor pode ser vista nas tabelas 5 e 6.
Eficácia da PAAF de acordo com a extensão até o lobo profundo
| Com extensão (n = 28) | Sem extensão (n = 166) | |
|---|---|---|
| Sensibilidade (%) | 80 | 63,15 |
| Especificidade (%) | 82,35 | 90,34 |
| VPP (%) | 72,72 | 46,15 |
| VPN (%) | 87,5 | 94,92 |
| Acurácia (%) | 81,48 | 87,19 |
PAAF, Punção Aspirativa com Agulha Fina; VPN, valor preditivo negativo; VPP, valor preditivo positivo.
Eficácia da PAAF de acordo com o tamanho do tumor
| 0‐2 cm (n = 57) | 2,1‐4 cm (n = 119) | 4,1 cm < (n = 18) | |
|---|---|---|---|
| Sensibilidade (%) | 54,54 | 75 | 100 |
| Especificidade (%) | 82,60 | 92 | 93,33 |
| VPP (%) | 42,85 | 60 | 66,66 |
| VPN (%) | 88,37 | 95,98 | 100 |
| Acurácia (%) | 77,19 | 89,65 | 94,11 |
PAAF, Punção Aspirativa com Agulha Fina; VPN, valor preditivo negativo; VPP, valor preditivo positivo.
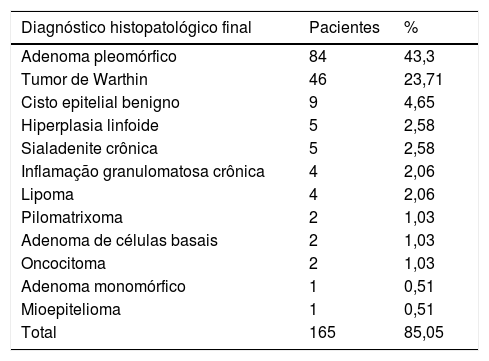
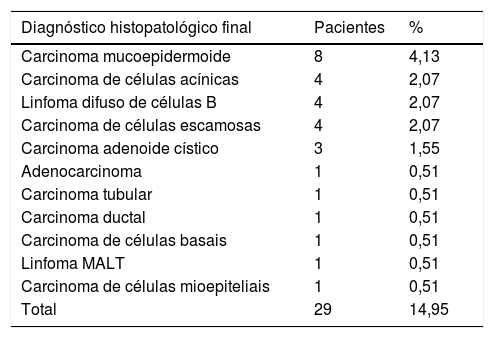
Os tumores da glândula parótida constituem 3% dos tumores de cabeça e pescoço.1 Os tumores benignos são mais frequentes do que os tumores malignos. Em nosso estudo, os tumores benignos foram mais comuns em 85,05% dos casos, o tipo mais comum foi o adenoma pleomórfico (43,3%), em acordo com a literatura.3,4 O segundo tumor benigno mais comum foi o tumor de Whartin (23,71%).3,4 Os tumores malignos foram observados em 14,95% dos casos, o tipo histopatológico mais comum foi o carcinoma mucoepidermoide (4,13%), também de acordo com a literatura.3 A distribuição dos diagnósticos histopatológicos finais benignos e malignos dos tumores em nosso estudo é mostrada nas tabelas 7 e 8, respectivamente.
Tumores benignos de parótida de acordo com o diagnóstico histopatológico final
| Diagnóstico histopatológico final | Pacientes | % |
|---|---|---|
| Adenoma pleomórfico | 84 | 43,3 |
| Tumor de Warthin | 46 | 23,71 |
| Cisto epitelial benigno | 9 | 4,65 |
| Hiperplasia linfoide | 5 | 2,58 |
| Sialadenite crônica | 5 | 2,58 |
| Inflamação granulomatosa crônica | 4 | 2,06 |
| Lipoma | 4 | 2,06 |
| Pilomatrixoma | 2 | 1,03 |
| Adenoma de células basais | 2 | 1,03 |
| Oncocitoma | 2 | 1,03 |
| Adenoma monomórfico | 1 | 0,51 |
| Mioepitelioma | 1 | 0,51 |
| Total | 165 | 85,05 |
Tumores malignos da parótida de acordo com o diagnóstico histopatológico final
| Diagnóstico histopatológico final | Pacientes | % |
|---|---|---|
| Carcinoma mucoepidermoide | 8 | 4,13 |
| Carcinoma de células acínicas | 4 | 2,07 |
| Linfoma difuso de células B | 4 | 2,07 |
| Carcinoma de células escamosas | 4 | 2,07 |
| Carcinoma adenoide cístico | 3 | 1,55 |
| Adenocarcinoma | 1 | 0,51 |
| Carcinoma tubular | 1 | 0,51 |
| Carcinoma ductal | 1 | 0,51 |
| Carcinoma de células basais | 1 | 0,51 |
| Linfoma MALT | 1 | 0,51 |
| Carcinoma de células mioepiteliais | 1 | 0,51 |
| Total | 29 | 14,95 |
Linfoma MALT, Linfoma de tecido linfoide associado a mucosa (do inglês Mucosa‐Associated Lymphoid Tissue).
Os tumores da glândula parótida são mais comuns em homens.3 Em nosso estudo, a idade dos pacientes era de 47,5 ± 15,88 (7-82); 88 (45,36%) dos pacientes eram do sexo feminino e 106 (54,64%) do masculino. Houve leve predominância do sexo masculino em nossos casos. Os tumores benignos de parótida são mais comumente vistos na quinta década e lesões malignas na sexta década.3,4 A média da idade foi de 47,2 anos para tumores benignos e 50,2 para tumores malignos. No entanto, não houve diferença significativa entre a média de idade dos casos benignos e malignos em nosso estudo (p > 0,05).
O exame clínico, o exame de imagem e a PAAF podem ser usados na avaliação pré‐operatória dos tumores da glândula parótida. A ultrassonografia (US) de alta resolução é a modalidade de imagem mais aceita.5–7 Outras modalidades de exame de imagem são a tomografia computadorizada (TC) e a ressonância magnética (RM). A TC e a RM são mais custosas e é necessário usar material de contraste. A escolha da US em relação à TC ou à RM,8,9 portanto, ocorre pela sua maior facilidade de implantação e a possibilidade de fazer a PAAF guiada por US. De maneira similar, nossos foram pacientes foram submetidos à US para aquisição de imagens e PAAF simultaneamente. Segundo Brenan et al.,10 a US pode fornecer informações adequadas para a imagem inicial em tumores no lobo superficial da glândula parótida e que algumas dificuldades podem ser encontradas nos casos que se estendem até o lobo profundo. Nesse caso, o uso de RM é preferido. Se a extensão até o lobo profundo e/ou suspeita de malignidade for detectada com US ou PAAF, uma TC e/ou RM é feita para avaliação adicional.
O tratamento primário dos tumores malignos da glândula parótida é geralmente cirúrgico. A extensão da cirurgia depende do tipo histopatológico.3 Com o diagnóstico pré‐operatório correto, uma melhor avaliação da possível extensão da cirurgia pode ajudar o cirurgião no planejamento pré‐operatório e no aconselhamento ao paciente, já que o esvaziamento cervical e o sacrifício do nervo facial podem ser necessários no caso de um tumor maligno. Embora as técnicas de imagem forneçam muita informação para a avaliação dos tumores da glândula parótida, o exame histopatológico ou citológico deve ser usado para o planejamento cirúrgico correto. A biópsia com agulha cortante (tru‐cut) guiada por US ou a punção da glândula parótida aberta não são preferidas devido aos riscos de complicações sérias, como deterioração da cápsula tumoral e possibilidade de disseminação do tumor.5,11 Em 1987, Layfield et al.12 fizeram um estudo no qual mostraram 58% de consistência entre a PAAF e diagnóstico histopatológico final para tumores de cabeça e pescoço. Embora a PAAF tenha sido descrita há muito tempo, começou a ganhar popularidade após este estudo e atualmente é feita rotineiramente. A PAAF é um método barato, rápido e fácil para o diagnóstico pré‐operatório, com baixa taxa de complicações e morbidade.13–15 Raramente complicações como sangramento, lesão do nervo facial, fibrose e erosão tumoral têm sido relatadas na literatura.7 Nenhuma complicação devido à PAAF foi observada em nosso estudo.
A PAAF demonstrou ser uma modalidade importante na avaliação das lesões da glândula tireoide e linfonodos, mas não há consenso sobre seu uso em grandes tumores das glândulas salivares. Tem sido demonstrado que a estrutura heterogênea das glândulas salivares é razão para a ampla variação da sensibilidade relatada em muitos estudos.16 De acordo com alguns pesquisadores, os tumores da parótida, exceto os adenomas pleomórficos, são incomuns e os citopatologistas podem diagnosticar erroneamente com o uso da PAAF se não forem especializados em tumores de parótida. Portanto, eles sugerem que a PAAF pode ser útil no planejamento pré‐operatório, mas não deve se sobrepor à experiência clínica do cirurgião e aos achados intraoperatórios.17
Para maior sensibilidade, a PAAF deve ser feita por um médico experiente. A PAAF deve incluir o córtex do tumor da glândula parótida e as amostras devem ser examinadas por citopatologistas experientes.11 Especialmente em lesões císticas, se a amostra for retirada do núcleo e não incluir o córtex, a probabilidade de conter material necrótico aumenta, leva a resultados não diagnósticos ou falsos negativos. Viguer et al.18 recomendaram a aspiração de vários pontos no mesmo tumor para reduzir a taxa de resultados falsos negativos. Em nosso estudo, as PAAFs foram feitas por radiologistas experientes guiadas por US; a seringa foi movida em 4-5 direções através do tumor, sem ser removida, para obtenção de material suficiente para o diagnóstico e avaliação por patologistas experientes.
Os valores relatados de sensibilidade e especificidade da PAAF também variam em diferentes populações.19,20 A sensibilidade varia entre 38%21 e 97%22 e a especificidade varia entre 81%13 e 100%.23 Para a acurácia diagnóstica, sensibilidade e especificidade, encontramos os valores de 86,52%, 68,96% e 89,63%, respectivamente, para a PAAF na detecção de malignidade. O valor preditivo positivo foi de 54,05% e o valor preditivo negativo foi de 94,23%.
O tamanho do tumor e o envolvimento do lobo profundo foram associados com a eficácia da PAAF.5 Ghantous et al. verificaram que a precisão da PAAF é maior5 em pacientes com tumores da glândula parótida maiores do que 24mm identificados na TC. Em nosso estudo, a sensibilidade da PAAF nos tumores menores do que 2cm foi de 54,54% e nos maiores do que 2cm foi de 77,77%. Nos tumores das glândulas parótidas com extensão até o lobo profundo, a sensibilidade da PAAF foi calculada em 80% e nos tumores do lobo superficial, em 63,15%. Em nossos pacientes, não foram encontrados tumores da parótida que envolvessem o lobo profundo de maneira isolada; geralmente os casos apresentam uma extensão até o lobo profundo a partir do lobo superficial. Acreditamos que a maior sensibilidade da PAAF nos tumores da parótida com extensão até o lobo profundo pode ser devido ao seu maior tamanho e que mais pacientes com envolvimento isolado do lobo profundo devem ser examinados.
Nosso estudo apresenta algumas desvantagens devido à sua natureza retrospectiva. Como possivelmente diferentes patologistas analisaram as amostras da PAAF nos 10 anos, alguma variação pode ter ocorrido nas interpretações. Resultados histopatológicos que não estavam disponíveis também podem ter afetado nossos resultados. No entanto, devido à baixa incidência de tumores nas glândulas parótidas, torna‐se necessário um período mais longo para acumular um número maior de casos e esses fatores podem ser considerados inevitáveis. Além disso, nossos resultados são semelhantes a resultados publicados anteriormente.
ConclusãoA PAAF é uma importante ferramenta diagnóstica na avaliação dos tumores da glândula parótida. A especificidade, sensibilidade e precisão da PAAF variam e dependem da localização nos lobos superficial e profundo da glândula parótida e do tamanho do tumor. Sua precisão é maior em tumores benignos. A sensibilidade é maior em tumores maiores do que 2cm e com extensão até o lobo profundo. O uso da PAAF em combinação com a avaliação clínica e radiológica pode ajudar a reduzir diagnósticos falsos positivos e falsos negativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Altin F, Alimoglu Y, Acikalin RM, Yasar H. Is fine needle aspiration biopsy reliable in the diagnosis of parotid tumors? Comparison of preoperative and postoperative results and the factors affecting accuracy. Braz J Otorhinolaryngol. 2019;85:275–81.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.