A hipocalcemia é uma das complicações mais comuns após a tireoidectomia total. A concentração sérica de vitamina D tem sido apontada como fator de risco para essa complicação. No entanto, o assunto ainda é controverso e o papel da vitamina D na ocorrência de hipocalcemia permanece incerto.
ObjetivoAvaliar se os níveis pré‐operatórios de vitamina D são capazes de predizer a hipocalcemia pós‐tireoidectomia total.
MétodoQuarenta e sete pacientes com tireoidectomia total foram avaliados prospectivamente quanto aos níveis séricos de 25(OH)vitamina D, cálcio e paratormônio antes da cirurgia, cálcio a cada 6 horas e paratormônio 8 horas após a cirurgia. Os pacientes foram divididos de acordo com o cálcio corrigido no pós‐operatório em grupos sem (cálcio corrigido ≥ 8,5mg/dL) e com hipocalcemia (cálcio corrigido < 8,5mg/dL), que foram avaliados em relação aos valores pré‐operatórios de 25(OH)vitamina D.
Resultados72,3% dos casos apresentaram concentrações séricas pré‐operatórias alteradas de vitamina D‐ 25 hidroxi e 51% desenvolveram hipocalcemia no pós‐operatório. Os grupos com e sem hipocalcemia não diferiram para a 25(OH)vitamina D pré‐operatório (p = 0,62). A análise univariada mostrou que a idade (p = 0,03), a concentração de paratormônio no pós‐operatório (p = 0,02) e o diagnóstico anatomopatológico de malignidade (p = 0,002) foram preditores de hipocalcemia no pós‐operatório. Na análise multivariada, apenas o paratormônio no pós‐operatório (p = 0,02) foi associado a hipocalcemia pós‐tireoidectomia total.
ConclusãoAs concentrações séricas pré‐operatórias de 25(OH)vitamina D não foram preditores de hipocalcemia pós‐tireoidectomia total, enquanto o paratormônio pós‐operatório influenciou a ocorrência dessa complicação.
A tireoidectomia total é uma das cirurgias mais comuns em cabeça e pescoço no mndo todo. A hipocalcemia é uma das complicações mais frequentes, que pode levar a sérias consequências e até mesmo à morte.1 É difícil estabelecer sua prevalência exata, considerando a ampla gama de definições e as diferenças amostrais.2
Apesar de a etiologia mais frequente da hipocalcemia pós‐tireoidectomia total ser o hipoparatireoidismo, secundária à lesão direta intraoperatória ou à desvascularização da paratireoide,3 outros fatores parecem predispor a essa condição clínico‐laboratorial, como hemodiluição, liberação de calcitonina, idade avançada, doença de Graves, técnica cirúrgica e experiência do cirurgião.4,5 Recentemente, alguns autores sugeriram que as concentrações séricas de vitamina D poderiam apresentar um fator de risco para o desenvolvimento de hipocalcemia.2,4,6–8 Yamashita et al. relataram que pacientes com doença de Graves com deficiência de vitamina D e níveis elevados de fosfatase alcalina apresentavam maior risco de desenvolver tetania pós‐tireoidectomia.9 Al‐Khatib et al. observaram que pacientes com níveis de vitamina D 25 hidroxi (25OHD) pré‐operatórios menores do que 25 nmol/L apresentavam um risco 7,3 vezes maior de desenvolver hipocalcemia pós‐tireoidectomia.2 Entretanto, o papel desse nível como preditor de hipocalcemia ainda é controverso. Falcone et al. avaliaram retrospectivamente 264 pacientes e concluíram que o 25OHD não previu uma queda no cálcio pós‐operatório.3 Lang et al. relataram que o déficit pré‐operatório de 25OHD (valores abaixo de 20 ng/mL) não aumentou a taxa de hipocalcemia pós‐tireoidectomia.10 Algumas das razões para esses resultados discordantes podem ser os critérios usados ??para diagnosticar a hipocalcemia, valores de corte para 25OHD e a heterogeneidade do grupo de estudo.
Diante disso, o objetivo principal de nosso estudo foi avaliar a capacidade das concentrações séricas pré‐operatórias de vitamina D na predição de hipocalcemia em um grupo homogêneo de pacientes submetidos à tireoidectomia total.
MétodoNeste estudo observacional prospectivo, avaliamos 47 pacientes submetidos à tireoidectomia total em um hospital terciário entre maio de 2017 e novembro de 2018, que preencheram os critérios de seleção descritos a seguir. A aprovação foi obtida do Comitê de Ética em Pesquisa local (Aprovação: 2.046.729) e todos os pacientes foram informados sobre o estudo e assinaram o termo de consentimento livre e esclarecido.
A cirurgia foi feita sempre pela mesma equipe (C.S.P.S. & J.V.T.) e a técnica cirúrgica padrão incluiu a dissecção capsular da glândula tireoide com identificação cuidadosa e conservação das glândulas paratireoides junto ao nervo laríngeo recorrente.
Os critérios de inclusão compreenderam pacientes entre 18 e 85 anos submetidos à tireoidectomia total por doença maligna ou benigna da tireoide. Os critérios de exclusão foram casos com hiper ou hipotireoidismo não controlado, doença da paratireoide, pacientes submetidos a qualquer tipo de procedimento dialítico e aqueles que recebiam medicações que alteravam as concentrações séricas de cálcio.
Os seguintes dados gerais foram coletados para caracterização da amostra: sexo, idade (em anos), volume da tireoide pelo exame ultrassonográfico (em cm3), diagnóstico anatomopatológico (maligno ou não) e se a linfadenectomia cervical central havia ou não sido feita no momento da cirurgia.
O principal desfecho avaliado foi a ocorrência de hipocalcemia nas primeiras 48 horas após a cirurgia, enquanto a principal variável de interesse foi a concentração sérica pré‐operatória de 25OHD. Todos os pacientes também forneceram amostras de sangue na hospitalização para análise do hormônio tireoestimulante (TSH), tiroxina livre (T4L), cálcio sérico e frações de proteína e paratormônio (PTH). Após a cirurgia, os pacientes foram novamente avaliados para níveis de PTH 8h após a tireoidectomia total e cálcio corrigido a cada 6h no período pós‐operatório por 48h. A fórmula de Payne foi usada para ajustar os valores de cálcio, onde: cálcio corrigido = cálcio + 0,8 (4‐albumina).
Os pacientes foram classificados de acordo com a concentração sérica de vitamina D no pré‐operatório, onde valores de 25OHD ≥ 30 ng/mL foram considerados normais e < 30 ng/mL foram considerados alterados.11 Os pacientes também foram subdivididos em grupos com e sem hipocalcemia, 48 horas após a cirurgia, onde a hipocalcemia foi considerada quando o cálcio corrigido era < 8,5mg/dL nas primeiras 48 horas de pós‐operatório. Grupos com e sem hipocalcemia e com o 25OHD normal ou alterado foram comparados considerando‐se os parâmetros listados acima.
Análise estatísticaA análise descritiva dos dados foi feita com frequência e porcentagens para variáveis qualitativas e médias e desvios‐padrão para variáveis quantitativas. A comparação das variáveis com distribuição simétrica foi feita com o teste t de Student. Variáveis com distribuição assimétrica foram ajustadas com um modelo linear generalizado com distribuição gama, seguido de comparações múltiplas. O mesmo procedimento foi feito para a vitamina D. Para verificar a associação entre as variáveis explicativas e a hipocalcemia, aplicamos o teste qui‐quadrado ou exato de Fisher, quando necessário. Por fim, para verificar os fatores que influenciaram o desfecho, foi aplicado um modelo ajustado de regressão logística univariada e as variáveis que apresentaram p < 0,15 foram usadas em um modelo de regressão logística multivariada. O nível de significância adotado foi de 5%. Para todas as análises, usamos o software SAS versão 9.4.
ResultadosDos pacientes avaliados, 39 (83%) eram do sexo feminino. A idade média (± desvio‐padrão) da amostra foi de 50 (± 14,5) anos. O volume médio da tireoide foi de 34,2 (± 46,5) cm3.. A malignidade foi identificada pelo exame anatomopatológico em 28 (60,9%) pacientes, dos quais 7 (25%; 14,9% do total) foram submetidos à linfadenectomia cervical central.
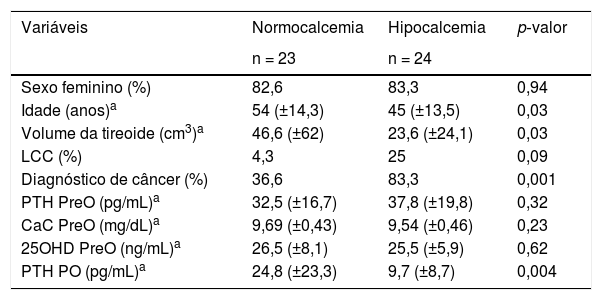
Vinte e quatro (51%) pacientes desenvolveram hipocalcemia no pós‐operatório (tabela 1). Os pacientes com hipocalcemia apresentaram idade menor (p = 0,03) e menor volume da tireoide (p = 0,03) do que o grupo normocalcêmico. O diagnóstico anatomopatológico de lesão maligna foi mais frequente no grupo com hipocalcemia (p = 0,001). As concentrações de PTH no pós‐operatório foram menores no grupo hipocalcêmico do que no grupo normocalcêmico (p = 0,004). Não houve diferenças estatísticas entre os grupos quanto a sexo, presença ou ausência de linfadenectomia cervical central, cálcio corrigido, PTH e 25OHD pré‐operatório.
Comparação entre os grupos com e sem hipocalcemia pós‐operatória
| Variáveis | Normocalcemia | Hipocalcemia | p‐valor |
|---|---|---|---|
| n = 23 | n = 24 | ||
| Sexo feminino (%) | 82,6 | 83,3 | 0,94 |
| Idade (anos)a | 54 (±14,3) | 45 (±13,5) | 0,03 |
| Volume da tireoide (cm3)a | 46,6 (±62) | 23,6 (±24,1) | 0,03 |
| LCC (%) | 4,3 | 25 | 0,09 |
| Diagnóstico de câncer (%) | 36,6 | 83,3 | 0,001 |
| PTH PreO (pg/mL)a | 32,5 (±16,7) | 37,8 (±19,8) | 0,32 |
| CaC PreO (mg/dL)a | 9,69 (±0,43) | 9,54 (±0,46) | 0,23 |
| 25OHD PreO (ng/mL)a | 26,5 (±8,1) | 25,5 (±5,9) | 0,62 |
| PTH PO (pg/mL)a | 24,8 (±23,3) | 9,7 (±8,7) | 0,004 |
CaC, cálcio corrigido; LCC, linfadenectomia cervical central; n, número; PO, pós‐operatório; PreO, pré‐operatório; PTH, paratormônio; 25OHD, vitamina D.
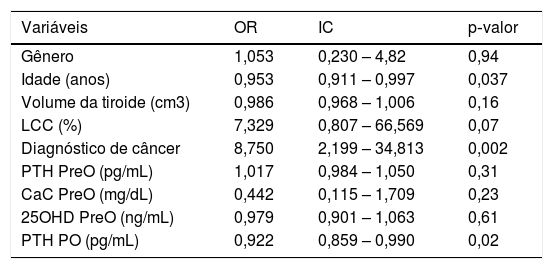
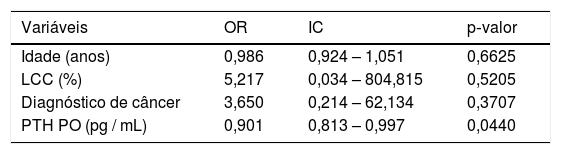
A análise univariada revelou que os preditores de hipocalcemia no pós‐operatório foram idade, concentração de PTH no pós‐operatório e diagnóstico anatomopatológico de malignidade (tabela 2). As concentrações séricas de 25OHD não foram preditoras desse desfecho. Considerando a idade, a feitura da linfadenectomia cervical central, o diagnóstico de malignidade e o PTH no pós‐operatório, a análise multivariada mostrou uma associação apenas entre o PTH e a hipocalcemia pós‐tireoidectomia total (tabela 3).
Regressão logística univariada na predição de hipocalcemia pós‐tireoidectomia total
| Variáveis | OR | IC | p‐valor |
|---|---|---|---|
| Gênero | 1,053 | 0,230 – 4,82 | 0,94 |
| Idade (anos) | 0,953 | 0,911 – 0,997 | 0,037 |
| Volume da tiroide (cm3) | 0,986 | 0,968 – 1,006 | 0,16 |
| LCC (%) | 7,329 | 0,807 – 66,569 | 0,07 |
| Diagnóstico de câncer | 8,750 | 2,199 – 34,813 | 0,002 |
| PTH PreO (pg/mL) | 1,017 | 0,984 – 1,050 | 0,31 |
| CaC PreO (mg/dL) | 0,442 | 0,115 – 1,709 | 0,23 |
| 25OHD PreO (ng/mL) | 0,979 | 0,901 – 1,063 | 0,61 |
| PTH PO (pg/mL) | 0,922 | 0,859 – 0,990 | 0,02 |
OR, odds ratio; IC, intervalo de confiança, nível de significância: p < 0,05; CaC, cálcio corrigido; CL, linfadenectomia cervical central; PO, pós‐operatório; PreO, pré‐operatório; PTH, paratormônio; 25OHD, vitamina D,
Regressão logística multivariada na predição de hipocalcemia pós‐tireoidectomia total
| Variáveis | OR | IC | p‐valor |
|---|---|---|---|
| Idade (anos) | 0,986 | 0,924 – 1,051 | 0,6625 |
| LCC (%) | 5,217 | 0,034 – 804,815 | 0,5205 |
| Diagnóstico de câncer | 3,650 | 0,214 – 62,134 | 0,3707 |
| PTH PO (pg / mL) | 0,901 | 0,813 – 0,997 | 0,0440 |
OR, odds ratio; IC, intervalo de confiança, nível de significância: p < 0,05; LCC, linfadenectomia cervical central; PO, pós‐operatório; PTH, paratormônio.
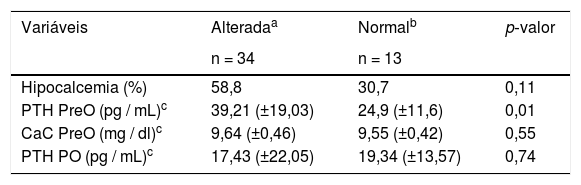
Trinta e quatro pacientes (72,3%) apresentaram níveis séricos pré‐operatórios alterados de 25OHD: 7 (14,9%) < 20 ng/mL e 27 (57,4%) ≥ 20 e < 29 ng/mL. Treze pacientes (27,7%) apresentaram níveis ≥ 30 ng/mL. A média (± DP) dos níveis séricos de 25OHD para os grupos com vitamina D alterada e normal foi de 22,79 (± 4,95) e 34,53 (± 3,73) ng/mL, respectivamente. Grupos com níveis alterados e normais de 25OHD apresentaram níveis diferentes de PTH pré‐operatório (p = 0,01) e não houve diferenças significantes para o cálcio pré‐operatório corrigido (p = 0,55), PTH no pós‐operatório (p = 0,74) e a frequência de pacientes que desenvolveram hipocalcemia no pós‐operatório (p = 0,11) (tabela 4).
Comparação entre os grupos com concentração alterada e normal de 25OHD
| Variáveis | Alteradaa | Normalb | p‐valor |
|---|---|---|---|
| n = 34 | n = 13 | ||
| Hipocalcemia (%) | 58,8 | 30,7 | 0,11 |
| PTH PreO (pg / mL)c | 39,21 (±19,03) | 24,9 (±11,6) | 0,01 |
| CaC PreO (mg / dl)c | 9,64 (±0,46) | 9,55 (±0,42) | 0,55 |
| PTH PO (pg / mL)c | 17,43 (±22,05) | 19,34 (±13,57) | 0,74 |
Testes estatísticos: teste t de Student e qui‐quadrado; nível de significância: p < 0,05.
CaC, cálcio corrigido; n, número; PO, pós‐operatório; PreO, pré‐operatório; PTH, paratormônio.
Neste estudo, que avaliou um grupo de pacientes relativamente homogêneos submetidos a tireoidectomia total, observamos que as concentrações séricas pré‐operatórias de 25OHD não foram preditoras de hipocalcemia pós‐operatória. O metabolismo do cálcio depende, entre outras coisas, da ação do PTH e da vitamina D. Por um lado, o hormônio promove a reabsorção renal de cálcio; por outro lado, a vitamina estimula a absorção intestinal de cálcio.6 Ambos agem de forma extremamente integrada, com o objetivo final principal de manter a calcemia. Assim, a deficiência de vitamina D com a consequente redução na absorção intestinal de cálcio leva ao hiperparatiroidismo secundário compensatório com hipertrofia das glândulas paratireoides e aumento da reabsorção óssea e renal de cálcio induzida pelo PTH. Em nosso estudo, essa resposta compensatória do PTH foi confirmada pelos níveis mais elevados de PTH no pré‐operatório no grupo com 25OHD < 30 ng/dL. Curiosamente, isso ocorreu mesmo com níveis médios de 25OHD compatíveis com insuficiência, e não com deficiência de vitamina D no grupo alterado.11 É importante ressaltar que a maioria dos pacientes avaliados apresentava níveis abaixo de 30 ng/mL. Desses, a maioria estava entre 20 e 29 ng/mL. Embora recentemente o nível de corte para a normalidade de 25OHD tenha sido questionado, tendeu‐se a considerar um valor de 20 ng/mL,12 nosso estudo mostrou que os níveis de PTH eram muito mais altos, mesmo quando os níveis de vitamina D não eram tão baixos.
Apesar do exposto acima, neste estudo não observamos relação entre hipocalcemia pós‐ tireoidectomia total e níveis pré‐operatórios de 25OHD. Não houve diferença nos níveis séricos de 25OHD entre os pacientes com normocalcemia e aqueles com hipocalcemia e não houve diferença na porcentagem de evolução da hipocalcemia entre aqueles com concentrações séricas normais e baixas de 25OHD. Teoricamente, os pacientes com níveis séricos reduzidos de vitamina D são mais propensos a desenvolver hipocalcemia em função de uma maior dependência dos mecanismos de reabsorção óssea e renal induzida pelo PTH.3 Vários estudos têm tentado correlacionar a deficiência de vitamina D com a hipocalcemia pós‐tireoidectomia total, porém esse tema ainda é controverso. Griffin et al. analisaram retrospectivamente 121 pacientes submetidos a tireoidectomia total e não encontraram relação entre hipocalcemia pós‐tireoidectomia total, totalização de tireoidectomia e deficiência de vitamina D.13 Danan e Sohnka, após avaliar 67 pacientes, concluíram que aqueles que tinham 3 ou mais glândulas paratireoides identificadas no período intraoperatório, associadas a concentrações séricas de 25OHD inferiores a 25 ng/mL, apresentaram um risco 5,8 vezes maior de desenvolver hipocalcemia após a cirurgia.6 As razões para esses resultados conflitantes podem ser devido a diferenças nos níveis de corte bioquímicos usados, assim como as características do paciente. Sabe‐se, por exemplo, que o risco de hipocalcemia seria maior em pacientes com tendência à “síndrome do osso com fome” no pós‐operatório (por exemplo, tireoidectomia devido a doença grave ou associada ao hiperparatireoidismo) e com um importante déficit de vitamina D.9 Em nosso estudo, os pacientes foram rigorosamente selecionados para ambas as morbidades ou medicações que poderiam influenciar o metabolismo do cálcio e, como já discutido, não apresentavam deficiência grave de vitamina D.
Embora outros parâmetros frequentemente associados à hipocalcemia tenham inicialmente mostrado uma relação com esse desfecho, apenas o PTH pós‐operatório permaneceu significante na análise multivariada. Portanto, o hormônio coletado 8h após a tireoidectomia total foi o único fator preditivo para hipocalcemia pós‐operatória. Esse achado concorda com os relatados por outros autores,14,15 inclusive uma recente metanálise que observou que a hipocalcemia transitória estava relacionada a um baixo valor de PTH entre 30 minutos e 5 dias após a cirurgia.16
A principal limitação do nosso estudo é o tamanho da amostra relativamente modesto, que impediu a análise de um intervalo mais estreito dos níveis de 25OHD. Entretanto, o estudo tem o mérito da análise prospectiva, além dos rigorosos critérios usados para excluir fatores confundidores de resultados.
ConclusãoOs níveis séricos de 25OHD não foram preditores de hipocalcemia no pós‐operatório no grupo de pacientes estudados. A influência do PTH pós‐operatório na ocorrência de hipocalcemia confirma a necessidade de mais estudos focados nos níveis desse hormônio, a fim de compreender melhor a dinâmica hormonal e os processos envolvidos na redução da calcemia pós‐tireoidectomia total.
Conflitos de interesseOs autores declaram não haver conflitos de interesse
A Eloisa Elena Paschoalinotte, do Escritório de Apoio à Pesquisa (EAP) da Escola de Medicina de Botucatu (FMB) da Universidade Estadual Paulista (Unesp), pelo suporte estatístico.
Como citar este artigo: Soares CS, Tagliarini JV, Mazeto GM. Preoperative vitamin D level as a post‐total thyroidectomy hypocalcemia predictor: a prospective study. Braz J Otorhinolaryngol. 2021;87:85–9.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.