As células progenitoras da orelha interna têm potencial para diferenciação multidirecional. O ácido retinoico é uma condição importante para o desenvolvimento da orelha interna. O bloqueio da via de sinalização do ácido retinoico no órgão de Corti pode reduzir significativamente o número de células ciliadas. Portanto, acreditamos que o ácido retinoico pode induzir a regeneração das células ciliadas do ouvido interno.
ObjetivoInvestigar se as células progenitoras neurais cocleares mantêm as características das células‐tronco durante a recuperação e subcultura, se o ácido retinoico pode induzir a transformação de células progenitoras neurais cocleares em células ciliadas in vitro e se o ácido retinoico promove ou inibe a proliferação das células progenitoras durante a diferenciação.
MétodoAs células progenitoras neurais cocleares foram cultivadas e induzidas em DMEM/F12+AR (10‐6M) e, então, foram detectadas as expressões de marcadores das células ciliadas (Math1 e Myosin?a) com o uso de citoquímica por imunofluorescência e real time ‐polymerase chain reaction e a proliferação de células progenitoras neurais cocleares foi detectada pelo teste Brdu.
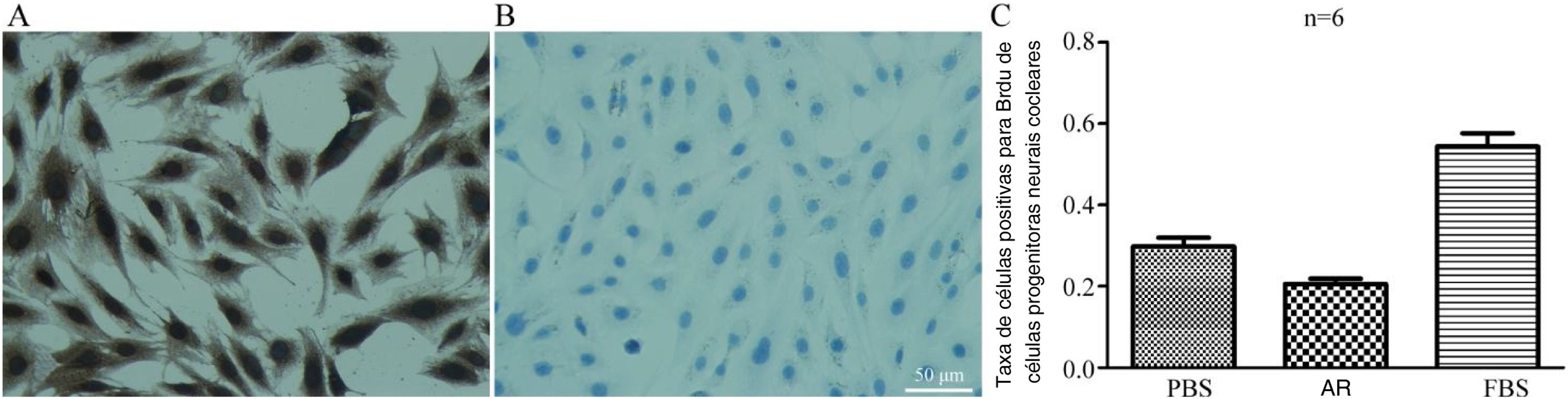
ResultadosA nestina das células progenitoras neurais cocleares foi expressa positivamente. As proporções de células positivas para Math1 no grupo controle e no grupo experimental foram 1,5% e 63%, respectivamente; as proporções de células positivas para Myosin?a no grupo controle e no grupo experimental foram de 0,96% e 56%, respectivamente (p <0,05). As proporções de células marcadas com Brdu+ no grupo ácido retinoico, grupo PBS e grupo FBS foram de 20,6%, 29,9% e 54,3%, respectivamente; no entanto, a taxa de proliferação no grupo experimental diminuiu.
ConclusõesO ácido retinoico pode promover a diferenciação das células progenitoras neurais cocleares em células ciliadas.
O número de pacientes com surdez neurossensorial tem aumentado e o implante coclear tem alcançado certos efeitos na restauração da audição como um substituto artificial para a orelha interna; entretanto, a resolução do implante coclear para o som não consegue atingir o nível coclear normal.1 Além disso, devido ao trauma e aos riscos do implante coclear, seus efeitos a longo prazo ainda precisam de mais avaliações. Portanto, explorar métodos eficazes para a regeneração e recuperação funcional das células ciliadas da orelha interna ainda é um importante objetivo na pesquisa para perda auditiva neurossensorial. Ao contrário dos não mamíferos,2 as células ciliadas dos mamíferos têm capacidades regenerativas muito limitadas, que estão longe da recuperação funcional.3,4 Nos últimos anos, o transplante de células‐tronco tornou‐se um ponto importante de pesquisa para perda auditiva neurossensorial. As células‐tronco embrionárias,5,6 as células‐tronco mesenquimais da medula óssea7 ou as células progenitoras neurais (CPNs) cocleares8 já foram aplicadas no estudo da regeneração de células ciliadas e também expressaram certos marcadores de células ciliadas. As células‐tronco podem ser divididas em células primárias e linhagens celulares. As células primárias têm características biológicas mais próximas das células vivas, mas sua viabilidade celular é fraca e algumas delas não conseguem sobreviver por três gerações; as linhagens de células têm propriedades biológicas estáveis, são mais convenientes para estudos e podem ser muito facilmente usadas para explorar os efeitos de um único fator na diferenciação celular. Neste estudo, o ácido retinoico (AR) foi usado para induzir a diferenciação de células progenitoras da orelha interna. As células progenitoras da orelha interna usadas neste estudo foram as linhagens celulares derivadas de células epiteliais sensoriais auditivas de camundongo, que foram estabelecidas em 2003 por Ozeki et al.9 As CPNs podem entrar novamente no ciclo celular sob a ação de fatores específicos de diferenciação celular e vias de sinalização e podem se diferenciar em células ciliadas. LIN JL usou a molécula de sinalização Sonic Hedgehog (SHH), o fator de crescimento epidérmico (EGF, do inglês Epidermal Growth Factor), ácido retinoico e o fator neurotrófico derivado do cérebro (BDNF, do inglês Brain‐derived neurotrophic factor) para coinduzir CPNs e verificou que isso pode induzir as células progenitoras da orelha interna a se diferenciarem em células ciliadas.10 Malgrange usou SHH para induzir diretamente as CPNs a se diferenciarem em células ciliadas,11 indicou que as CPNs são as células precursoras das células ciliadas e uma fonte ideal de células‐tronco.
As células progenitoras da orelha interna podem se diferenciar em células ciliadas sob a influência de vários fatores de indução, mas o papel do fator único não está claro. A razão pela qual o AR foi usado para induzir a diferenciação celular neste estudo dependeu de suas características. O AR é uma molécula lipofílica de baixo peso molecular que pode ser facilmente obtida e é uma das condições importantes para o da orelha interna. O AR pode regular a expressão de proteínas ao nível do gene.3 Ele pode regular a expressão da proteína cito‐esquelética Myosin?a ao nível do gene, que é um dos marcadores das células ciliadas.12 Durante a regeneração de células ciliadas de peixes e frangos,13 o AR promove células de suporte para se diferenciarem em células ciliadas. A diferenciação e regeneração em células ciliadas ocorrem principalmente através de duas formas: 1) As células precursoras sensoriais reentram no ciclo celular após serem induzidas e ativadas, seguido da proliferação por mitose e posterior diferenciação em células ciliadas e células de suporte; 2) As células precursoras sensoriais se diferenciam diretamente em células ciliadas.14 O AR tem certos efeitos protetores sobre a audição.15,16 O bloqueio da via de sinalização do AR no órgão de Corti revela que o número de células ciliadas é significativamente reduzido.17 Portanto, consideramos que esse também tem certos efeitos na diferenciação das células ciliadas.
Neste estudo, o AR foi usado na indução, para explorar seus papéis na diferenciação de células progenitoras do ouvido interno em células ciliadas.
MétodoCultura e indução de CPNsAs células progenitoras da orelha interna usadas neste estudo foram fornecidas pelo laboratório da University of Minnesota, que é uma linhagem celular de células epiteliais sensoriais auditivas de camundongo, inicialmente estabelecida em 2003 por Ozeki et al.,9 que tem potencial de diferenciação multidirecional18 e homologia relativamente alta com as células auditivas cocleares.
As células progenitoras da orelha interna foram primeiramente removidas de um tubo de criopreservação (University of Minnesota, Minnesota, EUA) e cultivadas em meio que consistiu em DMEM/F12 (Hyclone, Chicago, EUA) + 1% de N2 (Peprotech, New Jersey, EUA) + EGF (10 ng/mL) (Peprotech, New Jersey, EUA) + Bfgf (10 ng/mL) (Peprotech, New Jersey, EUA), o meio de cultura foi trocado em dias intercalados. Um microscópio invertido Nikon (Nikon, Xangai, China) foi usado para observar a morfologia celular e o status de crescimento e a expressão de nestina nas células foi detectada com o método imunoquímico celular. Amostras das células em bom estado de crescimento foram então obtidas, lavadas com PBS e divididas em grupo experimental (EXP) e grupo controle (CON) para posterior cultivo em placas de 12 poços. As células do grupo EXP foram induzidas com DMEM/F12+AR (10–6M) (Sigma, EUA) e as células do grupo CON foram cultivadas com DMEM/F12 + DMSO (0,11mg/mL) (Sigma, EUA); o meio era trocado todos os dias. Após 3 dias, as expressões das proteínas marcadoras de células ciliadas Math1 e Myosin VIIa foram detectadas com citoquímica por imunofluorescência.
Citoquímica por imunofluorescênciaApós aspirar o meio de cultura celular, o resíduo foi enxaguado com PBS 3 vezes *2min, seguido de secagem do líquido residual, fixação em 100μL de paraformaldeído a 4% por 20min, enxágue com PBS 3 vezes *2min, secagem, 15min de perfuração da membrana celular com 100μL de solução de Triton a 0,3%, enxágue com PBS 3 vezes *2min e secagem; 100μL de soro de cabra a 10% foram então adicionados para bloqueio de 30min a 37°C; o soro de cabra foi então removido (sem enxágue); 100μL de nestina anticamundongo produzida em coelho (Bioss, Pequim, China) (diluição 1:100) foram então adicionados para cultura durante a noite a 4°C em um umidificador (PBS foi adicionado para contraste no grupo CON); após a mistura ter sido reaquecida no dia seguinte por 45min, ela foi enxaguada com PBS 3 vezes *2min, seguido por secagem, 15min de cultura com 100μL de polímero adjuvante a 37°C, enxágue com PBS 3 vezes *2min, secagem, 15min de cultura com 100 uL de IgG anticoelho de cabra marcado com HRP (Nakasugi Jinqiao, Pequim, China) a 37°C, enxágue com PBS 3 vezes *2min, secagem, 5min. de cultura com 100μL de solução DAB no escuro em temperatura ambiente, enxágue com água da torneira, secagem, coloração de 2min com 100μL de solução de hematoxilina, enxágue com água destilada, secagem e observação em microscópio invertido.
Reação de polimerase em cadeia em tempo real (RT‐PCR)O reagente trizol foi usado para extrair o RNA total. Foi detectada a concentração e pureza através de um leitor de microplacas. A pureza do RNA total foi OD> 1,8 e a integridade do RNA foi detectada por eletroforese em gel de agarose de RNA. O RNA total foi então transcrito reversamente em cDNA com um kit de transcrição reversa, seguido de amplificação por PCR. Os primers foram sintetizados por Shanghai Shengong.
Primers:
Math1(269bp): upstream: 5,‐CCAGGGTGAGCTGGTAAGG‐3; downstream: 5,‐CGTTGTTGAAGGACGGGAT‐3; Myosin7a(628bp): upstream: 5,‐AAGCACCTGCTCCTGCTCGTCCACG‐3; downstream: 5,‐CTCCCTCTACATCGCTCTGTTCG‐3, GAPDH (462bp): upstream: 5,‐TGCTGTCCCTGTATGCCTCT‐3, downstream: 5,‐GGTCTTTACGGATGTCAACG‐3.
As condições da reação de PCR foram as seguintes: Math1: pré‐desnaturação a 94° C por 5min, desnaturação a 94° C por 30s, annealing a 59,8° C por 30s, 72°C por 30s e extensão dos primers a 72° C por 5‐ min, para 40 ciclos. As condições de reação de Myosin7a e GAPDH foram iguais às de Math1, mas as temperaturas de annealing foram 64° C e 57° C, respectivamente.
Os resultados da eletroforese foram observados com um revelador de imagem em gel.
Expressão intracelular de Math1 e MyosinVIIa após induçãoAs células em bom estado de crescimento foram colhidas, lavadas com PBS, divididas em grupo EXP e grupo CON e então cultivadas em placas de 12 poços. As células do grupo EXP foram induzidas com DMEM/F12 + RA (10‐6M) e as do grupo CON foram tratadas com DMEM/F12 + DMSO (0,11mg/mL); o meio era trocado todos os dias. Após 3 dias, as expressões das proteínas marcadoras de células ciliadas (Math1 e MyosinVIIa) foram detectadas com citoquímica por imunofluorescência. Os procedimentos foram os seguintes: após a remoção do meio de cultura de células, as células foram enxaguadas com PBS 3 vezes *2min, seguido de fixação de 20min com 100 uL de paraformaldeído a 4%, enxágue com PBS 3 vezes *2min, perfuração da membrana celular de 15min com 100μL de solução de Triton a 0,3%, enxágue com PBS 3 vezes *2min; 100μL de soro de cabra a 10% foram então adicionados para bloqueio por 30min a 37°C; o soro de cabra foi então removido (sem enxágue); 80μL de anticamundongo Math1 produzido em coelho (Sigma, EUA) (diluição 1:100) e 80μL de anti‐camundongo Myosin7a produzido em coelho foram então adicionados para cultura durante a noite a 4°C em um umidificador (PBS foi adicionado ao grupo CON para contraste); após a mistura ter sido reaquecida no dia seguinte por 45min, ela foi enxaguada com PBS 3 vezes *2min. Todas as operações devem ser feitas no escuro. Mais tarde, foram adicionadas às células 100μL de IgG anticoelho de cabra marcado com Tric, gota a gota (ZSGB‐BIO, Pequim, China) para incubação de 30min a 37° C, seguido de enxágue com PBS 3 vezes *2min, 2 minutos de incubação com solução DAPI em temperatura ambiente (no escuro), enxágue com PBS 3 vezes * 2min e observação sob um microscópio invertido fluorescente. Cinco campos visuais independentes foram selecionados para contagem de células em cada grupo e a taxa de células positivas foi calculada para análise estatística.
Teste BrduA suspensão de células (a uma concentração de 106 células/mL) foi inoculada em uma placa de 6 poços por um dia. No dia seguinte, as células aderidas à parede foram colhidas e divididas em três grupos: experimental (AR), controle negativo (Ctrl‐) e controle positivo (Ctrl+). O Grupo AR foi cultivado com DMEM/F12 + AR (10–6M) + Brdu (10μg/mL), o Grupo Ctrl‐ foi cultivado em DMEM/F12 + DMSO (0,11mL/mL) + Brdu (10μg/mL), e o grupo Ctrl + foi cultivado em DMEM/F12 + FBS 10% + Brdu (10μg/mL); a cultura durou 48h, o meio de cultura foi trocado todos os dias. O teste imunoquímico celular foi feito após 2 dias. O método de imuno‐histoquímica foi o mesmo da nestina: desnaturação do ácido nucléico com HCl antes de adicionar o peróxido. O anticorpo primário foi anti‐BrdU de camundongo (Sigma, EUA) (diluição 1:40) e o anticorpo secundário foi anti‐IgG de camundongo marcado com HRP (ZSGB‐BIO, Pequim, China). Os resultados foram observados em microscópio invertido. Seis campos visuais independentes foram selecionados em cada grupo para contagem de células e a taxa de células Brdu + foi calculada para análise estatística.
Análise estatísticaOs resultados foram expressos como x¯ ±s e a análise estatística foi feita com o software SPSS17.0. As diferenças entre os grupos foram analisadas por one‐way Anova. O método LED (L) foi usado quando a variância era homogênea e o método T3 de Dunnett foi usado quando a variância era não homogênea. A diferença foi considerada estatisticamente significante quando p <0,05. O software GraphPad Prism 5 foi usado para o mapeamento.
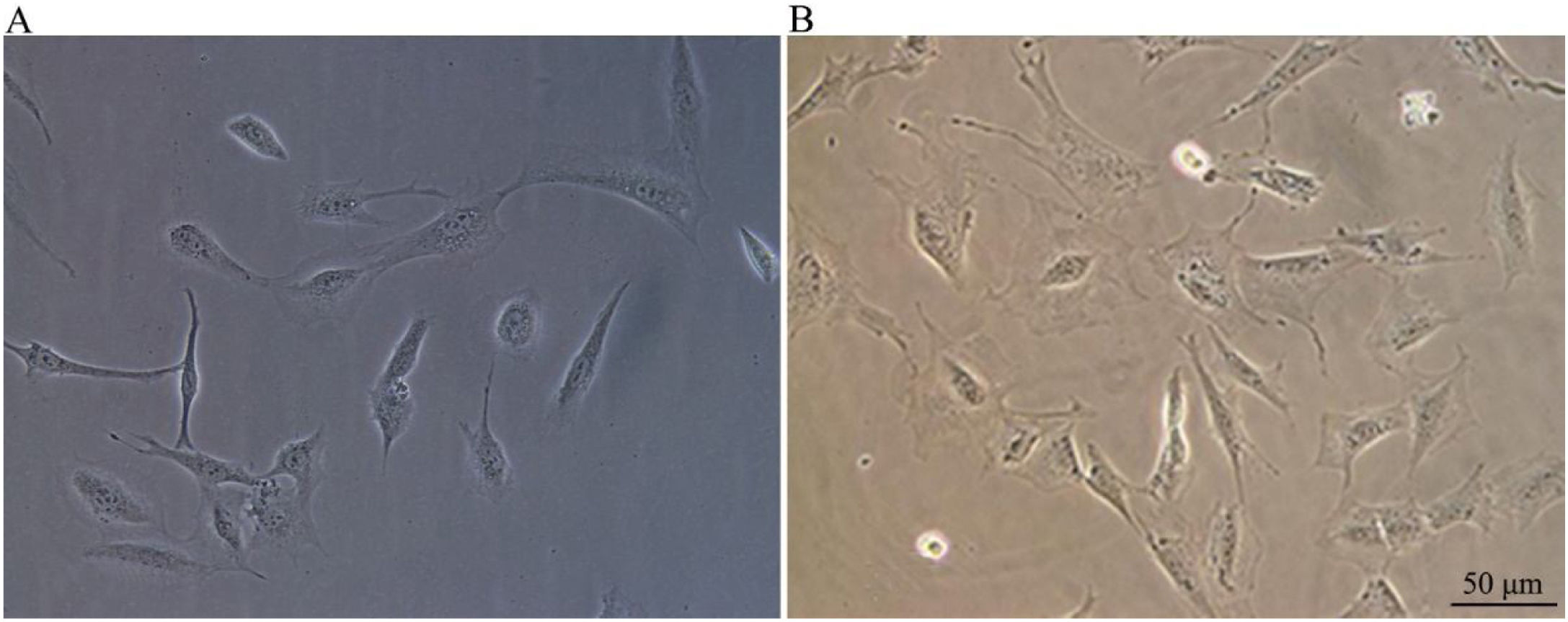
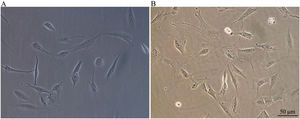
ResultadosProcesso de crescimento das CPNsApós o descongelamento, as CPNs encolheram até virar pequenas células esféricas e ficaram aderidas à parede da placa de cultura por cerca de meia hora após a inoculação. As células morreram e flutuaram na superfície do meio após 24h. Todas as células sobreviventes exibiram aderência à parede. O formato da célula era relativamente simples e, na sua maioria, fusiforme. Algumas células exibiram algumas protrusões celulares (fig. 1A). Após 48h, as morfologias celulares se diversificaram, exibiram formatos ovais, fusiformes (principalmente) ou poligonais. As protrusões celulares aumentaram ainda mais (fig. 1B).
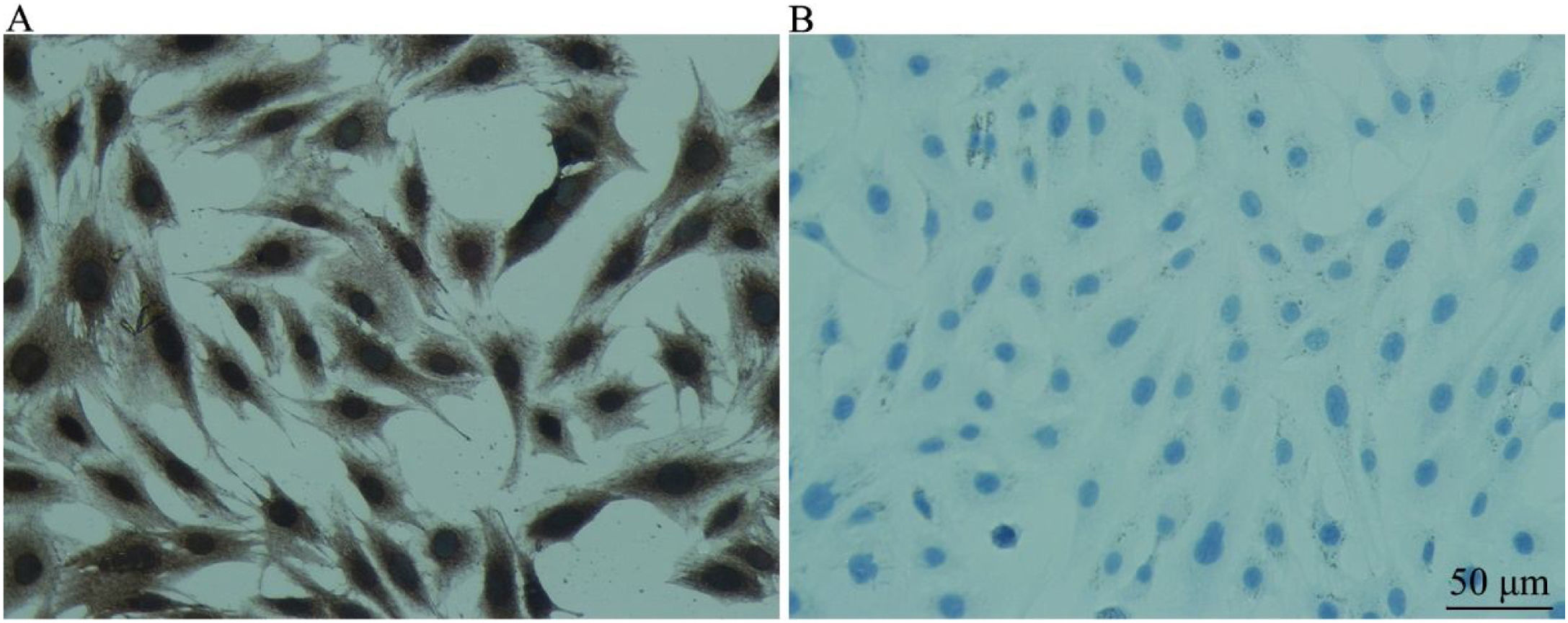
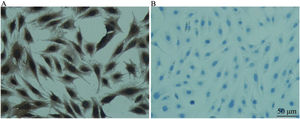
Expressão de marcador específico de células‐tronco neurais (nestina)Nas CPNs, o marcador de células‐tronco neurais foi expresso positivamente. As células progenitoras do ouvido interno eram indiferenciadas, pertencentes às células‐tronco neurais e favoráveis à indução da diferenciação (fig. 2).
Detecção de nestina em CPNs (coloração imunoquímica celular) (× 200). A, Grupo EXP para detecção de nestina em CPNs e B, Grupo CON. A, Identificação da expressão de nestina em CPNs por coloração imunoquímica celular. A coloração está no citoplasma. A coloração positiva é amarelo‐acastanhado e a negativa não exibe coloração. B, Coloração dos núcleos das CPNs e os núcleos são corados de azul com hematoxilina.
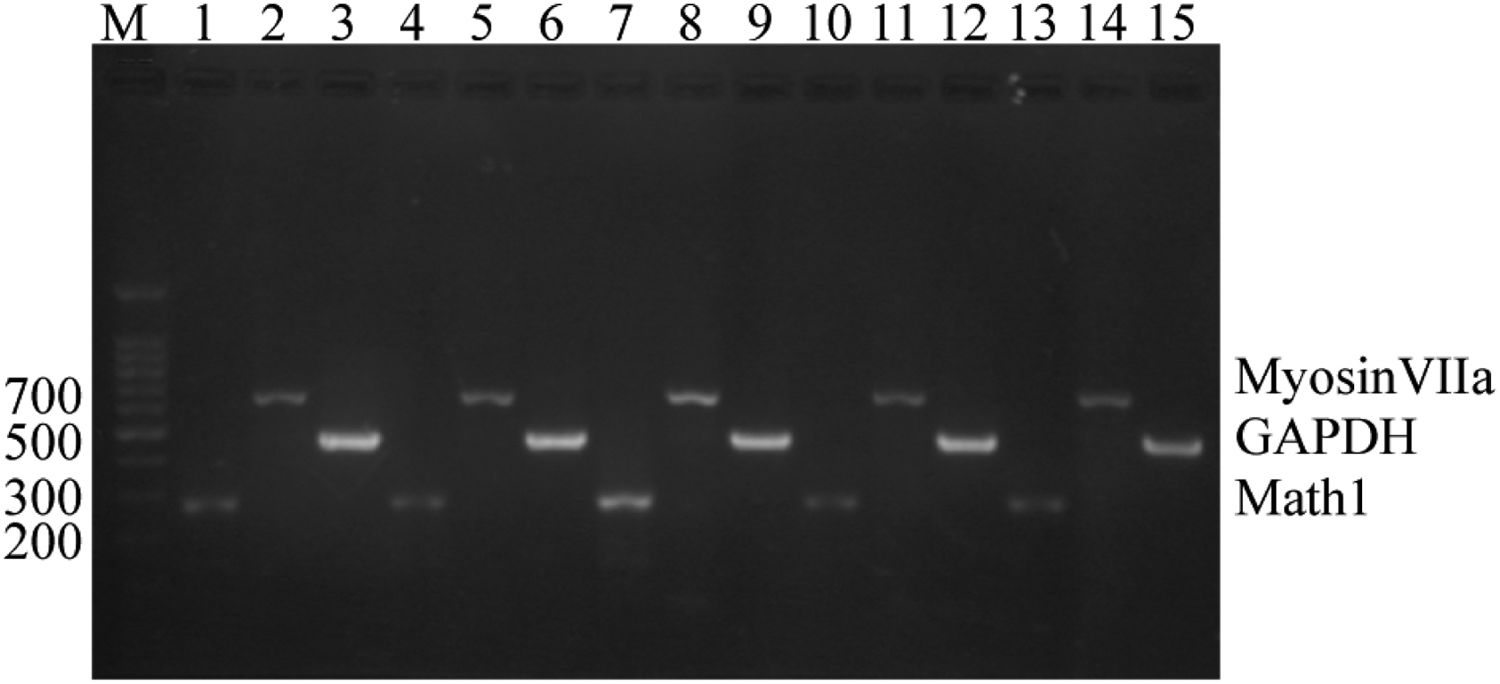
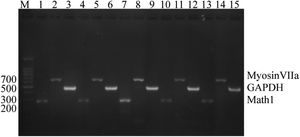
Pela figura, pode‐se observar que as expressões dos genes Math1 e Myosin7a podem ser vistas tanto no grupo CON quanto no grupo EXP. Após 3 dias de indução, as expressões desses dois genes no grupo EXP eram significativamente maiores do que no grupo CON (fig. 3).
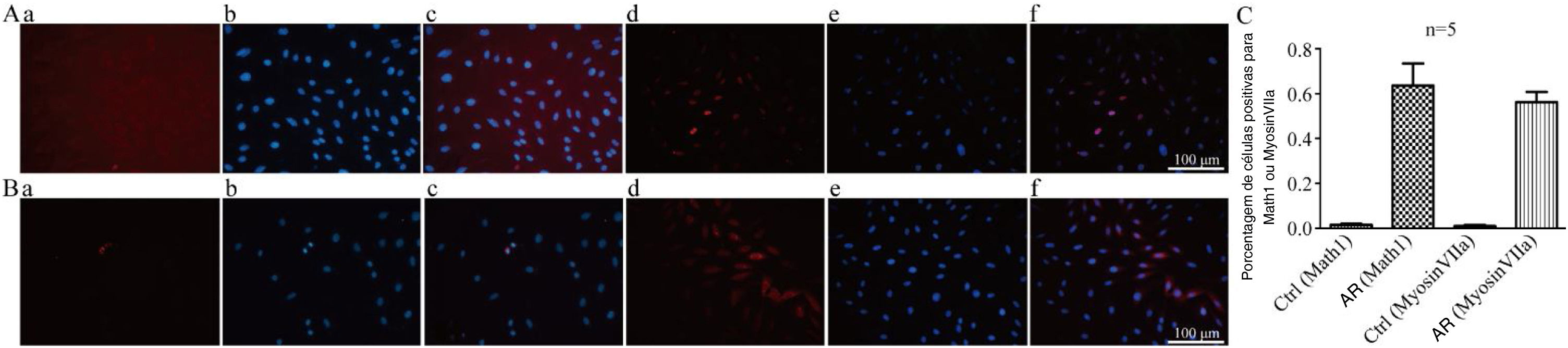
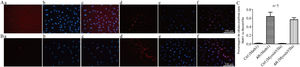
As taxas de células positivas para Math1 no grupo CON e no grupo EXP foram de 1,5% e 63% (figs. 4 A e C), respectivamente, e as taxas de células positivas para MyosinVIIa no grupo CON e no grupo EXP foram de 0,96% e 56% (figs. 4 B e C), respectivamente, com p <0,05, indicaram que o AR exógeno promove a formação das proteínas Math1 e Myosin?a em CPNs, de modo que as CPNs podem gradualmente se diferenciar em células ciliadas.
A, Coloração por imunofluorescência com Math1 em CPNs após indução de diferenciação (×200). (a e d) são coloração com Math1 (os núcleos corados exibem fluorescência vermelha); (b e e) são núcleos corados com DAPI (os núcleos corados exibem fluorescência azul); (c e f) combinam as duas primeiras imagens. B, Coloração por imunofluorescência com Myosin?a em CPNs após indução de diferenciação. (a e d) são coloração com Myosin?a (o citoplasma corado exibe fluorescência vermelha); (b e e) núcleos corados com DAPI (os núcleos corados exibem fluorescência azul); (c e f) combinam as duas primeiras imagens. C, Proporção de marcadores de células ciliadas coradas positivamente em CPNs após indução de diferenciação.
Os núcleos das células positivas exibiram partículas marrons e os núcleos foram corados de azul com hematoxilina (fig. 5A).
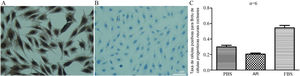
A, Teste Brdu de CPNs (coloração imunoquímica celular) (×400). Teste Brdu de CPNs, (a) Grupo ctrl‐; (b) Grupo RA; (c) Grupo ctrl+. Os núcleos das células positivas exibiram partículas marrons e os núcleos foram corados em azul com hematoxilina. B, Razão de células Brdu + em CPNs.
Brdu‐positive cell rate of cochlear neural progenitor cells=Taxa de células positivas para Brdu de células progenitoras neurais cocleares.
As taxas de coloração de células Brdu + no grupo AR, grupo ctrl‐ e grupo ctrl + foram 20,6%, 29,9% e 54,3%, respectivamente, com p <0,05, indicaram significância estatística entre os três grupos (fig. 5B).
DiscussãoNeste estudo, o AR foi usado para induzir CPNs a se diferenciarem em células ciliadas. Células com marcadores de células ciliadas (MyosinVIIa e Math1), bem como feixes ciliados, podem ser definidas como células ciliadas.19 A miosina é uma proteína de movimento molecular e a MyosinVIIa está localizada principalmente nos cílios e microvilosidades; como um produto tardio das células ciliadas, é um dos marcadores para a identificação delas.20,21
Math1 é um homólogo do gene atonal da Drosófila, que pode efetivamente promover o crescimento e o desenvolvimento das células ciliadas, bem como induzir a regeneração delas.22,23 Ele pode aparecer no estágio inicial da geração de células ciliadas e também é um gene especial que pode promover a diferenciação e maturidade dessas células.10 Neste estudo, DMEM/F12 + AR foi usado para induzir o crescimento de CPNs. Após 3 dias de indução, os marcadores das células ciliadas foram detectados a partir dos níveis de genes e proteínas. Os resultados mostram que as expressões dos genes MyosinVIIa e Math1 aumentaram após 3 dias de indução e as expressões das proteínas MyosinVIIa e Math1 também foram detectadas por imunofluorescência celular, o que confirmou adicionalmente que o AR pode promover a diferenciação de CPNs em células ciliadas. Outros estudos também descobriram que as CPNs têm potencial para substituir conexões nervosas que sofreram degeneração.24
O melhor ponto do processo de cultivo das CPNs é que ele consegue manter as características das células‐tronco neurais. A expressão da nestina, um marcador específico de células‐tronco neurais, foi encontrada nas CPNs deste estudo. A nestina é expressa apenas nas células neuroepiteliais embrionárias e desaparece após o nascimento; portanto, é um marcador específico de células‐tronco neurais.25 Não há correlação entre a diferenciação e proliferação de células ciliadas.26 A proliferação e diferenciação celular pertencem a duas direções diferentes da divisão celular. As CPNs sofrem proliferação celular principalmente através da mitose, portanto podem ser detectadas com 5‐bromo‐2‐deoxiuridina (Brdu). Os resultados da detecção de Brdu neste estudo revelam que o AR não pode promover a proliferação de CPNs; pelo contrário, inibe a proliferação celular, o que apoia ainda mais a conclusão de que as CPNs podem se diferenciar em células ciliadas.
As CPNs podem se diferenciar em células ciliadas marcadas pelas expressões de Math1 e MyosinVIIa sob a indução de AR, o que tem significado positivo para o estudo da regeneração de células ciliadas.
O número de pacientes com perda auditiva neurossensorial tem aumentado em todo o mundo. Ainda é um assunto importante para a pesquisa de reabilitação de indivíduos com perda auditiva na China e no exterior, objetiva explorar métodos de tratamento que atendam a requisitos e condições mais fisiológicas. A pesquisa sobre regeneração de células ciliadas ou transplante de células ciliadas é um tópico importante nesse campo; embora muitos estudos tenham sido feitos na China e no exterior, muitas questões básicas ainda precisam ser resolvidas, como, por exemplo, se a regeneração das células ciliadas pode ser acompanhada por uma recuperação funcional ou apenas por mudanças na morfologia e nos indicadores de marcadores. Questões sobre como o transplante de células ciliadas pode superar a baixa taxa de sobrevivência ou mesmo não sobreviver no receptor ainda requerem mais estudos.
ConclusãoAs células progenitoras da orelha interna são indiferenciadas durante o processo de passagem, para que possam manter as características das células‐tronco neurais; a proliferação de células progenitoras do ouvido interno é inibida sob indução do AR e algumas partes delas se diferenciam em células ciliadas. Os marcadores de células ciliadas (Math1 e MyosinVIIa) podem ser detectados ao nível de genes e proteínas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Chen M, Huang J. Retinoic acid induces differentiation of cochlear neural progenitor cells into hair cells. Braz J Otorhinolaryngol. 2022;88:962–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.