Age‐related hearing impairment is the most common sensory dysfunction in older adults. In osteoporosis, the mass of the ossicles will be decreased, affecting the bone density of the cochlea, and interfering with the sound transmission to the cochlea. Age related hearing loss might be closely related to osteoporosis.
ObjectiveTo determine the relationship between age‐related hearing impairment and osteoporosis by investigating the relationship between hearing loss and cortical bone density evaluated from femur neck bone mineral density.
MethodsWe used data from the Korea National Health and Nutrition Examination Survey to examine the associations between osteoporosis and age‐related hearing impairment from 2009 to 2011. Total number of participants was 4861 including 2273 men and 2588 women aged 50 years or older. Osteoporosis was defined as a bone mineral density 2.5 standard deviations below according to the World Health Organization diagnostic classification. Age‐related hearing impairment was defined as the pure‐tone averages of test frequencies 0.5, 1, 2, and 4kHz at a threshold of 40dB or higher on the more impaired hearing side.
ResultsTotal femur T‐score (p<0.001), lumbar‐spine T‐score (p<0.001) and, femur neck T‐score (p<0.001) were significantly lower in the osteoporosis group compared to the normal group. Thresholds of pure‐tone averages were significantly different in normal compared to osteopenia, and osteoporosis groups. In addition, there were significantly higher pure‐tone averages thresholds in the osteoporosis group compared to other groups (p<0.001). After adjusting for all covariates, the odds ratio for hearing loss was significantly increased by 1.7 fold with reduced femur neck bone mineral density (p<0.01). However, lumbar spine bone mineral density was not statistically associated with hearing loss (p=0.22).
ConclusionOur results suggest that osteoporosis is significantly associated with a risk of hearing loss. In addition, femur neck bone mineral density was significantly correlated with hearing loss, but lumbar spine bone mineral density was not.
A perda auditiva associada ao envelhecimento é a disfunção sensorial mais comum em idosos. Na osteoporose, a massa dos ossículos diminui e afeta a densidade óssea da cóclea, o que irá interferir na transmissão do som para a mesma. A perda auditiva associada à idade pode estar intimamente relacionada à osteoporose.
ObjetivoDeterminar a relação entre deficiência auditiva relacionada à idade e osteoporose, investigar a relação entre perda auditiva e densidade óssea cortical avaliada a partir da densidade mineral óssea do colo do fêmur.
MétodoUtilizamos dados da Korea National Health and Nutrition Examination Survey para examinar as associações entre osteoporose e perda auditiva associada ao envelhecimento de 2009 a 2011. O número total de participantes foi de 4.861, incluiu 2.273 homens e 2.588 mulheres com 50 anos ou mais. A osteoporose foi definida como densidade mineral óssea com 2,5 desvios‐padrão abaixo da média, de acordo com a classificação diagnóstica da Organização Mundial da Saúde. A perda auditiva associada ao envelhecimento foi definida como as médias de tom puro das frequências de teste de 0,5, 1, 2 e 4kHz a um limiar de 40dB ou superior no lado da audição mais afetado.
ResultadosO T‐score total do fêmur (p<0,001), o T‐score da coluna lombar (p<0,001) e o T‐score do colo do fêmur (p<0,001) foram significantemente menores no grupo com osteoporose em comparação ao grupo normal. Os limiares de médias de tom puro foram significantemente diferentes nos grupos normais em comparação com aqueles com osteopenia e osteoporose. Além disso, houve limiares significantemente maiores de médias de tom puro no grupo com osteoporose em comparação com os outros grupos (p<0,001). Após o ajuste para todas as covariáveis, a odds ratio da perda auditiva mostrou estar significantemente aumentada em 1,7 vez com densidade mineral óssea reduzida no colo do fêmur (p<0,01). No entanto, a densidade mineral óssea da coluna L não se associou estatisticamente à perda auditiva (p=0,22).
ConclusãoNossos resultados sugerem que a osteoporose está significantemente associada ao risco de perda auditiva. Além disso, a densidade mineral óssea da coluna lombar não se correlacionou com a perda auditiva, apenas a densidade mineral óssea do colo do fêmur foi significantemente correlacionada.
Como o envelhecimento da população ocorre em muitos países, a importância da expectativa de vida com saúde dos idosos tem se tornado uma grande preocupação. Além disso, há um crescente interesse em doenças crônicas e do envelhecimento que afetam a expectativa de saúde dos idosos.1–3 Dessas doenças do envelhecimento, a perda auditiva associada ao envelhecimento (PAAE) é a disfunção sensorial mais comum em adultos idosos. A PAAE reduz a qualidade de vida dos idosos e dificulta a comunicação, frequentemente resulta em isolamento social. 4–6 Vários estudos sugeriram que os fatores de risco para a PAAE incluem fatores de risco cardiovasculares tradicionais, como hipertensão, doença renal crônica e diabetes mellitus.7–10 Como resultado, parece que condições sistêmicas podem afetar a perda auditiva.
Recentemente, Yeh et al.11 fizeram o maior estudo de base populacional para avaliar o risco de perda auditiva neurossensorial súbita (PANSS) em uma coorte nacional de pacientes asiáticos com osteoporose. Eles relataram um aumento de 1,76 vez na incidência de PANSS em pacientes com osteoporose em relação ao grupo de comparação após considerar covariáveis como idade, sexo, comorbidades médicas, área geográfica e renda mensal. Além disso, sugeriram que a desmineralização da cápsula coclear estava correlacionada à perda auditiva em pacientes com distúrbios ósseos metabólicos. No entanto, outro estudo que investigou 120 mulheres na pós‐menopausa, não apresentou significância estatística em baixas frequências, independentemente dos valores de densidade mineral óssea (DMO).12
Zehnder et al. investigou o metabolismo ósseo na cápsula ótica e sugeriu que a osteoprotegerina (OPG), um potente inibidor de osteoclastos, está presente na orelha interna e é secretada como perilinfa para inibir a remodelação óssea da cápsula ótica e, em particular, da cóclea.13 Kanzaki et al. demonstraram que várias partes dos ossículos estavam adelgaçadas e enfraquecidas e que os ligamentos entre o estribo e a janela oval também tinham desaparecido. Nos limiares auditivos obtidos pela audiometria de tronco encefálico, o limiar auditivo geral foi maior no modelo de camundongo Opg ‐ / ‐ do que no grupo normal com o aumento da idade. Em particular, o limiar auditivo de 20dB ou maior foi observado em frequências altas, acima de 20kHz. No entanto, eles não puderam confirmar quais ossículos eram os mais vulneráveis.14
Quando o som é apresentado ao canal auditivo externo, é transmitido através da vibração dos ossículos para a cóclea. Essa vibração ossicular é diretamente proporcional à rigidez da membrana timpânica, da junção interossicular e da janela oval e inversamente proporcional à massa da membrana timpânica e dos ossículos.15,16 A massa ajuda a transmitir vibrações de baixa frequência e altera a transmissão de som de alta frequência, enquanto a rigidez ajuda a vibração de alta frequência e altera a transmissão de baixas frequências. Várias doenças da orelha média podem afetar a transmissão do som, como a vibração para a orelha interna, ao alterar a massa dos ossículos e a condição de rigidez da orelha média. Exemplos de doenças associadas ao aumento da rigidez incluem a pressão negativa na orelha média, otoesclerose e otite média. Um exemplo bem definido de diminuição da rigidez é uma ruptura ossicular, quando a vibração não pode ser transmitida para a cóclea. Na osteoporose, a massa dos ossículos diminui e afeta a densidade óssea da cóclea, o que interferirá na transmissão do som para a cóclea.15,17
Nossa hipótese é que a perda auditiva associada ao envelhecimento esteja intimamente relacionada à osteoporose e que a DMO medida no colo do fêmur, que ocupa uma grande porção do osso cortical, seja mais precisa do que as medições na coluna lombar.
Portanto, o objetivo deste estudo foi determinar a relação entre a PAAE e a osteoporose e investigar a relação entre a densidade óssea cortical avaliada pela DMO da coluna lombar (L) e do colo do fêmur e a perda auditiva.
MétodoDeclaração de éticaOs dados da Korea National Health and Nutrition Examination Survey (KNHANES) de 2009 a 2011 foram revisados e aprovados pelo comitê de ética institucional dos Centros de Controle e Prevenção de Doenças da Coreia (KCDC) (Aprovação n° 2009‐01CON‐03‐2C, 2010– 02CON‐21‐C e 2011–02CON‐06‐C). Consentimento informado por escrito foi obtido de todos os participantes quando os KNHANES de 2009, 2010 e 2011 foram feitos.
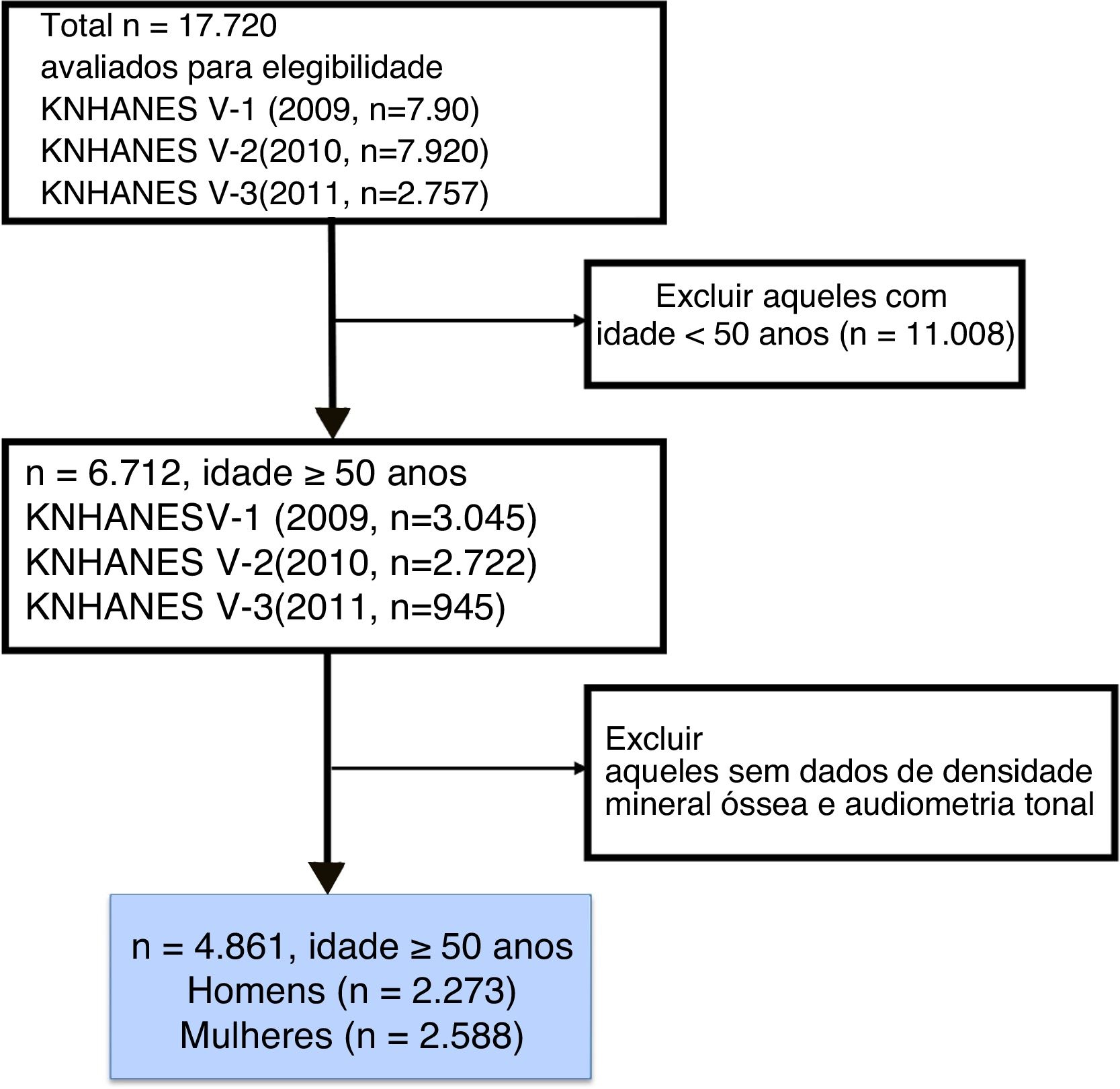
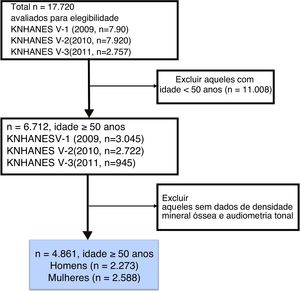
População do estudoKNHANES trata‐se de uma pesquisa transversal representativa em todo o país para a população coreana com um desenho de amostragem em cluster, multiestágio, estratificado e com flexibilidade para múltiplas finalidades. KNHANES consiste em uma entrevista de saúde, exame de saúde e pesquisa dietética. Os dados da pesquisa são coletados a partir de entrevistas domiciliares e exames físicos padronizados feitos em centros de exames móveis especialmente equipados. Os dados foram coletados de 17.720 participantes em 2009 (n = 7.920), 2010 (n = 7.043) e 2011 (n = 2.757). Os participantes com menos de 50 anos foram excluídos, bem como aqueles a quem faltavam dados sobre densidade mineral óssea ou audiometria tonal. Após essas exclusões, foram analisados 4.861 participantes (2.273 homens e 2.588 mulheres) com membrana timpânica normal (fig. 1).
Avaliação da osteoporoseO conteúdo mineral ósseo (CMO) e a densidade mineral óssea (DMO) do fêmur total e no colo femoral e coluna lombar (L1‐L4) foram medidos por técnicos treinados com DXA (QDR 4500A, Hologic Inc., Waltham, MA, EUA). Osteopenia ou osteoporose foi diagnosticada de acordo com as informações e recomendações do fabricante do equipamento de DXA18 com o T‐escore do fêmur total, colo do fêmur e coluna lombar de acordo com os critérios da Organização Mundial de Saúde. (T‐escore ≥ ‐1; Normal, ‐2,5 < T‐escore < ‐1; osteopenia, T‐escore ≤ ‐2,5; osteoporose).19
Avaliação do limiar auditivoPara avaliação do limiar auditivo, foi feita audiometria tonal com audiômetro SA 203 (Entomed; Malmö, Suécia) em cabine acústica e as instruções foram fornecidas por um otorrinolaringologista treinado. Em uma cabine à prova de som, os participantes usaram fones supra‐auriculares e apertavam um botão quando ouviam um som de tom puro. Apenas o limiar de condução aérea foi medido. As médias de tom puro (PTA) foram calculadas como a média do limiar a 0,5, 1, 2 e 4kHz. A perda auditiva foi definida como a PTA do limiar de 40dB ou superior.
Avaliação das covariáveisInformações sobre a população do estudo, inclusive IMC, tabagismo, consumo de álcool, atividade física e condições médicas, foram obtidas a partir dos dados da KNHANES. O IMC foi calculado a partir da altura, que foi medida com precisão de 0,1cm com um estadiômetro.
A hipertensão foi definida como pressão arterial (PA) sistólica de 140mmHg, PA diastólica de 90mmHg ou mais ou tratamento com agentes anti‐hipertensivos. Diabetes mellitus foi definida por glicemia de jejum >126mg/dL, tratamento com hipoglicemiantes orais ou insulina ou diagnóstico feito por um médico.
Em relação ao tabagismo, os participantes foram categorizados como fumantes atuais ou outros. Um participante foi considerado com “histórico mensal de ingestão de álcool” se havia ingerido álcool mais de uma vez por mês no último ano. Uma atividade física moderada feita por pelo menos 20 minutos e mais de três vezes por semana foi considerada exercício regular.
Análise bioquímicaOs níveis séricos de 25 (OH) D e hormônio paratireoidiano (PTH) foram medidos com um contador gama (1470 Wizard; Perkin Elmer, Turku, Finlândia) e LIAISON (DiaSorin) com radioimunoensaio (25 (OH)D 125I RIA Kit; DiaSorin) e imunoensaio quimioluminescente (kit N‐tact PTH Assay; DiaSorin), respectivamente.
Análise estatísticaPara comparar a PTA pela presença de osteoporose, foi feita a análise de variância (Anova) com correção de Bonferroni. Análises de regressão logística múltipla também foram feitas para estimar a associação entre o T‐escore e a perda auditiva. Os dados são apresentados como OR (IC95%) após o ajuste para determinados fatores em cada modelo com a análise hierárquica (Modelo 1: Ajustado para idade; Modelo 2: Ajustado para idade, tabagismo atual, uso de álcool, exercício regular e percentagem de gordura corporal; Modelo 3: Ajustado para idade, tabagismo atual, uso de álcool, exercícios regulares).
Para avaliar os pesos amostrais, foram feitas análises complexas de amostragem. Todas as análises estatísticas foram feitas com o software SAS (versão 9.3; SAS Institute, Cary, NC, USA). Todos os dados com p < 0,05 foram aceitos como resultados estatisticamente significantes.
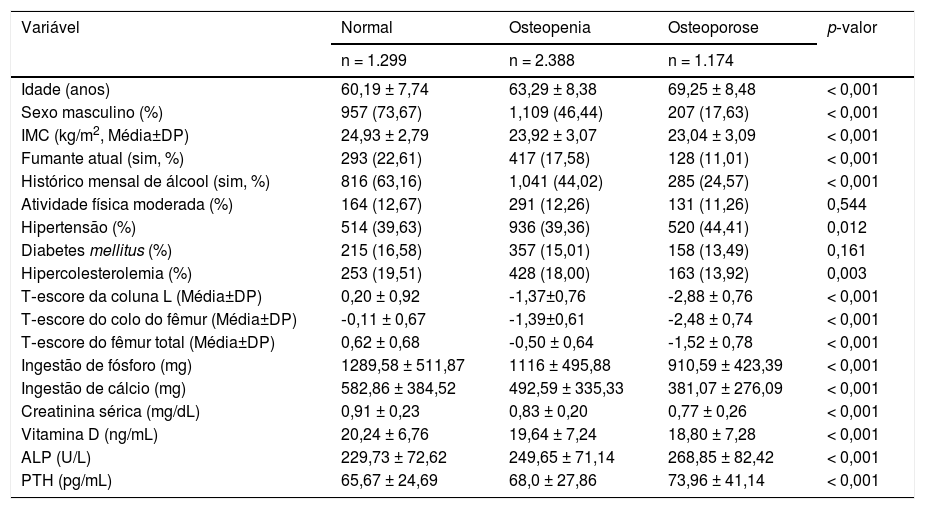
ResultadosAs características dos indivíduos são mostradas na tabela 1 (p < 0,001). Osteopenia e osteoporose foram mais comuns em mulheres do que em homens. Tabagismo atual (p < 0,001), consumo mensal de álcool (p < 0,001) e IMC (p < 0,001) foram significantemente maiores no grupo normal quando comparado aos grupos com osteopenia e osteoporose. No entanto, atividade física moderada, diabetes mellitus e hipercolesterolemia não foram significantemente diferentes.
Características demográficas e clínicas da população estudada
| Variável | Normal | Osteopenia | Osteoporose | p‐valor |
|---|---|---|---|---|
| n = 1.299 | n = 2.388 | n = 1.174 | ||
| Idade (anos) | 60,19 ± 7,74 | 63,29 ± 8,38 | 69,25 ± 8,48 | < 0,001 |
| Sexo masculino (%) | 957 (73,67) | 1,109 (46,44) | 207 (17,63) | < 0,001 |
| IMC (kg/m2, Média±DP) | 24,93 ± 2,79 | 23,92 ± 3,07 | 23,04 ± 3,09 | < 0,001 |
| Fumante atual (sim, %) | 293 (22,61) | 417 (17,58) | 128 (11,01) | < 0,001 |
| Histórico mensal de álcool (sim, %) | 816 (63,16) | 1,041 (44,02) | 285 (24,57) | < 0,001 |
| Atividade física moderada (%) | 164 (12,67) | 291 (12,26) | 131 (11,26) | 0,544 |
| Hipertensão (%) | 514 (39,63) | 936 (39,36) | 520 (44,41) | 0,012 |
| Diabetes mellitus (%) | 215 (16,58) | 357 (15,01) | 158 (13,49) | 0,161 |
| Hipercolesterolemia (%) | 253 (19,51) | 428 (18,00) | 163 (13,92) | 0,003 |
| T‐escore da coluna L (Média±DP) | 0,20 ± 0,92 | ‐1,37±0,76 | ‐2,88 ± 0,76 | < 0,001 |
| T‐escore do colo do fêmur (Média±DP) | ‐0,11 ± 0,67 | ‐1,39±0,61 | ‐2,48 ± 0,74 | < 0,001 |
| T‐escore do fêmur total (Média±DP) | 0,62 ± 0,68 | ‐0,50 ± 0,64 | ‐1,52 ± 0,78 | < 0,001 |
| Ingestão de fósforo (mg) | 1289,58 ± 511,87 | 1116 ± 495,88 | 910,59 ± 423,39 | < 0,001 |
| Ingestão de cálcio (mg) | 582,86 ± 384,52 | 492,59 ± 335,33 | 381,07 ± 276,09 | < 0,001 |
| Creatinina sérica (mg/dL) | 0,91 ± 0,23 | 0,83 ± 0,20 | 0,77 ± 0,26 | < 0,001 |
| Vitamina D (ng/mL) | 20,24 ± 6,76 | 19,64 ± 7,24 | 18,80 ± 7,28 | < 0,001 |
| ALP (U/L) | 229,73 ± 72,62 | 249,65 ± 71,14 | 268,85 ± 82,42 | < 0,001 |
| PTH (pg/mL) | 65,67 ± 24,69 | 68,0 ± 27,86 | 73,96 ± 41,14 | < 0,001 |
ALP, fosfatase alcalina; IMC, índice de massa corpórea; PTH, paratormoni.
O T‐escore de coluna L (p < 0,001), T‐escore de colo do fêmur (p < 0,001) e T‐escore total do fêmur (p < 0,001) estavam todos significantemente diminuídos no grupo com osteoporose em comparação aos controles. Os níveis de cálcio (p < 0,001), ingestão de fósforo (p < 0,001), níveis de creatinina sérica (p < 0,001) e vitamina D (p < 0,001) também estavam significantemente diminuídos no grupo com osteoporose. No entanto, os níveis de fosfatase alcalina (p < 0,001) e hormônio paratireoidiano (p < 0,001) estavam significantemente aumentados no grupo com osteoporose.
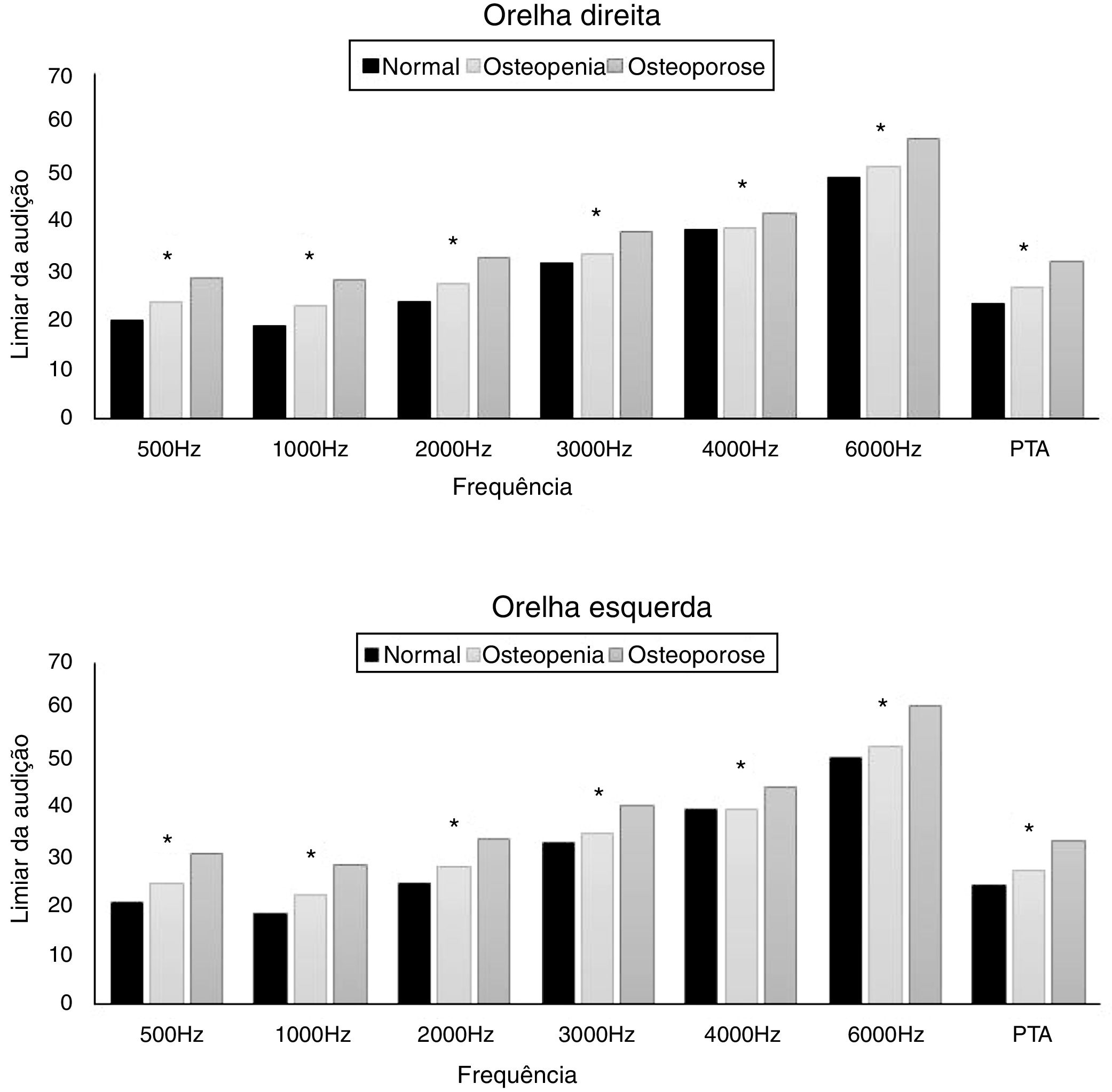
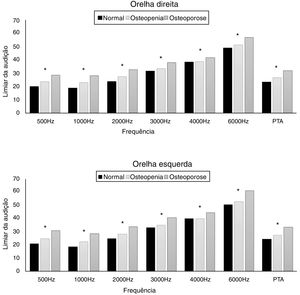
Os limiares de PTA foram significantemente diferentes entre os grupos normal e osteopenia e osteoporose. Um limiar significantemente maior de PTA foi observado no grupo com osteoporose em comparação com os outros grupos (p < 0,001) (fig. 2, suplemento 1).
Após o ajuste para todas as covariáveis, como idade, sexo, hipertensão, ingestão de fósforo, creatinina sérica, vitamina D, hipercolesterolemia e história mensal de consumo de álcool, a odds ratio para perda auditiva aumentou significantemente em 1,7 vez com a diminuição da DMO do colo do fêmur (p < 0,01). No entanto, a DMO da coluna L e do corpo do fêmur não se correlacionou estatisticamente com a perda auditiva, respectivamente (p = 0,22 e 0,16) (tabela 2).
DiscussãoO achado principal do presente estudo é que existe uma correlação significante entre a osteoporose e a PAAE. Embora a DMO da coluna L e a perda auditiva não estivessem significantemente relacionadas, a DMO do colo do fêmur e a perda auditiva mostraram uma relação significante.
Vários estudos relataram uma associação entre osteoporose e perda auditiva na população idosa. No entanto, essa relação é controversa. Jung et al. fizeram um estudo de caso‐controle com 1.009 mulheres na pós‐menopausa. Eles não relataram associação entre densidade mineral óssea e deficiência auditiva na população estudada.20 No entanto, vários outros estudos relatam que a PAAE e a osteoporose estão relacionados. Recentemente, Ye et al. investigaram a perda auditiva na base de dados de seguro de saúde de Taiwan de 1998 a 2008, com 16.600 casos diagnosticados com osteoporose e 30.080 casos sem osteoporose. Eles verificaram que o risco relativo de perda auditiva no grupo com osteoporose foi 1,76 vez maior do que no grupo controle, após a correspondência por idade, sexo, diabetes, hipertensão, doença cardiovascular e doença renal crônica. Nosso estudo, em estreita concordância com esses achados, mostrou que a odds ratio de perda auditiva no grupo com osteoporose foi 1,7 vez maior. No entanto, acreditamos que nossos dados são mais objetivos devido ao uso do limiar de tom puro em comparação com a análise desses autores, que usou o código de diagnóstico.
Neste estudo, a DMO da coluna L não foi associada à perda auditiva: 75% das colunas L são compostas de osso trabecular, enquanto 75% dos colos de fêmur são compostos de osso cortical.21 Como a configuração do fêmur proximal é semelhante à dos ossículos, especialmente do maléolo, e como a cavitação óssea aumenta na osteoporose, um fenômeno semelhante ocorre nos ossículos. Portanto, parece razoável que a correlação seja mais significante no colo do fêmur do que no corpo do fêmur e na coluna‐L.22 Um estudo anterior relatou uma associação entre a DMO e a perda auditiva em pacientes na pós‐menopausa.12 Embora o mecanismo da perda auditiva não seja claro, tem sido sugerido que a desmineralização da cápsula ótica esteja associada à degeneração neuronal secundária, resulta em perda auditiva neurossensorial.23,24
Houve várias limitações para este estudo. Primeiro, seu desenho foi transversal e retrospectivo. Portanto, não foi possível avaliar a causalidade entre a densidade mineral óssea e a perda auditiva. Estudos prospectivos são necessários para esclarecer essa relação. Em segundo lugar, existe uma falta de explicação para o mecanismo de ação. Portanto, estudos experimentais bem desenhados serão necessários para esclarecer esse mecanismo. Terceiro, não avaliamos perda auditiva leve em adultos jovens. Portanto, no futuro, estudos em larga escala, inclusive perda auditiva leve e adultos jovens, serão necessários. Finalmente, há diferenças nos fatores bioquímicos em indivíduos do leste asiático que podem afetar a osteoporose e a perda auditiva em comparação com indivíduos dos países ocidentais. Em particular, a proporção de deficiência de vitamina D em idosos, que é maior na Coreia do que nos países ocidentais. Entretanto, neste estudo, fatores bioquímicos, inclusive vitamina D, foram ajustados para análise estatística.
ConclusãoA osteoporose está significantemente associada ao risco de perda auditiva. Além disso, a densidade mineral óssea da coluna lombar não se correlacionou com a perda auditiva, apenas a densidade mineral óssea do colo do fêmur foi significantemente correlacionada.
FinanciamentoEste estudo foi financiado pelo Ministério das SMEs e Startups, República da Coreia (Projeto n° P0002726). O financiador não teve papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Yoo J‐I, Park KS, Seo S‐H, Park HW. Osteoporosis and hearing loss: findings from the Korea National Health and Nutrition Examination Survey 2009–2011. Braz J Otorhinolaryngol. 2020;86:332–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.