The prevalence of rhinosinusitis is quite high. Despite the widespread use of antibiotics for rhinosinusitis, there are other forms of treatment, including phytotherapy. One of the most widely used herbal medicines for treatment of rhinosinusitis is Luffa operculata.
ObjectiveThis study aimed to evaluate the efficacy of topical nasal solution of the aqueous extract of L. operculata, determining the toxicity to its use and identifying the active principles presented in the aqueous extract. The secondary objective was to evaluate the action of active principles on bacteria commonly involved in acute rhino sinusitis.
MethodsThe study was conducted in experimental model of sinusitis. Three different concentrations of L. operculata were used as local treatment of rhino sinusitis. The results were compared with those observed in control groups that received nasal saline solution. Histological examination of the liver, kidney, spleen, myocardium, brain and lungs of all animals evaluated the toxicity of L. operculata. The aqueous extract used was subjected to chromatographic analysis and an active principle was isolated and tested for in vitro inhibition of bacterial colonies usually found in rhino sinusitis.
ResultsIntranasal treatment of sinusitis with L. operculata showed better clinical evolution than control group. Statistically significant difference (p>0.10) between the treated group and the control group was observed in the histologic evaluation for inflammatory pattern. The aqueous extract of L. operculata used presented a predominance of 2,3‐dicafeoilglicaric acid, a substance not yet described in the literature. There was a significant difference in bacterial growth of Streptococcus pyogenes on blood‐agar plates when under the influence of both the aqueous extract and the active substance.
ConclusionTopical nasal solution of the aqueous extract of L. operculata is effective compared to the application of saline solution for the treatment of bacterial rhinosinusitis in an experimental model. L. operculata determined in vitro inhibition of growth of S. pyogenes.
A prevalência de rinossinusite (RS) é bastante alta. Apesar do uso generalizado de antibióticos para RS, existem outras formas de tratamento, incluindo a fitoterapia. Uma das ervas medicinais mais utilizadas no tratamento da RS é a Luffa operculata.
ObjetivoEsse estudo teve como objetivo avaliar a eficácia da solução tópica nasal do extrato aquoso de Luffa operculata, determinando a toxicidade ao seu uso e identificando os princípios ativos apresentados no extrato aquoso. O objetivo secundário foi avaliar a ação dos princípios ativos sobre as bactérias comumente envolvidas na RS aguda.
MétodoO estudo foi realizado em modelo experimental de sinusite. Utilizaram-se três concentrações diferentes de Luffa operculata como tratamento local de RS. Os resultados foram comparados com os observados em grupos de controle que receberam solução salina nasal. O exame histológico do fígado, rim, baço, miocárdio, cérebro e pulmões de todos os animais avaliou a toxicidade de Luffa operculata. O extrato aquoso utilizado foi submetido à análise cromatográfica e um princípio ativo foi isolado e testado para inibição in vitro de colônias bacterianas normalmente encontradas em RS.
ResultadosO tratamento intranasal da sinusite com Luffa operculata mostrou melhor evolução clínica do que o do grupo controle. Foi observada diferença estatisticamente significante (p > 0.10) entre o grupo tratado e o grupo controle na avaliação histológica do padrão inflamatório. O extrato aquoso de Luffa operculata utilizado apresentou predominância do ácido 2,3-dicafeoilglicarico, substância ainda não descrita na literatura. Houve uma diferença significativa no crescimento bacteriano de Streptococcus pyogenes em placas de ágar-sangue quando sob a influência tanto do extrato aquoso quanto da substância ativa.
ConclusãoA solução tópica nasal do extrato aquoso de Luffa operculata é eficaz em comparação com a aplicação de solução salina para o tratamento de RS bacteriana em um modelo experimental. Luffa operculata determinou a inibição in vitro do crescimento de Streptococcus pyogenes.
Rinossinusite (RS) aguda é um dos diagnósticos mais comuns na atenção primária e seu tratamento tem implicações significativas para a saúde e os gastos públicos.1 Estima‐se que crianças tenham de sete a 10 resfriados comuns por ano. A frequência estimada para adultos é de dois a cinco episódios/ano.1 Cerca de 0,5%‐2% desses resfriados comuns resultam em RS bacteriana aguda.2 A sinusite afeta um em cada sete adultos nos Estados Unidos, resulta em cerca de 31 milhões de indivíduos diagnosticados a cada ano.3
Os dados obtidos em 2002 indicam que casos de RS representam 9% dos antibióticos prescritos para crianças e 21% dos antibióticos prescritos para adultos, o que a torna a quinta doença mais comum para a qual esse tipo de medicamento é prescrito nos EUA.4
Apesar do uso generalizado de antibióticos sistêmicos para a rinossinusite, há muitas outras formas de tratamento, inclusive medicamentos de uso sistêmico e local. Corticosteroides sistêmicos e medicamentos anti‐inflamatórios não esteroides (AINEs), anti‐histamínicos, descongestionantes sistêmicos e tópicos, antileucotrienos e antissépticos locais são usados para o tratamento de RS.5 A fitoterapia também é amplamente usada pela população,5 embora haja poucos estudos controlados na literatura que mostrem sua efetividade.2,6,7
Entre as vantagens do uso da fitoterapia estão a ampla aceitação de ervas e plantas medicinais pela população devido a fatores culturais e a crença de que pelo fato de serem “naturais” apresentam menos efeitos adversos.8 O baixo custo e sua abundância em países tropicais são outros fatores.7
Um dos fitoterápicos mais usados no tratamento da RS no Brasil é a Luffa operculata, usada em preparações para uso nasal.9
Em um levantamento feito em um mercado popular do Brasil, 86% (13 de 15) dos vendedores de plantas recomendaram Luffa operculata para tratamento da RS.10
A análise química mostra que a Luffa operculata tem entre seus componentes glicosídeos, saponinas, resinas, esteróis livres, ésteres alifáticos, quinonas, ácidos orgânicos e fenóis e não contém taninos e flavonoides. Na resina encontram‐se a elasterina A, B e D e a cucurbitacina isocucurbitacina B.9
Apesar do uso generalizado de Luffa operculata, existem poucos estudos que comprovem seu valor terapêutico para tratamento da sinusite.5
O objetivo deste estudo foi avaliar a eficácia da solução tópica nasal do extrato aquoso de Luffa operculata, determinar a toxicidade de seu uso e identificar os princípios ativos apresentados no extrato aquoso. O objetivo secundário foi avaliar a ação dos princípios ativos da Luffa operculata em bactérias comumente envolvidas na RS aguda.
MétodoIndução de RS em modelo animalO estudo foi submetido ao Comitê de Ética em Pesquisa e aprovado sob o número 2011‐3. Um veterinário acompanhou todos os procedimentos feitos em animais. Foram seguidas diretrizes institucionais referentes à experimentação animal.
Foram estudados 180 coelhos Nova Zelândia adultos brancos, de ambos os sexos, com aproximadamente 2.500g no início da experiência. Ao longo do estudo, os animais foram confinados em gaiolas individuais adequadas para raça e peso.
Os animais foram divididos em três grupos. Um grupo foi avaliado em relação ao uso terapêutica de Luffa operculata. Esse grupo foi acompanhado por três períodos. Outro grupo não foi tratado com Luffa operculata (grupo controle) e, finalmente, um terceiro grupo recebeu Luffa operculata para avaliar sua toxicidade. Portanto, cada grupo tinha 20 animais para cada tempo de seguimento. Assim, foram avaliados animais para o grupo terapêutico (n=60), 60 para o grupo controle e 60 para o grupo de toxicidade.
Os coelhos foram submetidos a um procedimento cirúrgico sob anestesia geral para gerar um processo inflamatório nasal, semelhante à RS infecciosa aguda. Inicialmente, uma esponja porosa de polivinil com 3,0×0,5×0,3cm foi esterilizada em óxido de etileno e depois introduzida em uma cavidade nasal de cada animal.
Um mL de uma solução composta de 0,8mL de sangue animal e 0,2mL de toxoide estreptocócico e estafilocócico (Toxoidepot®) foram injetados por via percutânea no antro maxilar no mesmo lado em que a esponja foi introduzida. As esponjas foram mantidas na cavidade nasal de cada animal por dez dias, após o qual as esponjas foram removidas e deu‐se início à fase de tratamento. Quando a esponja foi removida da cavidade nasal e antes do início do tratamento cada animal teve a secreção da cavidade nasal coletada por cotonete (Culturette®). Amostras das secreções sinusais foram semeadas em meio de cultura de ágar‐sangue e ágar‐chocolate (Probac do Brasil). As placas com agar‐sangue e agar‐chocolate foram incubadas a 35°±2° C, com leitura em 48 horas.
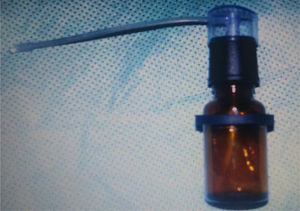
Preparação do tratamento medicamentoso – Solução de Luffa operculataCom solução salina fisiológica como solvente, preparou‐se uma diluição com 0,1g de extrato aquoso de Luffa operculata em 10mL de solução salina para se obter a concentração esperada. A solução foi colocada em um atomizador (fig. 1), que produziu um jato da mistura em um bico de spray, resultou na formação de aerossol microparticulado. Cada jato aplicava 0,5mL de solução.
TratamentoApós o período de indução da RS, os animais do grupo de estudo terapêutico receberam tratamento com aplicação nasal de extrato aquoso de Luffa operculata diluído a 1% em solução salina. A cabeça do animal foi mantida na posição vertical e o bico do atomizador foi inserido na narina direita. O bico atomizador foi pressionado uma vez. Em seguida, o dispositivo foi limpo e o processo foi repetido na narina esquerda. Os animais receberam um spray da solução, três vezes ao dia durante todo o período de tratamento. O grupo controle recebeu tratamento com solução salina na mesma forma e quantidade do grupo de estudo durante 30 dias. Após cinco dias de tratamento, 20 animais de cada grupo foram sacrificados. O mesmo procedimento foi repetido após 15 dias e após 30 dias.
Avaliação histológica da mucosa sinusalImediatamente após a eutanásia, foram coletadas amostras da mucosa de revestimento do seio maxilar. Os parâmetros histológicos observados foram infiltração de células inflamatórias (infiltrado leve, moderado ou grave), neovascularização (presente ou ausente) e proliferação conjuntivo‐fibrosa (ausência em surtos isolados ou proliferação difusa). Todas as lâminas foram avaliadas por dois patologistas diferentes, cegos ao protocolo de tratamento.
Estudo de toxicidadeForam divididos 60 coelhos em três grupos, que receberam solução de Luffa operculata em concentração terapêutica 30 dias. Depois de receberem o fármaco, amostras de sangue, fígado, rim, cérebro e pulmão foram colhidas dos animais para avaliação histopatológica.
Análise estatísticaOs valores de avaliação histológica da mucosa também foram descritos de acordo com os grupos e tempos com o uso de frequências absolutas e relativas. Eles foram comparados com o teste não paramétrico de Wilcoxon para a infiltração de células inflamatórias, variáveis de proliferação conjuntiva, vascular e fibrosa. As comparações foram feitas para investigar as diferenças entre os grupos ou os tempos de acompanhamento. Todos os testes foram feitos com nível de significância de 10%.
ResultadosDos 180 animais que iniciaram o experimento, oito morreram antes do tempo da eutanásia. Três desses pertenciam ao grupo de estudo, dois ao grupo de controle e um ao grupo de toxicidade. Desses oito, três morreram durante o período de indução da RS. Os outros animais morreram logo após o início do período de tratamento.
Um animal que pertencia ao grupo de estudo morreu seis dias após o início da administração de solução nasal de Luffa operculata, um pertencia ao grupo de controle e morreu entre dois e seis dias após o início da administração nasal de solução fisiológica. Dos oito animais, sete morreram de gastroenterocolite e um de pneumonia. Todos os animais no fim do período de indução de RS tiveram rinorreia purulenta no lado onde a esponja foi colocada e nenhum deles apresentou rinorreia contralateral.
A fim de identificar possíveis alterações histológicas que pudessem estar relacionadas com o uso contínuo da substância de teste, avaliamos histologicamente o cérebro, coração, pulmão, rim e fígado, usamos coloração de hematoxilina/eosina. Não havia anormalidades que pudessem estar relacionadas ao uso do fármaco.
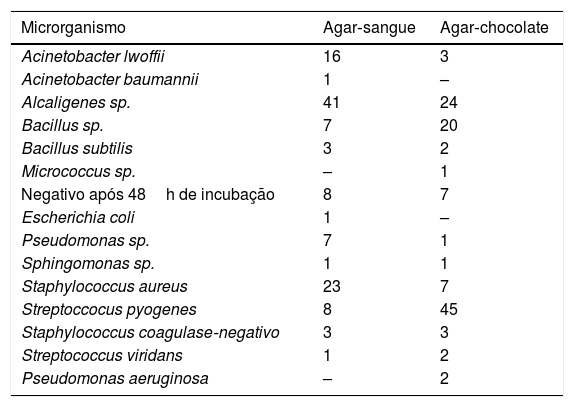
Cultura de secreção sinusalAs secreções sinusais foram colhidas do interior de cada seio maxilar de coelho com cotonete (Culturette®) após a eutanásia. As secreções recolhidas foram semeadas em agar‐sangue e agar‐chocolate. As bactérias encontradas após o procedimento estão descritas na tabela 1.
Descrição das bactérias identificadas nas culturas de material recolhido nas narinas dos animais no início do tratamento nos grupos controle e estudo
| Microrganismo | Agar‐sangue | Agar‐chocolate |
|---|---|---|
| Acinetobacter lwoffii | 16 | 3 |
| Acinetobacter baumannii | 1 | – |
| Alcaligenes sp. | 41 | 24 |
| Bacillus sp. | 7 | 20 |
| Bacillus subtilis | 3 | 2 |
| Micrococcus sp. | – | 1 |
| Negativo após 48h de incubação | 8 | 7 |
| Escherichia coli | 1 | – |
| Pseudomonas sp. | 7 | 1 |
| Sphingomonas sp. | 1 | 1 |
| Staphylococcus aureus | 23 | 7 |
| Streptoccocus pyogenes | 8 | 45 |
| Staphylococcus coagulase‐negativo | 3 | 3 |
| Streptococcus viridans | 1 | 2 |
| Pseudomonas aeruginosa | – | 2 |
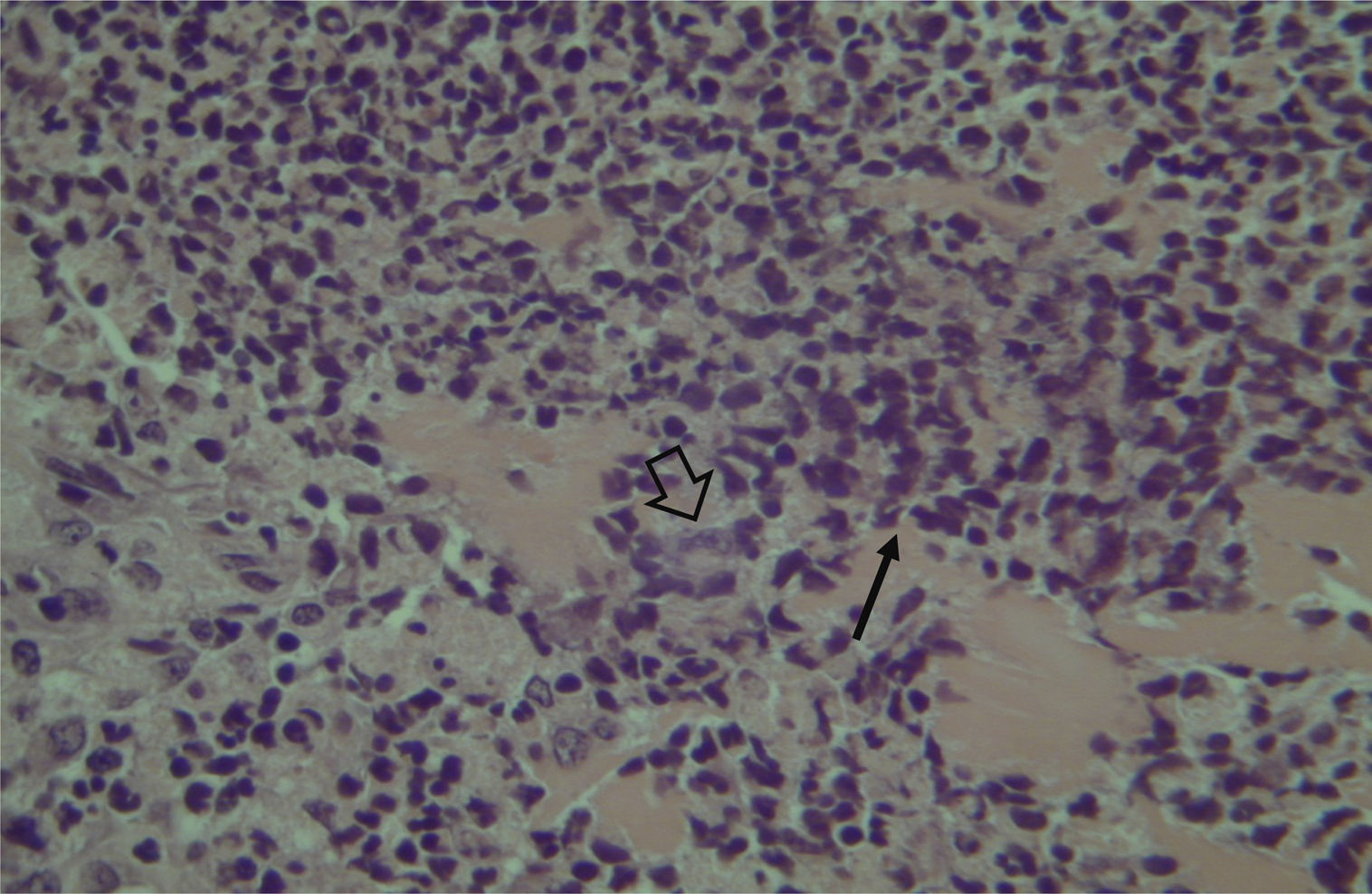
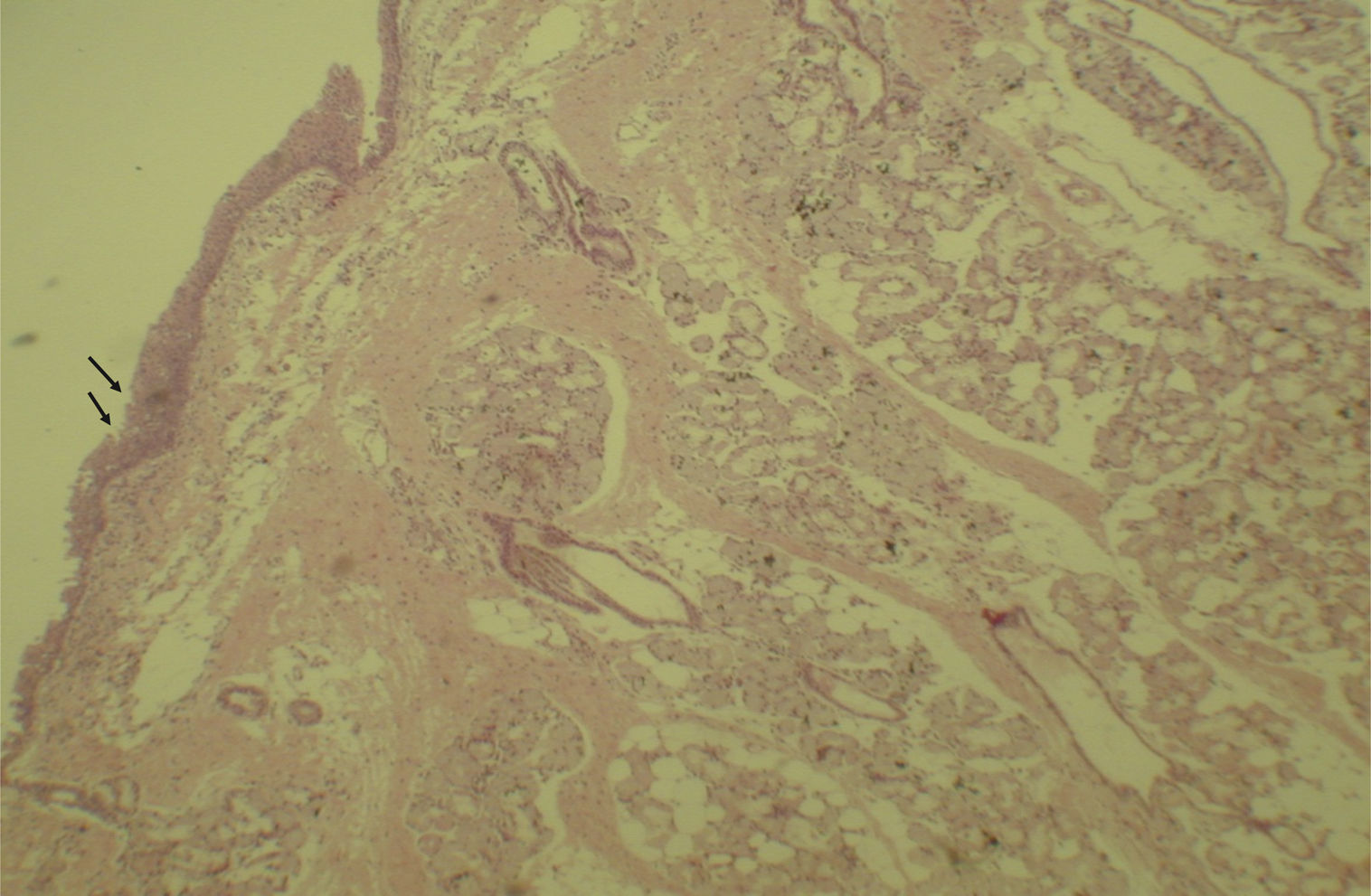
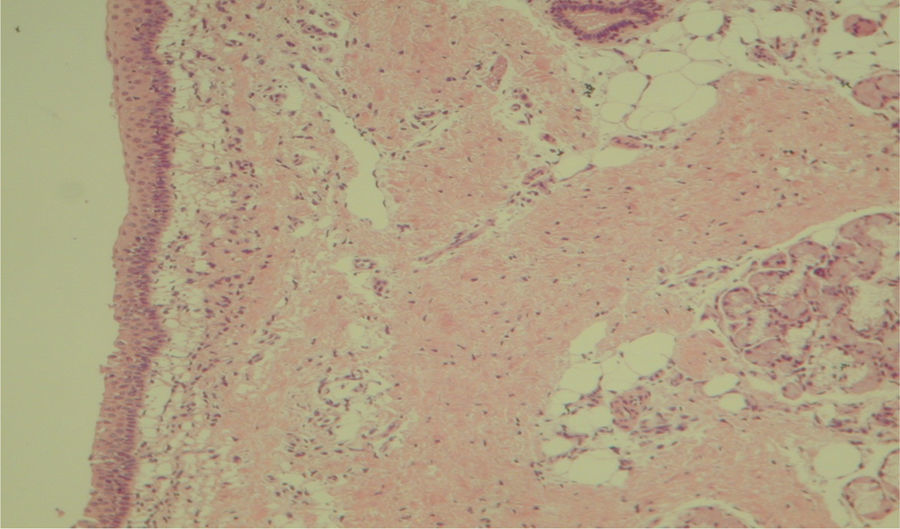
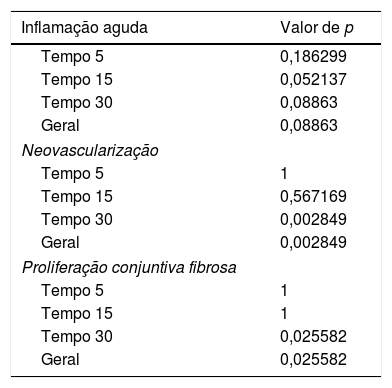
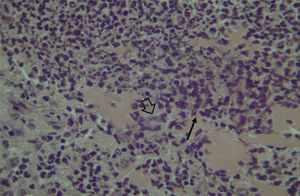
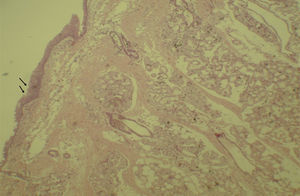
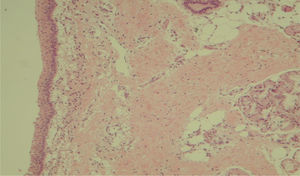
A avaliação histológica da mucosa sinusal mostrou vários graus de inflamação, caracterizados pela intensa infiltração de células inflamatórias (fig. 2), alterações epiteliais (fig. 3), neovascularização, destruição glandular e proliferação conjuntivo‐fibrosa à mucosa praticamente normal (fig. 4). As variações estavam presentes em ambos os grupos de tratamento (tabela 2).
Resultados das comparações de dados entre parâmetros – inflamação aguda, neovascularização e proliferação conjuntiva fibrosa – no seguimento de diferentes tratamentos
| Inflamação aguda | Valor de p |
|---|---|
| Tempo 5 | 0,186299 |
| Tempo 15 | 0,052137 |
| Tempo 30 | 0,08863 |
| Geral | 0,08863 |
| Neovascularização | |
| Tempo 5 | 1 |
| Tempo 15 | 0,567169 |
| Tempo 30 | 0,002849 |
| Geral | 0,002849 |
| Proliferação conjuntiva fibrosa | |
| Tempo 5 | 1 |
| Tempo 15 | 1 |
| Tempo 30 | 0,025582 |
| Geral | 0,025582 |
Esses dados mostram uma diferença estatisticamente significante entre os grupos e os tempos de tratamento na avaliação global dos três diferentes critérios usados para a análise histológica.
As análises histológicas não demonstraram toxicidade nos órgãos estudados que pudesse estar relacionada ao uso de Luffa operculata.
Definição químicaA avaliação fitoquímica de Luffa operculata foi feita através de cromatografia líquida com coluna de fase reversa. A eluição foi feita no modo gradiente a uma taxa de fluxo de 1,0mL/min e detecção de UV a 254nm. A substância principal foi escolhida como marcador fitoquímico. A análise quantitativa foi feita com o método do padrão externo e o marcador, devidamente purificado e identificado, foi usado como padrão.
Purificação do marcador fitoquímicoO extrato aquoso bruto foi fraccionado por extração em fase sólida com fase reversa (EFS‐C18), com gel de sílica C18 como adsorvente. Foram obtidas dez fracções, que depois foram eluídas com água inicialmente e subsequentemente foram feitas misturas de água/MeOH para 100% de MeOH. A purificação final do composto foi feita por cromatografia líquida de alta eficiência (HPLC).
Elucidação estrutural do marcadorOs espectros de NMR foram obtidos no espectrômetro 500 (11,7T), a 500MHz e 125MHz para 13C, com amostras dissolvidas em D2O. Os espectros de massa de alta resolução foram obtidos e os espectros foram obtidos nos modos positivo e negativo.
A substância purificada, obtida na forma de um composto sólido esbranquiçado, foi identificada como ácido 2,3‐dicafeoilglicarico. Esse composto não foi previamente descrito na literatura.
O espectro de massa de alta resolução no modo positivo apresentou cátions a m/z 543.1177 [M+Na]+(calculado 543.1109) e o modo negativo mostrou o íon a m/z 519.1221 [MH] ‐ (calculado 519.1144), o que indicou a fórmula molecular C24H24O13. Além disso, pode‐se observar a perda de duas unidades cafeoil (162) para MS2, tanto no modo positivo como no modo negativo. Determinou‐se que a pureza cromatográfica desse padrão era igual a 86,97%.
Avaliação in vitroStaphylococcus aureus ATCC 25923 – sensível à meticilina (MSSA) e Staphylococcus aureus ATCC 43300 – resistente à meticilina (MRSA) foram usados como agentes bacterianos e cultivados em placas Muller‐Hilton. Após 24 horas de incubação foi observado crescimento bacteriano em todas as amostras. As placas foram cultivadas com e sem a presença de Luffa operculata em extrato aquoso 1% e 0,5% e ácido 2,3‐dicafeoilglicarico 1%. Quanto maior a concentração do fármaco, maior era a inibição do crescimento bacteriano nas amostras. Quando isolado, o princípio ativo mostrou‐se mais eficaz do que as amostras com extrato de Luffa operculata nas mesmas concentrações. O princípio ativo a 1% foi mais eficaz do que o extrato aquoso a 1%, que por sua vez foi mais eficiente do que o extrato aquoso a 0,5%. Todas as placas com Streptococcus pyogenes ATCC 19615 tiveram seu crescimento bacteriano comprometido pela ação de Luffa operculata em diferentes concentrações e nenhuma diferença foi observada para Staphylococcus aureus ATCC 25923 – Sensível à Meticilina (MSSA) e Staphylococcus aureus ATCC 43300 – Resistente à Meticilina (MRSA).
DiscussãoDiferentes estudos destacaram a importância do tratamento local da doença sinusal.11,12Luffa operculata é usada no tratamento de doenças inflamatórias das vias aéreas superiores em medicamentos homeopáticos e alopáticos produzidos na Europa, América do Norte e no Brasil.13,14 Apesar do uso generalizado de Luffa operculata, há poucos estudos que determinam seu valor terapêutico.15
O mecanismo de ação exato da Luffa operculata ainda não está claro. De acordo com Matos e Gottlieb (1967),16 o ingrediente ativo isocucurbitacina B apresenta atividades biológicas com ações descongestionantes, bem como propriedades laxantes, hemolíticas, embriotóxicas e indutivas de aborto. Assim, tendo em vista relatos que confirmam a toxicidade de cucurbitáceas, presume‐se que a isocucurbitacina B seja o princípio tóxico da Luffa operculata.16
Após o estabelecimento de modelos experimentais eficazes e reprodutíveis de rinossinusite em coelhos, muitos autores usaram essa ferramenta para estudar e comparar várias formas de tratamento para infecção nasossinusal.17–19 Alguns autores chegaram a avaliar o efeito fitoterápico da aplicação local nessas situações.20
Alguns estudos já avaliaram o padrão inflamatório histológico da sinusite em modelos animais.21,22 Alguns desses estudos usaram modelos experimentais de sinusite para comparar diferentes tratamentos e também fizeram a avaliação histológica da mucosa nasal ou sinusal como parâmetro de intensidade da inflamação. Na maioria dos casos, essa análise é feita qualitativamente.22 Entretanto, em outros estudos, essa análise também é feita através da técnica semiquantitativa.21 Dessa forma, fatores como infiltração de células inflamatórias, ulceração epitelial, perda ciliar, edema e proliferação conjuntivo‐fibrosa são frequentemente investigados.23
Similarmente ao nosso estudo, outros autores mostram que a técnica de indução da sinusite bacteriana é efetiva19–23 e os agentes etiológicos da infecção estão relacionados ao modelo de infecção usado.24
O efeito antimicrobiano e a indução da produção de secreção são provavelmente as principais atividades de Luffa operculata. Esses mecanismos são reconhecidamente importantes no tratamento de diferentes infecções respiratórias, tais como a RS.23
A administração tópica nasal da solução do extrato de Luffa operculata a 1% demonstrou eficácia superior à solução salina para o tratamento da rinossinusite bacteriana no modelo experimental de coelho, levou em consideração os parâmetros histológicos e o resultado da cultura da secreção sinusal.
Os resultados positivos observados no teste in vivo combinados com o efeito irritante no trato respiratório já descrito na literatura como um efeito secundário da Luffa operculata estimularam‐nos a identificar os ingredientes ativos no extrato de Luffa e submetê‐los a testes de atividade antibacteriana.
A substância purificada obtida foi identificada como ácido 2,3‐dicafeoilglicarico. Esse composto ainda não foi descrito na literatura. A substância demonstrou ser eficaz em testes in vitro, inibiu o crescimento de bactérias da espécie Streptococcus pyogenes. Uma vez que o tratamento da rinossinusite com extrato aquoso tópico de Luffa operculata tem efeitos secundários devido à presença de saponinas que causam alguma irritação nas vias aéreas, o uso do princípio ativo na sua ausência pode revelar‐se de grande valor no tratamento de RS em humanos, traz a possibilidade de um novo fármaco para uso tópico com grande utilidade prática e viabilidade comercial.
ConclusãoA solução tópica nasal do extrato aquoso de Luffa operculata é eficaz no tratamento de RS bacteriana em um modelo experimental quando comparada à aplicação de solução salina. Luffa operculata determinou in vitro a inibição do crescimento de Streptococcus pyogenes.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Silva L, Costa HO, Souza FC, Lopes EM, Ueda SM. Preclinical evaluation of Luffa operculata Cogn. and its main active principle in the treatment of bacterial rhinosinusitis. Braz J Otorhinolaryngol. 2018;84:82–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.