Upper aerodigestive tract cancer is among the most frequent malignancies and has epidemiological importance worldwide. Most cases are already advanced at the diagnosis, with a strong negative impact on survival and high cost to the government. Campaigns directed against these cancers have often failed in Brazil.
ObjectiveTo evaluate the effectiveness of screening for upper aerodigestive tract cancers, using active search strategies and the use of equipped propaedeutics.
MethodsA cross‐sectional, prospective, descriptive, analytical and exploratory study, since its objectives are based on the visualization of cancerous lesions in a sample consisting of individuals with risk factors, aiming to expand the necessary knowledge for cancer detection, aiming at secondary prevention of the oral cavity, oropharynx, larynx and hypopharynx cancer.
ResultsA total of 16.7% of precancerous lesions and 0.5% of cancer lesions located in the upper aerodigestive tract were clinically visualized.
ConclusionThe method was effective in the identification of precancerous lesions for the purpose of secondary prevention, but equally important against upper aerodigestive tract cancer, since in the present study the chance of finding the latter was increased by 22.7, showing it is an alternative for future campaigns against the disease.
O câncer do trato aerodigestivo superior configura‐se entre os mais frequentes e apresenta‐se com importância epidemiológica no mundo. A maior parte apresenta‐se avançada ao diagnóstico, com forte impacto negativo na sobrevida e elevado custo ao erário. As campanhas feitas contra esses cânceres têm frequentemente falhado no Brasil.
ObjetivoAvaliar a efetividade do rastreamento para lesões cancerizáveis do trato aerodigestivo superior com estratégias de busca ativa e uso da propedêutica armada.
MétodoEstudo transversal, prospectivo, descritivo, analítico e exploratório, uma vez que os seus objetivos se alicerçam na visualização das lesões cancerizáveis numa amostra composta por indivíduos com fatores de risco, de forma a aprofundar o conhecimento necessário para a sua detecção, visando à prevenção secundária do câncer da cavidade oral, orofaringe, laringe e hipofaringe.
ResultadoForam visualizadas clinicamente 16,7% lesões cancerizáveis e 0,5% cânceres de localização no trato aerodigestivo superior.
ConclusãoO método mostrou‐se efetivo na identificação de lesões cancerizáveis com intuito de prevenção secundária, mas igualmente importante contra o câncer do trato aerodigestivo superior, uma vez que neste presente estudo multiplicou‐se a chance do encontro desse por 22,7; apresenta‐se como opção para futuras campanhas contra a doença.
Pela semelhança em sua história natural, os cânceres que acometem a cavidade oral, a orofaringe, a laringe e a hipofaringe são usualmente descritos como o carcinoma de células escamosas do trato aerodigestivo superior (CTADS), câncer de cabeça e pescoço ou relatados na forma leiga como câncer de boca e garganta. Mesmo que sejam doenças diferentes e acometam regiões anatômicas distintas, considerá‐las em conjunto pode ser relevante em termos epidemiológicos e na elaboração de ações na saúde pública.1
O CTADS é o sexto tipo de câncer mais prevalente no mundo, com 9,2% dos casos e globalmente responsável por 4,6% das mortes por câncer.2 No Brasil, para o biênio 2018/19, o Instituto Nacional do Câncer (INCA)3 estimou 22.370 casos novos de CTADS (C00‐10, C32), 17.590 para o gênero masculino e 4.780 para o feminino, corresponde respectivamente ao 3° câncer mais prevalente entre os homens e ao 12° entre as mulheres. Ainda conforme o INCA, os CTADS em ambos os gêneros respondem por um risco estimado de 21,51 casos novos por 100.000 habitantes. Trata‐se de um sério problema de saúde pública não somente pela sua incidência, mas no Brasil o estadiamento encontra‐se avançado em 75% a 80% dos casos ao diagnóstico, com mortalidade média de 46% em 5 anos e essa permanece inalterada nas últimas duas a três décadas.4–6
Os principais fatores de risco7 para o CTADS são o tabagismo, o etilismo, o sol para o câncer do lábio e o vírus do papiloma humano (HPV), esse especialmente na orofaringe. Trata‐se de doença assintomática ou oligossintomática em seu curso inicial, tem como as principais lesões cancerizáveis (LCs) ou precursoras as eritroplasias, as eritroleucoplasias e as leucoplasias.7,8
São descritas diversas barreiras ao diagnóstico precoce, as quais parecem interagir com o desconhecimento da população acerca dos fatores de risco, o pobre suporte social, os baixos índices de escolaridade e renda per capita, os aspectos demográficos/geográficos e a dificuldade de acesso aos serviços de saúde.9,10 Considerando a realidade brasileira, não há como atuar sobre todos os fatores mencionados. Por esse motivo, tem‐se sugerido que o achado de uma lesão cancerizável (LC) no trato aerodigestivo superior (TADS) seja a forma mais eficaz de prevenção e intervenção clínica com sucesso,11 o que seria possível com as campanhas de prevenção.
Entretanto, as campanhas de prevenção contra os cânceres da cavidade oral e laringe feitas no Brasil são em grande número ocasionais, convocadas aos indivíduos com/sem os fatores de risco, idade fora do grupo etário de maior prevalência devido à convocação por amplo apelo à comunidade e com menor atenção às lesões cancerizáveis. Em parte a população‐alvo dessas campanhas não é composta exclusivamente pelo grupo de risco, o que explica parcialmente o baixo número de detecção do câncer.12 Não se deve, contudo, desconsiderar o elemento para conscientização e orientação à população contra os vários tipos de câncer, mas é necessário uma melhor compreensão dos processos biológicos e epidemiológicos para a prevenção ao CTADS.
Diferentemente das campanhas de prevenção convencionais, pode‐se captar os indivíduos que se enquadram ao perfil de alto risco, convidá‐los ao atendimento médico pela busca ativa.13 Essa estratégia foi usada em Kerala (Índia) numa campanha contra o câncer da cavidade oral, obtiveram‐se resultados considerados satisfatórios para rastreamento.14 Seguindo a essa, uma estratégia focada na visualização e abordagem terapêutica das LCs pode ser viável na redução da incidência e mortalidade pelos CTADS.15 Em consonância com a literatura, a propedêutica armada através videolaringoscopia (VL) ou videonasolaringoscopia (VNL) é segura e efetiva para a visualização de lesões ou alterações no epitélio do TADS.16
MétodoEstudo transversal, prospectivo, descritivo, analítico e exploratório. Projeto de pesquisa interinstitucional, Plataforma Brasil – CAAE: 28081014.2.1001.5505, CEP Universidade Federal de São Paulo/Unifesp – Parecer n° 618.107 e CEP Universidade Estadual de Montes Claros/Unimontes – Parecer n° 006/2015, cujo objetivo foi avaliar a efetividade do rastreamento das LCs no TADS através da estratégia de busca ativa concomitante à propedêutica armada em indivíduos com fatores de risco para o CTADS. Também mensurar a magnitude das associações entre as LCs e as variáveis estudadas.
O desconhecimento na prevalência (P) das LCs do CTADS de base populacional em nosso meio não permite inferir valores. Diante disso, coube a regra estatística para inferência amostral:17 n0=z2×P (1 ‐ P)/E2, onde: p=0,5; z2 se 95% IC=1,96 e E2=erro amostral de 4% → n0=600. A amostra foi composta por 603 indivíduos residentes no município de Montes Claros/MG, ambos os gêneros, idade ≥ 40 anos, tabagistas e/ou etilistas. Foram triados pela Estratégia da Saúde da Família nos vários territórios em sistema de rodízio e encaminhados ao ambulatório de referência – busca ativa – onde foram submetidos à oroscopia e à propedêutica armada por único especialista através do telescópio rígido convencional de 8 mm/70° (VL) ou pelo nasofibroscópio flexível adulto (VNL) naqueles intolerantes ao primeiro.
As variáveis estudadas foram distribuídas como sociodemográficas (idade, gênero, estado civil, escolaridade, situação profissional), clínicas (gradações do tabagismo e etilismo, presença da LC) e clinicopatológicas (apresentação macroscópica da LC e localização anatômica desta).
Tabagista pesado foi aquele que consumiu ≥ 40 maços/ano18 e etilista pesado aquele que consumiu ≥ 5 unidades de álcool/dia (1 unidade=8 gramas de álcool).19 Considerados macroscopicamente como LCs a leucoplasia, o líquen plano, a queilite actínica, a eritroplasia, a fibrose submucosa e a lesão verrucosa da orofaringe20,21 As LCs com suspeição para câncer foram submetidas à biópsia e estudo histopatológico tendo em vista a necessidade para tratamento imediato.
Para a análise estatística usou‐se o programa SPSS V. 21®. Inicialmente foi feita uma análise descritiva dos dados e posteriormente, aos testes não paramétricos, com a análise bivariada (X2), o modelo de regressão logística bivariada e a múltipla ajustada e hierarquizada dos dados (OR, 95% IC). Nível de significância de 5% (p=0,05).
ResultadoAtenderam aos critérios de inclusão 603 indivíduos. Consideraram‐se as variáveis sociodemográficas (tabela 1), a idade média foi de 55,3 anos±11,51 (Min: 40 / Max: 90) com distribuição prevalente para o gênero masculino em 334 (55,4%); casados 306 (50,7%); escolaridade ≤ 8ª série 419 (69,5%); aposentados 138 (22,9%) e atividades do lar/assemelhados 104 (17,2%).
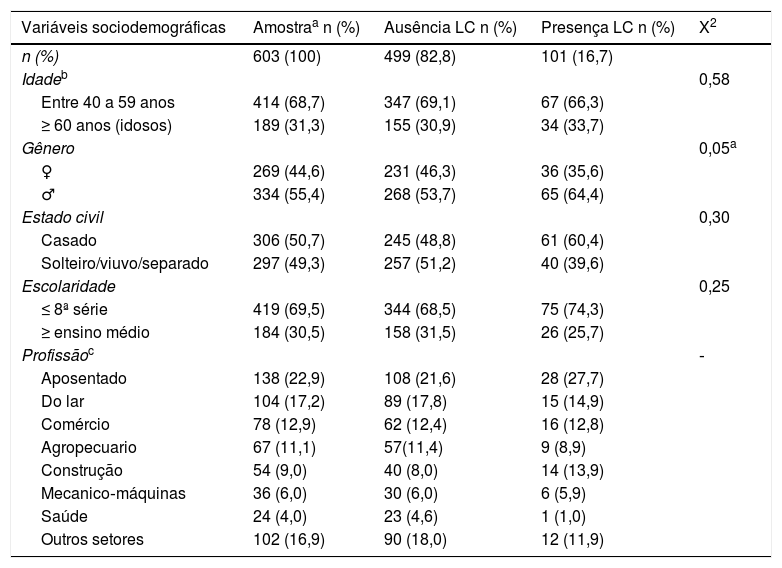
Frequências e porcentagens das variáveis sociodemográficas da amostra. Análise bivariada pelo qui‐quadrado entre as LCs segundo as variáveis sociodemográficas
| Variáveis sociodemográficas | Amostraa n (%) | Ausência LC n (%) | Presença LC n (%) | X2 |
|---|---|---|---|---|
| n (%) | 603 (100) | 499 (82,8) | 101 (16,7) | |
| Idadeb | 0,58 | |||
| Entre 40 a 59 anos | 414 (68,7) | 347 (69,1) | 67 (66,3) | |
| ≥ 60 anos (idosos) | 189 (31,3) | 155 (30,9) | 34 (33,7) | |
| Gênero | 0,05a | |||
| ♀ | 269 (44,6) | 231 (46,3) | 36 (35,6) | |
| ♂ | 334 (55,4) | 268 (53,7) | 65 (64,4) | |
| Estado civil | 0,30 | |||
| Casado | 306 (50,7) | 245 (48,8) | 61 (60,4) | |
| Solteiro/viuvo/separado | 297 (49,3) | 257 (51,2) | 40 (39,6) | |
| Escolaridade | 0,25 | |||
| ≤ 8ª série | 419 (69,5) | 344 (68,5) | 75 (74,3) | |
| ≥ ensino médio | 184 (30,5) | 158 (31,5) | 26 (25,7) | |
| Profissãoc | ‐ | |||
| Aposentado | 138 (22,9) | 108 (21,6) | 28 (27,7) | |
| Do lar | 104 (17,2) | 89 (17,8) | 15 (14,9) | |
| Comércio | 78 (12,9) | 62 (12,4) | 16 (12,8) | |
| Agropecuario | 67 (11,1) | 57(11,4) | 9 (8,9) | |
| Construção | 54 (9,0) | 40 (8,0) | 14 (13,9) | |
| Mecanico‐máquinas | 36 (6,0) | 30 (6,0) | 6 (5,9) | |
| Saúde | 24 (4,0) | 23 (4,6) | 1 (1,0) | |
| Outros setores | 102 (16,9) | 90 (18,0) | 12 (11,9) |
Foram identificadas visualmente 101 (16,7%) LCs com ocorrência no gênero masculino em 65 (64,4%); 4ª e 6ª décadas de vida em 67 (66,3%) e escolaridade ≤ 8ª série em 75 (74,3%). Através da análise bivariada, apenas o gênero masculino (p=0,05) associou‐se de maneira estatisticamente significativa às LCs.
Em relação às variáveis clínicas (tabela 2), todos os indivíduos da amostra foram submetidos à oroscopia e à propedêutica armada pela VL em 525 (87,1%) ou pela VNL em 78 (12,9%).
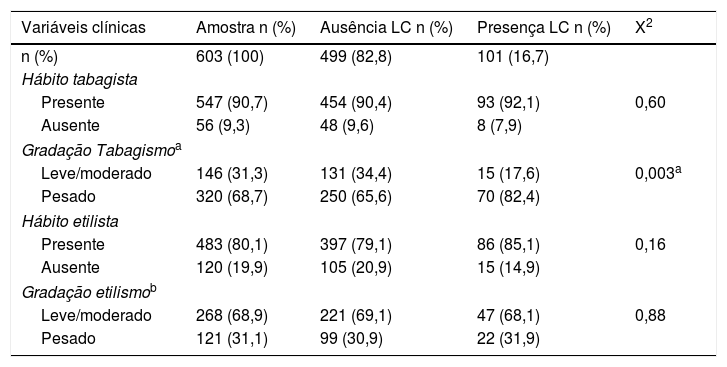
Frequências e porcentagens das variáveis clínicas da amostra. Análise bivariada pelo qui‐quadrado entre as LCs segundo as variáveis clínicas
| Variáveis clínicas | Amostra n (%) | Ausência LC n (%) | Presença LC n (%) | X2 |
|---|---|---|---|---|
| n (%) | 603 (100) | 499 (82,8) | 101 (16,7) | |
| Hábito tabagista | ||||
| Presente | 547 (90,7) | 454 (90,4) | 93 (92,1) | 0,60 |
| Ausente | 56 (9,3) | 48 (9,6) | 8 (7,9) | |
| Gradação Tabagismoa | ||||
| Leve/moderado | 146 (31,3) | 131 (34,4) | 15 (17,6) | 0,003a |
| Pesado | 320 (68,7) | 250 (65,6) | 70 (82,4) | |
| Hábito etilista | ||||
| Presente | 483 (80,1) | 397 (79,1) | 86 (85,1) | 0,16 |
| Ausente | 120 (19,9) | 105 (20,9) | 15 (14,9) | |
| Gradação etilismob | ||||
| Leve/moderado | 268 (68,9) | 221 (69,1) | 47 (68,1) | 0,88 |
| Pesado | 121 (31,1) | 99 (30,9) | 22 (31,9) | |
Quanto aos hábitos deletérios à saúde avaliados, o tabagismo ocorreu em 547 (90,7%) indivíduos e o etilismo em 483 (80,1%). Entre os primeiros e desconsiderando o ex‐tabagista, 320 (68,7%) foram graduados como tabagistas pesados e dentre os segundos desconsiderando o ex‐etilista, 121 (31,1%) foram graduados como etilistas pesados.
Entre as LCs, o tabagismo ocorreu em 93 (92,1%) indivíduos e o etilismo em 86 (85,1%). Através da análise bivariada, somente o tabagista pesado (p=0,003) associou‐se de maneira estatisticamente significativa às LCs.
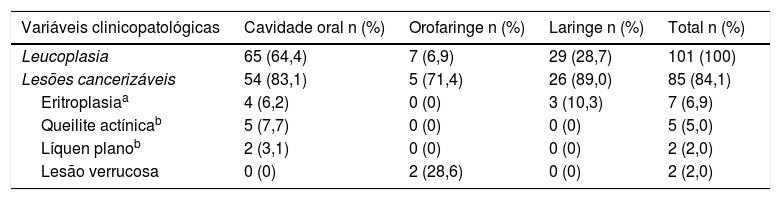
Considerando as variáveis clinicopatológicas (tabela 3), as LC distribuíram‐se como leucoplasia em 92 (91,1%), eritroplasia em 7 (6,9%) e lesão verrucosa em 2 (2,0%). Quanto à distribuição por sítio anatômico, 65 (64,4%) das LCs encontravam‐se na cavidade oral, 29 (28,7%) na laringe e 7 (6,9%) na orofaringe. Não se identificou LC na hipofaringe.
Frequências e porcentagens das variáveis clinicopatológicas (LCs) segundo a localização anatômica e apresentação clínica
| Variáveis clinicopatológicas | Cavidade oral n (%) | Orofaringe n (%) | Laringe n (%) | Total n (%) |
|---|---|---|---|---|
| Leucoplasia | 65 (64,4) | 7 (6,9) | 29 (28,7) | 101 (100) |
| Lesões cancerizáveis | 54 (83,1) | 5 (71,4) | 26 (89,0) | 85 (84,1) |
| Eritroplasiaa | 4 (6,2) | 0 (0) | 3 (10,3) | 7 (6,9) |
| Queilite actínicab | 5 (7,7) | 0 (0) | 0 (0) | 5 (5,0) |
| Líquen planob | 2 (3,1) | 0 (0) | 0 (0) | 2 (2,0) |
| Lesão verrucosa | 0 (0) | 2 (28,6) | 0 (0) | 2 (2,0) |
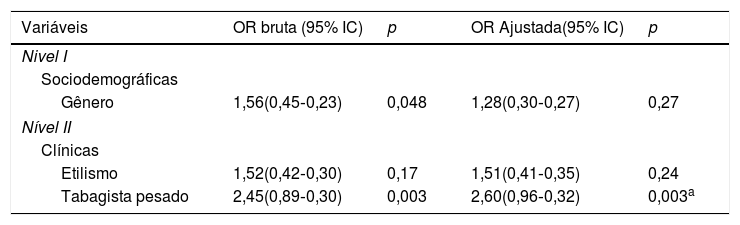
Através da regressão logística bivariada (bruta) seguida pela regressão múltipla ajustada e hierarquizada, somente o tabagista pesado (p=0,003) associou‐se de maneira estatisticamente significativa com as LCs (tabela 4).
Associação entre as LC segundo as variáveis sociodemográficas e clínicas estimadas pelo modelo de regressão logística bivariada e pela múltipla ajustada e hierarquizada. Odds ratio (OR) com intervalo de confiança (IC) de 95%
| Variáveis | OR bruta (95% IC) | p | OR Ajustada(95% IC) | p |
|---|---|---|---|---|
| Nivel I | ||||
| Sociodemográficas | ||||
| Gênero | 1,56(0,45‐0,23) | 0,048 | 1,28(0,30‐0,27) | 0,27 |
| Nível II | ||||
| Clínicas | ||||
| Etilismo | 1,52(0,42‐0,30) | 0,17 | 1,51(0,41‐0,35) | 0,24 |
| Tabagista pesado | 2,45(0,89‐0,30) | 0,003 | 2,60(0,96‐0,32) | 0,003a |
Apenas as variáveis com p ≤ 0,20 na OR bruta seguiram‐se para a OR ajustada e hierarquizada.
Por fim, foram visualizados, biopsiados e estadiados (TNM/2017)24 3 (0,5%) carcinomas de células escamosas na amostra, um na cavidade oral in situ, outro na laringe glótica estádio I e o terceiro na hipofaringe estádio III.
DiscussãoNeste contexto de busca ativa concomitante ao uso da propedêutica armada em indivíduos com fatores de risco, obteve‐se na amostra um perfil epidemiológico semelhante aos portadores do CTADS, em sua maior parte composta por homens (55,4%); idade média em torno dos 55 anos, baixa escolaridade (69,5%); hábitos tabágicos (90,7%) e etílicos (80,1%).25
As LCs foram visualizadas em 16,7% da amostra, dispersas na cavidade oral, orofaringe, laringe e nenhuma foi visualizada na hipofaringe. Associaram‐se estatisticamente ao gênero masculino em 64,4% (p=0,05); ao tabagista pesado em 82,4% (p=0,003) e pela análise múltipla ajustada e hierarquizada esse (p=0,003) mostrou‐se significativo estatisticamente com risco de 2,6 vezes mais. Esses achados são coerentes com a literatura, visto que o homem expõe‐se mais aos fatores de risco para o CTADS se comparado às mulheres e o tabagismo isoladamente representa o fator de risco mais importante.25
Por este estudo a cavidade oral foi o sítio anatômico mais prevalente, com 10,8% das LCs, sua visualização dependeu apenas da oroscopia e variou dentro das margens descritas pela literatura. A taxa de LCs detectáveis na cavidade oral na população varia entre 1% a 5%,26 mas para o gênero masculino, tabagista e idade superior a 40 anos pode atingir índices de 9% a 12,7%.27
A visualização das LCs na cavidade oral ocorreu em maior frequência, pode ao menos em parte se dever a um amplo e prolongado contato com os agentes carcinogênicos existentes no tabaco e nas bebidas alcoólicas, em especial nos destilados fortes.28 Já a visualização das LCs na laringe corresponderam à 4,8%, foi o segundo sítio anatômico em prevalência e dependente da propedêutica armada. A taxa de LCs detectáveis para a laringe na população brasileira ainda é incerta, mas achados dessas por técnicas microcirúrgicas em indivíduos com alterações prévias do epitélio laríngeo variaram entre 7,5% a 18,5%.29
Na orofaringe a visualização das LCs ocorreu em 1,2%, dependente em parte da propedêutica armada para a adequada avaliação da base lingual. Diferentemente da cavidade oral, descrições epidemiológicas das LCs em orofaringe, laringe e hipofaringe são escassas na literatura, impossibilitam‐se assim comparações precisas.30
Quanto à apresentação clinicopatológica, a leucoplasia respondeu por 91,1% das LCs (inclusive o líquen plano e a queilite actínica), com maior ocorrência na cavidade oral em praticamente 2/3 dos casos, seguido pela laringe com 28,3% e pela orofaringe com 5,4%. Já na orofaringe, além da leucoplasia foram visualizadas lesões verrucosas (2,0%), as quais podem ser investigadas através da imuno‐histoquímica quanto à infecção pelo HPV‐16. A LC eritroplásica ocorreu em 6,9% na cavidade oral e laringe, com predileção à primeira. Apesar de menos frequente, a eritroplasia no TADS apresenta elevado potencial carcinogênico e merece abordagem terapêutica incisiva.
Existem recomendações atuais para o acompanhamento do indivíduo com LCs no TADS através da propedêutica armada. Afirma um autor que “esses são indivíduos que merecem vigilância permanente e o uso de instrumentos de imagem mais do que duplica a taxa de lesões malignas detectáveis”.31 Outro ponto crucial para a prevenção secundária do CTADS assenta‐se na avaliação das LCs quanto ao seu pontencial carcinogênico através da patologia e definição dos graus de displasia, o que não se encontra bem delineado em considerável número das campanhas de prevenção.
Hoje em dia no Brasil muitas campanhas de prevenção para o CTADS apresentam características de amplo apelo à população e enfoque principal na prevenção terciária, mobilizam recursos humanos, impõem custos maiores ao erário ou às instituições proponentes e baixa eficácia, induzem um autor a dizer que “é preciso avaliar a conveniência de fazer a campanha nos próximos anos”.12 Outro exemplo assenta‐se na campanha de prevenção ao câncer bucal denominada Abra a Boca para a Saúde na cidade de São Bernardo do Campo/São Paulo, cujo resultado mostrou que a população de risco para o desenvolvimento de câncer de cavidade oral “não está sendo efetivamente atingida pela campanha de prevenção, fato esse que provavelmente também está ocorrendo na maioria das campanhas nas cidades brasileiras”.32
Apesar de este estudo objetivar a visualização das LCs no TADS, foram diagnosticados 3 (0,5%) CTADS, 2 (66,6%) em estadiamentos iniciais.
O encontro do câncer nesta pesquisa mostrou‐se muito relevante, pois excedeu a proporção esperada do CTADS de forma significativa em 22,7 vezes mais se considerar a população brasileira com 21,51 casos novos por 100.000 habitantes ou 0,022%; fato esse presumivelmente provocado pela seleção dos indivíduos em risco e pelo uso da propedêutica armada, que ampliou as áreas anatômicas a serem avaliadas. Isso se torna interessante, uma vez que programas de rastreio em larga escala permanecem por ser estabelecidos regional ou globalmente, tendo ainda em vista a escassez de recursos para a saúde em nosso meio.33
Tendo em consideração o número de indivíduos estudados, julgamos ser possível generalizar os resultados obtidos a outras regiões do interior do país que se apresentem com uma densidade populacional e características socioeconômicas e culturais semelhantes.
ConclusãoO método estudado mostrou‐se válido não somente na identificação de LCs (16,7%) para a prevenção secundária do CTADS, mas igualmente importante ao identificar esse em índices elevados se comparados às campanhas tradicionalmente feitas (22,7 vezes mais), apresenta‐se então como uma nova opção a ser explorada.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Santos FB, Leonhardt FD, Abrahão M. Prevention of upper aerodigestive tract cancer through active search strategies and use of equipped propaedeutics. Braz J Otorhinolaryngol. 2020;86:443–9.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.
Estudo feito no Município de Montes Claros, MG, Brasil.
Projeto de pesquisa interinstitucional, Plataforma Brasil ‐ CAAE: 28081014.2.1001.5505, CEP Universidade Federal de São Paulo/Unifesp ‐ Parecer n° 618.107 e Universidade Estadual de Montes Claros/Unimontes ‐ Parecer n° 006/2015.
- Início
- Todos os conteúdos
- Publique seu artigo
- Sobre a revista
- Métricas