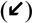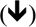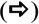Ototoxicity is a health problem appearing after powerful treatments in serious health conditions. It is sometimes inevitable when treatment of the serious disease is required. Cisplatin is an antineoplastic agent which was investigated previously to reveal increased nitrogen and reactive oxygen radicals that damages hair cells, resulting in ototoxicity. N‐acetylcysteine, previously shown to decrease ototoxicity caused by different agents, is known to be a powerful in vitro antioxidant. Probably N‐acetylcysteine, in addition to its antioxidant effect, blocks a cascade where reactive oxygen species result in apoptosis in the cochlea.
ObjectivesThe possible preventive effect of N‐acetylcysteine in cisplatin ototoxicity was studied with auditory brain stem responses, otoacoustic emissions, and histopathological investigation of the cochlea in a scanning electron microscopy.
MethodsThis study was conducted on 21 Wistar Albino rats in four groups. 1mL/kg/day three times in total intraperitoneal (i.p.) Saline (n=5), 500mg/kg/day i.p. three times in total N‐acetylcysteine (n=5), i.p. 15mg/kg cisplatin alone (single dose) (n=5) and i.p. 15mg/kg cisplatin plus 500mg/kg/day N‐acetylcysteine (n=6) were administered. The rats were anesthetized to study the hearing tests before and after the experiment. The rats were sacrificed to investigate the cochleas by scanning electron microscopy.
ResultsAuditory brain stem responses and otoacoustic emissions values were attenuated in the cisplatin group. The group that received N‐acetylcysteine in addition to cisplatin had better auditory brain stem responses thresholds and otoacoustic emissions. The samples obtained from the cisplatin group showed surface irregularities, degeneration areas, and total or partial severe stereocilia losses. The changes were milder in the cisplatin+N‐acetylcysteine group.
ConclusionCisplatin ototoxicity can be detected by auditory brain stem responses and otoacoustic emissions testing in rats. N‐acetylcysteine may protect the cochlear cells from histopathological changes. We concluded that N‐acetylcysteine given 4h after cisplatin injection has a potential otoprotective effect against cisplatin ototoxicity. which suggests it could be used in clinical trials.
A ototoxicidade é um problema que pode ocorrer após certos tipos de tratamentos para condições graves de saúde. Às vezes é inevitável quando o tratamento da doença é necessário. A cisplatina é um agente antineoplásico cujo uso em pesquisas anteriores demonstrou aumentar os radicais livres de nitrogênio e espécies reativas de oxigênio que danificam as células ciliadas e resultam em ototoxicidade. Por outro lado, a N‐acetilcisteína, que já demonstrou diminuir a ototoxicidade causada por diferentes agentes, é conhecida por ser um potente antioxidante in vitro. Provavelmente a N‐acetilcisteína, além de seu efeito antioxidante, bloqueia uma cascata onde espécies reativas de oxigênio resultam em apoptose na cóclea.
ObjetivosEstudar o possível efeito preventivo da N‐acetilcisteína na ototoxicidade por cisplatina por meio de potencial evocado auditivo de tronco encefálico, emissões otoacústicas e investigação histopatológica da cóclea por microscopia eletrônica de varredura.
MétodoEste estudo foi realizado em 21 ratos albinos Wistar, separados em quatro grupos. Foram administrados: 1mL/kg/dia intraperitoneal (i.p.) de solução salina (n=5), três vezes no total; 500mg/kg/dia i.p. de N‐acetilcisteína (n=5), três vezes no total; 15mg/kg i.p. (dose única) somente de cisplatina (n=5) e 15mg/kg i.p. de cisplatina e 500mg/kg/dia i.p. de N‐acetilcisteína (n=6). Os ratos foram anestesiados para estudo dos testes auditivos antes e depois do experimento. Os ratos foram sacrificados para investigação da cóclea por microscopia eletrônica de varredura.
ResultadosOs potenciais evocados auditivos de tronco encefálico e os valores das emissões otoacústicas estavam atenuados no grupo cisplatina. O grupo que recebeu N‐acetilcisteína além da cisplatina apresentou melhores limiares de respostas auditivas do tronco encefálico e emissões otoacústicas. As amostras obtidas do grupo cisplatina apresentaram irregularidades de superfície, áreas de degeneração, com perdas graves totais ou parciais de estereocílios. As alterações foram mais leves no grupo cisplatina+N‐acetilcisteína.
ConclusãoA ototoxicidade por cisplatina pode ser detectada por meio de potenciais evocados auditivos de tronco encefálico e pelo teste de emissões otoacústicas em ratos. A N‐acetilcisteína pode proteger as células cocleares contra alterações histopatológicas. Concluímos que a N‐acetilcisteína administrada 4 horas após a injeção de cisplatina tem potencial efeito otoprotetor contra a ototoxicidade por cisplatina e pode ser utilizada em ensaios clínicos.
A ototoxicidade é um problema que pode ocorrer após tratamentos intensos de condições graves de saúde.1–3 Às vezes é inevitável quando o tratamento da doença é uma necessidade, como nos sobreviventes de câncer. Para pacientes com câncer, a cisplatina é um agente antineoplásico comum, foi investigado anteriormente, demonstrou produzir um aumento de radicais livres de nitrogênio e espécies reativas de oxigênio, prejudiciais às células ciliadas, e causar ototoxicidade.3–8
Existem alguns agentes, inclusive tiossulfato de sódio, amifostina, D‐metionina, vitamina E, dexametasona, salicilatos, neurotrofinas, flunarizina, ácido lipoico, ebselen, dietilditiocarbamato e ácido 4‐metiltiobenzóico, aos quais se atribui a capacidade de prevenir ototoxicidade.9–15 A N‐acetilcisteína (NAC), que já demonstrou diminuir a ototoxicidade causada por diferentes agentes, é conhecida por ser um potente antioxidante invitro.16–18
A ototoxicidade é mediada por espécies reativas de oxigênio, o que resulta em morte celular.1–3 Em contrapartida, a N‐acetilcisteína (NAC) é um antioxidante, originalmente usado como agente mucolítico para o tratamento pulmonar. Entretanto, também é usado para doenças dos pulmões, fígado, coração e rim, com o objetivo de tratar as lesões tóxicas e isquêmicas.19 Por exemplo, a NAC melhora a hemodinâmica renal em ratos com nefrotoxicidade induzida por cisplatina.20 Provavelmente, além de seu efeito antioxidante, a NAC possa bloquear a cascata onde espécies reativas de oxigênio resultam em apoptose na cóclea.21
A ototoxicidade permanente é uma condição incapacitante que pode afastar ainda mais o paciente do ambiente social, além dos efeitos devastadores da doença primária. A detecção dela por meio de emissões otoacústicas (EOAs), potencial evocado auditivo de tronco encefálico (PEATE) e a prevenção de sua persistência, com o uso da NAC, pode ser muito benéfica para o paciente, que já lida com os problemas da doença primária.
O objetivo deste estudo foi avaliar as possíveis propriedades protetoras de um potente antioxidante (NAC) contra a ototoxicidade da cisplatina, que ocorre através dos radicais livres. A NAC poderá contribuir para a literatura sobre prevenção da ototoxicidade na quimioterapia com cisplatina, uma vez que pode ser usada em seres humanos.
MétodoO artigo foi aprovado pelo comitê regional de ética em pesquisa animal (n° 16/147). Os experimentos foram feitos em laboratório de animais. Este é um estudo prospectivo e controlado em animais, sobre a ototoxicidade da cisplatina.
Nos experimentos, 21 ratos albinos machos Wistar, com 5 meses de idade e peso médio de 300‐350g, receberam uma dieta‐padrão de laboratório. Todos os ratos foram mantidos em jaulas na mesma sala e sob as mesmas condições ambientais, com ciclos claro/escuro de 12/12 horas, a uma temperatura de 22 ±3°C e nível de ruído inferior a 50dB. Os ratos foram alimentados ad libitum.
Inicialmente, cada rato foi anestesiado com cetamina (40mg/kg) e xilazina (5mg/kg) via intraperitoneal (i.p.). Após a anestesia, o meato acústico externo e as membranas timpânicas de cada rato foram submetidos a otomicroscopia, não foi encontrado sinal de doença. As emissões otoacústicas por produto de distorção (EOAPD) e os potenciais evocados auditivos de tronco encefálico (PEATE) foram feitos para ambas as orelhas de cada animal para avaliação basal do limiar auditivo. Durante os experimentos, três ratos que pertenciam ao grupo controle, grupo cisplatina e grupo NAC e dois ratos que pertenciam ao grupo cisplatina + NAC não se recuperaram da anestesia e foram excluídos do estudo; portanto, novos ratos foram incluídos no lugar dos animais mortos no estudo. Como conclusão, 42 orelhas funcionalmente normais de 21 ratos foram incluídas na pesquisa.
Estudo clínico preliminarInicialmente, foi feito um estudo preliminar para ototoxicidade em 20 ratos. A cisplatina foi administrada a 15 ratos albinos Wistar e a ototoxicidade foi determinada por decréscimo dos valores dos limiares. Solução salina foi administrada a 5 ratos. Os ratos albinos Wistar receberam cisplatina, a primeira dose foi de 5mg/kg, seguida de 10mg/kg e 15mg/kg até a ototoxicidade resultante. A dose de 15mg/kg de cisplatina foi considerada ototóxica pelos testes de EOAs e PEATE. Portanto, no estudo foram usados 15mg/kg de cisplatina.
Formação de grupos e procedimentos experimentaisOs animais foram randomizados em 4 grupos, conforme mostrado na tabela 1.
Os ratos do terceiro e quarto grupos receberam cisplatina apenas uma vez durante o estudo. Para o quarto grupo, a NAC foi administrada três vezes no total (dose total de 1.500mg/kg) no primeiro dia e 4 horas após a cisplatina, no segundo e terceiro dias. Nos dias 0 e 7, os animais foram submetidos a anestesia seguida de avaliação das EOAs e PEATE para as funções auditivas e os resultados foram registrados.
Depois que todas as injeções e medidas foram feitas, os ratos foram eutanasiados com a administração de uma dose alta de anestésicos e as cócleas foram colhidas e fixadas em solução de formol para estudos histopatológicos.
Medidas de emissões otoacústicasOs valores da relação sinal‐ruído (SNR, do inglês Signal‐to‐Noise Ratio), calculados com a subtração do nível de ruído de fundo das medidas das EOAPD em decibéis (dB), foram usados para interpretação dos resultados dos testes. Um sistema de EOA e sondas neonatais foram usados para triagem das EOAPD. A relação f2/f1 foi fixada em 1,22 e a diferença L1–L2 foi ajustada para 10dB de nível de pressão sonora (L1 = 70dB NPS; L2 = 60dB NPS). As EOAPD foram avaliadas nos tons iguais a 2f1‐f2 e geradas nas frequências correspondentes à média geométrica de f1 e f2. Os valores da SNR foram registrados de ambas as orelhas nos dias 0 e 7 a 2000, 3000, 4000, 6000 e 8000Hz.
Medidas do PEATEAs respostas do PEATE foram registradas por eletrodos‐agulhas subdermicamente posicionados com o eletrodo ativo no vértice, o eletrodo‐terra na glabela e os eletrodos referência nos campos do mastoide direito e esquerdo. Os cliques foram apresentados como estímulos auditivos de acordo com os seguintes parâmetros: filtros passa‐banda de 100–3000Hz e uma taxa de repetição de 21s. O limiar do PEATE ocorreu na quinta onda. O limiar foi identificado a 70dB e quando uma forma de onda apropriada era obtida, o volume era diminuído em 20dB por vez. Caso não ocorresse uma forma de onda apropriada, usava‐se 90dB. Quando a onda estava prestes a desaparecer, eram aplicados decréscimos de 10dB. O volume da última onda, antes de desaparecer, representa o limiar caso confirmada a reprodutibilidade e a identificação do limiar for melhorada em dois testes.
Avaliação histopatológicaO segmento médio das cócleas foi removido dos ratos sob anestesia com xilazina e cetamina no 7° dia após a aplicação. Após a remoção do tecido ósseo que envolve o meato auditivo interno, o lúmen coclear foi fixado em glutaraldeído a 2,5% por 48 horas para o exame de microscopia eletrônica. A pós‐fixação foi feita com tetróxido de ósmio a 1% (OsO4) e tratada com séries crescentes de acetona (50%, 70%, 80%, 90%, 100%, 100%, 100%) por 15 minutos e seca com secador de ponto crítico em CO2 líquido. As amostras foram colocadas em blocos de metal e revestidas com ouro‐paládio com uma espessura de 18‐20nm, com um dispositivo de revestimento Sputter, e examinadas com microscópio eletrônico de varredura LEO 440 em modo de elétron secundário a 15kV.
Análise estatísticaO programa SPSS for Windows 16.0 foi usado para analisar os achados deste experimento. Para a análise estatística, as variáveis foram expressas e usadas como número (n), porcentagem (%) e média ± desvio‐padrão. O teste de Shapiro‐Wilk, Q‐Q e histogramas foram usados para avaliar a normalidade dos dados. As comparações foram feitas com análise de variância de dois fatores com medidas repetidas. O teste de Kruskal‐Wallis unidirecional foi usado para comparar os resultados das EOAPD entre os grupos antes e após a aplicação do medicamento. O teste de Bonferroni foi implantado para comparações múltiplas. Comparações intragrupo foram usadas com base na análise de Wilcoxon. Valores de p < 0,05 foram aceitos como estatisticamente significantes.
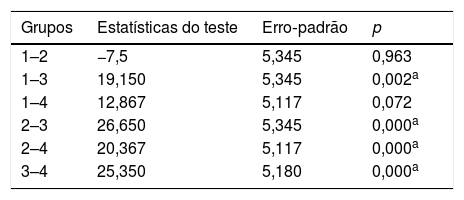
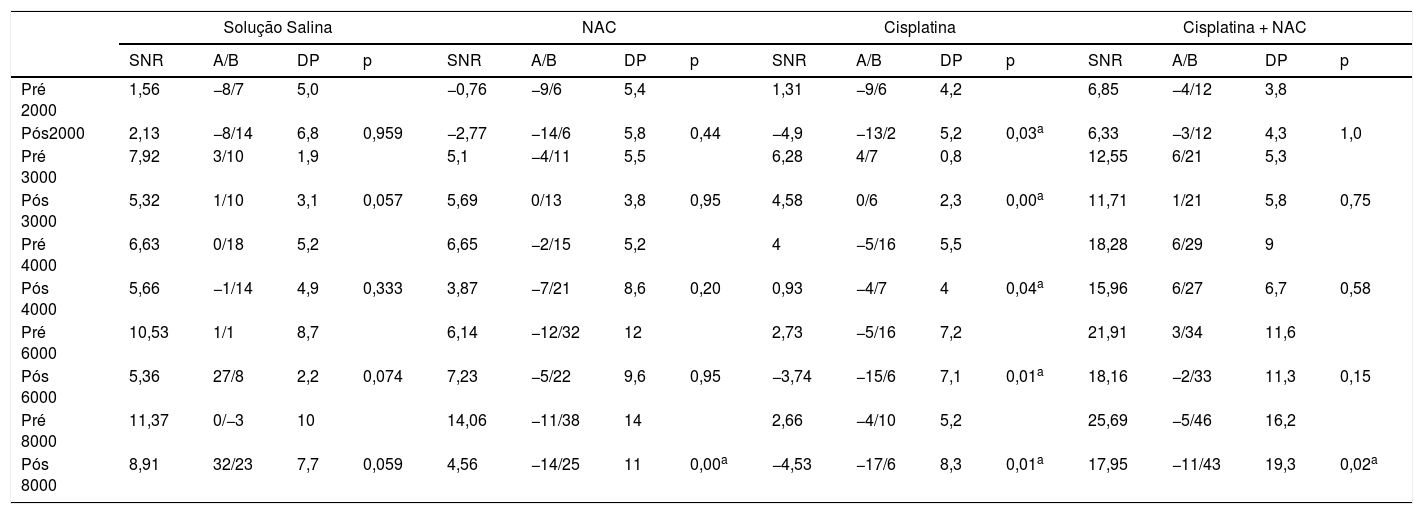
ResultadosAvaliação dos resultados das EOAPD e dos PEATEOs valores das EOAPD iniciais não foram significantemente diferentes entre os grupos e intragrupos. Após a aplicação da cisplatina, os valores das EOAPD e dos limiares dos PEATE foram atenuados. Houve alterações estatisticamente significantes nos limiares dos PEATE antes e após a administração de cisplatina (p < 0,05) (tabela 2). Os outros grupos que receberam cisplatina mais NAC, solução salina ou apenas NAC não apresentaram alterações significantes nos limiares auditivos após o tratamento (tabela 2). Observaram‐se mudanças estatisticamente significantes nas comparações do PEATE entre os grupos 1–3, 2–3, 2–4 e 3–4 (p < 0,05) (tabela 3). O tratamento com cisplatina reduziu acentuadamente as respostas das EOAPD em todas as frequências (tabela 4). As alterações nas respostas das EOAPD e nos limiares dos PEATES nos outros três grupos não foram significantes. Houve alterações estatisticamente significantes nos limiares dos PEATES entre o pré‐tratamento e o pós‐tratamento no grupo NAC e no grupo Cisplatina + NAC. Mas essa condição não representou ototoxicidade. É importante mencionar o fato de que, após o tratamento, houve melhoria nos limiares dos grupos com NAC e cisplatina + NAC.
Limiares do potencial evocado auditivo de tronco encefálico (PEATE) pré‐tratamento e pós‐tratamento nos grupos (valor médio)
| Grupo | Pré‐tratamento | Pós‐tratamento | p |
|---|---|---|---|
| Grupo Controle | 26 ± 14,29 | 23 ± 10,59 | 0,083 |
| Grupo NAC | 28 ± 7,88 | 17 ± 11,5 | 0,004a |
| Grupo Cisplatina | 26 ± 10,74 | 37 ± 11,59 | 0,005a |
| Grupo Cisplatina + NAC | −11,25 ± 17,72 | −5 ± 15,81 | 0,006a |
Comparações intragrupo foram feitas com o teste de postos sinalizados de Wilcoxon.
Comparações do potencial evocado auditivo de tronco encefálico (PEATE) pós‐tratamento entre os grupos
| Grupos | Estatísticas do teste | Erro‐padrão | p |
|---|---|---|---|
| 1–2 | −7,5 | 5,345 | 0,963 |
| 1–3 | 19,150 | 5,345 | 0,002a |
| 1–4 | 12,867 | 5,117 | 0,072 |
| 2–3 | 26,650 | 5,345 | 0,000a |
| 2–4 | 20,367 | 5,117 | 0,000a |
| 3–4 | 25,350 | 5,180 | 0,000a |
1, Grupo Controle; 2, Grupo NAC; 3, Grupo Cisplatina; 4, Grupo Cisplatina + NAC.
Teste de Kruskal‐Wallis foi usado para comparar os resultados do PEATE entre os grupos.
Respostas das emissões otoacústicas por produto de distorção (EOAPD) pré‐tratamento e pós‐tratamento em todas as frequências (valores médios de SNR, S, mínimo e máximo, p)
| Solução Salina | NAC | Cisplatina | Cisplatina + NAC | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SNR | A/B | DP | p | SNR | A/B | DP | p | SNR | A/B | DP | p | SNR | A/B | DP | p | |
| Pré 2000 | 1,56 | −8/7 | 5,0 | −0,76 | −9/6 | 5,4 | 1,31 | −9/6 | 4,2 | 6,85 | −4/12 | 3,8 | ||||
| Pós2000 | 2,13 | −8/14 | 6,8 | 0,959 | −2,77 | −14/6 | 5,8 | 0,44 | −4,9 | −13/2 | 5,2 | 0,03a | 6,33 | −3/12 | 4,3 | 1,0 |
| Pré 3000 | 7,92 | 3/10 | 1,9 | 5,1 | −4/11 | 5,5 | 6,28 | 4/7 | 0,8 | 12,55 | 6/21 | 5,3 | ||||
| Pós 3000 | 5,32 | 1/10 | 3,1 | 0,057 | 5,69 | 0/13 | 3,8 | 0,95 | 4,58 | 0/6 | 2,3 | 0,00a | 11,71 | 1/21 | 5,8 | 0,75 |
| Pré 4000 | 6,63 | 0/18 | 5,2 | 6,65 | −2/15 | 5,2 | 4 | −5/16 | 5,5 | 18,28 | 6/29 | 9 | ||||
| Pós 4000 | 5,66 | −1/14 | 4,9 | 0,333 | 3,87 | −7/21 | 8,6 | 0,20 | 0,93 | −4/7 | 4 | 0,04a | 15,96 | 6/27 | 6,7 | 0,58 |
| Pré 6000 | 10,53 | 1/1 | 8,7 | 6,14 | −12/32 | 12 | 2,73 | −5/16 | 7,2 | 21,91 | 3/34 | 11,6 | ||||
| Pós 6000 | 5,36 | 27/8 | 2,2 | 0,074 | 7,23 | −5/22 | 9,6 | 0,95 | −3,74 | −15/6 | 7,1 | 0,01a | 18,16 | −2/33 | 11,3 | 0,15 |
| Pré 8000 | 11,37 | 0/−3 | 10 | 14,06 | −11/38 | 14 | 2,66 | −4/10 | 5,2 | 25,69 | −5/46 | 16,2 | ||||
| Pós 8000 | 8,91 | 32/23 | 7,7 | 0,059 | 4,56 | −14/25 | 11 | 0,00a | −4,53 | −17/6 | 8,3 | 0,01a | 17,95 | −11/43 | 19,3 | 0,02a |
A, valor mínimo; B, valor máximo; DP, desvio‐padrão; SNR, relação sinal‐ruído.
Comparações intragrupo foram feitas com o teste de postos sinalizados de Wilcoxon.
As células ciliadas externas do grupo controle estavam dispostas em forma de U ou V. Houve um aumento gradual no comprimento dos estereocílios localizados na superfície externa, em comparação com aqueles localizados na superfície interna. Os estereocílios na superfície das células do grupo controle estavam dispostos individualmente e de maneira regular, refletiram as funções de absorção e secreção dessas células (fig. 1).
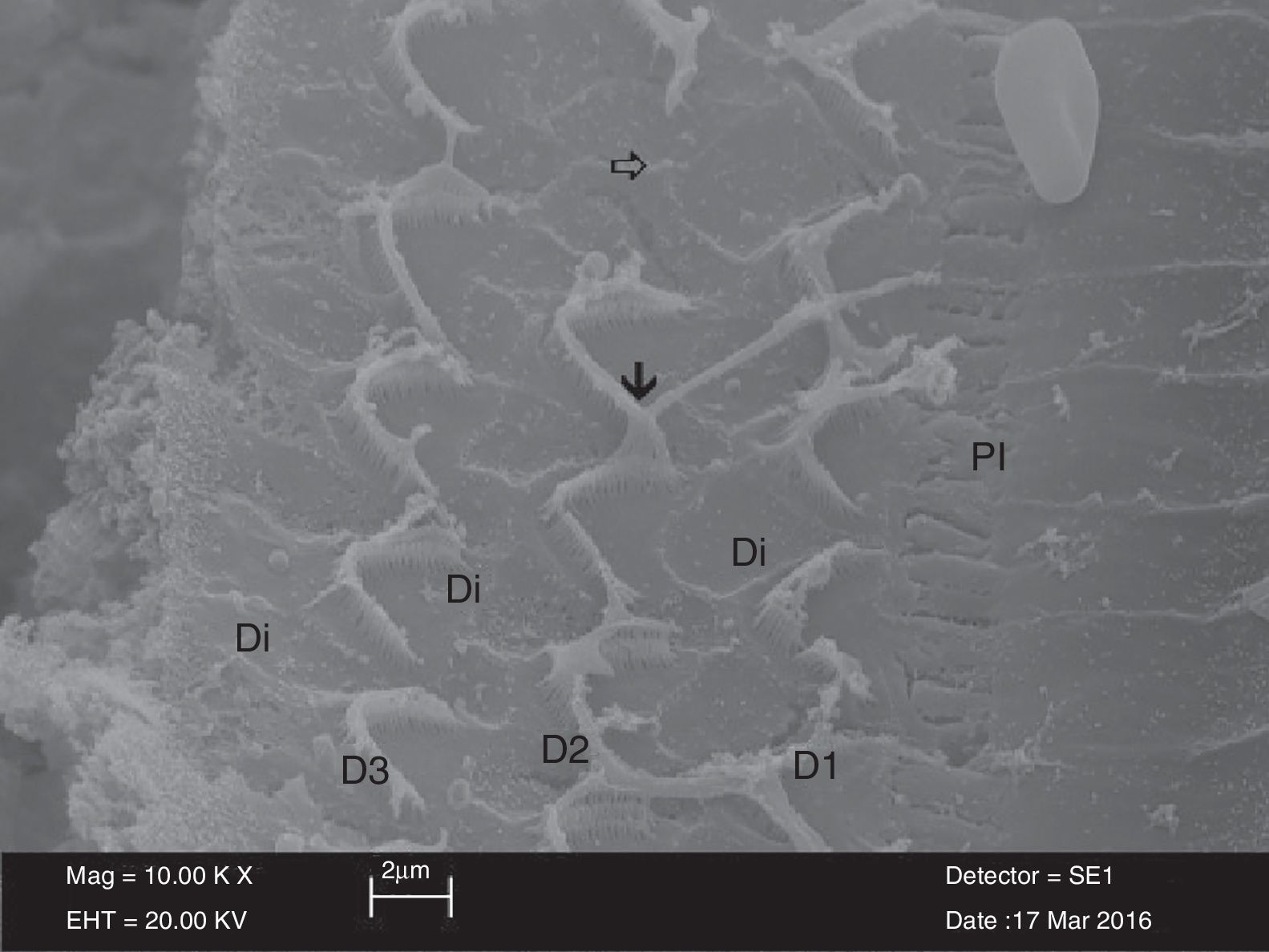
No exame de microscopia eletrônica da morfologia da superfície do órgão de Corti nos grupos NAC, os estereocílios nas células ciliadas externas eram semelhantes às do grupo controle e seus formatos em U ou V estavam preservados. No entanto, as seções apicais dos estereocílios dessas células estavam firmemente aderidas umas às outras. Não foi possível diferenciar cada estereocílio devido a essas aderências. Além disso, foram observadas irregularidades estruturais e rupturas nos estereocílios. Semelhantemente ao grupo controle, as células ciliadas externas preservaram sua organização de três camadas. No entanto, havia aderência e união entre estereocílios em formato de U ou V no grupo NAC, embora não houvesse aderência entre os estereocílios localizados nas seções superiores das células ciliadas externas e os estereocílios das células ciliadas externas adjacentes no grupo controle. Houve perda parcial de estereocílios e perda total de células em células ciliadas externas sucessivamente (fig. 2).
Imagem de microscopia eletrônica de varredura (MEV) das estruturas das células ciliadas externas (D1‐D2‐D3) cercadas por células de Deiters (Di) no grupo NAC. Imagem das áreas de aderências na seção apical dos estereocílios
e as áreas de perda na célula ciliada externa PI, células pilares internas (× 10.000).Havia dissociação, irregularidades e ondulações entre os estereocílios no exame da morfologia da superfície do órgão de Corti no grupo cisplatina. Além disso, rupturas foram observadas no arranjo em U ou V das células ciliadas externas. Em particular, houve perda total ou parcial de estereocílios e áreas de degeneração nos três arranjos das células ciliadas externas. Havia também uma ampla gama de áreas de deformação celular nas células ciliadas internas (fig. 3). Protrusões semelhantes a balões na estrutura das células ciliadas externas, adjacentes às células de Hensen, também foram observadas (fig. 4).
Área de perda parcial
nos estereocílios das células ciliadas internas (İ) e perda total nas células ciliadas externas (D1‐D2‐D3) no grupo cisplatina. Visualização de protrusões em forma de balão nas células ciliadas externas adjacentes às células de Deiters (Di). Pİ, células pilares internas; H, célula de Hensen (x 3.000).No grupo cisplatina mais NAC, as células ciliadas externas eram semelhantes às do grupo controle e preservaram seus formatos em U ou V. No entanto, havia aderências, embora não tão graves como no grupo NAC, nos estereocílios localizados na parte superior das células ciliadas externas. Houve perda total ou parcial de estereocílios entre as células ciliadas externas organizadas em três camadas. Além disso, havia áreas de degeneração nos estereocílios (fig. 5).
DiscussãoDiferentes aspectos da ototoxicidade e agentes preventivos foram estudados anteriormente.9–15 Embora existam outros métodos para a detecção da ototoxicidade, inclusive a histopatologia pós‐morte, o rastreamento com EOAs e PEATE é uma maneira confiável. O decréscimo nas EOAs produzidas pelas células ciliadas externas é a evidência de ototoxicidade estudada anteriormente.5,7,17
O NAC diminui o peróxido de hidrogênio e aumenta a glutationa celular, assim conhecida por reduzir a ototoxicidade da cisplatina.22,23 A NAC pode exercer atividade osteogênica através do aumento da síntese de glutationa.24 Nenhuma osteogênese foi observada após o uso de NAC neste estudo. Mas discute‐se se a NAC também poderia diminuir o efeito antitumoral, uma vez que se sabe que ela interage com a molécula de cisplatina. Para evitar essa atenuação no efeito antitumoral, a NAC foi introduzida através de uma via totalmente diferente, ou seja, transtimpânica, o que garantiu que as duas moléculas não interagissem.25 A introdução transtimpânica de diferentes moléculas protetoras, por exemplo, o tiossulfato de sódio, também foi tentado por outros autores.26 Para resolver o problema de interação, Muldoon et al.27 introduziram a NAC 4 horas após a quimioterapia e alegaram que a quimioproteção da NAC não alterava a terapia com cisplatina, se adiada em até 4 horas (h) após a quimioterapia. Eles também alegaram que esse tipo de protocolo evita a ototoxicidade. Para testar isso em nosso estudo atual, também introduzimos a NAC protetora 4 horas após a injeção de cisplatina, o que acabou reduzindo o efeito ototóxico da cisplatina. Enquanto as EOAs e PEATE estivessem diminuídos no grupo cisplatina, a NAC administrada 4 horas após a cisplatina não alterou as EOAs e o PEATE. Fomos capazes de detectar claramente a ototoxicidade com essas medidas in vivo. O grupo cisplatina revelou os piores resultados nos testes de EOAs e PEATE. As EOA e o PEATE não estavam alterados no grupo que recebeu NAC, significou que a NAC não afetou a audição por si só. Low et al.18 avaliaram a NAC administrada 72h após a radiação e afirmaram ter observado menos radicais de oxigênio no ouvido interno, o que resultou em menos apoptose da cóclea. Isso é semelhante à ideia que testamos no presente estudo. Em estudos de fertilidade animal, nenhum efeito adverso foi relatado em doses de até 250mg/kg de NAC e nenhum efeito teratogênico foi observado em doses de até 2000mg/kg de NAC.28 Duan et al.29 observaram que uma dose cumulativa de NAC (1750mg/kg), administrada antes e após o trauma causado por ruídos de impulso resultou em um maior desvio permanente do limiar e maior perda de células ciliadas internas em comparação aos animais controle. Em vez disso, uma dose cumulativa de 1.050mg/kg, durante 5 dias resultou em uma proteção significativa contra o ruído de impulso. Em outro experimento, dois grupos de animais foram tratados com duas doses cumulativas diferentes e não foram expostos a trauma acústico: estes animais não apresentaram qualquer mudança no limiar. Assim, embora a NAC não seja tóxica para a cóclea isoladamente, a dosagem do fármaco é crítica para induzir seu efeito protetor. Fetoni et al.30 usaram uma dose de 500mg/kg i.p. administrada imediatamente após a exposição ao ruído e, em seguida, durante os dois dias seguintes (dose cumulativa de 1500mg/kg). Então, usamos uma dose de 500mg/kg i.p. de NAC. Não observamos o efeito tóxico da NAC.
Como Okur et al.22 revelaram que a ototoxicidade da carboplatina aumentou os níveis de óxido nítrico e a N‐acetilcisteína evitou a produção de NO, pode haver mecanismos diferentes de ototoxicidade e prevenção.
Com relação à otopreservação em presença de drogas antineoplásicas, particularmente a cisplatina, Church et al.31 encontraram preservação do potencial encefálico eletrofisiológica induzido em hamsters com tiossulfato de sódio e dietildimetiltiocarbamato e não observaram proteção significante contra a amifostina e a fosfomicina. Kaltenbach et al.32 investigaram os mesmos fármacos, agora associados à avaliação estrutural por microscopia eletrônica e potencial evocado auditivo do tronco encefálico. Eles determinaram 91% de renovação das células ciliadas externas com tiossulfato de sódio, 68% com dietildimetiltiocarbamato, 52% com fosfomicina e 45% com amifostina.
Fetoni et al.30 revelaram que as células ciliadas externas desapareceram e feixes desorganizados de estereocílios das células ciliadas externas foram observados. Em contraste, aqueles expostos ao ruído e a NAC mostraram apenas uma perda moderada de células ciliadas externas nas mesmas regiões e os estereocílios estavam normais.
Que seja de nosso conhecimento, os achados audiológicos e histopatológicos combinados em relação à ototoxicidade por cisplatina e a proteção por N‐acetilcisteína não foram relatados anteriormente. Mostramos que os valores de PEATE e EOAs e o número de células danificadas não se alteraram acentuadamente no grupo que recebeu cisplatina e NAC, enquanto aqueles que receberam somente cisplatina mostraram alteração marcante. Os achados histopatológicos na cóclea também foram semelhantes aos achados audiológicos. A microscopia eletrônica mostrou perda de células ciliadas externas na ototoxicidade por cisplatina. Concluímos que a ototoxicidade por cisplatina pode ser evitada com o uso de NAC em ratos.
Em conclusão, houve aumento do comprimento das células ciliadas da base ao ápice na estrutura coclear. Com base nesses achados, o comprimento das células ciliadas internas e externas não pôde ser comparado entre o grupo experimental e o grupo controle. Portanto, concluímos que a deficiência auditiva pode se desenvolver como resultado de problemas no fluxo de K+ causados por irregularidades em junções apertadas e desmossomos em estereocílios ou bloqueio de canais por cisplatina, considerando o fato de que a informação sensorial é transportada das células ciliadas externas para a canais auditivos.
Considerando a sua dose efetiva, tempo e modo de administração, a NAC pode servir como um agente antioxidante valioso para minimizar a ototoxicidade não apenas da cisplatina, mas também de outras substâncias. Outros estudos semelhantes também são necessários para apoiar a introdução tardia do agente protetor.
ConclusãoA NAC não exerce efeito adverso na orelha interna quando usada isoladamente. Em nosso modelo experimental, a cisplatina desencadeou a ototoxicidade com sucesso, o que é evidente com base nos decréscimos nos resultados das EOAPD e PEATE e dos achados morfológicos; a NAC mostra sinais evidentes de proteção contra a ototoxicidade causada pela cisplatina no sétimo dia após a aplicação. A administração da NAC 4 horas após a injeção de cisplatina foi um fator protetor contra os achados histopatológicos negativos e a atenuação dos limiares das EOAs e PEATE causados pela cisplatina.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Somdaş MA, Güntürk İ, Balcıoğlu E, Avcı D, Yazıcı C, Özdamar S. Protective effect of N‐acetylcysteine against cisplatin ototoxicity in rats: a study with hearing tests and scanning electron microscopy. Braz J Otorhinolaryngol. 2020;86:30–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.