A proteína tipo‐lisil oxidase‐4 é uma amina oxidase da família lisil oxidase cuja superexpressão em câncer de cabeça e pescoço e up‐regulação em resposta à hipóxia foram previamente demonstradas. O possível papel da proteína tipo‐lisil oxidase‐4 como um marcador tumoral no câncer de laringe em estágio avançado foi investigado.
ObjetivosInvestigar a expressão da proteína tipo‐lisil oxidase‐4 no câncer de laringe em estágio avançado e elucidar seu possível papel como marcador tumoral, preditor da resposta ao tratamento e do prognóstico.
MétodoAmostras diagnósticas de 72 pacientes tratados para carcinoma espinocelular da laringe em estágio III‐IV foram avaliadas quanto à expressão da proteína tipo‐lisil oxidase‐4 por imuno‐histoquímica.
ResultadosA expressão de proteína tipo‐lisil oxidase‐4 foi correlacionada com o estágio avançado do tumor (p=0,041) e melhor diferenciação (p=0,025), mas foi independente do diâmetro do tumor (p=0,456). A resposta à quimioterapia de indução ou a necessidade de laringectomia de resgate não foram afetadas pela expressão da proteína tipo‐lisil oxidase‐4 (p=0,999, p=0,070 respectivamente). O aumento da expressão da proteína tipo‐lisil oxidase‐4 foi associado a melhor sobrevida global de 2 anos nas análises univariada (p=0,036) e multivariada (p=0,014).
ConclusãoA expressão da proteína tipo‐lisil oxidase‐4 surge com o avanço dos estágios e desaparece com pioria da diferenciação e pode ter propriedades supressoras de tumor no câncer de laringe.
Anualmente, mais de meio milhão de pessoas são diagnosticadas com carcinoma espinocelular (CEC) de cabeça e pescoço e o CEC da laringe é o segundo mais comum entre essas lesões malignas.1 Dos pacientes, 40% com CEC da laringe apresentam‐se em estágio avançado e a sobrevida de 5 anos apresentou um ligeiro declínio, para menos de 60%, em estudos recentes.2 A eficácia da quimiorradioterapia concomitante para preservação de órgãos no estágio avançado do CEC laríngeo foi estabelecida na coorte RTOG 91‐11, com o estudo de referência de Forastiere et al., em 2003.3 Entretanto, o CEC de laringe exibe uma heterogeneidade clínica e genética acentuada,4 torna a falta de resposta à quimiorradioterapia, a recorrência locorregional e a necessidade de cirurgia de resgate um risco significativo. Identificar os indivíduos que podem ter uma resposta deficiente aos protocolos de preservação de órgãos ou uma tendência à progressão do tumor, apesar da quimiorradioterapia em CEC de laringe, através de biomarcadores, seria, portanto, uma estratégia desejável.
A hipóxia tumoral está associada a comportamento biológico agressivo, tendência metastática, resistência ao tratamento e mau prognóstico em tumores sólidos e a resistência à radiação em tumores hipóxicos está bem estabelecida. A associação entre os marcadores de hipóxia com o prognóstico em CEC de laringe é um tópico de investigação recente que revelou uma correlação positiva entre a mortalidade específica da doença e os marcadores de hipóxia, como a anidrase carbônica‐9 (CA‐9).5
Uma nova família de enzimas da matriz extracelular (MEC) que catalisam a reticulação do colágeno e da elastina é expressa em resposta à hipóxia tecidual: proteínas tipo lisil‐oxidase (LOXL) mostraram ser mediadores essenciais para metástases induzidas por hipóxia.6 Na coorte RTOG 90‐03 confirmou‐se que a LOX, a enzima parental nessa família, promove metástases e é um marcador prognóstico negativo para a sobrevida em carcinoma de cabeça e pescoço.7 Outro membro dessa família de enzimas, a proteína tipo‐lisil oxidase‐4 (LOXL4), foi recentemente estabelecida como um marcador molecular seletivo no CEC primário e metastático de cabeça e pescoço.8 Este estudo tem como objetivo caracterizar a relação entre a expressão de LOXL4 no tecido e o tamanho do tumor, metástases nodais, resposta à quimiorradioterapia e sobrevida em CEC de laringe localmente avançado.
MétodoCaracterísticas dos pacientesOs pacientes tratados para CEC da laringe estágio T3–4 do American Joint Committee on Cancer (AJCC, 7ª ed.) em um centro de atendimento terciário foram identificados e os dados clinicopatológicos e de desfechos foram registrados retrospectivamente. Todos os casos foram diagnosticados entre janeiro de 2001 e outubro de 2013 e designados para tratamento com laringectomia total ou terapia de preservação de órgãos com intenção curativa pelo conselho de oncologia multidisciplinar institucional. Foram solicitados blocos do tumor pré‐tratamento fixados em formalina e embebidos em parafina e o diagnóstico de CEC foi confirmado por um histopatologista sênior (GGT).
O período mínimo de seguimento foi de 24 meses para os casos sem recidiva ou óbito. Casos com dados de seguimento insuficientes foram excluídos da análise de sobrevida.
O estudo foi aprovado pelo comitê de ética institucional (ref. N° GO 14/4216‐03) e uma bolsa de pesquisa foi concedida pelo fundo de pesquisa científica institucional.
Foram seguidas as recomendações REMARK para relatar estudos prognósticos de marcadores tumorais.
Imuno‐histoquímicaOs espécimes de biópsia laringoscópica primária fixados em formalina e embebidos em parafina dos pacientes foram recuperados e cortes de 5μm de espessura foram dispostos em lâminas carregadas positivamente. A coloração imuno‐histoquímica foi automatizada, usou‐se o instrumento de coloração automática Ventana BenchMark® Gx (Roche, Basel ‐ Suécia). Após a desparafinização a 75°C, a recuperação do antígeno foi feita com tampão citrato por 38 minutos. As lâminas foram então incubadas com anticorpo de coelho anti‐LOXL4 (Abcam, Cambridge ‐ Reino Unido) a uma diluição de 5μg/mL por 20 minutos a 37° C. Os locais LOXL4 positivos foram corados com 3,3’‐Diaminobenzidina (DAB) e a contracoloração foi feita com hematoxilina. Tecidos humanos testiculares e renais foram usados como controles positivos.
Análise histológicaA coloração de tecido LOXL4 foi avaliada por dois histopatologistas experientes em uma única sessão, os quais foram cegados para as características clínicas dos pacientes. A intensidade da coloração foi categorizada como leve (1 ponto), moderada (2 pts.) e forte (3 pts.). A extensão da coloração foi categorizada como <10% (1 pt.), 11% –25% (2 pts.), 26% –50% (3 pts.), 51% –75% (4 pts.), 76% –100% (5 pts.). O produto da multiplicação da intensidade e extensão da pontuação foi usado como um escore de expressão de LOXL4 composto e os casos com escore de 6 pontos ou mais (uma coloração de pelo menos 11%‐25% ou intensidade moderada) foram considerados LOXL4‐positivos para os fins deste estudo. A diferenciação tumoral também foi avaliada na mesma sessão.
Medida do tamanho tumoralO maior diâmetro do tumor primário em centímetros, do relatório patológico macroscópico original, foi registrado apenas para pacientes tratados com laringectomia total primária.
Análise estatísticaO software SPSS versão 22 (IBM, Armonk ‐ New York) foi usado para todas as análises estatísticas. Variáveis categóricas foram avaliadas com teste χ2 (substituído pelo teste exato de Fisher se as frequências esperadas estivessem abaixo de 20%). As comparações entre as distribuições não paramétricas foram feitas com o teste U de Mann‐Whitney e o tempo para a recorrência da doença ou morte foi estimado com o método de Kaplan‐Meier. As curvas de sobrevivência foram comparadas com o teste de log‐rank de Mantel‐Cox. A análise multivariada para estimativa de risco foi feita com a regressão de Cox. Todos os valores de p <0,05 foram considerados estatisticamente significativos. A Sobrevida Livre da Doença (SLD) foi definida como o tempo decorrido desde o diagnóstico até qualquer recorrência (local, regional, distante). A sobrevida geral (SG) foi definida como o tempo decorrido desde o diagnóstico até a morte por qualquer causa.
ResultadosForam incluídos no estudo 72 pacientes com CEC de laringe no estágio T3–4 (69 homens, 3 mulheres). O paciente mais jovem tinha 43 anos na época do diagnóstico e o mais velho tinha 86 (média de idade de 58 [± 9,4 DP]). Quarenta e dois casos eram T3 (58,3%) e 30 eram T4 (41,7%) de acordo com o estadiamento do AJCC. Metástases nodais não estavam presentes em 44 pacientes (61,1%), mas 7 (9,7%) eram estágio N1, 19 (26,4%) eram N2 e 2 (2,8%) eram N3. Nenhum tinha metástases a distância no momento do diagnóstico.
Todas as amostras foram confirmadas como CEC na análise histopatológica, com 25 (34,7%) tumores bem diferenciados, 41 (56,9%) moderadamente diferenciados, 6 (8,3%) pouco diferenciados.
O tratamento primário dos pacientes consistiu em laringectomia total e esvaziamento cervical em 29 casos (40,2%). Foram tratados 18 casos (25%) com quimiorradioterapia concomitante (70Gy de radioterapia por intensidade modulada em 35 frações e cisplatina 35mg/m2 por semana) e 21 pacientes (29,1%) necessitaram de quimioterapia de indução (3 ciclos de cisplatina 75mg/m2 + docetaxel 75mg/m2 + fluorouracil 750mg/m2) mais quimiorradioterapia concomitante (como descrito anteriormente). O tratamento de quatro pacientes (5,6%) foi iniciado com quimioterapia de indução, mas foi concluído com uma laringectomia de resgate devido à falta de resposta objetiva suficiente à quimioterapia no tumor primário. A tabela 1 mostra um resumo das características dos pacientes.
Características dos pacientes
| Característica | N° of Cases | Porcentagem de casos (%) |
|---|---|---|
| Sexo | ||
| Masculino | 69 | 95,8 |
| Feminino | 3 | 4,2 |
| Classificação AJCC‐T | ||
| T3 | 42 | 58,3 |
| T4 | 30 | 41,7 |
| Classificação AJCC‐N | ||
| N0 | 44 | 61,1 |
| N1 | 7 | 9,7 |
| N2 | 19 | 26,4 |
| N3 | 2 | 2,8 |
| Estágio | ||
| III | 32 | 44,4 |
| IVa | 38 | 52,8 |
| IVb | 2 | 2,8 |
| Diferenciação tumoral | ||
| Bem diferenciado | 25 | 34,7 |
| Moderadamente diferenciado | 41 | 56,9 |
| Pouco diferenciado | 6 | 8,3 |
| Tratamento primário | ||
| Laringectomia total + EC | 29 | 40,3 |
| Quimiorradioterapia concomitante b | 18 | 25 |
| Quimioterapia por induçãoc | 25 | 34,7 |
| Com resposta (preservação de órgão) | 21 | 29,2 |
| Sem resposta (cirurgia de resgate) | 4 | 5,6 |
| Característica | Valor de Média±DP/Mediana | Variação |
|---|---|---|
| Idade | 58±9,4 anos (média±DP) | 43 – 86 anos |
| Diâmetro tumorala | 3,9±1,88cm (média±DP) | 1,6 – 10 cm |
| Escore da expressão de LOXL4 | 4 (mediana) | 1– 15 |
AJCC, American Joint Committee on Cancer; EC, Esvaziamento cervical; DP, Desvio‐padrão; LOXL4, Proteína tipo‐lisil oxidase‐4.
Dos 43 pacientes inicialmente designados para preservação de órgãos, a laringectomia total de resgate foi necessária em 17 (39%) devido à falha de indução ou recorrência local. A duração média do acompanhamento foi de 37 meses (± 27,5 meses) e 61 casos (85%) tiveram dados de seguimento suficientes para ser incluídos na análise de sobrevida.
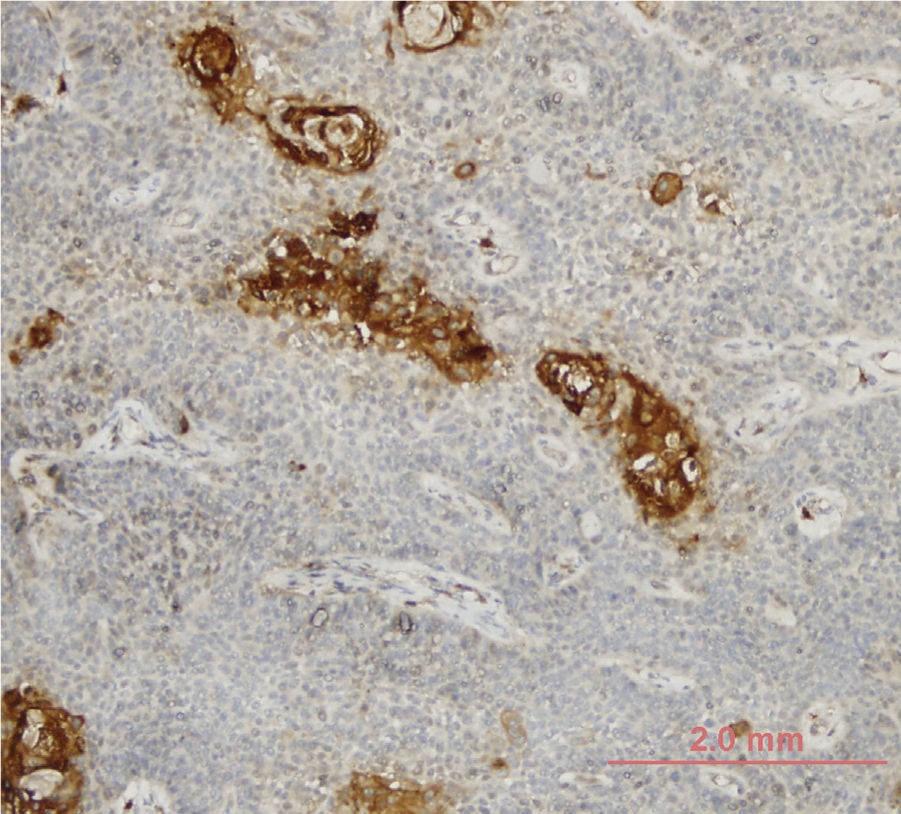
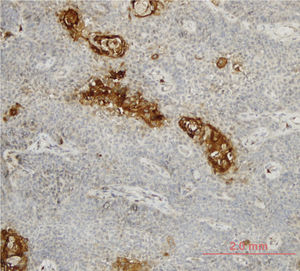
A expressão de LOXL4 foi positiva em 25 (34,7%) e negativa em 47 (65,3%) tumores. Estágio T e expressão de LOXL4 mais elevados demonstraram uma correlação estatisticamente significante com 15 (50%) dos tumores T4 vs. 10 (23,8%) dos tumores T3 considerados LOXL4 positivos (p=0,021). Uma correlação semelhante não foi evidente em relação ao estágio nodal dos pacientes (p=0,171). Os tumores com melhor diferenciação demonstraram expressão de LOXL4 acentuadamente aumentada, pois 13 (52%) dos tumores bem diferenciados e 25 (25,5%) dos tumores moderadamente diferenciados mostraram positividade para LOXL4 e esse achado foi considerado estatisticamente significante (p=0,025) (tabela 2). A demonstração de coloração imuno‐histoquímica intensa em zonas tumorais bem diferenciadas é mostrada na figura 1.
Associação da expressão de LOXL4 com características tumorais
| LOXL4 negativa | LOXL4 positiva | p‐valor | |
|---|---|---|---|
| Classificação AJCC‐T | |||
| T3 | 32 (76,2%) | 10 (23,8%) | |
| T4 | 15 (50%) | 15 (50%) | |
| Total | 47 (65,3%) | 25 (34,7%) | p=0,021a |
| Classificação AJCC‐N | |||
| N0 | 30 (68,2%) | 14 (31,8%) | |
| N1 | 6 (85,7%) | 1 (14,3%) | |
| N2‐3 | 11 (52,4%) | 10 (47,6%) | |
| Total | 47 (65,3%) | 25 (34,7%) | p=0,248 |
| Estágio | |||
| III | 25 (78,1%) | 7 (21,9%) | |
| IV | 22 (55%) | 18 (45%) | |
| Total | 47 (65,3%) | 25 (34,7%) | p=0,041a |
| Diferenciação tumoral | |||
| Bem diferenciado | 12 (48%) | 13 (52%) | |
| Moderadamente/Pouco diferenciado | 35 (57,9%) | 12 (25,5%) | |
| Total | 47 (65,3%) | 25 (34,7%) | p=0,025a |
AJCC, American Joint Committee on Cancer; LOXL4, Proteína tipo‐lisil oxidase‐4.
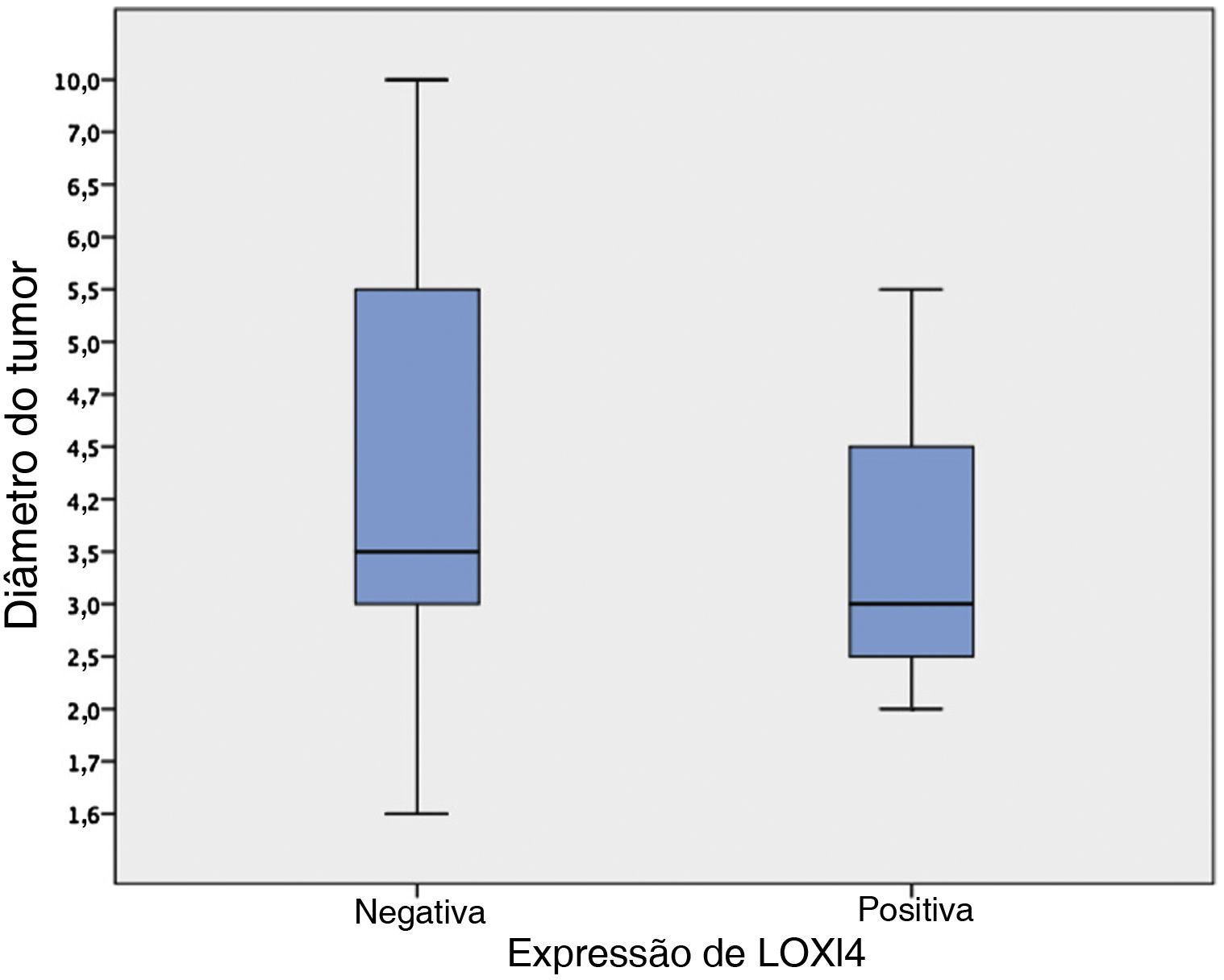
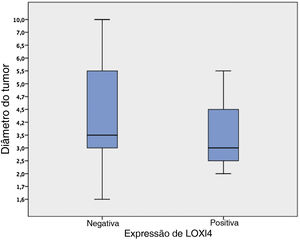
Entre os 29 pacientes tratados principalmente com laringectomia total, os tumores aumentados apresentavam uma tendência a perder a expressão de LOXL4 (diâmetro médio do tumor de 4,1±0,49 [LOXL4 negativo] vs. 3,4±0,38 [LOXL4 positivo]), mas essa tendência não atingiu significância estatística (p=0,456) (fig. 2).
Embora a necessidade de laringectomia de resgate pareça aumentar em casos LOXL4 negativos (76,5% foram submetidos a laringectomia de resgate vs. 23,5% dos pacientes LOXL4 positivos), a associação não foi estatisticamente significante (p=0,070). Da mesma forma, não foi encontrada correlação entre a expressão de LOXL4 e a resposta à quimioterapia de indução (p=0,999) (tabela 3).
Associação da expressão de LOXL4 com resposta de indução e sucesso na preservação de órgãos
| LOXL4 negativa | LOXL4 positiva | p‐valor | |
|---|---|---|---|
| Resposta de induçãoa | |||
| Com resposta | 11 (52,4%) | 10 (47,6%) | |
| Sem resposta | 2 (50%) | 2 (50%) | |
| Total | 13 (52%) | 12 (48%) | p=0,999 |
| Laringectomia de resgateb | |||
| Laringectomia (+) | 13 (76,5%) | 4 (23,5%) | |
| Laringectomia (‐) | 10 (47,6%) | 11 (52,4%) | |
| Total | 23 (60,5%) | 15 (39,5%) | p=0,070 |
LOXL4, Proteína tipo‐lisil oxidase‐4.
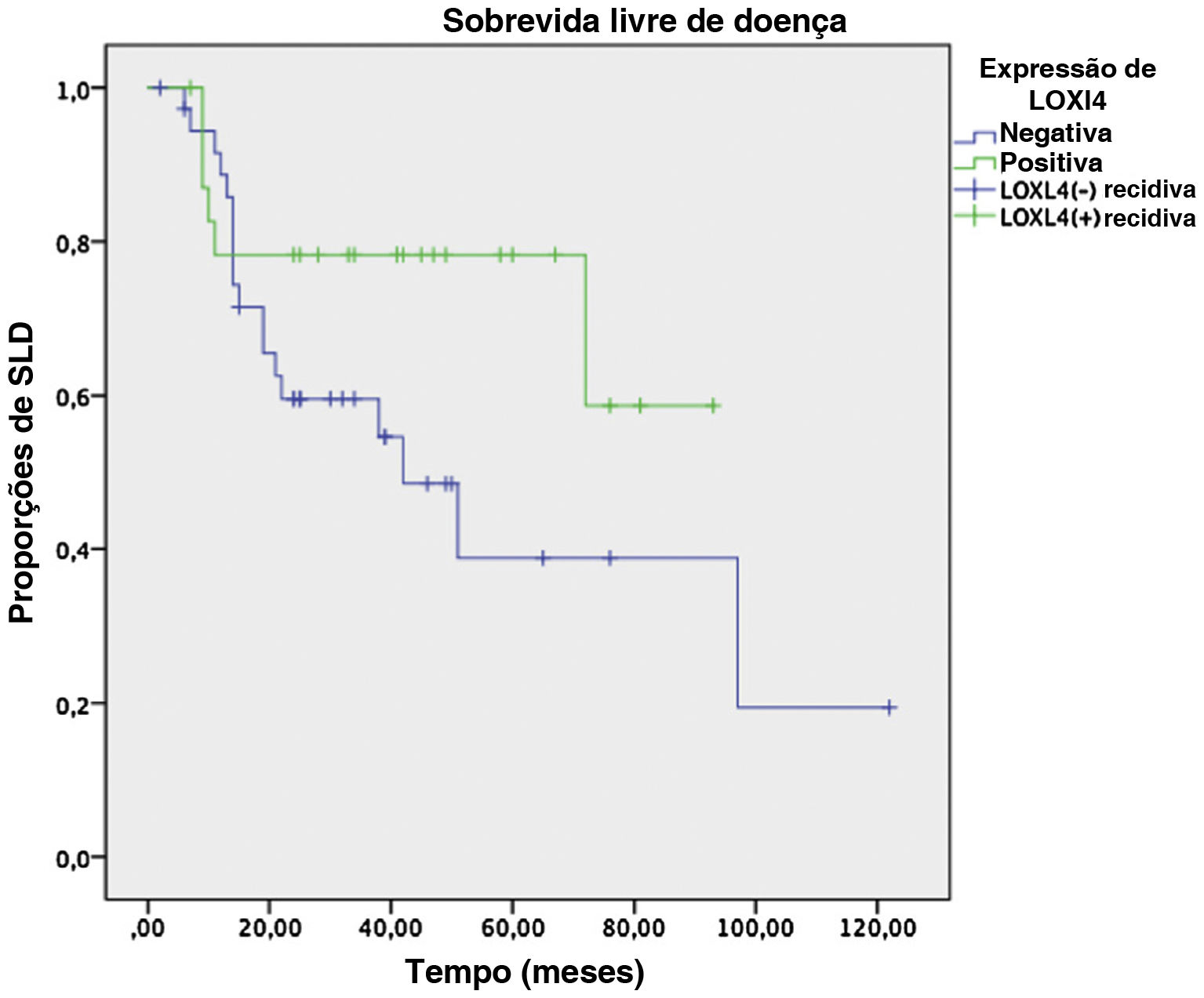
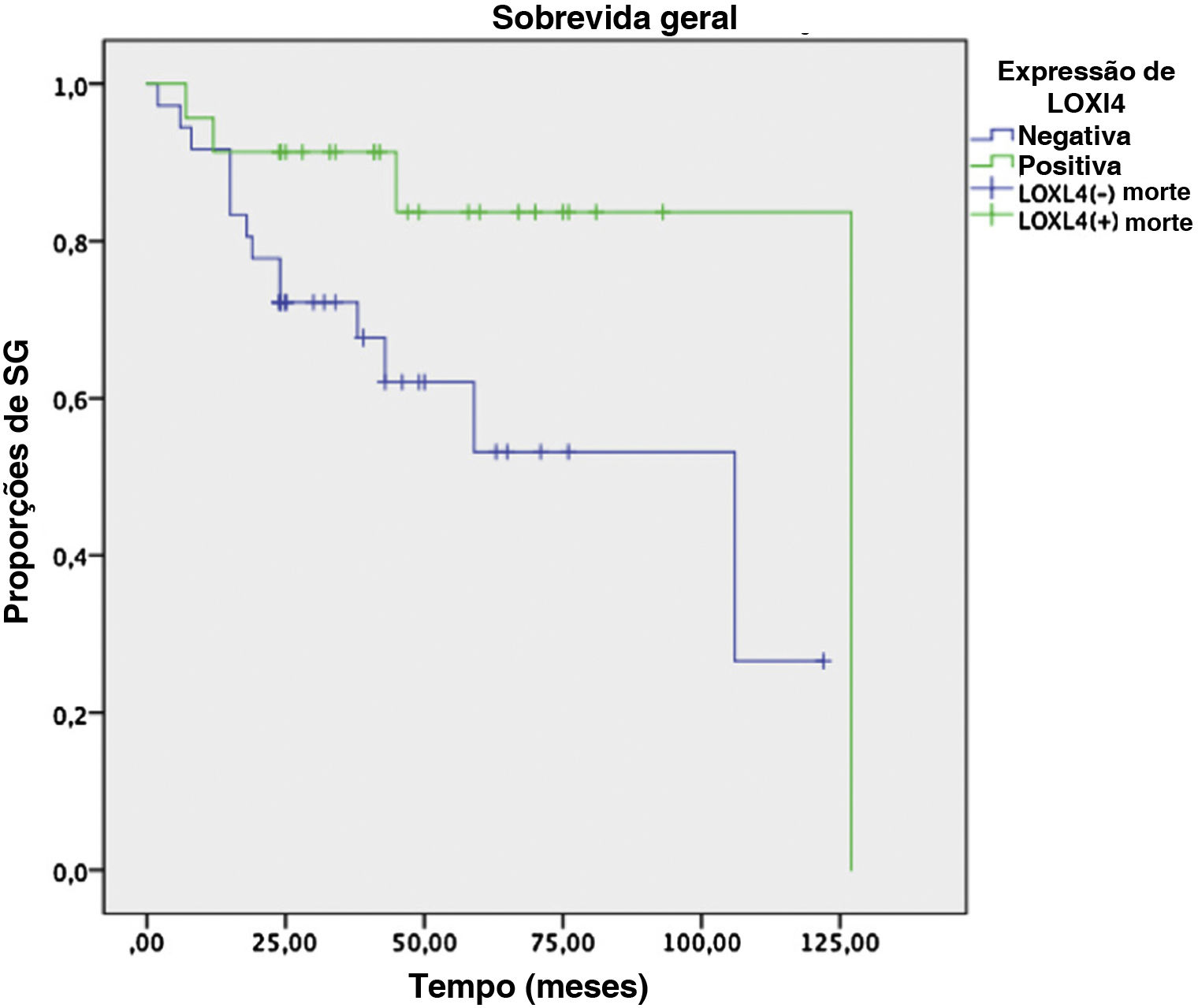
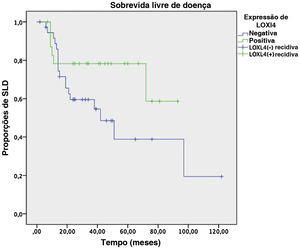
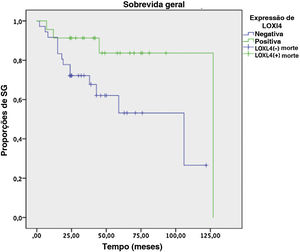
Análises de SLD e SG em dois anos conduzidas pelo método de Kaplan‐Meier em um subgrupo de 61 pacientes que tinham dados de seguimento suficientes revelaram uma tendência de melhor SLD em 2 anos (78,3% vs. 59,6%) para pacientes LOXL4 positivos em comparação aos LOXL4 negativos, mas esse achado não foi estatisticamente significante (p=0,104). A SG mostrou uma tendência mais clara na melhoria da sobrevida para pacientes LOXL4 positivos (91,3% vs. 72,2%), que foi estatisticamente significante (p=0,036). A influência de vários parâmetros na SLD e SG em 2 anos pode ser observada na tabela 4. As figuras 3 e 4 exibem as curvas de sobrevivência para a SLD e SG em 2 anos, respectivamente.
Efeito das variáveis na sobrevida livre de doença (SLD) e sobrevida geral (SG) em 2 anos estimadas pela análise de Kaplan‐Meier
| SLD em 2 anos | SG em 2 anos | ||||||
|---|---|---|---|---|---|---|---|
| # | % | IC95% | p | % | IC95% | p | |
| Expressão de LOXL4 | |||||||
| + | 24 | 78,3 | 61–95 | 0,104 | 91,3 | 69–98 | 0,036a |
| ‐ | 37 | 59,6 | 43–76 | 72,2 | 55–84 | ||
| Classificação AJCC‐T | |||||||
| T3 | 24 | 72,2 | 53–91 | 0,396 | 81,1 | 64–90 | 0,184 |
| T4 | 37 | 63,9 | 48–80 | 70,8 | 48–85 | ||
| Classificação AJCC‐N | |||||||
| N0 | 38 | 71,1 | 51–91 | 0,413 | 78,3 | 59–87 | 0,974 |
| N+ | 23 | 64,9 | 50–80 | 76,3 | 55–90 | ||
| Estágio | |||||||
| III | 27 | 74,8 | 60–90 | 0,113 | 79,4 | 62–90 | 0,870 |
| IV | 34 | 57,7 | 39–77 | 74,1 | 53–87 | ||
| Diferenciação tumoral | |||||||
| Bem diferenciado | 21 | 73,7 | 54–93 | 0,393 | 80,9 | 57–92 | 0,925 |
| Moderadamente/Pouco diferenciado | 40 | 64 | 49–79 | 75 | 59–86 | ||
SLD, Sobrevida livre de doença; SG, Sobrevida geral; IC, Intervalo de confiança; LOXL4, Proteína tipo‐lisil oxidase‐4; AJCC, American Joint Committee on Cancer.
Em seguida, uma análise multivariada foi feita para verificar se a positividade de LOXL4 era um fator independente para melhorar a SG, particularmente para evitar confusão com o efeito de melhor diferenciação tumoral em pacientes positivos para LOXL4. A negatividade da LOXL4 mostrou uma razão de risco de 5,38 (IC 95% 1,4–20,7, p=0,014) para morte na análise de regressão de Cox, independentemente do estágio e diferenciação tumoral.
DiscussãoO CEC de laringe em estágio avançado é uma doença maligna agressiva de composição genética e comportamento clínico heterogêneos, que apresenta taxas de sobrevida em 5 anos em declínio. As abordagens de preservação de órgãos combinam a radioterapia com a quimioterapia semanal para fornecer tratamento sem a necessidade de cirurgia radical. A identificação de pacientes que se beneficiariam com esse tratamento multimodal, métodos terapêuticos adjuvantes opcionais e prognóstico com subtipagem do tumor são tópicos recentes de debate.
A hipóxia tecidual é significativa em tumores sólidos com um volume superior a 1cm3 e possivelmente leva a um fenótipo agressivo/metastático.9 A hipóxia leva a uma resposta genômica específica em células humanas: um fator de transcrição, o fator indutor de hipóxia 1‐alfa (HIF‐1), liga‐se a e ativa os Elementos Responsivos à Hipóxia (HREs, Hypoxia Responsive Elements) nos promotores de certos genes que constituem a resposta hipóxica.10 Incluídas entre essas proteínas up‐reguladas estão as amina‐oxidases que contêm cobre e quinona, a família Lisil Oxidase (LOX), que catalisa a desaminação oxidativa de resíduos de lisila no colágeno e elastina para estabilizar a matriz extracelular. Em sua pesquisa pioneira, Erler et al.6 mostraram que a expressão de LOX é regulada por HIF, pacientes com tumores que apresentam alta expressão de LOX têm sobrevida curta e a inibição de LOX elimina metástases em camundongos com tumores de câncer de mama cultivados ortotopicamente. Ainda assim, os autores apontaram que a expressão de LOX está paradoxalmente associada tanto à progressão quanto à supressão tumoral, depende do tipo de célula e do status de transformação, com base em pesquisas anteriores em células de câncer de mama e gástrico.11,12 Em 306 pacientes da coorte RTOG 90‐03 (um ensaio de fase 3 comparou diferentes séries de fracionamento de radiação em câncer localmente avançado de cabeça e pescoço), a expressão aumentada de LOX foi associada a um menor tempo até a metástase, tempo de progressão e pior sobrevida geral.7
A família LOX tem quatro outras enzimas, as proteínas tipo‐lisil oxidase 1‐4 (LOXL1‐4), e o último membro dessa família, LOXL4, foi investigado por suas características de expressão e efeitos potenciais em CEC de cabeça e pescoço. A LOXL4 foi proposta pela primeira vez como um marcador molecular seletivo para CEC de cabeça e pescoço por Görögh et al.13 em um artigo de 2007 que demonstrou a superexpressão do transcrito do mRNA da LOXL4 em 74% dos tumores CEC de cabeça e pescoço invasivos e 90% das linhagens celulares de CEC de cabeça e pescoço primárias e metastáticas. Scola et al.8 elucidaram ainda que, em comparação com o receptor do fator de crescimento epidérmico (EGFR, do inglês Epidermal Growth Factor Receptor), um marcador molecular estabelecido em CEC de cabeça e pescoço, a superexpressão de LOXL4 pode ser excessivamente seletiva (71% em tecido tumoral vs. 9% em mucosa normal). Os achados no CEC da laringe por Yilmaz et al.14 são consistentes com pesquisas anteriores que mostraram que LOXL4 era fortemente superexpressa em CEC de laringe em comparação com a mucosa normal correspondente, mas esse trabalho não foi capaz de demonstrar uma relação entre LOXL4 e estágio tumoral ou tendência metastática. Nossos resultados indicam que enquanto o avanço da classe T e do estágio está correlacionado com o aumento da expressão de LOXL4, o estágio nodal não exibe uma associação semelhante. Isso pode sugerir que a expressão de LOXL4 é um fator significativo para a progressão do tumor primário, embora não seja igualmente importante para a tendência metastática regional, ao contrário dos achados para sua enzima parental LOX.
A associação entre a diferenciação tumoral e a expressão de LOXL4 não foi debatida até agora na literatura em inglês. Um achado particular em nossa pesquisa é que a expressão de LOXL4 está significantemente correlacionada com uma melhor diferenciação em CEC de laringe. Com a desdiferenciação, pode‐se teorizar que as células do CEC de laringe perdem a capacidade de expressar enzimas modificadoras de MEC, como LOXL4. Era esperado que o aumento do tamanho tumoral fosse outro preditor para a expressão de LOXL4, já que um tumor sólido que aumenta invariavelmente torna‐se mais hipóxico. O diâmetro médio do tumor foi maior em pacientes LOXL4 positivos, mas essa tendência não atingiu significância estatística. Esse fato pode ser explicado pela amostra menor usada na análise (pacientes que foram submetidos à laringectomia total como tratamento primário) devido à indisponibilidade do arquivo de imagem transversal para todos os pacientes.
Os marcadores de hipóxia foram amplamente estudados como indicadores prognósticos em tumores sólidos e a resposta genômica à hipóxia tecidual, denominada “assinatura de hipóxia”, tem sido associada a mau prognóstico em vários tipos de malignidade, como câncer de mama e de ovário.15 O CEC de laringe não é exceção. Um estudo de Eustace et al.16 determinou que os tumores classificados como mais hipóxicos de acordo com a mediana da expressão de hipóxia de 26 genes tinham ambos pior controle regional em 5 anos em comparação com tumores menos hipóxicos e se beneficiaram dos modificadores de hipóxia carbogênio e nicotinamida durante a radioterapia acelerada (o controle regional em 5 anos foi de 100% em comparação com 81% para radioterapia isolada). Há outras pesquisas sobre marcadores específicos de hipóxia no CEC de laringe em estágio avançado: Bernstein et al.5 investigaram o efeito do fator indutor de hipóxia 1‐alfa (HIF‐1) e a expressão de CA‐9 em 114 pacientes com CEC da laringe ou hipofaringe estágio T3‐4 e encontraram pioria da sobrevida específica da doença em pacientes positivos para CA‐9. Ao contrário da tendência geral neste assunto, o único artigo com implicações prognósticas para a expressão de LOXL4 em CEC de cabeça e pescoço, conduzido por Weise et al.,17 encontrou uma tendência de melhoria na sobrevida em pacientes que expressam um alto nível de LOXL4 em seu tecido metastático nodal, embora essa correlação não seja estatisticamente significante. Nossos resultados prognósticos são paralelos a esse achado: a positividade de LOXL4 foi associada à melhoria da sobrevida específica da doença em 2 anos (78,3% vs. 59,6%) e global (91,3% vs. 72,2%), independentemente da diferenciação tumoral, mas essa tendência só atingiu significância estatística para sobrevida global em 2 anos. Pesquisas sobre câncer de bexiga em seres humanos podem lançar luz sobre essa situação aparentemente paradoxal: Wu et al.18 propuseram que a superexpressão de LOXL1 e LOXL4 exibe ação supressora tumoral através da inibição da via de sinalização Ras/ERK em células de câncer de bexiga. O papel da LOXL4 na progressão tumoral no CEC de laringe ainda precisa ser determinado claramente, mas nossos achados à luz da literatura sugerem que a LOXL4 é uma enzima superexpressa por um CEC que avança, que é perdida com a pioria da diferenciação e confere uma vantagem na sobrevivência através das propriedades supressoras tumorais até então indefinidas.
Apesar dos achados conflitantes sobre o prognóstico da família LOX, a LOXL4 também é uma importante candidata terapêutica devido à sua expressão altamente específica pelas células de CEC da laringe. Weise et al.19 usaram células dendríticas transfectadas com LOXL4 para induzir uma resposta de células T citotóxicas LOXL4‐específicas em um estudo de viabilidade para imunoterapia mediada por células. Um artigo recente de Görögh et al.20 surpreendentemente demonstrou que os anticorpos monoclonais anti‐LOXL4 inibem significativamente o crescimento em 80% de 15 linhagens de células de CEC de cabeça e pescoço e causam extensa destruição do tumor em 41 animais xenoenxertados com CEC de cabeça e pescoço. Esses resultados sugerem que a imunoterapia anti‐LOXL4 pode ser aplicável a CEC de cabeça e pescoço que exibem a up‐regulação de LOXL4 tumor‐específica.
Embora nossa coorte seja substancial por ser composta por uma população relativamente homogênea de pacientes com CEC da laringe em estágio avançado, distribuídos quase uniformemente entre cirurgia primária e preservação de órgãos, um desenho retrospectivo e certas deficiências dos dados de seguimento limitaram a generalização de nossas conclusões. Acreditamos que uma coorte prospectiva maior, com métodos totalmente quantitativos para avaliar a expressão de LOXL4, pode produzir resultados mais sólidos. O papel potencial da LOXL4 como supressor tumoral ao nível celular também garante pesquisas adicionais para esclarecer a função sofisticada desse novo marcador na progressão tumoral.
ConclusãoO CEC da laringe apresenta uma heterogeneidade intrínseca que influencia a resposta ao tratamento e o prognóstico. A subtipagem com biomarcadores apropriados é necessária para adaptar o tratamento às propriedades específicas do tumor, como por exemplo a hipóxia tumoral. A LOXL4 é uma enzima ativada por hipóxia que é altamente específica para CEC de cabeça e pescoço e é mais fortemente expressa por células tumorais em estágios mais avançados. Nossa pesquisa demonstrou que a LOXL4 também pode ter certas propriedades supressoras tumorais, pois pacientes com tumores com alta expressão de LOXL4 apresentam sobrevida global mais longa. O papel exato que a LOXL4 desempenha na tumorigênese do CEC precisa de mais esclarecimentos e novos métodos de tratamento, como a imunoterapia direcionada a LOXL4, podem ser baseados nesses achados.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Altuntaş OM, Süslü N, Güler Tezel YG, Doğan HT, Yılmaz T. Lysyl Oxidase Like‐4 (LOXL4) as a tumor marker and prognosticator in advanced stage laryngeal cancer. Braz J Otorhinolaryngol. 2022;88:968–74.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.
Este estudo foi financiado por uma bolsa de pesquisa da Comissão de Projetos de Pesquisa Científica da Hacettepe University.