Allergic rhinitis is associated with several complications, including sleep disorders. The Children's Sleep Habits Questionnaire has been recently translated and validated in Portuguese for the evaluation of sleep disorders in children.
ObjectiveTo assess sleep disorders in children with moderate to severe persistent allergic rhinitis and to correlate the findings with disease severity markers.
MethodsWe evaluated 167 children (4–10 years), 112 with allergic rhinitis and 55 controls. Parents/guardians of the children answered the Children's Sleep Habits Questionnaire, consisting of 33 questions divided into eight subscales, which refers to the previous week. Patients with rhinitis were also evaluated regarding the score of nasal and extra‐nasal symptoms related to the previous week and the peak nasal inspiratory flow.
ResultsThere were no significant differences between groups of different age. All patients with rhinitis were being treated with nasal topical corticosteroids. The total Children's Sleep Habits Questionnaire score was significantly higher among children with rhinitis than in controls (median 48 vs. 43, p<0.001). Significantly higher values were also observed for the parasomnia (9 vs. 8), respiratory disorders (4 vs. 3) and daytime sleepiness (14 vs. 12) subscales. Among the patients with rhinitis, no significant correlation was observed between the total Children's Sleep Habits Questionnaire score and disease activity variables, but moderate correlations were observed for the respiratory distress subscale vs. nasal symptom score (r=0.32) and vs. extra‐nasal symptom score (r=0.32).
ConclusionChildren with moderate to severe persistent allergic rhinitis, even when submitted to regular treatment, have a higher frequency of sleep disorders than controls, particularly concerning nocturnal breathing disorders, daytime sleepiness, and parasomnias. The intensity of sleep disorders found in some subscales was correlated with objective markers of allergic rhinitis severity.
A rinite alérgica está associada a diversas complicações, como, por exemplo, os distúrbios do sono. O Children's Sleep Habits Questionnaire é um questionário para avaliação dos distúrbios do sono em crianças, recentemente traduzido e validado para o português.
ObjetivosAvaliar distúrbios do sono em crianças com rinite alérgica persistente moderada/grave e correlacionar os achados com marcadores de gravidade da doença.
MétodoForam avaliadas 167 crianças (4‐10 anos), 112 com rinite alérgica e 55 controles. Todos os responsáveis pelas crianças responderam o questionário, composto por 33 questões dividas em oito subescalas e referentes à última semana. Os pacientes com rinite foram avaliados também pelo escore de sintomas nasais e extranasais referentes à última semana e pelo pico de fluxo inspiratório nasal.
ResultadosNão houve diferenças significantes entre os grupos com relação à idade. Todos os pacientes com rinite eram tratados com corticosteroide tópico nasal. O escore total do questionário foi significantemente maior entre os com rinite do que entre os controles (mediana 48 vs. 43; p<0,001). Valores significantemente maiores também foram observados para as subescalas de parassonias (9 vs. 8), distúrbios respiratórios (4 vs. 3) e sonolência diurna (14 vs. 12). Entre os pacientes com rinite não foi observada correlação significante entre o escore total do questionário e as variáveis de atividade da doença, porém correlações moderadas foram observadas para a subescala de distúrbios respiratórios vs. escore de sintomas nasais (r=0,32) e vs. escore de sintomas extranasais (r=0,32).
ConclusõesCrianças com rinite alérgica persistente moderada‐grave, mesmo em tratamento regular, apresentam maior frequência de distúrbios do sono do que controles, particularmente em relação aos distúrbios respiratórios noturnos, à sonolência diurna e às parassonias. A intensidade das alterações do sono encontradas em algumas subescalas se correlacionou com marcadores objetivos de gravidade da rinite alérgica.
Dados obtidos pelo International Study of Allergies in Childhood (ISAAC) apontam ser a prevalência de sintomas de rinite entre escolares e adolescentes brasileiros de 25,7% e 29,6%, respectivamente, e a de rinoconjuntivite alérgica de 12,6% para aqueles e de 14,6% para os adolescentes.1
Embora seja vista, muitas vezes, como uma doença de menor gravidade quando comparada com a asma, a rinite alérgica é capaz de alterar de forma marcante a qualidade de vida dos pacientes, assim como seu desempenho, aprendizado e sua produtividade.2–7 Além dos sintomas per se, o esquema de tratamento pode ser responsabilizado pelo incômodo relatado pelos pacientes com rinite alérgica, sobretudo os com formas mais intensas.8 Distúrbios de sono, dificuldade de concentração, queda de rendimento (escola/trabalho) e sonolência diurna tem sido frequentemente referidos pelos pacientes com rinite alérgica, sobretudo nas formas persistentes.2–8
A avaliação da interferência da rinite alérgica sobre o sono tem sido objeto de estudo por pesquisadores, entretanto, o emprego de métodos objetivos, como a polissonografia, é muito limitado em estudos populacionais pelas dificuldades técnicas e práticas. Assim, o desenvolvimento de questionários e escalas de avaliação para uso em pediatria tem sido estimulado para poder ser usado em estudos mais amplos.9–16 Entre esses destacamos o Children's Sleep Habits Questionnaire (CSHQ),17 cujo propósito é avaliar o comportamento do sono em crianças com idade escolar e inclui os sintomas mais comuns dos distúrbios do sono infantil, segundo a Classificação Internacional dos Distúrbios do Sono.18 Idealizado em língua inglesa, o CSHQ foi recentemente traduzido e validado para o português e escore global médio de 47 pontos foi observado entre crianças saudáveis.19
Até o momento, apenas um único artigo estudou a presença de distúrbios do sono em crianças com alergia respiratória com o questionário CSHQ.4 Neste estudo multicêntrico, feito em diversos centros da América Latina, foi evidenciado que crianças com asma e/ou rinite alérgica apresentavam maior prevalência de distúrbios do sono quando comparadas com controles.4
Objetivo: avaliar a presença de distúrbios do sono em crianças com rinite alérgica persistente moderada‐grave e correlacionar os achados com marcadores de gravidade da doença.
MétodoParticiparam do estudo pacientes (quatro a 10 anos) matriculados e regularmente acompanhados havia pelo menos um ano em ambulatório especializado por rinite alérgica persistente moderada/grave (RAPMG), e controles hígidos, não alérgicos, da mesma faixa etária. Todas as crianças foram submetidas, à admissão, a exame físico completo para exclusão de possíveis doenças crônicas capazes de interferir com a qualidade do sono, além de consumo de medicamentos. Não foram admitidas crianças (pacientes e controles) com obstrução mecânica das vias aéreas superiores, doenças neurológicas, distúrbios psiquiátricos ou as em uso de anticonvulsivantes, assim como de asma não controlada.20 Também não foram incluídas crianças em uso de anti‐histamínicos de primeira geração.
Todos os responsáveis pelas crianças responderam o CSHQ traduzido e validado para o português.19 O CHSQ é composto por 33 questões divididas em subescalas denominadas como: resistência a ir dormir (vai para a cama no mesmo horário; adormece só na própria cama; adormece na cama de outro; precisa de um dos pais no quarto de dormir; reluta na hora de dormir; tem medo de dormir sozinho (pontuação: 6 a 18); início do sono (pontuação: 1 a 3); duração do sono (dorme pouco, dorme o necessário; dorme a mesma quantidade de horas todos os dias – pontuação: 3 a 9); c) ansiedade ao dormir (precisa de um dos pais no quarto de dormir; medo de dormir no escuro; medo de dormir sozinho; problemas para dormir fora de casa – pontuação: 4 a 12); despertares noturnos (muda para outra cama no meio da noite; desperta uma vez durante a noite, acorda mais de uma vez – pontuação: 3 a 9); parassonias (molha a cama à noite; fala durante o sono; inquieto e se move muito; anda dormindo; range dentes durante o sono; acorda gritando, suando; acorda assutado com pesadelo – pontuação: 7 a 21); distúrbios respiratórios do sono (ressona alto; parece parar de respirar durante o sono; roncos – pontuação: 3 a 9) e sonolência diurna (acorda sozinho de manhã; acorda mal‐humorada; é acordada por outros; tem dificuldade de sair da cama; demora a ficar bem acordado; parece cansado ao: ver TV; andar de carro – pontuação: 8 a 24). O escore é obtido pela somatória dos pontos referentes às questões e o escore total (variação de 35 a 105) pela soma dos escores dos oito itens.17
Os pacientes com RAPMG também foram avaliados por escores clínicos de sintomas nasais (ESN; obstrução nasal, prurido nasal, espirros e rinorreia) e de sintomas extranasais (Esen; hiperemia ocular, prurido ocular, lacrimejamento e prurido faríngeo) referentes à semana anterior. Para cada sintoma atribui‐se pontuação de 0 a 3 (0 = ausente; 1 = leve; 2 = moderado e 3 = intenso).21 Assim, o ESN total e o Esen total oscilaram entre 0 e 12 pontos. Os pacientes com ESN ≥ 3 que não tinham apenas um sintoma foram considerados com rinite controlada.
Além dos escores, os pacientes com RAPMG foram avaliados quanto à função da cavidade nasal pela medição do pico de fluxo inspiratório nasal (PFIN), empregou‐se equipamento específico (Peak Nasal Inspiratory Flow Meter®, HS Clement Clarke, Reino Unido). Durante o procedimento, os pacientes após expiração pulmonar máxima, com o medidor de pico de fluxo acoplado à face, foram instruídos a fazer inspiração máxima pelo nariz, manter os lábios totalmente fechados, até a capacidade pulmonar total. Foram feitas três medições e a melhor foi anotada, desde que não houvesse diferença superior a 10% entre elas.22 O fluxo inspiratório nasal máximo foi registrado pelo cursor do aparelho em litros por minuto.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição (824.192/2014). Todos os pais e/ou responsáveis pelas crianças, assim como elas, concordaram em participar do estudo mediante a assinatura do termo de consentimento livre e esclarecido, assim como o de assentimento pelas crianças.
Análise estatísticaDe acordo com a natureza das variáveis estudadas foram empregados testes paramétricos e não paramétricos. A comparação entre as idades dos pacientes e dos controles foi feita pelo teste t de Student. A análise comparativa dos escores totais e de subescalas entre os pacientes e os controles e os dos com rinite controlada e não controlada foi feita pelo teste de Mann Whitney. O estudo da relação entre os escores global e das subescalas do CHSQ e o ESN e o PFIN foi feito com o cálculo do coeficiente de correlação de Spearman. Em todos os testes fixou‐se em 5% o nível de rejeição da hipótese de nulidade.
Para o cálculo amostral foram considerados a média do escore total do CSHQ de 47 pontos observada na validação do questionário em português,19 diferença mínima de 4 pontos em relação aos controles, desvio padrão de 8 pontos, poder de 80% e p= 0,05. Assim seriam necessárias 51 crianças por grupo. Para o estudo das correlações do questionário com as variáveis de gravidade da rinite alérgica, consideramos coeficiente de correlação mínimo de 0,25; poder de 80% e p= 0,05; com definição de pelo menos 98 crianças no grupo com rinite alérgica.
ResultadosCompletaram o estudo 112 crianças com RA e 55 controles. Os dois grupos foram semelhantes com relação à idade (tabela 1). Entre os pacientes, 48 (43%) eram do gênero feminino; 88 (79%) tinham asma e oito (7%) conjuntivite alérgica associada à RAPMG. Todos os pacientes eram tratados com corticosteroide tópico nasal e parte deles, 46 (41%), recebia anti‐histamínico H1 oral de segunda geração na semana que antecedeu a avaliação. A medição do PFIN foi feita de modo apropriado em 94% (94/112) dos pacientes.
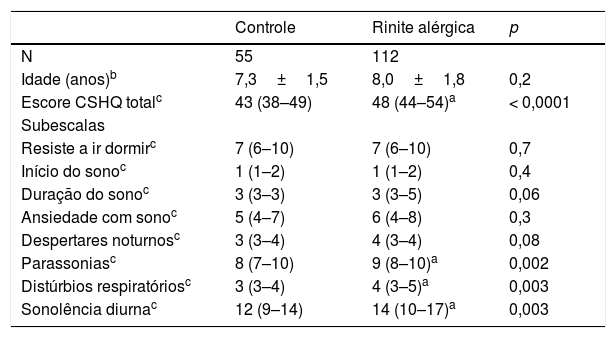
Análise comparativa de crianças com rinite alérgica persistente moderada/grave e controles não alérgicos segundo o escore total e o escore das subescalas (mediana e intervalo interquartil) do Children's Sleep Habits Questionnaire (CSHQ)
| Controle | Rinite alérgica | p | |
|---|---|---|---|
| N | 55 | 112 | |
| Idade (anos)b | 7,3±1,5 | 8,0±1,8 | 0,2 |
| Escore CSHQ totalc | 43 (38–49) | 48 (44–54)a | < 0,0001 |
| Subescalas | |||
| Resiste a ir dormirc | 7 (6–10) | 7 (6–10) | 0,7 |
| Início do sonoc | 1 (1–2) | 1 (1–2) | 0,4 |
| Duração do sonoc | 3 (3–3) | 3 (3–5) | 0,06 |
| Ansiedade com sonoc | 5 (4–7) | 6 (4–8) | 0,3 |
| Despertares noturnosc | 3 (3–4) | 4 (3–4) | 0,08 |
| Parassoniasc | 8 (7–10) | 9 (8–10)a | 0,002 |
| Distúrbios respiratóriosc | 3 (3–4) | 4 (3–5)a | 0,003 |
| Sonolência diurnac | 12 (9–14) | 14 (10–17)a | 0,003 |
A análise comparativa entre os dois grupos em relação à pontuação total do CSHQ demonstrou valores significantemente maiores de escore total e dos escores das subescalas parassonias, distúrbios respiratórios e sonolência diurna entre os pacientes com RAPMG (tabela 1).
A presença de asma, entre os pacientes, não induziu alterações significantes no escore total e os das subescalas quando comparados com os com RAPMG isolada (escore total rinite com asma vs. rinite sem asma: mediana [Me] = 49; intervalo interquartil [IIQ] = 43–54) vs. Me = 47 [IIQ = 44–53]; p= 0,8).
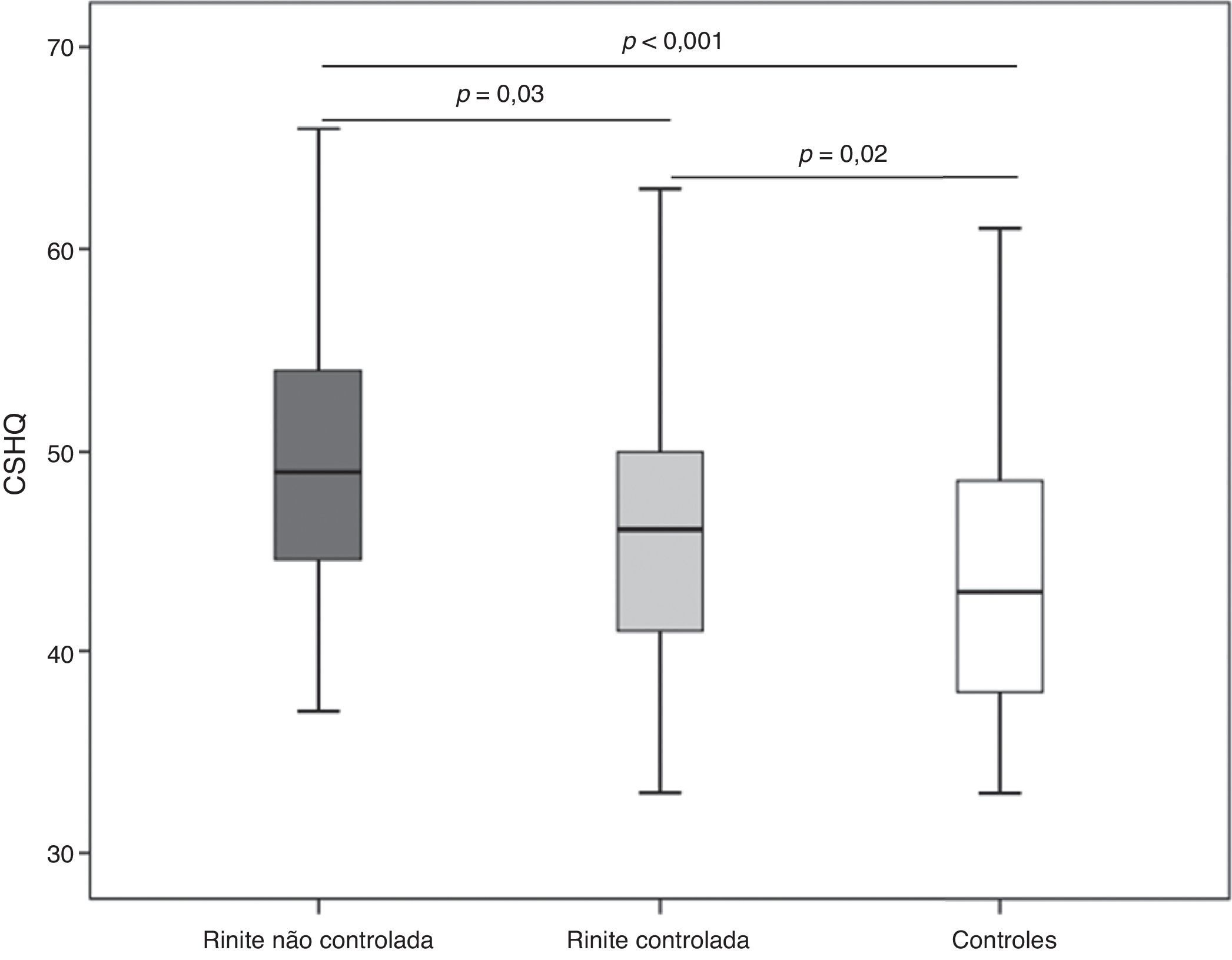
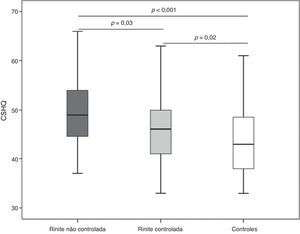
Com o critério de ESN > 3 verificamos que 53 (47,3%) pacientes apresentavam RAPMG não controlada. O escore total do CSHQ foi significantemente mais elevado entre os com rinite não controlada (Me = 49; IIQ = 44–54) em comparação com os controlados (Me = 46; IIQ = 41–50) (fig. 1). Esses dois subgrupos de crianças com rinite alérgica apresentaram escores significantemente superiores aos do grupo controle (fig. 1). De forma semelhante, o uso de anti‐histamínico oral também não se associou a alterações nas respostas do questionário (escore total uso vs. não uso: Me = 46 [IIQ = 42–52] vs. Me = 49 [IIQ = 44–53]; p= 0,2).
Considerando a média do escore total CSHQ observada na sua validação em português (47 pontos) como critério para diagnóstico de distúrbio de sono, verificamos que entre os pacientes com RAPMG 57 (51%) poderiam ser definidos como portadores de distúrbio do sono. Em relação ao controle da rinite, 58% dos com rinite não controlada apresentaram alteração no escore total do CSHQ e 44% dos com rinite controlada.
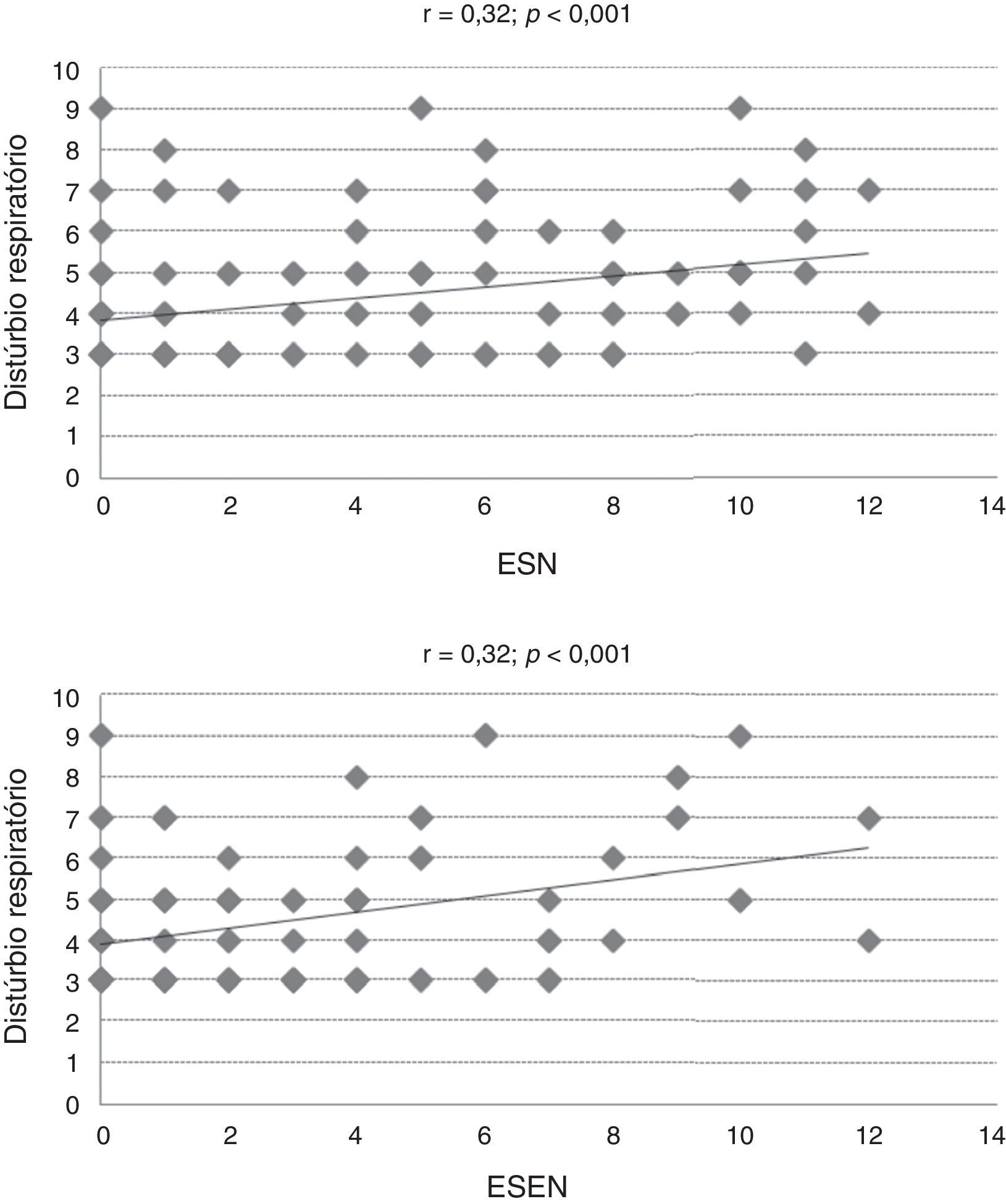
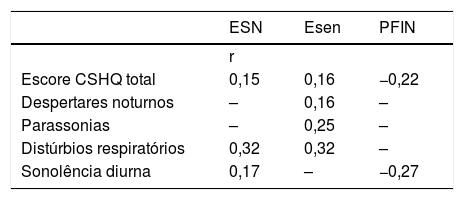
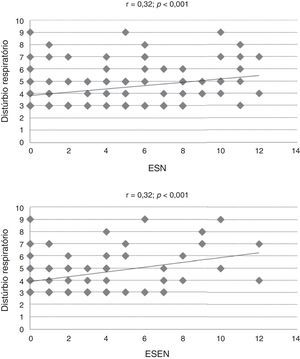
O estudo da relação entre o escore total do CSHQ e suas subescalas com o ESN, Esen e os valores de PFIN documentou significância parcial dessas comparações (tabela 2). Coeficientes de correlação moderados (r > 0,30) foram observados apenas entre a subescala de distúrbios respiratórios e os escores de sintomas nasais (r = 0,32) e extranasais (r = 0,32) (tabela 2, fig. 2).
Coeficientes de correlação de Spearman (valores significantes; p< 0,05) entre o escore total e os escores das subescalas do Children's Sleep Habits Questionnaire (CSHQ) e marcadores de controle da rinite alérgicaa
| ESN | Esen | PFIN | |
|---|---|---|---|
| r | |||
| Escore CSHQ total | 0,15 | 0,16 | −0,22 |
| Despertares noturnos | – | 0,16 | – |
| Parassonias | – | 0,25 | – |
| Distúrbios respiratórios | 0,32 | 0,32 | – |
| Sonolência diurna | 0,17 | – | −0,27 |
Acredita‐se que a rinite alérgica possa afetar o sono por diferentes mecanismos. A congestão nasal secundária ao processo inflamatório da mucosa nasal induz aumento da resistência das vias aéreas e pode resultar em respiração oral, interrupção do sono e fadiga.23 Além disso, mediadores inflamatórios do processo alérgico, como a histamina e certas citocinas, podem atuar diretamente no sistema nervoso central e alterar o ritmo do sono.23 Recentemente, foi observado em crianças com distúrbio do sono que a presença de rinite alérgica (sem apneia obstrutiva do sono) diminui o tempo de sono REM (Rapid Eyes Movement).24
Apesar de ser apontada como uma das principais consequências da rinite alérgica, as alterações ou os distúrbios do sono foram ainda pouco avaliados por ferramentas ou instrumentos validados em crianças.25
Em nosso estudo documentamos que as crianças com rinite alérgica apresentam maiores pontuações no CSHQ quando comparadas com as crianças hígidas, o que indica maior chance de distúrbios do sono entre aquelas. Todavia, se pensarmos no uso isolado do CSHQ, qual escore seria capaz de identificar a presença de distúrbio do sono? Segundo os idealizadores do CSHQ, esse valor seria 41.17 Empregando esse valor como ponte de corte, verificamos que 83% das crianças com RAPMG seriam classificadas como portadores de distúrbios de sono e entre os controles essa porcentagem chegaria a 60%. Por outro lado, se empregássemos a mediana do escore total do CSHQ observada em nosso grupo controle (Me = 43) como ponto de corte, teríamos 76% de alterações entre os com RAPMG e 44% entre os controles. Entretanto, no estudo amplo de validação para o português esse ponto foi de 47.19 Admitindo‐se esse ponto de corte, teríamos distúrbios de sono em 51% dos com RAPMG e em 24% dos controles. Diante desses resultados, qualquer que fosse o critério empregado fica claro que os pacientes com RAPMG têm maior frequência de distúrbios de sono.
Revisão sistemática recente avaliou a associação entre rinite alérgica e distúrbios do sono em crianças.26 Dos 18 estudos selecionados sobre o tema, publicados nos últimos 25 anos, 12 encontraram maior prevalência de distúrbios do sono nas crianças com rinite alérgica, com predominância de roncos habituais.26 As grandes diferenças nos métodos empregados em cada estudo, que envolveram diversas faixas etárias e diferentes métodos diagnósticos, não possibilitaram a metanálise e compilação dos dados da revisão,26 assim como dificultam a comparação com nosso estudo.
Diversos estudos mostraram que a congestão nasal é um fator de risco independente para distúrbios respiratórios durante o sono. O sono é mais afetado quando a congestão nasal é grave, leva a parassonias, roncos, distúrbios na respiração e consequentemente a sonolência diurna.26 Nosso estudo demonstrou que parassonias, distúrbios respiratórios e sonolência diurna apresentam medianas maiores nos pacientes com rinite alérgica do que nos pacientes controles. Essas alterações do sono observadas nas crianças com rinite alérgica provavelmente contribuem para complicações previamente descritas da rinite alérgica, como redução da qualidade de vida e no desempenho escolar.2–7
No presente estudo pudemos observar associação significativa entre os distúrbios do sono e diversos marcadores de gravidade ou não controle da rinite alérgica, achado documentado até o momento por limitado número de estudos.25 Notas significativamente maiores do CSHQ foram encontradas naqueles com rinite alérgica não controlada (fig. 1) e houve correlação significante de diversas subescalas do questionário com o escore de sintomas e pico de fluxo nasal (tabela 2). Essas correlações, entretanto, foram fracas na maioria dos casos, correlações moderadas foram encontradas apenas na subescala de distúrbios respiratórios.
Em nosso estudo, uma ferramenta objetiva de avaliação da função nasal foi empregada, o pico de fluxo inspiratório nasal. Pudemos documentar correlação significante e negativa dessa variável com o escore total do questionário e com a subescala de sonolência diurna.
A falta de tratamento regular e efetivo da rinite alérgica é apontada como uma das prováveis causas da associação da doença com alterações do sono.26 Ensaios clínicos observaram que a introdução do corticosteroide intranasal nesses pacientes contribui positivamente para na qualidade do sono e na redução desses distúrbios.27,28 Em nosso estudo incluímos apenas pacientes em tratamento com corticosteroide intranasal e pudemos documentar que a associação da rinite com as alterações do sono também é observada nessas crianças. Chama a atenção a elevada taxa de pacientes tratados e mesmo assim não controlados (47%). Esse achado pode ser devido, em parte, ao rigoroso critério definido para controle da rinite alérgica (escore de sintomas máximo de 3 pontos em escala de 12 pontos). Por outro lado, estudos feitos em pacientes com rinite alérgica já documentaram a persistência de sintomas em boa parte deles, mesmo com uso regular da medicação.3,29 Finalmente, nenhum controle objetivo do uso da medicação foi feito, uma vez que esse não era o objetivo do estudo, e, assim, não é possível garantir real e regular da medicação.
Apesar de muito usado, o CSHQ ainda carece de validação contra instrumentos clássicos para o diagnóstico de distúrbios do sono. Pelo nosso conhecimento, apenas um estudo comparou subescalas do CSHQ com achados objetivos evidenciados em polissonografia de crianças.30 Neste estudo não foi encontrada correlação significante entre a polissonografia e quatro subescalas do CSHQ e os autores observaram que essas subescalas do questionário apresentam baixa sensibilidade e alta especificidade no diagnóstico de distúrbios do sono.30 Entretanto, é importante destacar que os distúrbios do sono englobam uma vasta série de alterações, doenças e sintomas. O questionário usado no presente estudo (CSHQ) é uma ferramenta de triagem, tem a limitação de não poder estabelecer de forma conclusiva a presença ou não de distúrbios do sono e sua natureza.
A presença de outras doenças alérgicas, como a asma, ou de tratamentos com certas medicações, poderia representar possível viés do estudo. Para minimizar tal fato optamos por incluir apenas crianças com asma controlada e excluir as em uso de anticonvulsivantes e anti‐histamínicos clássicos. Observamos que a presença de asma controlada e o uso de anti‐histamínicos de segunda geração não se associaram significantemente com as respostas do questionário.
ConclusãoCrianças com RAPMG, mesmo em tratamento regular, apresentam maior frequência de distúrbios do sono do que controles, particularmente em relação aos distúrbios respiratórios noturnos e a sonolência diurna. A intensidade das alterações do sono encontradas nessas subescalas se correlacionou com marcadores objetivos de gravidade da rinite alérgica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Loekmanwidjaja J, Carneiro AC, Nishinaka ML, Munhoes DA, Benezoli G, Wandalsen GF, et al. Sleep disorders in children with moderate to severe persistent allergic rhinitis. Braz J Otorhinolaryngol. 2018;84:178–84.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.