Mammalian hair cells and auditory neurons do not show regenerative capacity. Hence, damage to these cell types is permanent and leads to hearing loss. However, there is no treatment that re‐establishes auditory function. Regenerative therapies using stem cells represent a promising alternative.
ObjectiveThis article aims to review the current literature about the main types of stem cells with potential for application in cell therapy for sensorineural hearing loss, the most relevant experiments already performed in animals, as well as the advances that have been recently made in the field.
MethodsResearch included the databases PubMed/MEDLINE, Web of Science, Science Direct and SciELO, as well as gray literature. Search strategy included the following main terms: “stem cells”, “hair cells” and “auditory neurons”. Additionally, the main terms were combined with the following secondary terms: “mesenchymal”, “iPS”, “inner ear”, “auditory”. The research was conducted independently by three researchers.
ResultsDifferentiation of stem cells into hair cells and auditory neurons has a high success rate, reaching up to 82% for the first and 100% for the latter. Remarkably, these differentiated cells are able to interact with hair cells and auditory neurons of cochlear explants through formation of new synapses. When transplanted into the cochlea of animals with hearing loss, auditory restoration has been documented to date only in deafferented animals.
ConclusionAdvances have been more prominent in cases of auditory neuropathy, since partial improvement of auditory nerve conditions through cell‐based therapy may increase the number of patients who can successfully receive cochlear implants.
Nos mamíferos, as células ciliadas e os neurônios auditivos não apresentam capacidade regenerativa. Assim, os danos a esses tipos celulares são permanentes e levam à perda auditiva. Contudo, como não há tratamento que restabeleça a função auditiva, as terapias regenerativas utilizando células‐tronco representam uma alternativa promissora.
ObjetivoEste artigo tem como objetivo revisar a literatura atual sobre os principais tipos de células‐tronco com potencial para aplicação em terapia celular para perda auditiva sensorioneural, os experimentos mais relevantes já realizados em animais, bem como os avanços obtidos recentemente nessa área.
MétodoAs pesquisas incluíram as bases de dados PubMed/MEDLINE, Web of Science, Science Direct e SciELO, além da literatura cinza. A estratégia de busca incluiu os seguintes termos principais: “stem cells”, “hair cells” e “auditory neurons”. Além disso, os termos principais foram combinados com os seguintes termos secundários: “mesenchymal”, “iPS”, “inner ear” e “auditory”. A pesquisa foi realizada de forma independente por três pesquisadores.
ResultadosA diferenciação de células‐tronco em células ciliadas e neurônios auditivos têm alta taxa de sucesso, chegando a 82% para o primeiro caso e 100% para o segundo. Notavelmente, essas células diferenciadas são capazes de interagir com células ciliadas e neurônios auditivos de explantes cocleares através da formação de novas sinapses. Quando transplantadas para a cóclea de animais com perda auditiva, a restauração da função auditiva foi observada, até o momento, apenas em animais com ablação do VIII nervo craniano.
ConclusãoOs avanços têm sido mais proeminentes em casos de neuropatia auditiva. A melhora parcial das condições do nervo auditivo por meio de terapia baseada em células‐tronco pode aumentar o número de pacientes candidatos a receber implantes cocleares com sucesso.
A perda auditiva (PA) é um distúrbio com múltiplas causas que afeta aproximadamente 360 milhões de pessoas em todo o mundo, de acordo com a Organização Mundial da Saúde (OMS).1 Conforme revisto por Shearer et al. (14 de fevereiro de 1999; atualizado em 27 de julho de 2017),2 a PA pode ter origem ambiental e/ou genética. Células cocleares de mamíferos não se regeneram. Portanto, a perda dessas células, seja congênita ou de início tardio, devido a fatores genéticos ou ambientais, causa déficits auditivos irreversíveis.3 A PA pode ser classificada de acordo com muitos critérios, mas a classificação em relação a região do sistema auditivo onde a disfunção está localizada é relevante para o manejo clínico. Com base nesse critério, existem três tipos principais de PA: (i) Condutiva, quando o defeito está localizado na região externa e/ou média da orelha e resulta em uma incapacidade mecânica de conduzir o som; (ii) Sensorioneural, quando a região afetada é a orelha interna e/ou neurônios auditivos e/ou as vias auditivas centrais; e (iii) Mista, quando resulta da combinação dos dois tipos de comprometimentos mencionados anteriormente.
Atualmente, não existem terapias clínicas para regenerar a perda ou lesão de células sensorioneurais, mas uma variedade de tecnologias de suporte auditivo pode ajudar indivíduos com perda auditiva. Entre elas, estão os aparelhos de amplificação sonora individual (AASI) e os implantes cocleares (ICs). Os AASI são indicados para pessoas com surdez condutiva de qualquer grau ou surdez sensorioneural de grau leve a moderado. ICs são indicados para pacientes com surdez sensorineural severa a profunda.4,5 Os AASI são diferentes tipos de equipamentos que modificam e amplificam frequências de som onde a audição está comprometida. Por outro lado, os ICs são próteses eletrônicas, parcialmente implantadas no osso temporal e na cóclea, capazes de promover a estimulação elétrica das células ganglionares do nervo auditivo.6
O conhecimento sobre o desenvolvimento do sistema auditivo e sobre doenças que afetam a audição tem sido constantemente ampliado e tem possibilitado avanços notáveis em relação às terapias gênicas e celulares direcionadas para o restabelecimento da função auditiva. Dentre essas alternativas, as células‐tronco (CTs) desempenham um papel fundamental na restauração das células cocleares perdidas.
As CTs são caracterizadas pelas propriedades de (i) autorrenovação, isto é, são capazes de entrar indefinidamente em divisão celular, e (ii) diferenciação, ou seja, são capazes de modificar seu fenótipo e se transformar em vários tipos celulares. Esse potencial de diferenciação tem sido explorado visando a regeneração de células ciliadas e neurônios auditivos. Três tipos de CTs, em especial, são usadas para estudos de regeneração celular: (i) células‐tronco embrionárias (CTEs), (ii) células‐tronco adultas (CTAs) e (iii) células‐tronco pluripotentes induzidas (CTPis).7–9
As CTE são isoladas da massa celular interna do blastocisto de mamíferos. Essas células exibem capacidade ilimitada de proliferação, in vivo e in vitro, e podem se diferenciar em qualquer tecido derivado das três camadas germinativas primárias. Assim, são classificadas como células pluripotentes. Embora a pluripotência represente uma característica atraente para a aplicação clínica e a terapia celular, as CTEs humanas estão cercadas por desvantagens e questões éticas, como a destruição de embriões para isolá‐las e o risco potencial de rejeição imunológica quando transplantadas.7,10
De acordo com a ISSCR (International Society for Stem Cell Research – Sociedade Internacional para Pesquisa com Células‐Tronco), as CTAs ou células‐tronco tecido‐específicas existem em órgãos ou tecidos completamente formados. Como retêm a capacidade de autorrenovação e diferenciação em células do mesmo tecido ou órgão em que se localizam, são classificadas como multipotentes. Apesar dessa limitação, as células‐tronco adultas são consideradas valiosas porque: (i) são mais fáceis de obter a partir de amostras de tecidos; (ii) enfrentam menos questões éticas do que as CTEs humanas; e (iii) são boas candidatas para uso em terapia celular, uma vez que podem ser obtidas de pacientes adultos em tratamento, reduzindo os riscos de rejeição imunológica.11 Uma terapia baseada no uso de células do mesmo indivíduo permitiria um avanço significativo na regeneração auditiva parcial ou total em pacientes que não apresentam mutações germinativas causadoras de surdez, pois evitaria tratamentos que necessitem de imunossupressão e eliminariam complicações decorrentes da rejeição de tecidos originados de outros pacientes ou embriões.
A reprogramação celular devido à expressão ectópica de fatores de transcrição específicos tem sido, até o momento, a forma clássica de obter linhagens de células‐tronco pluripotentes induzidas (CTPis) de qualquer tecido somático de quase todas as espécies de mamíferos. Em geral, fatores de transcrição relacionados à pluripotencialidade, também conhecidos como “Fatores de Yamanaka”, ou OSKMs (OCT4, SOX2, KLF4 e MYC), podem induzir a formação de CTPis. Entre a infinidade de aplicações para CTPis, destacam‐se: terapia celular, modelagem de doenças poligênicas e monogênicas, estudos de variação alélica e de características genéticas complexas, bem como testes de triagem de drogas.12
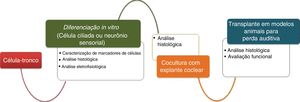
Células‐tronco têm o potencial de contribuir para o reparo e a restauração da orelha interna. Para que essa estratégia de terapia celular seja um sucesso, alguns passos são essenciais, como a diferenciação in vitro de diferentes tipos de CT em células ciliadas e/ou neurônios auditivos, a integração funcional dessas células diferenciadas na cóclea e a avaliação de restauração auditiva resultante da terapia em si (fig. 1).
Como resultado, opções promissoras para a restauração auditiva têm surgido, com o objetivo de regenerar as células cocleares perdidas. Nosso objetivo é revisar os principais tipos de CTs com potencial para uso em terapia celular para PA sensorioneural, bem como os avanços feitos recentemente, com foco na regeneração de células ciliadas e neurônios auditivos.
MetodologiaUma revisão estruturada foi feita a partir de artigos encontrados nas bases de dados PubMed/Medline, Web of Science, Science Direct e SciELO, bem como na literatura cinza. A estratégia de pesquisa incluiu os seguintes termos principais: “stem cell”, “hair cell”, “auditory neuron” e “sensory neuron”. Além disso, os principais termos foram combinados com os seguintes termos secundários: “mesenchymal”, “iPS”, “inner ear”, “auditory”. Apenas artigos relevantes publicados após 1995 foram selecionados para esta revisão. A pesquisa foi feita de forma independente por três pesquisadores.
ResultadosObtenção de células ciliadas e neurônios auditivos a partir de células‐troncoCélulas‐tronco embrionárias (CTEs)Conforme descrito por Morsli et al. (1998),13 o desenvolvimento coclear começa a partir da invaginação de um espessamento ectodérmico no placódio ótico, formando uma vesícula ótica. As células multipotentes presentes na vesícula ótica então se diferenciam em três linhagens celulares: (i) linhagem pró‐sensorial, que dá origem às células ciliadas e de suporte; (ii) linhagem pró‐neural, que dá origem aos neurônios auditivos e vestibulares; e (iii) linhagem não sensorial, responsável pela origem das células com funções estruturais, secretoras e/ou de absorção.14
A diferenciação in vitro em células neuronais ciliadas ou sensoriais a partir de CTs embrionárias humanas foi relacionada à expressão de vários marcadores bem caracterizados para cada uma das etapas. Entretanto, a obtenção de células neuronais auditivas e ciliadas apresenta um grande desafio, tanto na escolha do meio de cultura quanto nos fatores específicos necessários para direcionar a diferenciação das células progenitoras óticas para um tipo celular desejado.
De acordo com alguns estudos, o meio de cultura sem soro e com suplementos N2 e B27 é o ponto de partida para a diferenciação de CTEs em progenitores neurais (PNs), expressando marcadores característicos de neuroblastos de placódio ótico, tais como Otx2, Brn3a, NeuroD, Pax2, Pax8 e nestina.15–17 Entretanto, a eficiência desses suplementos e substratos de cultura celular no processo de diferenciação varia, mesmo quando o objetivo é gerar os mesmos tipos de células. Shi et al. (2007)16 fizeram a cocultura das CTEs humanas a partir de epitélio sensorial da cóclea de camundongos na presença do fator BMP4. Essa cocultura foi determinante para a expressão de periferina, GATA3, TRKB, TRKC e NGN1, marcadores de neurônios auditivos, em até 20,6% das células. Por outro lado, células imaturas semelhantes a células ciliadas também podem ser obtidas por meio da ativação da via de sinalização de FGF e cultivo por tempo prolongado com meio de cultura KSR (Knockout Serum Replacement), embora com baixa eficiência de diferenciação.17 Nesse caso, apenas cerca de 3% das células ciliadas expressaram três ou mais marcadores específicos ao seu fenótipo, como ATOH1, MYO7A, MYO15A e OTOF. Também já foi observado que CTEs humanas dissociadas em uma camada de laminina e tratadas com FGF3 e FGF10 foram capazes de gerar dois tipos de colônias de células progenitoras óticas: progenitores epiteliais óticos (PEOs) e progenitores neurais óticos (PNOs). Ao submeter os PEOs a condições de cultivo específico para obtenção de células sensoriais, produziram‐se células semelhantes que expressavam os marcadores relacionados ao fenótipo das células ciliadas (BRNC3 e ATOH1 ou MYO7A), com 45% de eficiência; além disso, ao submeter PNOs a condições de cultura “neutralizante”, produziram‐se neurônios sensoriais com quase 100% de eficiência e com expressão de BRN3A, β‐tubulina III e NF200. Também foi demonstrado que essas células semelhantes a células ciliadas e aos neurônios sensoriais exibem propriedades eletrofisiológicas, demonstrando a viabilidade dessas células em responder a estímulos mecânicos e transmitir estímulos elétricos.15
Para obter neurônios sensoriais gerados a partir de CTEs, alguns autores se concentraram em provar que tais células são capazes de projetar processos neurais em direção à cóclea, seja in vitro ou in vivo. Shi et al. (2007),16 por exemplo, mostraram que os progenitores neurais sensoriais diferenciados a partir de CTE humanas foram capazes de amadurecer, de se transformar em neurônios sensoriais e inervar células ciliadas de explantes de órgão de Corti murino, ainda que escassamente. Além disso, foi detectada a expressão de β‐tubulina e sinapsina nos locais de contato. Resultados semelhantes também foram observados por Nayagam et al. (2013),18 que cocultivaram progenitores neurais humanos com explantes de cóclea murinos denervados por 10 dias.
Em ensaios in vivo, Shi et al. (2007)16 transplantaram progenitores neurais, previamente diferenciados de CTE humanas, na base da cóclea de gerbils com ablação do VIII nervo craniano. Após 60 dias do procedimento, as cócleas tratadas apresentaram abundantes projeções neurais novas em direção ao ápice do tronco do nervo coclear. De maneira similar, Chen et al. (2012)15 transplantaram PNOs para o modíolo de gerbils com ablação do VIII nervo craniano e, três semanas após o transplante, observaram PNOs que expressavam β‐tubulina III e que emitiam projeções neurais em direção ao órgão de Corti. Dez semanas após o transplante, essas células também migraram para o canal de Rosenthal, fizeram conexões sinápticas com as células ciliadas e emitiram novas projeções em direção ao tronco cerebral. No entanto, o resultado mais importante deste estudo é que os animais transplantados com PNOs foram submetidos a testes de desempenho funcional e apresentaram melhoria auditiva de aproximadamente 46%, com redução dos limiares auditivos dos animais tratados com ouabaína de aproximadamente 80dB para 50dB, dez semanas após o transplante.
Células‐tronco adultas (CTA)Células‐tronco da orelha interna (CTOI)Para nosso conhecimento, a primeira evidência da existência de CT na orelha interna (CTOI) de mamíferos data de 2003. Li et al. (2003) 19 demonstraram a existência de células do labirinto posterior ou vestíbulo (sistema vestibular periférico) com capacidade de formar esferas, com propriedades de autorrenovação e diferenciação em células dos três folhetos germinativos. Os pesquisadores demonstraram que essas CTAs, obtidas especificamente da mácula utricular, poderiam se diferenciar em células ciliadas, tanto in vitro quanto in vivo.
Até o momento, não há relatos da existência de CTOI na cóclea de mamíferos adultos. Entretanto, a existência de células com propriedades de CT foi evidenciada a partir de suspensões de células dissociadas do órgão de Corti de ratos neonatos (P0). 20 Após o cultivo, essas células expressaram marcadores de células indiferenciadas, relacionados a um fenótipo similar ao encontrado em CTOI neuroepiteliais. Além disso, essas células mostraram a formação de colônias esféricas, denominadas otosferas, e foram diferenciadas in vitro em células ciliadas e de suporte, embora com uma taxa de eficiência extremamente baixa (cerca de 1‐2 células por colônia).
Em um estudo mais detalhado realizados a partir de suspensões de células dissociadas do órgão de Corti de fetos humanos com nove a 11 semanas de desenvolvimento,21 CTOI com expressão de marcadores de pluripotência também foram identificados. Após o estabelecimento da cultura, vários experimentos de manipulação de cultura foram feitos para induzir a diferenciação em células neuronais e ciliadas. Os melhores protocolos devem, idealmente, resultar em células diferenciadas que exibem não apenas marcadores celulares desses tipos específicos, mas também propriedades eletrofisiológicas semelhantes a esses tipos de células in vivo. Isso foi obtido por meio de tripsinização, com adição de Shh e bFGF para diferenciação neuronal, com eficiência de 49%, e por meio de suplementação de meio de cultura com EGF e ácido retinoico para diferenciação de células ciliadas, com eficiência de 56%.
Como mencionado anteriormente, a capacidade regenerativa da cóclea dos mamíferos é inexistente. No entanto, se há evidências da existência de CTOI na cóclea de ratos neonatos e fetos humanos, bem como no vestíbulo de camundongos adultos, qual é a razão por trás da incapacidade regenerativa da cóclea de mamíferos? Para responder a essa pergunta, Oshima et al. (2007)22 investigaram a distribuição de CTOI na orelha interna de camundongos com idades que variaram de P1 a P120. As CTOI foram obtidas tanto do sistema vestibular, representado pela mácula utricular, mácula sacular e crista ampular, como do sistema coclear, representado pelo órgão de Corti, gânglio espiral e estria vascular em camundongos com idade até P21, com um rápido declínio na população dessas células no órgão de Corti na 2ª e 3ª semanas de vida. Ao investigar camundongos P120, CTOI foram ainda identificadas nas três regiões vestibulares estudadas, mas, aparentemente, estão ausentes no órgão de Corti por volta dessa idade. Duas hipóteses foram levantadas para o esgotamento dessa população de células pluripotentes: (i) perda de fato de CTOI durante as primeiras duas semanas de desenvolvimento pós‐natal, 23 devido à apoptose na grande crista epitelial (GCE), um epitélio adjacente ao órgão de Corti e que contém células com capacidade proliferativa; 24 ou (ii) perda da expressão de marcadores de pluripotência por por parte dessas células durante a maturação da cóclea, como resultado do processo de diferenciação. 25 Nesse último caso, as otosferas formadas a partir do órgão de Corti teriam se originado a partir de células de suporte pós‐mitóticas, uma vez que a capacidade dessas células de proliferar e se diferenciar in vitro em células ciliadas já foi demonstrada. Até o momento, nenhuma das hipóteses foi refutada.
Em suma, embora a orelha interna tenha células‐tronco após o desenvolvimento do sistema auditivo, tanto no vestíbulo quanto na cóclea, essa população de células é limitada apenas à região vestibular na idade adulta. Soma‐se a essa limitação a grande dificuldade de obtenção dessas células e a baixa eficiência de sua diferenciação nos tipos celulares desejados. Portanto, as CTOI são atualmente mais úteis como objeto de estudo de diferenciação básica e triagem de ototoxicidade, em vez de uma opção para terapia celular relacionada a distúrbios auditivos.
Células‐tronco mesenquimais (CTMs)Conforme revisado por Keating (2012),26 as CTMs são definidas como um fenômeno resultante da cultura in vitro e foram inicialmente identificadas como uma subpopulação de células da medula óssea. Os critérios para definir CTMs incluem a aderência ao plástico, diferenciação in vitro em células adipogênicas, condrogênicas e osteogênicas, expressão dos marcadores CD105, CD73 e CD90 e a ausência de expressão dos marcadores hematopoiéticos.27,28 A capacidade de diferenciação de múltiplas linhagens de CTs mesenquimais as torna muito valiosas para terapias médicas baseadas em células. Entre as muitas propriedades úteis das CTMs estão as propriedades imunomoduladoras, que as tornaram atraentes para a medicina regenerativa.29
As progenitoras de células ciliadas diferenciadas de CTs mesenquimais foram obtidas primeiro por Jeon et al. (2007).30 As CTMs obtidas da medula óssea de camundongos foram inicialmente transfectadas com o fator de transcrição EGFP‐Math1 e depois diferenciadas em precursores sensoriais através de cultura com EGF, IGF‐1, bFGF, NT3 e BDNF por 14 dias. No 14° dia, os autores observaram que a superexpressão de Math1 foi capaz de induzir a expressão de marcadores específicos de células epiteliais sensoriais auditivas, tais como BRN3C, P27KIP e JAGGED2. A expressão de marcadores de células ciliadas maduras, tais como MYO7a e ESPIN, também foi detectada em 7,1% das células transfectadas, indicando a diferenciação das CTMs murinas em células ciliadas.
As células ciliadas também foram obtidas, em cultura, a partir de CTMs de medula óssea de ratos. No relato de Qin et al. (2011),31 as CTMs da medula óssea foram primeiramente diferenciadas em progenitores neurais através de cultura em meio sem soro e contendo EGF e bFGF. Após duas semanas de cultivo em meio contendo N2/B27, EGF e IGF‐1, a expressão de MYO7a foi detectada através de ensaios imuno‐histoquímicos, sugerindo que essas células são fenotipicamente semelhantes às células ciliadas. Outros fatores de transcrição adicionados ao meio de cultura das CTMs da medula óssea também contribuíram para a produção de células progenitoras neurais, neurônios e células ciliadas. Lee et al. (2012),32 por exemplo, usaram os fatores BDNF, GDNF e NT3 em meio de cultura por 14 dias. Novas células ciliadas foram obtidas, como pôde ser confirmado por RT‐qPCR e ensaios imuno‐histoquímicos, mostrando que de 3% a 4% das células expressaram MYO7a.
Com o objetivo de induzir a diferenciação em células ciliadas a partir de CTMs de medula óssea humana, Alonso et al. (2012)33 identificaram alguns pré‐requisitos espécie‐específicos para o processo ser bem‐sucedido. Inicialmente, eles obtiveram células progenitoras neurais com quatro protocolos bem estabelecidos, expressando vários marcadores de progenitores neurais, como nestina, SOX‐2, OCT‐4 e musashi‐1. Contudo, embora combinações de EGF, bFGF e IGF‐1 já fossem reconhecidas como importantes para a indução do fenótipo de células ciliadas a partir de CTMs de medula óssea de ratos, os autores não obtiveram os mesmos resultados para a contraparte humana. Nesse caso, a indução do fenótipo de células ciliadas só foi possível após a cultura das células humanas em meio sem soro e com EGF e ácido retinoico, protocolo esse usado anteriormente para a diferenciação de CTOI humanas em células ciliadas.21 As células humanas diferenciadas expressaram marcadores específicos de células ciliadas, tais como ATOH1, MYO7a e calretinina, com eficiência máxima de 17,5%.33
Células ciliadas também podem ser diferenciadas a partir de CTMs obtidas de outros tecidos que não a medula óssea, como o tecido adiposo. Lin et al. (2012),34 por exemplo, reprogramaram CTMs derivadas de tecido adiposo murino em progenitores de células ciliadas com uma combinação de transfecção de proteína, adenovírus e cocultura com neurônios. As CTMs foram transfectadas com adenovírus que expressam ATOH, um fator de transcrição fundamental para o desenvolvimento de células ciliadas, fundido com EGFP (proteína verde fluorescente melhorada). Após dois dias, todas as células marcadas com EGFP expressaram o marcador de células ciliadas MYO7a. Aproximadamente 82% das células submetidas à expressão de Atoh1 apresentaram protrusões na superfície celular, semelhantes aos estereocílios. É importante ressaltar que o grupo de Lin foi o primeiro a obter células ciliadas diretamente de CTs multipotentes sem diferenciação prévia em células progenitoras ópticas, mostrando, portanto, que o processo de diferenciação em células ciliadas pode ser acelerado.
Em relação à obtenção de neurônios auditivos a partir de CTMs, Alonso et al. (2012)33 primeiro diferenciaram CTMs de medula óssea humana em progenitores neurais e, em seguida, induziram fenótipo de neurônios sensoriais por meio de suplementação do meio de cultura com SHH, ácido retinoico, BDNF, NT‐3 e bFGF. No fim do protocolo de diferenciação, os autores observaram a expressão dos marcadores de neurônios sensoriais GATA‐3, SOX2, NGN‐1 e ISLET‐1 em até 47% das células. No estudo de Lee et al. (2012),32 o processo de diferenciação consistiu na incubação de CTMs de medula óssea de rato durante cinco dias em meio de cultura suplementado com DMEM/F12, N2, B27, EGF e IGF‐1, para indução do fenótipo de progenitor neural. Os progenitores neurais foram então diferenciados em neurônios auditivos ao se substituir o meio de cultura por um meio de fator neurotrófico básico com GDNF, BDNF e NT‐3. No fim do experimento, os ensaios de RT‐qPCR e imunofluorescência confirmaram a expressão dos marcadores neuronais NeuN e β‐tubulina III em 7% a 8% das células diferenciadas.
Células‐tronco pluripotentes induzidas humanas (CTPis)Com o objetivo de desenvolver um modelo celular para o estudo da patogênese do vírus varicela zoster (VVZ), Lee et al. (2012)35 se concentraram na geração de neurônios sensoriais in vitro a partir de CTPis, uma vez que o VVZ se mantém latente nos gânglios sensoriais. Para esse propósito, células CTPi diferenciadas a partir de fibroblastos foram expostas a pequenas moléculas inibitórias e ácido retinoico por 10 dias, convertendo as células pluripotentes em progenitoras neurais, que expressavam os marcadores de progenitores neurais PAX6 e nestina. Após o cultivo por duas semanas em meio de cultura rico em fatores de crescimento, 80% das células expressaram β‐tubulina III, um marcador neuronal, enquanto 15% coexpressaram BRN3A e periferina, marcadores neuronais sensoriais. Os neurônios sensoriais diferenciados a partir de CTPi também sendo funcionais, sendo capazes de gerar potenciais de ação em resposta à despolarização.
Gunewardene et al. (2014)36 também foram bem‐sucedidos no estabelecimento in vitro de linhagens celulares sensorioneurais a partir de duas linhagens de CTPis humanas derivadas do prepúcio. As células foram submetidas ao seguinte processo de diferenciação: (i) indução neuronal, com o uso de Noggin e de bFGF; (ii) indução de neurosfera, com EGF e bFGF; (iii) indução de crista neural, tratada com inibidor de Rho quinase; e, finalmente, (iv) a indução de neurônios sensoriais por meio do cultivo somente com NBM. As células sensorioneurais derivadas das CTPis humana expressaram marcadores de rombencéfalo dorsal (PAX7), placódio ótico (PAX2), domínio pró‐neuro‐sensorial (SOX2), gânglios neurais (neurod1, BRN3A, ISLET1, β‐tubulina III, NFM) e neurônios sensoriais (GATA3 e VGLUT1) ao longo do período examinado, com os maiores níveis de expressão observados no 35° dia de diferenciação in vitro. Os neurônios sensoriais diferenciados também eram eletrofisiologicamente ativos, embora o padrão de atividade observado fosse mais semelhante aos neurônios auditivos de camundongos nos primeiros estágios pós‐natais. No entanto, vale a pena notar que, conforme relatado em estudos com CTPis humanas, os níveis de expressão de mRNA observados sempre foram variáveis entre diferentes linhagens de CTPis humanas, entre amostras das mesmas linhagens e também quando CTPis foram comparadas com CTEs humanas controles. Essa variação, como sugerido pelos autores, pode estar relacionada a mutações genéticas e epigenéticas resultantes da integração aleatória de lentivírus no genoma durante o processo de indução de pluripotência.
Após a padronização do processo de diferenciação neuronal descrito acima, os autores continuaram com a avaliação da viabilidade dos neurônios sensoriais diferenciados das duas linhagens diferentes de CTPis na inervação de células ciliadas ex vivo.37 Após 10 dias de cocultura, os progenitores neurais foram capazes de emitir projeções em direção às células ciliadas do explante coclear com eficiência de até 94,2% e de forma desordenada, um padrão de ramificação semelhante ao observado nos neurônios auditivos no início do desenvolvimento. Os ensaios de imunofluorescência também revelaram sinapses entre os neurônios derivados das CTPis e as células ciliadas, como indicado pela expressão da sinapsina‐1. Por fim, os autores observaram que os neurônios menos diferenciados (21 dias de diferenciação in vitro) apresentavam mais sinapses com maior número de células ciliadas quando comparados com os neurônios mais diferenciados (28 dias de diferenciação in vitro), mostrando a importância da fase de diferenciação dos progenitores neurais escolhida para a maximização da integração funcional dessas células no tecido coclear.
Quanto à diferenciação de CTPis em células ciliadas, um elegante trabalho foi conduzido por Oshima et al. (2010).38 As CTPis derivadas de fibroblastos de camundongos transgênicos Atoh1/nGFP foram cultivadas por cinco dias com um inibidor da via Wnt, um inibidor de Smad3 e IGF‐1, seguido de exposição a bFGF por três dias. Os progenitores óticos foram obtidos e depois diferenciados em células ciliadas através de cocultura com células estromais de utrículo de galinhas mitoticamente inativadas. A eficiência global de diferenciação de células ciliadas, no entanto, foi baixa: cerca de 12% das células ciliadas derivadas de CTPis expressaram MYO7a, enquanto apenas 2,6% expressaram MYO7a e espina. Estas células ciliadas derivadas da CTPis eram morfológica e eletrofisiologicamente semelhantes às células ciliadas imaturas. Finalmente, experimentos de co‐cultura revelaram que gânglios neurossensoriais coletados de camundongos neonatos emitiram projeções neurais em direção às células ciliadas derivadas de CTPis, com formação de sinapses confirmada pela expressão de sinaptosina (SYN). Por outro lado, Chen et al. (2018)39 obtiveram mais sucesso na obtenção de células ciliadas derivadas da CTPis humanas. Esses autores submeteram CTPis derivadas de células urinárias humanas ao mesmo protocolo de diferenciação de células ciliadas usado para CTEs,15 obtiveram PEOs que, após o uso de condições de cultura de “células ciliadas”, produziam células semelhantes a células ciliadas com até 50% de eficiência. Experimentos in vitro mostraram que os neurônios do gânglio espiral murino eram capazes de emitir projeções neurais em direção às células com fenótipo semelhante a células ciliadas derivadas de CTPis humanas e formar sinapses. Por fim, pela primeira vez na literatura, essas PEOs derivadas de CTPis humanas foram transplantadas para camundongos Slc26a4‐null, animais que sofrem perda auditiva devido à perda da função da pendrina, o que prejudica a funcionalidade das células ciliadas. Quatro semanas após o transplante, novas células ciliadas foram identificadas no órgão de Corti, embora em números extremamente pequenos. Apesar de não conseguirem se organizar de forma regular como as células ciliadas nativas, as células transplantadas expressaram MYO7a e foram alvo de neurônios de gânglios espirais nativos para sinapses. Infelizmente, os animais transplantados não foram submetidos à avaliação funcional para verificar se houve melhoria da audição.
Obstáculos e indagações sobre terapia celular na perda auditivaNão há dúvidas sobre o enorme potencial da terapia celular no tratamento de diversas patologias que requerem a regeneração de células e tecidos danificados, como doenças neurodegenerativas,40 distrofias musculares41 e surdez. Além dos obstáculos mais óbvios a serem superados, que incluem a possibilidade de formação de tumor e a rejeição de células transplantadas pelo sistema imune do receptor, outros aspectos importantes sobre o sucesso de uma terapia direcionada à surdez também devem ser levados em consideração.
O primeiro ponto é a eficiência da diferenciação das CT transplantadas em células ciliadas ou neurônios auditivos. Apesar do constante aumento do conhecimento sobre biologia molecular e desenvolvimento embrionário da orelha interna e seus tipos celulares específicos, é geralmente observado uma eficiência de diferenciação muito limitada para os tipos celulares desejados. Entretanto, tem‐se trabalhado para superar essa adversidade, seguindo o exemplo de Liu et al. (2015),42 que, com base em estudos de perfis de expressão gênica durante todos os estágios de diferenciação de células ciliadas, foram capazes de identificar conjuntos de marcadores moleculares específicos para CTOI, células progenitoras e células ciliadas. Isso deve aumentar significativamente a eficiência na identificação e diferenciação de CT em células ciliadas maduras.
O segundo ponto é a sobrevivência das células transplantadas após sua inserção na cóclea dos pacientes, pois isso influenciaria o número de transplantes necessários para obter e manter a recuperação auditiva final desejada. Até o momento, os transplantes foram feitos apenas em modelos animais para a regeneração de neurônios auditivos e a maior taxa de sobrevivência foi de 94% das células transplantadas, 10 semanas após o transplante.21
Um terceiro ponto que deve ser considerado é a integração funcional das CT transplantadas para o sistema auditivo do paciente. Por enquanto, entre todos os estudos de transplante para regeneração de neurônios auditivos, apenas um apresentou dados quantitativos sobre essa questão, em que, no grupo de 50% de células transplantadas que sobreviveram uma semana após o transplante, apenas 2,3% expressaram um marcador glutamatérgico neural de neurônios auditivos.43
Finalmente, há outras questões levantadas de maneira brilhante por alguns autores,44,45 as quais merecem investigação futura, tais como (i) de que maneira as células transplantadas se distribuirão ao longo do duto coclear e regenerarão o órgão de Corti, (ii) a possibilidade de que a endolinfa, o líquido que preenche o compartimento que abriga o órgão de Corti, possa ser tóxica para as células transplantadas devido ao seu alto teor de potássio; (iii) o fato de que, para uma integração bem‐sucedida das células transplantadas, há a necessidade de uma quebra na adesão celular entre as células ciliadas e as células de suporte remanescentes no órgão de Corti; e (iv) no caso de regeneração das células ciliadas, existe a possibilidade de as CT se integrarem ectopicamente na cóclea e prejudicarem a função coclear. É necessário que as células transplantadas se integrem e se posicionem corretamente na membrana basilar, para que possam ser corretamente ativadas, um fato bastante improvável considerando a alta complexidade da citoarquitetura do órgão de Corti.
ConclusãoGrandes avanços foram feitos em estudos sobre diferenciação celular, tanto de células ciliadas quanto de neurônios auditivos (fig. 1). No entanto, as taxas de sucesso dos protocolos de regeneração dos neurônios auditivos (tabela 1) são geralmente maiores do que em células ciliadas (tabela 2), com alguns estudos já concentrados no transplante dessas células para a cóclea de modelos animais e com obtenção de resultados muito encorajadores. Também foi observado que a restauração da audição através da regeneração de células ciliadas, embora igualmente importante, ainda está longe de ser alcançada. Poucos estudos fizeram transplantes de células ciliadas diferenciadas em cócleas de modelos animais e, portanto, não há muitos relatos da capacidade efetiva de restaurar a audição com o uso dessas células. Além disso, a regeneração de células ciliadas apresenta alguns obstáculos difíceis de ser superados, como a alta complexidade da citoarquitetura do órgão de Corti, o que dificulta a correta integração das células transplantadas no epitélio sensorial. Uma opção que tem sido explorada muito recentemente é a transdiferenciação de células de suporte em células ciliadas, um processo observado pela primeira vez no sistema auditivo das aves e que, em teoria, superaria os problemas mencionados.46–49
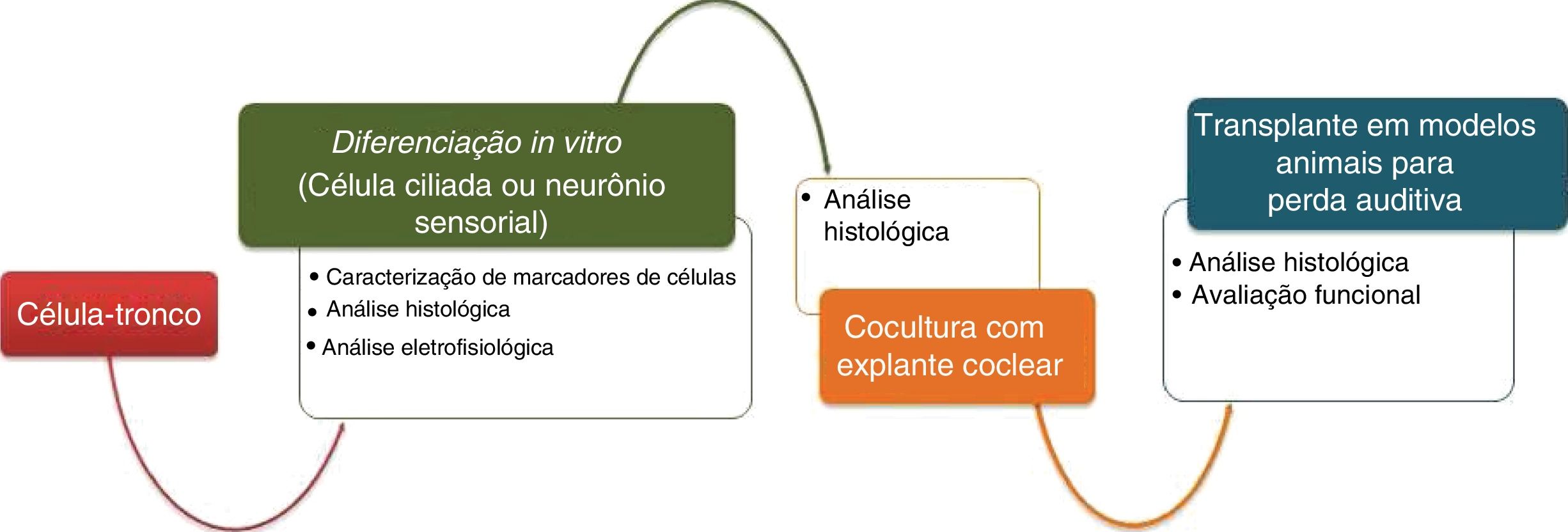
Resumo dos avanços nos principais passos para a regeneração neuronal auditiva
| Neurônio auditivo | ||||
|---|---|---|---|---|
| Diferenciação in vitro a partir de | ||||
| CTEs15,16 | CTOI21 | CTM32,33 | CTPi35,36 | |
| Marcadores celulares expressos | PERIFERINA, GATA3, TRKB, TRKC e NGN | NEUROG1, POU4F1, ß‐TUBULINA III e PVALB | GATA‐3, NGN‐1, NeuN, ISLET‐1 and B‐TUBULIN III | ß‐TUBULINA III, BRN3A e PERIFERINA |
| Eficiência | 20,6%–100% | 49% | 7%–47% | 80%–100% |
| Testes eletrofisiológicos? | Realizados | Realizados | Não realizados | Realizados |
| Cocultura com explantes cocleares | ||||
| CTE16,18 | CTOI | CTM | CTPi37 | |
| Marcadores celulares expressos | β‐TUBULINA e SINAPSINA | – | – | SYNAPSIN‐1, PAX7, PAX2, SOX2, NEUROD1, BRN3A, ISLET1, ß‐TUBULINA III, NFM, GATA3 e VGLUT1 |
| Novas projeções de neurite entre células‐tronco e células cocleares? | Sim | – | – | Sim, melhora de 94,2% |
| Transplante em modelos animais para perda auditiva | ||||
| CTE15,16 | CTOI | CTM | CTPi | |
| Taxa de sobrevivência | 22,87%–94,9% | – | – | – |
| Intervalo de tempo de análise pós‐transplante | 21–70 d | – | – | – |
| Recuperação auditiva? | Sim, parcial | – | – | – |
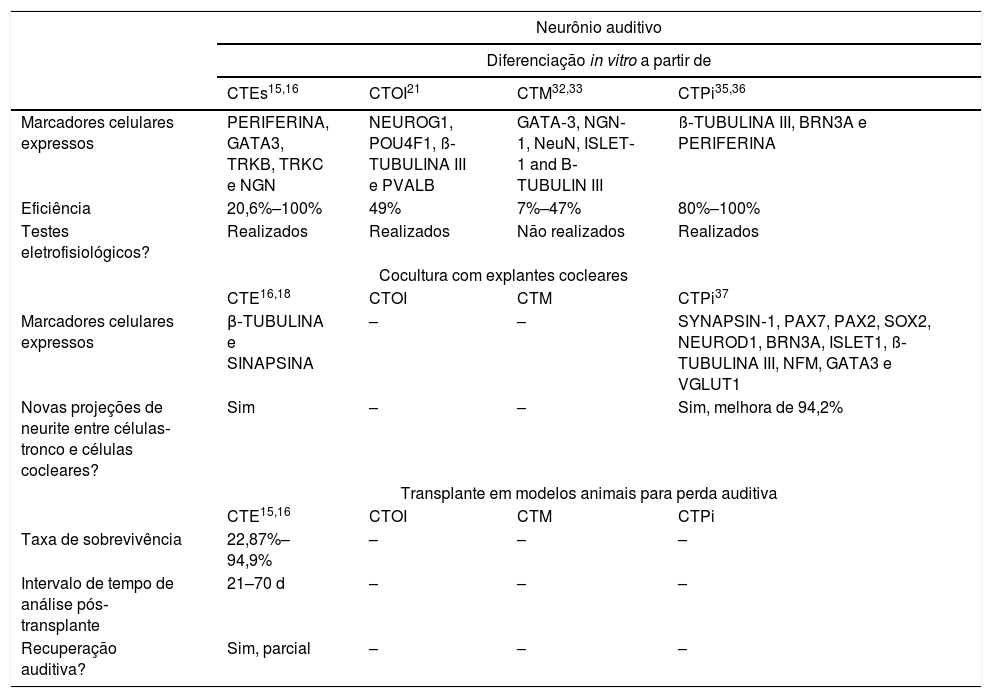
Resumo dos avanços nos principais passos para a regeneração de células ciliadas
| Célula ciliada | ||||
|---|---|---|---|---|
| Diferenciação in vitro a partir de | ||||
| CTE15–17 | CTOI19,21 | CTM30,33–35 | CTPi38,39 | |
| Marcadores celulares expressos | ATOH1, MYO7A, MYO15A, OTOF, BRN3A, β‐TUBULIN III e NF200 | ATOH1, MYO7a, ESPINA e CALRETININA | CD105, CD73, CD90 and MYO7a | MYO7a e ESPINA |
| Eficiência | 3,3%–45% | 10,7%–56% | 3%–82% | 2,6%–50% |
| Testes eletrofisiológicos? | Conduzidos | Conduzidos | Não conduzidos | Conduzidos |
| Cocultura com gânglios neurossensoriais | ||||
| CTE | CTOI | CTM33 | CTPi38,39 | |
| Marcadores celulares expressos | – | – | – | SYP |
| Novas projeções de neurite entre células‐tronco e células cocleares? | – | – | – | Sim |
| Transplante em modelos animais para perda auditiva | ||||
| CTE | CTOI | CTM | CTPi38,39 | |
| Taxa de sobrevivência | – | – | – | Não avaliado |
| Intervalo de tempo de análise pós‐transplante | – | – | – | 28d |
| Recuperação auditiva? | – | – | – | Não avaliado |
Portanto, dada a grande melhoria nas tentativas de regeneração de neurônios auditivos, acreditamos que mais estudos devam ser feitos nessa área, com foco na eficiência da integração funcional de células transplantadas no sistema auditivo de modelos animais. Assim, pode ser que estejamos mais perto de tratar os casos de neuropatia auditiva, ou seja, os casos de deficiência auditiva caracterizada pelo funcionamento normal das células ciliadas e funcionamento anormal ou ausente de neurônios auditivos,49 que compõem 15% dos casos de perda auditiva.50 Tais procedimentos iriam, no mínimo, possibilitar que mais pessoas com deficiência auditiva recebessem ICs, já que um dos pré‐requisitos para esse tipo de tratamento é a presença de neurônios auditivos saudáveis no paciente.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), Centro de Pesquisa sobre o Genoma Humano e Células‐Tronco (Cepid), processos 2009/09473‐3 e13/08028‐1. Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, processos 133182/2015-0), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes, processos 33002010070P8 e PROEX (001)).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Dr. Oswaldo Keith Okamoto (Laboratório de Genética Translacional da Universidade de São Paulo, São Paulo, Brasil) por seu apoio inspirador.
Como citar este artigo: Dufner‐Almeida LG, Cruz DB, Mingroni Netto RC, Batissoco AC, Oiticica J, Salazar‐Silva R. Stem‐cell therapy for hearing loss: are we there yet? Braz J Otorhinolaryngol. 2019;85:520–9.