The distribution, concentration and function of glycosaminoglycans in the various vocal fold tissues are still unclear.
ObjectiveTo evaluate the distribution and concentration of sulfated glycosaminoglycans in different layers of the human vocal fold according to gender and age.
MethodsWe used 11 vocal folds obtained from cadavers (7 men and 4 women) with no laryngeal lesion, less than 12h after death, and aged between 35 and 98 years. The folds underwent glycosaminoglycans extraction from the cover and ligament, and post‐electrophoresis analysis. Data were compared according to the layer, age and gender.
ResultsThe concentration of dermatan sulfate was significantly higher in all layers. No differences were observed in the total concentrations of glycosaminoglycans in layers studied according to gender. It is significantly lower in the cover of individuals aged below 60 years.
ConclusionDermatan sulfate, chondroitin sulfate, and heparan sulfate were observed in the human vocal folds cover and ligament of both genders, with the concentration of dermatan sulfate being significantly higher in all layers. Glycosaminoglycans concentration on the cover is significantly lower in individuals below 60 years compared with elderly.
A distribuição, concentração e função dos glicosaminoglicanos nos diversos tecidos da prega vocal ainda não está esclarecida.
ObjetivoAvaliar a distribuição e concentração dos glicosaminoglicanos sulfatados nas diferentes camadas da prega vocal humana de acordo com o sexo e a idade.
MétodoForam usadas 11 pregas vocais obtidas de cadáveres (sete homens e quatro mulheres) sem lesão de laringe, com menos de 12 horas de óbito e entre 35 e 98 anos. As pregas foram submetidas à extração de glicosaminoglicanos da cobertura e ligamento e leitura pós‐eletroforese. Os dados foram comparados segundo camada, idade e sexo.
ResultadosA concentração de dermatan sulfato foi significativamente maior em todas as camadas. Não foram observadas diferenças nas concentrações totais de glicosaminoglicanos nas camadas estudadas quanto ao gênero. É significantemente menor em indivíduos abaixo de 60 anos na cobertura.
ConclusãoDermatam sulfato, condroitim sulfato e heparam sulfato foram observados na cobertura e no ligamento de pregas vocais humanas, de ambos os sexos, sendo a concentração de dermatam sulfato foi significativamente maior em todas as camadas. A concentração de glicosaminoglicanos na cobertura é significativamente menor em indivíduos abaixo de 60 anos em comparação com idosos.
As pregas vocais são adaptadas para a função de fonação. A vibração das pregas vocais depende de sua estrutura histológica, especialmente da lâmina própria (LP), que é estratificada na região da borda livre em três camadas: superficial, intermediária e profunda. Todas são compostas por células e matriz extracelular, diferem qualitativa e quantitativamente entre si, principalmente quanto às proteínas fibrosas (fibras elásticas e colágenas) e proteínas intersticiais.1
Entre as proteínas intersticiais destacam‐se os glicosaminoglicanos (GAGs), os proteoglicanos (PG) e as glicoproteínas não colagênicas. Essas controlam a viscosidade, a hidratação e o volume tecidual.2,3 As diferenças nos arranjos e nas quantidades dos componentes da matriz extracelular e, ainda, as diferentes interações desses componentes entre si e com as células são adaptações dinâmicas às demandas funcionais de cada tecido.4–6 No caso das pregas vocais, essa demanda funcional é a produção da onda mucosa e, consequentemente, a vibração do tecido e a formação da onda sonora.7
Pawlak et al.2 foram os primeiros a estudar os PGs e GAGs na LP de pregas vocais. Foi verificada a expressão de receptor de ácido hialurônico (AH), queratam sulfato, condroitim sulfato, PG de heparam sulfato e decorim em várias regiões, bem como os tipos celulares na LP.
Paulsen et al.8 observaram diminuição dos GAGs sulfatados nos tendões (extremidades) do ligamento vocal. Foi também observada uma perda mais acentuada de GAGs no tendão do ligamento vocal com o processo de envelhecimento. Dessa forma, essas estruturas perdem a sua capacidade de reter água e a viscoelasticidade da prega vocal é comprometida. Hammond et al.,9 por meio de método indireto, compararam o tecido incubado ou não com hialuronidase e observaram que a concentração de AH na LP foi maior no sexo masculino em relação ao feminino. A distribuição também variou conforme as camadas e o sexo, foi mais uniformemente distribuída no sexo masculino e mais concentrada nas camadas profundas no sexo feminino.10 Com o método direto, Lebl et al.11 e Korn et al.12 verificaram maior concentração de AH na LP do sexo feminino em relação ao masculino e tendência a diminuir com o envelhecimento. Como a hialuronidase bovina testicular não é específica para AH, pode ter degradado outros GAGs presentes na LP, como condroitin sulfato, o que explicaria a diferença encontrada nos dois estudos, se houvesse também diferença nas concentrações das demais proteínas intersticiais.
O conhecimento da distribuição e concentração das macromoléculas intersticiais, que têm especificidades e características diversas, nas camadas da LP funcionalmente estratificadas trará auxílio na compreensão da fisiologia normal da fonação, do envelhecimento, bem como nos processos patológicos com alteração da onda mucosa.
Assim, o objetivo deste estudo foi verificar a distribuição e a concentração dos glicosaminoglicanos sulfatados nas diferentes camadas da prega vocal de acordo com o sexo e a idade.
MétodoEstudo experimental prospectivoForam usadas 11 pregas vocais obtidas em necropsias de 11 cadáveres (sete homens e quatro mulheres) sem lesão de laringe envolvida em causa mortis, com menos de 12 horas de óbito e entre 35 e 98 anos. O projeto foi aprovado pelo Comitê de Ética em Pesquisa de uma universidade (CEP 1203/07). As laringes foram removidas dos cadáveres e transportadas em refrigeração até o laboratório, onde foram dissecadas. As peças foram avaliadas com o uso de câmera e sistema de vídeo com aumento de 25 vezes e foram excluídas aquelas nas quais foram observadas quaisquer lesões ou alterações estruturais, tais como pólipos, sulcos ou leucoplasias.
Foi usada aleatoriamente uma prega vocal de cada indivíduo, que foram submetidas à decorticação com auxílio do sistema de vídeo. Foram isolados três fragmentos: cobertura (epitélio e camada superficial da LP), ligamento (camadas intermediária e profunda da LP) e músculo. Desses, foram usados a cobertura e o ligamento.
Para a extração de GAGs dos tecidos, o fragmento da camada da prega vocal foi picotado com bisturi, homogeneizado e desidratado em acetona, por 18 horas, em temperatura ambiente. Em seguida, o excesso de acetona foi removido por centrifugação, 4.000× g, 15 minutos, e o precipitado secado em estufa. Para cada 1mg de pó seco foram adicionados 100 μL de maxatase 4 mg/mL em Tris‐HCl 0,05M+NaCl 1M, Ph 8 e incubado a 60°C, por 18 horas. Após a incubação, a protease foi inativada por aquecimento a 100°C, 20 minutos. À solução foi adicionado, em refrigeração, ácido tricloroacético 90% para uma concentração final de 10%. A solução foi homogeneizada e deixada a 4°C por 10 minutos. Após esse período, seguiu‐se centrifugação a 4.000× g, por 15 minutos. O sobrenadante foi separado e adicionou‐se etanol absoluto (três volumes); a solução final foi mantida a ‐20°C, por pelo menos três horas. Seguiu‐se centrifugação a 10.000× g, 30 minutos, e o precipitado obtido foi secado a vácuo e guardado a ‐20°C até as análises.13,14
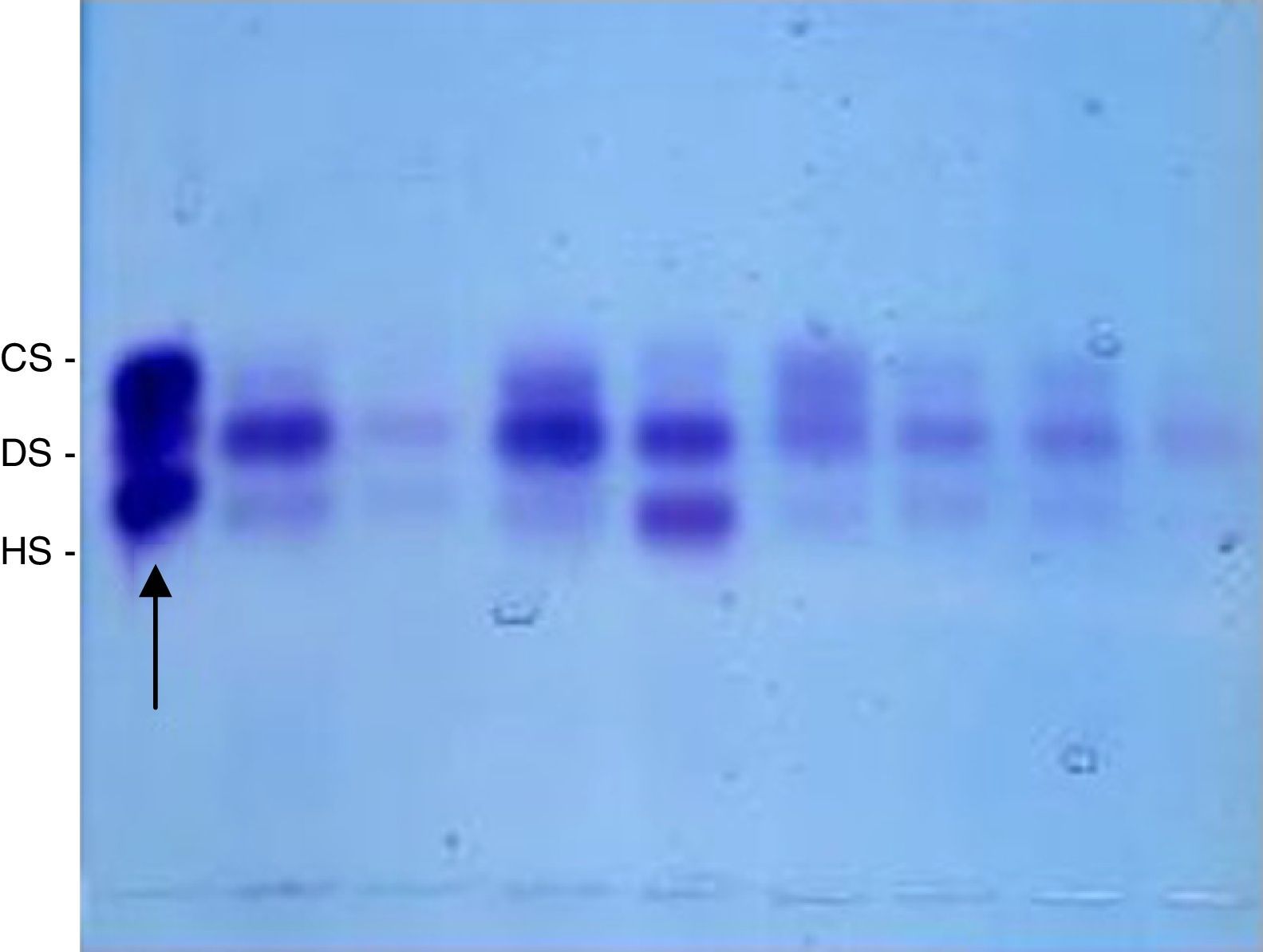
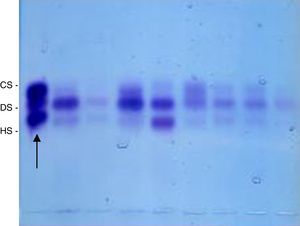
Em seguida, o precipitado obtido nos procedimentos anteriores foi novamente suspenso em água destilada (10 μL para cada 1 mg de tecido seco) e 5 μL dessa solução foram aplicados em lâmina de gel de agarose, tampão 1,3‐diaminopropanoacetato, pH 9, e submetidos a eletroforese (5 V/cm, uma hora, em refrigeração) para separação dos diversos GAGs.10,11 Como padrão, foi usada mistura de GAGs 1 μg/mL (heparam sulfato+dermatam sulfato+condroitim sulfato). Após a eletroforese, o gel foi secado sob ventilação, em temperatura ambiente, e corado com azul de toluidina 0,1% em ácido acético 1% e etanol 50%. Após 10 minutos, o gel foi descorado com solução de ácido acético 1% e etanol 50% e secado em temperatura ambiente; as bandas obtidas foram quantificadas por densitometria (fig. 1). A concentração dos GAGs foi expressa em μg/g de tecido seco.15
Bandas obtidas após coloração com azul de toluidina 0,1% em ácido acético 1% e etanol 50% solução e descoloração com ácido acético 1% e etanol 50% que foram quantificadas por densitometria. O padrão encontra‐se à esquerda da imagem (seta). CS, condroitim sulfato; DS, dermatam sulfato; HS, heparam sulfato.
Os dados foram submetidos a análise estatística. Para comparar os valores da concentração de GAGs quanto ao sexo e à faixa etária foi usado o teste não paramétrico de Mann‐Whitney. Para comparar os valores da concentração de GAGs nas diferentes camadas da prega vocal foi usado o teste não paramétrico de Wilcoxon pareado. Foram feitas as estatísticas descritivas da variável quantitativa: concentração por camada por meio da média e mediana; e desvios padrão mínimo e máximo para apontar a variabilidade. Também foi usada a análise de variância com medidas repetidas (univariada), pois as observações nas diferentes camadas são relativas a um mesmo indivíduo. Para a comparação da concentração dos GAGs entre as camadas da prega vocal, a matriz de covariância das observações de um mesmo indivíduo devia ter uma forma específica. Quando essa forma específica não foi encontrada e devido ao pequeno tamanho da amostra o teste foi corrigido com base na correção de Huynh‐Feldt. Para identificação das diferenças entre as concentrações, foram feitas comparações duas a duas, com o teste de Bonferroni. Foi verificado também se houve existência de interação (efeito de interação) nos resultados, ou seja, comportamentos diferenciados em função de outra variável. Para todos os testes foi considerado o nível de significância de 5% (p ≤ 0,05).
ResultadoNo presente estudo, foram avaliadas pregas vocais (PPVV) de 11 indivíduos, quatro do sexo feminino e sete do masculino. Cinco indivíduos tinham até 60 anos e outros seis, mais de 60.
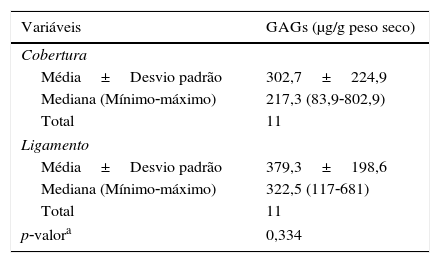
Em relação à concentração de GAGs sulfatados, não foi observada diferença significativa entre a cobertura e o ligamento (tabela 1).
Concentração de GAGs na cobertura e ligamento da prega vocal
| Variáveis | GAGs (μg/g peso seco) |
|---|---|
| Cobertura | |
| Média±Desvio padrão | 302,7±224,9 |
| Mediana (Mínimo‐máximo) | 217,3 (83,9‐802,9) |
| Total | 11 |
| Ligamento | |
| Média±Desvio padrão | 379,3±198,6 |
| Mediana (Mínimo‐máximo) | 322,5 (117‐681) |
| Total | 11 |
| p‐valora | 0,334 |
ap‐valor do teste não paramétrico de Wilcoxon pareado.
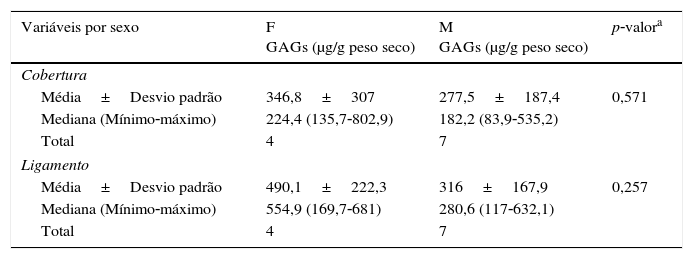
Nas camadas cobertura e ligamento, em relação à concentração de GAGs sulfatados quanto ao sexo, não foi observada diferença significativa (tabela 2).
Concentração de GAGs quanto ao sexo na cobertura e ligamento
| Variáveis por sexo | F GAGs (μg/g peso seco) | M GAGs (μg/g peso seco) | p‐valora |
|---|---|---|---|
| Cobertura | |||
| Média±Desvio padrão | 346,8±307 | 277,5±187,4 | 0,571 |
| Mediana (Mínimo‐máximo) | 224,4 (135,7‐802,9) | 182,2 (83,9‐535,2) | |
| Total | 4 | 7 | |
| Ligamento | |||
| Média±Desvio padrão | 490,1±222,3 | 316±167,9 | 0,257 |
| Mediana (Mínimo‐máximo) | 554,9 (169,7‐681) | 280,6 (117‐632,1) | |
| Total | 4 | 7 | |
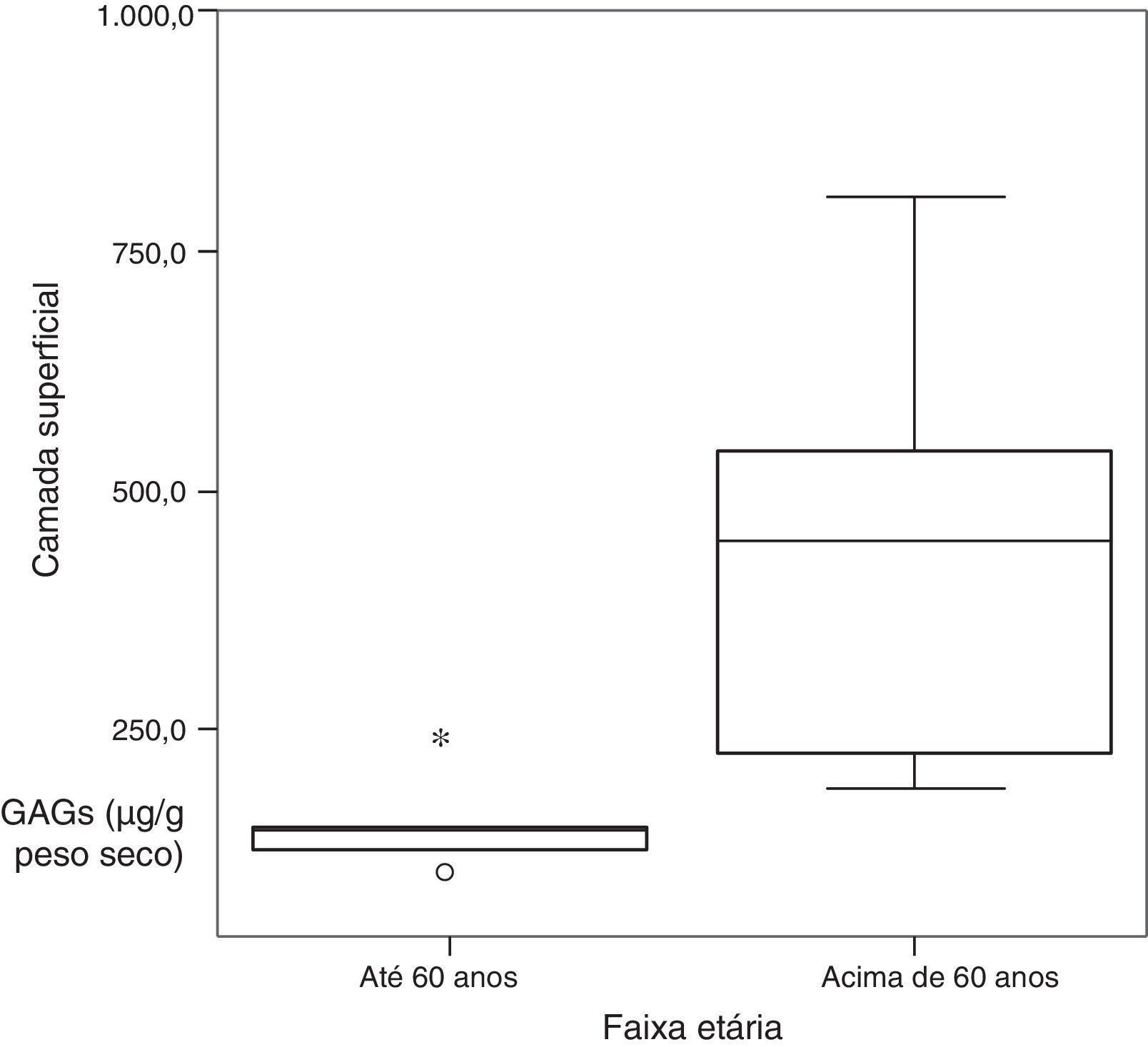
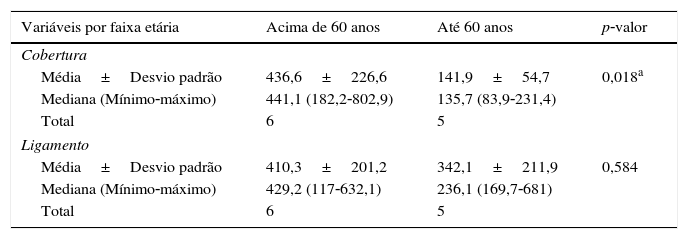
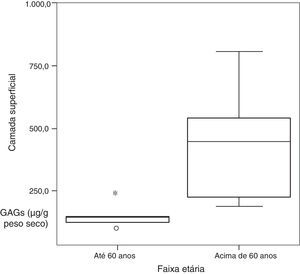
Nas diferentes camadas, na comparação da concentração de GAGs sulfatados quanto à faixa etária, foi observada diferença significativa na cobertura. Pacientes acima de 60 anos apresentaram valores significativamente maiores do que pacientes até 60 (tabela 3 e fig. 2).
Concentração de GAGs de acordo com a faixa etária nos locais: cobertura e ligamento
| Variáveis por faixa etária | Acima de 60 anos | Até 60 anos | p‐valor |
|---|---|---|---|
| Cobertura | |||
| Média±Desvio padrão | 436,6±226,6 | 141,9±54,7 | 0,018a |
| Mediana (Mínimo‐máximo) | 441,1 (182,2‐802,9) | 135,7 (83,9‐231,4) | |
| Total | 6 | 5 | |
| Ligamento | |||
| Média±Desvio padrão | 410,3±201,2 | 342,1±211,9 | 0,584 |
| Mediana (Mínimo‐máximo) | 429,2 (117‐632,1) | 236,1 (169,7‐681) | |
| Total | 6 | 5 | |
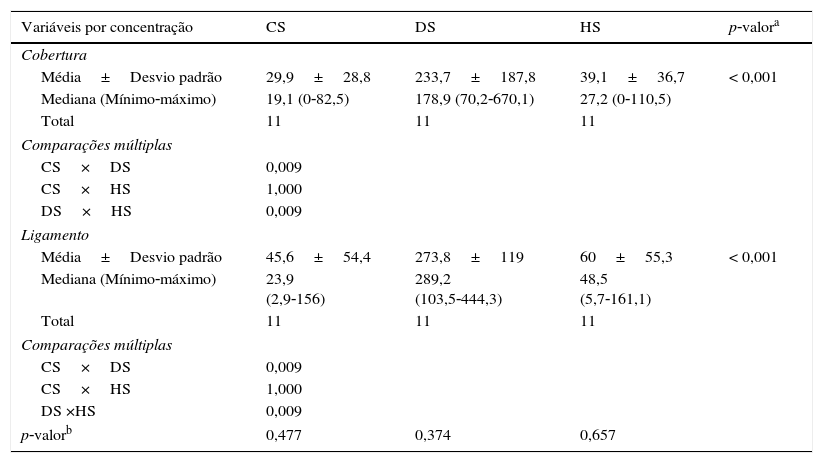
Ao se comparar a concentração de CS, DS e HS na cobertura e no ligamento, observou‐se maior concentração de DS nas diferentes camadas, porém sem diferença significativa na comparação entre as camadas (tabelas 4 e 5).
Concentração de GAGs (CS, DS e HS) nas diferentes camadas da prega vocal
| Variáveis por concentração | CS | DS | HS | p‐valora |
|---|---|---|---|---|
| Cobertura | ||||
| Média±Desvio padrão | 29,9±28,8 | 233,7±187,8 | 39,1±36,7 | < 0,001 |
| Mediana (Mínimo‐máximo) | 19,1 (0‐82,5) | 178,9 (70,2‐670,1) | 27,2 (0‐110,5) | |
| Total | 11 | 11 | 11 | |
| Comparações múltiplas | ||||
| CS×DS | 0,009 | |||
| CS×HS | 1,000 | |||
| DS×HS | 0,009 | |||
| Ligamento | ||||
| Média±Desvio padrão | 45,6±54,4 | 273,8±119 | 60±55,3 | < 0,001 |
| Mediana (Mínimo‐máximo) | 23,9 (2,9‐156) | 289,2 (103,5‐444,3) | 48,5 (5,7‐161,1) | |
| Total | 11 | 11 | 11 | |
| Comparações múltiplas | ||||
| CS×DS | 0,009 | |||
| CS×HS | 1,000 | |||
| DS ×HS | 0,009 | |||
| p‐valorb | 0,477 | 0,374 | 0,657 | |
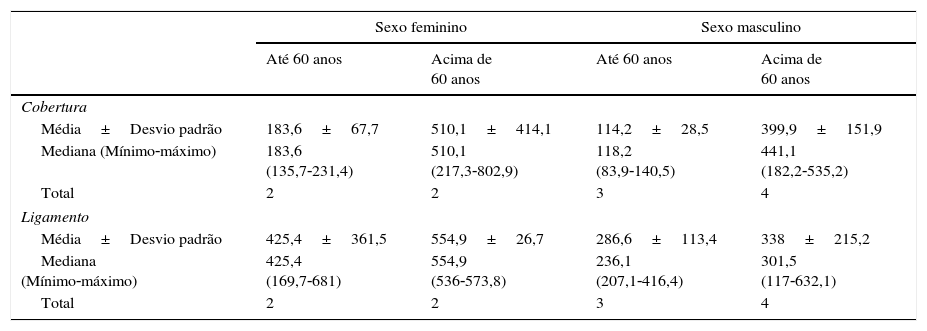
Concentração de GAGs quanto a sexo e faixa etária nos locais: cobertura e ligamento
| Sexo feminino | Sexo masculino | |||
|---|---|---|---|---|
| Até 60 anos | Acima de 60 anos | Até 60 anos | Acima de 60 anos | |
| Cobertura | ||||
| Média±Desvio padrão | 183,6±67,7 | 510,1±414,1 | 114,2±28,5 | 399,9±151,9 |
| Mediana (Mínimo‐máximo) | 183,6 (135,7‐231,4) | 510,1 (217,3‐802,9) | 118,2 (83,9‐140,5) | 441,1 (182,2‐535,2) |
| Total | 2 | 2 | 3 | 4 |
| Ligamento | ||||
| Média±Desvio padrão | 425,4±361,5 | 554,9±26,7 | 286,6±113,4 | 338±215,2 |
| Mediana (Mínimo‐máximo) | 425,4 (169,7‐681) | 554,9 (536‐573,8) | 236,1 (207,1‐416,4) | 301,5 (117‐632,1) |
| Total | 2 | 2 | 3 | 4 |
A tabela 5 refere‐se à concentração de GAGs quanto à faixa etária e ao sexo nas camadas cobertura e ligamento. A análise estatística não foi possível, devido ao número de pregas vocais em cada categoria.
DiscussãoAlguns componentes da matriz extracelular na prega vocal são mais conhecidos e estudados, como elastina e colágenos, e, mais recentemente, o AH. No entanto, outros componentes da matriz extracelular, como GAGs e PGs, não têm sido estudados quanto a sua função e importância na fisiologia da prega vocal humana.
Assim, considerando a fisiologia da prega vocal na produção de voz e as propriedades distintas já conhecidas, o presente estudo verificou a presença e a concentração de GAGs sulfatados na prega vocal humana: na cobertura, onde predomina a camada superficial da lâmina própria, e no ligamento. A cobertura e o ligamento têm funções distintas na formação da onda mucosa, bem como constituição histológica característica em relação a proteínas fibrosas, elastina e colágeno.1,7 A separação entre cobertura e ligamento, e entre ligamento e músculo, é segura por meio de dissecção com visão ampliada.
A concentração total de GAGs sulfatados foi comparada nas diferentes camadas e mostrou distribuição semelhante (tabela 1). Também não houve diferença significativa considerando as diferentes camadas e o sexo (tabela 2). Outros autores, embora com método diferente, sem separação em camadas, também não observaram diferença nos GAGs totais em relação ao sexo.16,17
Considerando a faixa etária, no entanto, foi observada diferença estatisticamente significativa entre as concentrações dos GAGs na cobertura, com maiores valores em indivíduos acima de 60 anos (tabela 3). A maior concentração de GAGs em idosos pode também estar relacionada à diminuição de outras substâncias em pregas vocais, como o próprio AH, conforme observado por Lebl et al.11 e Korn et al.,12 pois a sua concentração é calculada em termos de μg/peso seco do material da prega vocal. No ligamento não há diferença estatisticamente significante na concentração de GAGs, seja considerando o sexo ou a idade (tabelas 2 e 3). Paulsen et al.8 observaram diminuição dos GAGs sulfatados nos tendões do ligamento vocal, isto é, nas extremidades do ligamento, bem como perda mais acentuada de GAGs no tendão do ligamento vocal com o processo de envelhecimento.
Hammond et al.,9 em um estudo que relacionava a concentração de elastina observada em pregas vocais com a idade e gênero, não encontraram diferença expressiva em termos de sexo, mas uma diferença importante e significativa pôde ser vista quanto à idade dos pacientes. Pregas vocais de adultos mostravam elastina em quantidade menor do que a da população idosa. No entanto, esse aumento em densidade de elastina não significava necessariamente aumento da elasticidade da prega vocal, pois as fibras observadas nos idosos apresentavam estrutura alterada.
Assim, a modificação na estrutura de elastinas e na concentração de AH e de GAGs sulfatados pode estar relacionada ao envelhecimento do tecido, com consequente repercussão na produção da onda mucosa e voz.
Quando comparados separadamente os três tipos de GAGs (condroitim, heparam e dermatam sulfato) entre a cobertura e o ligamento, não houve diferença significante. Porém, tanto na cobertura como no ligamento, a comparação entre os tipos de GAGs evidenciou de modo significante maior concentração de dermatam sulfato (tabelas 4 e 5). Pawlak et al.2 fizeram estudo sobre a presença e distribuição de GAGs e proteoglicanos na prega vocal com anticorpos antiqueratam sulfato, antiproteoglicanos de CS, antiproteoglicanos de HS e antidecorin. Os dados foram quantificados segundo coloração comparada com amostra de pele normal, em 0–3+. Os autores observaram queratam sulfato e decorin (que pode se ligar covalentemente a QS ou DS) em componentes fibrilares da lâmina própria. Decorin com predomínio na camada superficial (2+) em relação às camadas profundas e QS nas profundas em relação à superficial. CS foi observado apenas em citoplasma de células da lâmina própria (2+). Proteoglicanos de HS foram observados na lâmina basal e nos vasos sanguíneos, bem como em citoplasma de macrófagos e provavelmente fibroblastos (2+). Diante dos resultados, os autores assinalam para a provável importância da fibromodulina (ligada covalentemente a QS nas camadas profundas e decorin na superficial, ambas relacionadas à regulação do tipo e tamanho de colágeno produzido). Os autores não estudaram DS, o GAG encontrado em maior concentração no presente estudo. Sua presença em grande quantidade nas duas camadas da prega vocal deve ser mais bem entendida, bem como a maior quantidade de GAGs observada com o envelhecimento.
Os dados do presente estudo sinalizam para a necessidade de novas pesquisas com maior número de indivíduos, e não apenas de GAGs sulfatados, bem como dos diferentes tipos de PGs formados de sua ligação às diversas estruturas proteicas, para o entendimento da função de cada GAG e PG na fisiologia da prega vocal enquanto fonte sonora.
Conclusão- 1.
Dermatam sulfato, condroitim sulfato e heparam sulfato foram observados na cobertura e no ligamento de pregas vocais humanas, de ambos os sexos, sendo que a concentração de dermatam sulfato foi significativamente maior em todas as camadas.
- 2.
Não foram observadas diferenças significantes nas concentrações dos GAGs sulfatados entre cobertura e ligamento, segundo o sexo.
- 3.
A concentração de GAGs na cobertura é significativamente menor em indivíduos abaixo de 60 anos, em comparação com idosos.
Os autores declaram não haver conflitos de interesse.
Como citar este artigo: Park SW, Korn GP, Kobayashi EY, Martins JR, De Biase NG. Sulfated glycosaminoglycans in human vocal fold lamina propria. Braz J Otorhinolaryngol. 2017;83:426–31.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.