Temporomandibular disorder is an umbrella term for various clinical problems affecting the muscles of mastication, temporomandibular joint and associated structures. This disorder has a multifactor etiology, with oral parafunctional habits considered an important co‐factor. Among such habits, sleep bruxism is considered a causal agent involved in the initiation and/or perpetuation of temporomandibular disorder. That condition can result in pain otologic symptoms.
ObjectiveThe aim of the present study was to investigate the relationship between temporomandibular disorder and both otologic symptoms and bruxism.
MethodsA total of 776 individuals aged 15 years or older from urban areas in the city of Recife (Brazil) registered at Family Health Units were examined. The diagnosis of temporomandibular disorder was determined using Axis I of the Research Diagnostic Criteria for temporomandibular disorders, addressing questions concerning myofascial pain and joint problems (disk displacement, arthralgia, osteoarthritis and osteoarthrosis). Four examiners had previously undergone training and calibration exercises for the administration of the instrument. Intra‐examiner and inter‐examiner agreement was determined using the Kappa statistic. Individuals with a diagnosis of at least one of these conditions were classified as having temporomandibular disorder. The diagnosis of otologic symptoms and bruxism was defined using the same instrument and a clinical exam.
ResultsAmong the individuals with temporomandibular disorder, 58.2% had at least one otologic symptom and 52% exhibited bruxism. Statistically significant associations were found between the disorder and both otologic symptoms and bruxism (p<0.01 for both conditions; OR=2.12 and 2.3 respectively). Otologic symptoms and bruxism maintained statistical significance in the binary logistic regression analysis, which demonstrated a 1.7 fold and twofold greater chance of such individuals have temporomandibular disorder, respectively.
ConclusionThe logistic regression analysis demonstrated strong associations between the disorder and both otologic symptoms and bruxism when analyzed simultaneously, independently of patient age and gender.
A disfunção temporomandibular é um termo que engloba vários problemas clínicos que afetam os músculos da mastigação, a articulação temporomandibular e estruturas associadas. Esse distúrbio tem uma etiologia multifatorial, com hábitos parafuncionais orais considerados um importante cofator. Entre esses hábitos, o bruxismo do sono é considerado um agente causador envolvido no desenvolvimento e/ou na perpetuação de disfunção temporomandibular. Esse problema pode resultar em sintomas otológicos dolorosos.
ObjetivoInvestigar a relação entre disfunção temporomandibular e os sintomas otológicos e bruxismo.
MétodoForam examinados 776 indivíduos com idade igual ou superior a 15 anos de áreas urbanas da cidade de Recife (Brasil) registrados nas Unidades de Saúde da Família. O diagnóstico da disfunção foi determinado utilizando o Eixo I dos Critérios de Diagnóstico de Pesquisa para Distúrbios Temporomandibulares, abordando questões relativas a dor miofascial e problemas articulares (luxação discal, artralgia, osteoartrite e osteoartrose). Quatro examinadores foram treinados para a administração do instrumento. A concordância intraexaminador e interexaminador foi determinada usando a estatística Kappa. Os indivíduos com diagnóstico de pelo menos uma dessas condições foram classificados como tendo disfunção temporomandibular. O diagnóstico de sintomas otológicos e bruxismo foi definido utilizando o mesmo instrumento de diagnóstico e exame clínico.
ResultadosEntre os indivíduos com a disfunção, 58,2% apresentaram pelo menos um sintoma otológico e 52% apresentaram bruxismo. Foram encontradas associações estatisticamente significativas entre a disfunção temporomandibular e ambos os sintomas otológicos e bruxismo (p < 0,01 para ambos os problemas, OR = 2,12 e 2,3, respectivamente). Os sintomas otológicos e o bruxismo mantiveram significância estatística na análise de regressão logística binária, o que demonstrou uma probabilidade de 1,7 e 2 vezes maior chance de que esses indivíduos tenham disfunção temporomandibular, respectivamente.
ConclusãoA análise de regressão logística demonstrou associações fortes entre disfunção temporomandibular e sintomas otológicos e bruxismo quando analisados simultaneamente, independentemente da idade e do sexo do paciente.
A disfunção temporomandibular (DTM) é um termo que abrange vários problemas clínicos que acometem os músculos da mastigação, a articulação temporomandibular (ATM) e estruturas associadas1. Esse distúrbio tem etiologia multifatorial2 e os hábitos parafuncionais orais são considerados um importante cofator.3 Entre esses hábitos, o bruxismo do sono é considerado um agente causador envolvido tanto no início do desenvolvimento quanto na perpetuação da DTM.4 O bruxismo é o ato de ranger ou apertar os dentes de maneira parafuncional ou inconsciente. O bruxismo causa hiperatividade dos músculos da mastigação devido a movimentos mandibulares não funcionais, o que pode resultar em sintomas de dor e, portanto, é um fator importante para as mudanças na ATM.5
Os sintomas clínicos da DTM incluem sons de cliques ou crepitação na ATM, dificuldade para abrir e fechar a boca e dor, a última pode se estender para diferentes regiões da cabeça, inclusive as regiões pré‐auriculares e auriculares.5 Uma série de estudos sugeriu uma associação entre sintomas otológicos e sintomas da DTM.6–8 Os sintomas mais frequentemente relatados na literatura incluem zumbido, otalgia, sensação de plenitude auricular, perda de audição e tonturas.1,6,7 Acredita‐se que a associação desses sintomas com DTM é multicausal, devido a relações anatômicas, neurológicas e emocionais.9
Nesse contexto, há uma hipótese provável de que a hiperatividade dos músculos da mastigação possa contrair o músculo tensor do tímpano e a membrana timpânica, o que resultaria em disfunção da tuba auditiva, ocasionaria sintomas como sensação de plenitude auricular, perda de equilíbrio e perda auditiva.2 Devido à escassez de estudos na literatura, o objetivo do presente estudo foi investigar a associação entre DTM e ambos os sintomas otológicos e de bruxismo do sono.
MétodoUm estudo transversal foi feito com uma amostra de 776 indivíduos com 15 anos ou mais de áreas urbanas registradas em unidades de saúde da família. Não foram impostas restrições quanto ao gênero ou à etnia. A idade foi classificada com base em uma adaptação dos critérios da Organização Mundial de Saúde: 15‐18, 19‐24, 25‐44, 45‐59 e 60 anos ou mais.10
A amostragem em vários estágios foi usada para determinar o tamanho da amostra e obter uma amostra representativa de toda a cidade. Primeiro, uma amostragem sistemática foi empregada para definir os bairros nos distritos de saúde que participariam do estudo. A amostra sistemática foi então feita para selecionar as unidades de saúde primárias, das quais 776 voluntários em suas respectivas unidades de saúde foram selecionados aleatoriamente.
Todo o projeto, inclusive o consentimento informado, recebeu aprovação do Comitê de Ética em Pesquisa Humana (n° 05650512.9.0000.5208). Todos os participantes assinaram uma declaração de consentimento informado e aqueles diagnosticados com DTM foram encaminhados para um centro de referência para tratamento. Para menores de 18 anos, o consentimento informado para fazer os exames foi obtido dos pais ou responsáveis. Esta pesquisa foi conduzida em plena conformidade com a Declaração da Associação Médica Mundial de Helsinque.11
O diagnóstico de DTM foi determinado com o uso do Eixo I dos Critérios de Diagnóstico de Pesquisa para Disfunções Temporomandibulares (RDC/TMD), abordou questões relativas a dor miofascial e problemas articulares (luxação de discos, artralgia, osteoartrite e osteoartrose). O diagnóstico de dor miofascial baseou‐se no relato de dor nas têmporas, mandíbula, face, área pré‐auricular ou dentro da orelha em repouso ou durante função. O indivíduo relatou dor em resposta à palpação de três ou mais grupos musculares. Em relação à presença de dor muscular com ou sem limitação da abertura oral, a luxação discal é diagnosticada por movimentos de abertura, fechamento, excursão lateral ou protrusão da mandíbula; cliques recíprocos na ATM (luxação discal com redução), limitação de abertura (luxação discal sem redução) ou luxações discais sem redução e sem sinais de limitação da abertura da boca. A artralgia é detectada pela presença de um ou mais sintomas de dor na região articular, dor na articulação durante a abertura máxima sem auxílio, dor na articulação durante a abertura com auxílio, dor na articulação durante a excursão lateral, caso haja crepitação grosseira. Observou‐se a presença de osteoartrite da ATM quando havia artralgia e crepitação grosseira e de osteoartrose da ATM quando não havia evidência de artralgia e com crepitações grosseiras (Manfredini eixo 1).12 Os indivíduos com diagnóstico de pelo menos um desses problemas foram classificados com tendo DTM. Quatro examinadores foram treinados para os exercícios de calibração e administração de RDC/TMD. A concordância intraexaminador e interexaminador foi determinada com uso da estatística de Kappa (K = 0,90 e 0,82, respectivamente).
A presença de sintomas otológicos foi considerada quando pelo menos um dos seguintes sintomas estava presente: zumbido, otalgia, plenitude auricular, tonturas e perda auditiva, os quais foram todos diagnosticados pelo relato dos pacientes. O bruxismo do sono foi diagnosticado por autorrelato ou relato de um parente sobre ranger ou apertar os dentes durante o sono com RDC/TMD (Eixo II). O eixo II consiste em um questionário com 31 itens, dividido em fatores sociodemográficos, socioeconômicos, psicológicos (subescalas de depressão e sintomas físicos não específicos – dolorosos e não dolorosos), psicossociais (grau de gravidade da dor crônica – intensidade de dor e deficiência relacionada); sinais e sintomas relacionados com o paciente e a escala de limitação na função mandibular (limitações relacionadas com o funcionamento mandibular). O escore médio é calculado pela soma da pontuação de itens individuais, possibilita que os pacientes sejam avaliados dentro de níveis normais, moderados ou graves de depressão e escalas de sintomas físicos específicos e não específicos. No entanto, para o propósito do presente estudo, foram extraídas apenas informações relevantes relacionadas ao bruxismo do sono e a sintomas otológicos.13,14
Deve‐se enfatizar que todos os pacientes com sintomas otológicos não conheciam seu diagnóstico de DTM, portanto não estavam em tratamento. Além disso, o tratamento para DTM não é disponível nos centros de saúde pública no Estado de Pernambuco. Todos os pacientes devidamente diagnosticados são encaminhados para faculdades estaduais de odontologia.
Indivíduos com distúrbios neurológicos, com história de tumor na região da cabeça e do pescoço, que fizeram uso contínuo ou pelo menos nos três dias anteriores de agentes anti‐inflamatórios, analgésicos ou corticoides, incapazes de entender ou responder ao RDC/TMD, com história de doença reumática, com dor de origem odontogênica e aqueles com otalgia primária foram excluídos do estudo. Essa informação foi extraída dos prontuários dos pacientes nos serviços de saúde.
Para a análise estatística, o Statistics Package for the Social Sciences (SPSS, versão 20.0) foi empregado para a coleta de dados e cálculos estatísticos. O teste de Shapiro‐Wilk foi usado para determinar a distribuição dos dados (normal ou não normal). O teste de qui‐quadrado de Pearson foi usado para testar associações entre variáveis dependentes e independentes. Uma margem de erro de 5% com um nível de significância de 95% (p < 0,05) foi considerada para todas as análises. Um modelo de regressão foi criado para identificar possíveis variáveis de confusão e variáveis explicativas.
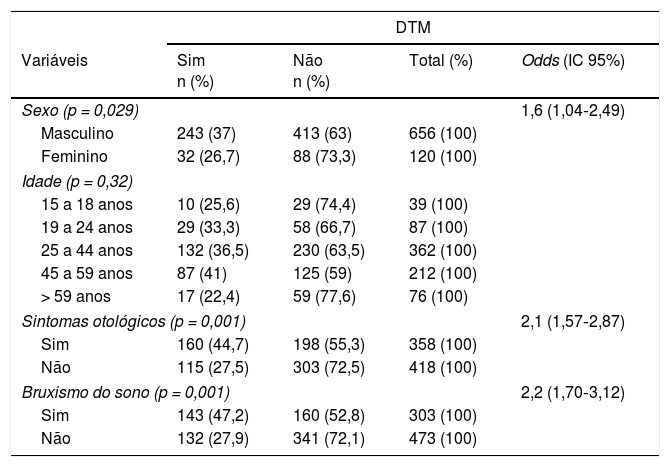
ResultadosParticiparam do presente estudo 776 indivíduos entre 15 e 85 anos (média: 39,88 anos, mediana: 39 anos). A prevalência de DTM na amostra analisada foi de 35,4%. Entre os 275 indivíduos diagnosticados com DTM, 88,4% eram do sexo feminino. A prevalência foi maior na faixa de 45‐59 anos, correspondeu a 41% dos indivíduos acometidos (tabela 1).
Distribuição dos participantes com DTM de acordo com os sintomas otológicos e bruxismo
| DTM | ||||
|---|---|---|---|---|
| Variáveis | Sim n (%) | Não n (%) | Total (%) | Odds (IC 95%) |
| Sexo (p = 0,029) | 1,6 (1,04‐2,49) | |||
| Masculino | 243 (37) | 413 (63) | 656 (100) | |
| Feminino | 32 (26,7) | 88 (73,3) | 120 (100) | |
| Idade (p = 0,32) | ||||
| 15 a 18 anos | 10 (25,6) | 29 (74,4) | 39 (100) | |
| 19 a 24 anos | 29 (33,3) | 58 (66,7) | 87 (100) | |
| 25 a 44 anos | 132 (36,5) | 230 (63,5) | 362 (100) | |
| 45 a 59 anos | 87 (41) | 125 (59) | 212 (100) | |
| > 59 anos | 17 (22,4) | 59 (77,6) | 76 (100) | |
| Sintomas otológicos (p = 0,001) | 2,1 (1,57‐2,87) | |||
| Sim | 160 (44,7) | 198 (55,3) | 358 (100) | |
| Não | 115 (27,5) | 303 (72,5) | 418 (100) | |
| Bruxismo do sono (p = 0,001) | 2,2 (1,70‐3,12) | |||
| Sim | 143 (47,2) | 160 (52,8) | 303 (100) | |
| Não | 132 (27,9) | 341 (72,1) | 473 (100) | |
Entre os indivíduos com DTM, 58,2% apresentaram pelo menos um sintoma otológico e 52% apresentaram bruxismo do sono. O teste do qui‐quadrado de Pearson demonstrou associações estatisticamente significativas entre DTM e ambos os sintomas otológicos e os de bruxismo do sono (p < 0,01 para ambas as condições), com odds ratio de 2,12 para os sintomas otológicos e 2,3 para o bruxismo do sono.
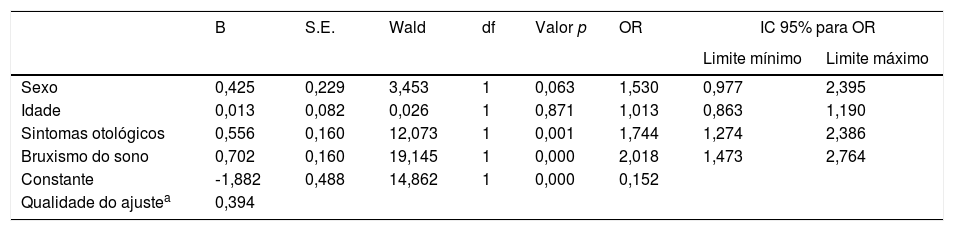
A análise de regressão logística binária foi feita para avaliar o comportamento das covariáveis simultaneamente com o desfecho (DTM). Os sintomas urológicos e o bruxismo do sono mantiveram significância estatística, demonstraram uma chance de 1,7 vez e duas maiores de desenvolverem DTM, respectivamente (tabela 2).
Modelo de regressão logística final para DTM de acordo com sexo, idade, sintomas otológicos e bruxismo
| B | S.E. | Wald | df | Valor p | OR | IC 95% para OR | ||
|---|---|---|---|---|---|---|---|---|
| Limite mínimo | Limite máximo | |||||||
| Sexo | 0,425 | 0,229 | 3,453 | 1 | 0,063 | 1,530 | 0,977 | 2,395 |
| Idade | 0,013 | 0,082 | 0,026 | 1 | 0,871 | 1,013 | 0,863 | 1,190 |
| Sintomas otológicos | 0,556 | 0,160 | 12,073 | 1 | 0,001 | 1,744 | 1,274 | 2,386 |
| Bruxismo do sono | 0,702 | 0,160 | 19,145 | 1 | 0,000 | 2,018 | 1,473 | 2,764 |
| Constante | ‐1,882 | 0,488 | 14,862 | 1 | 0,000 | 0,152 | ||
| Qualidade do ajustea | 0,394 | |||||||
O objetivo do presente estudo foi investigar comorbidades que podem estar associadas à DTM. A literatura relata associações entre esse distúrbio e hábitos parafuncionais.15,16 Os estudos citados indicaram que os hábitos parafuncionais podem alterar a harmonia do sistema estomatognático e, portanto, são considerados um elemento significativo na etiologia e progressão dos distúrbios musculares e da ATM. Entre esses hábitos, o presente estudo descobriu que o bruxismo do sono foi associado à DTM, o que está de acordo com os achados descritos em estudos anteriores.15,16
É importante notar que os distúrbios do movimento relacionados com o sono também foram descritos em outros instrumentos, como na Classificação Internacional de Distúrbios do Sono (ICSD‐3), reconhecida como um importante texto clínico para o diagnóstico de distúrbios do sono e que classifica os distúrbios do sono em seis categorias principais (Insônia, Distúrbios Respiratórios Relacionados com o Sono, Distúrbios Centrais de Hiperssonologia, Distúrbios do Ritmo Circadiano do Sono‐Vigília, Parassonias e Distúrbios do Movimento Relacionados com o Sono). No entanto, a abordagem do presente estudo centrou‐se no uso da RDC considerando sua relevância para fins epidemiológicos.17 O bruxismo pode levar a hiperatividade muscular, resultar em dor nos músculos da mastigação. Na presença de dor e outros sintomas, o sistema estomatognático tende a fazer compensações para possibilitar a mastigação, fala e deglutição com eficiência e conforto. No entanto, isso pode ter um efeito negativo em longo prazo, pois essas compensações não são necessariamente saudáveis e podem contribuir para a progressão da DTM. Além disso, o uso indiscriminado de analgésicos sem supervisão médica, como ocorre frequentemente em indivíduos com DTM, pode mascarar os sintomas e levar a um agravamento do problema.18
A análise da amostra também indicou uma associação positiva entre os sintomas otológicos e DTM, o que está de acordo com alguns relatos encontrados na literatura.19,20 Um estudo anterior observou que os sinais de DTM são preditores do desenvolvimento de alguns sintomas otológicos, como o zumbido.21 No entanto, a relação entre DTM e sintomas otológicos ainda não foi totalmente esclarecida. Contudo, essa relação baseou‐se em relações embriológicas, anatômicas e funcionais na região que abrange a ATM, músculos inervados pelo nervo trigêmeo e estruturas da orelha média.
Entre outros fatores, sugeriu‐se que as alterações musculares em indivíduos com DTM, como espasmos no músculo pterigoideo lateral, causam hipertonia do músculo tensor do tímpano, geram mudanças na tuba auditiva e consequente redução na ventilação da orelha média.19 Assim, a atividade anormal do músculo tensor do tímpano estaria associada a sintomas otológicos, como sensação de plenitude auricular, zumbido, tonturas e hipo/hiperacusia, sem a existência de outra doença de natureza otológica.2
Um estudo feito por Felício et al.18 sugere que a solicitação anormal dos músculos da mastigação devido ao bruxismo não só causa dor, mas também pode contribuir para mudanças na ATM e desencadear DTM. Além disso, como afirmado anteriormente, a hiperatividade dos músculos da mastigação pode resultar em atividade anormal do músculo tensor do tímpano e levar a sintomas otológicos.18
Também é importante considerar os fatores culturais, ambientais e biológicos que podem desempenhar um papel importante na manutenção e na progressão da DTM.22–24 No presente estudo foi encontrada uma maior prevalência de DTM entre as mulheres. De acordo com Poveda Roda et al., a DTM é quatro vezes mais frequente em mulheres, que também tendem a buscar tratamento três vezes mais do que os homens.25 Estudos sugeriram que os receptores de estrogênio modulam as funções metabólicas em relação ao relaxamento dos ligamentos, o que pode contribuir para a progressão da DTM.25 Nesse contexto, deve‐se ressaltar que a faixa etária mais acometida corresponde a mudanças hormonais importantes, como a menopausa, que sugere participação nesse processo, de acordo com estudos anteriores.26,27 No entanto, tanto o sexo quanto a idade perderam sua importância estatística na análise de regressão logística, que demonstrou fortes associações entre DTM e ambos, sintomas otológicos e de bruxismo do sono quando analisados simultaneamente, independentemente da idade e do sexo dos pacientes. Assim, é importante considerar a tríade de sintomas de DTM‐bruxismo do sono‐otológicos em avaliações de diagnóstico clínico e epidemiológico, de forma que os pacientes possam ser corretamente diagnosticados e tratados.
ConclusãoA análise de regressão logística demonstrou fortes associações entre DTM e sintomas otológicos e de bruxismo quando analisados simultaneamente, independentemente da idade e do sexo do paciente.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) do Ministério da Educação pelo financiamento da pesquisa.
Como citar este artigo: Magalhães BG, Freitas JL, Barbosa AC, Gueiros MC, Gomes SG, Rosenblatt A, et al. Temporomandibular disorder: otologic implications and its relationship to sleep bruxism. Braz J Otorhinolaryngol. 2018;84:614–19.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.