Systemic inflammatory biomarkers are promising predictive and prognostic factors for solid cancers. The neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio are used to predict inflammation and used as biomarker in several malignancies.
ObjectiveThe purpose of this study was to demonstrate the diagnostic, predictive and prognostic role of neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio in patients with laryngeal neoplasms.
MethodsA retrospective study was conducted on medical records involving 229 patients with benign, premalignant and malignant laryngeal neoplasms between 2002 and 2015. The diagnostic, predictive and prognostic role of neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio were evaluated using uni– and multivariate analysis.
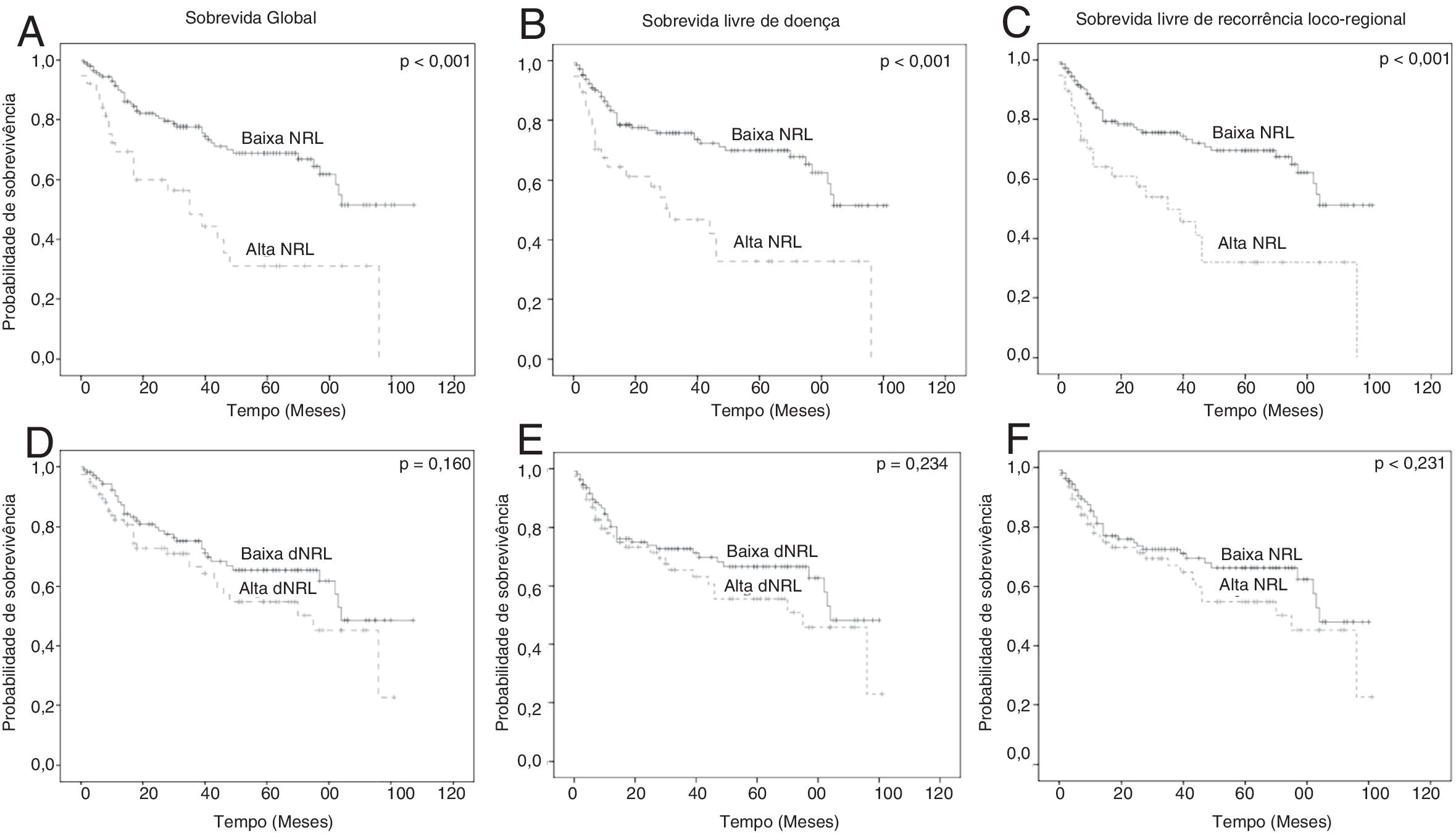
ResultsThe neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio were not statistically different between patients with benign, premalignant and malignant laryngeal neoplasms. Both neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio were predictive factors for stage, lymph node metastasis, and distant metastasis. Patients with high neutrophil–lymphocyte ratio value (≥4) had a poor prognosis when compared with patients with low neutrophil–lymphocyte ratio value (5 year, Overall Survival: 69.0% vs. 31.1%, p<0.001; 5 year, disease free survival: 70.0% vs. 32.7%, p˂0.001; 5 year, locoregional recurrence free survival: 69.7% vs. 32.0%, p<0.001). Furthermore, neutrophil–lymphocyte ratio was an independent prognostic factor for 5 year: Overall survival (HR=2.396; 95% CI 1.408–4.077; p=0.001), Disease free survival (HR=2.246; 95% CI 1.322–3.816; p=0.006) and locoregional recurrence free survival (HR=2.210; 95% CI 1.301–3.753; p=0.003).
ConclusionPretreatment neutrophil–lymphocyte ratio is a useful and reliable predictive and prognostic biomarker for patients with laryngeal carcinoma.
Biomarcadores inflamatórios sistêmicos são fatores preditivos e prognósticos promissores para cânceres sólidos. A relação neutrófilo‐linfócito e a relação neutrófilo‐linfócito derivada são utilizadas para predizer a inflamação e como biomarcadores em várias malignidades.
ObjetivoO objetivo deste estudo foi demonstrar o papel diagnóstico, preditivo e prognóstico da relação neutrófilo‐linfócito e relação neutrófilo‐linfócito derivada em pacientes com neoplasias laríngeas.
MétodoFoi realizado um estudo retrospectivo em prontuários médicos de 229 pacientes com neoplasias laríngeas benignas, pré‐malignas e malignas entre 2002 e 2015. O papel diagnóstico, preditivo e prognóstico da relação neutrófilo‐linfócito e relação neutrófilo‐linfócito derivada foi avaliado por meio de análise uni‐ e multivariada.
ResultadosA relação neutrófilo‐linfócito e a relação neutrófilo‐linfócito derivada não foram estatisticamente diferentes entre pacientes com neoplasias laríngeas benignas, pré‐malignas e malignas. Ambas as relação neutrófilo‐linfócito e relação neutrófilo‐linfócito derivada foram fatores preditivos para o estágio, metástase linfonodal e metástase a distância. Pacientes com valor alto da relação neutrófilo‐linfócito (≥ 4) apresentaram pior prognóstico quando comparados com pacientes com valor mais baixo da relação neutrófilo‐linfócito (5 anos, Sobrevida Global: 69,0% vs. 31,1%, p<0,001; 5 anos, sobrevida livre de doença: 70,0% vs. 32,7%, p<0,001; 5 anos, sobrevida livre de recorrência loco‐regional: 69,7% vs. 32,0%, p<0,001). Além disso, a relação neutrófilo‐linfócito foi um fator prognóstico independente para 5 anos: Sobrevida global (HR=2,396; IC95% 1,408–4,077; p=0,001), sobrevida livre de doença (HR=2,246; IC95%: 1,322–3,816; p=0,006) e sobrevida livre de recorrência loco‐regional (HR=2,210; IC95%: 1,301–3,753; p=0,003).
ConclusãoA relação neutrófilo‐linfócito no pré‐tratamento é um biomarcador preditivo e de prognóstico útil e confiável para pacientes com carcinoma de laringe.
O câncer de laringe é um dos cânceres mais comuns de cabeça e pescoço. Em 2012, os novos casos estimados de carcinoma de laringe (CL) chegaram a 157.000 e os óbitos relacionados ao câncer foram de 83.000 em todo o mundo.1 A taxa de sobrevida em cinco anos é de aproximadamente 75% em pacientes com doença localizada; contudo, observa‐se uma notável redução na sobrevida quando a doença é regional ou em órgãos distantes (44% e 35%).2 Portanto, a detecção precoce do CL e a avaliação de metástase regional e a distância (MD) são cruciais para o estadiamento clínico, seleção de tratamento, controle locorregional e sobrevida.
Na literatura, vários fatores têm sido relatados como biomarcadores diagnósticos, preditivos e/ou prognósticos para o câncer. Biomarcadores de câncer são assinaturas moleculares únicas produzidas pelo próprio tumor ou em resposta à atividade tumoral. Um biomarcador ideal para o câncer deve ter as seguintes características: (i) Ser altamente específico e sensível, (ii) Simples de identificar a doença, (iii) Fácil de obter, (iv) Estável em relação a sexo, idade e etnia, (v) Indicador de prognóstico e (vi) Ter bom custo‐benefício. Apesar da existência de vários biomarcadores, como ERRC1, p16, K‐ras, EGFR e EGFRvIII, esses não são ampla e rotineiramente usados em cânceres de cabeça e pescoço devido às suas limitações em aplicações clínicas, reprodutibilidade e custos.3,4
A relação neutrófilo‐linfócito (NLR) e a NLR derivada (dNLR) foram recentemente popularizadas como biomarcadores da resposta inflamatória sistêmica.5,6 A NLR determina principalmente a inflamação sistêmica, particularmente em doenças inflamatórias crônicas.7,8 Diversas evidências clínicas demonstraram que um valor alto da NLR está associado a um prognóstico e sobrevida ruins em vários tipos de câncer, como o de nasofaringe, gastrointestinal, pulmão e rins.9–12 Além disso, a dNLR, uma forma modificada da NLR, também é usada para demonstrar a inflamação sistêmica e o prognóstico em uma variedade de cânceres, como câncer gastrointestinal e de mama.6,13,14 A relação fisiopatológica entre valores altos da NLR ou dNLR e um prognóstico ruim ainda permanece incerta. Acredita‐se que possa estar relacionada a uma diminuição no número de linfócitos e a um aumento na contagem de neutrófilos em pacientes com câncer.15 De fato, os linfócitos são responsáveis pela resposta imunológica anticâncer e as células T CD8(+) controlam especificamente a atividade tumoral por apoptose e efeito citotóxico. Portanto, a contagem de linfócitos é inversamente correlacionada com a gravidade do câncer.16,17 A inflamação relacionada ao câncer também pode levar a um aumento no número de neutrófilos.18,19 Além disso, as citocinas, produzidas pelas células cancerígenas, podem desencadear a migração de neutrófilos do sangue para o microambiente tumoral; assim, os neutrófilos podem estimular o crescimento do tumor e a angiogênese através do fator de crescimento endotelial vascular, IL‐8 e metaloproteinase da matriz‐9.20–22
Na literatura, o papel preditivo e prognóstico da NLR foi relatado em cânceres de cabeça e pescoço.23–26 Rassouli et al.23 enfatizaram a relação entre os valores da NLR (> 4,27) e o risco de recorrência do tumor. Além disso, a NLR foi relatada como um fator preditivo e prognóstico independente para a sobrevida em pacientes com cânceres de cabeça e pescoço recorrentes ou metastáticos.24 De maneira similar, Haddad et al.25 determinaram um alto risco de mortalidade em pacientes com uma NLR ≥ 5 (89% vs. 61%, p=0,0017). Rachidi et al.26 também demonstraram uma relação significativa entre o aumento do valor da NLR e um prognóstico ruim em pacientes com câncer de cabeça e pescoço. Eles defenderam a hipótese de que o alto nível de neutrófilos e/ou o baixo nível de linfócitos estavam correlacionados com uma notável diminuição na sobrevida global (SG). O objetivo deste estudo foi determinar o papel diagnóstico da NLR e dNLR no pré‐tratamento em pacientes com neoplasias da laringe, e demonstrar o seu papel preditivo e prognóstico em pacientes com CL.
MétodoEste estudo foi aprovado pelo comitê de ética institucional da Manisa Celal Bayar University (Número de Aprovação: 20478486‐408).
Pacientes e métodoUma revisão retrospectiva foi feita entre 2002 e 2015 na Manisa Celal Bayar University, foram incluídos os pacientes com diagnóstico de neoplasias laríngeas benignas, pré‐malignas e malignas. Os critérios de exclusão foram os seguintes: (i) pacientes com segundo câncer primário, (ii) pacientes com doença inflamatória crônica/autoimune, (iii) pacientes com neoplasias malignas que não o carcinoma de células escamosas. Portanto, a população do estudo incluiu três grupos: (i) pacientes com neoplasias laríngeas benignas, (ii) pacientes com neoplasias pré‐malignas e (iii) pacientes com neoplasias malignas ou CL. Todos os casos foram avaliados por exames clínicos e radiológicos, como ultrassonografia, tomografia computadorizada ou ressonância magnética. O estadiamento TNM de pacientes com CL foi determinado de acordo com os critérios da 7ª edição do American Joint Committee on Cancer – AJCCCancer Staging Manual, de 2009.
Todas as amostras para hemograma completo foram coletadas de cinco a 10 dias antes da biópsia/excisão cirúrgica, feita sob anestesia geral. Portanto, nenhum dos pacientes apresentava qualquer sinal de infecção. O valor da NLR foi medido dividindo‐se a contagem absoluta de neutrófilos (CNC, do inglês Complete Neutrophil Count) pela contagem absoluta de linfócitos (CLC, do inglês Complete Lymphocyte Count) e o valor da dNLR foi determinado pela fórmula CNC/CWBCC‐CNC (contagem completa de glóbulos brancos – CWBCC, do inglês Complete White Blood Cell Count).
Análise estatísticaForam feitas no software SPSS v. 20.0 para Windows (Chicago, IL, EUA). Os valores médios e desvios‐padrão foram calculados de acordo com as características sociodemográficas e clinicopatológicas da população estudada. Os testes de Kolmogorov‐Smirnov e Shapiro‐Wilk demonstraram uma distribuição anormal dos valores de NLR e dNLR. Portanto, o teste U de Mann‐Whitney foi usado para a comparação de dois grupos; e o teste de Kruskal‐Wallis foi usado para a comparação de três ou mais grupos. Além disso, a população do estudo foi dicotomizada de acordo com os valores de corte da NLR e dNLR (baixo vs. alto). Os valores de corte foram 4 para a NLR e 2 para a dNLR, dependeram de estudos clínicos com elevado nível de evidência.5,6 Assim, o papel diagnóstico e preditivo da NLR e dNLR também foi analisado com o teste qui‐quadrado.
Neste estudo, três endpoints (5 anos: SG, Sobrevida Livre de Doença [SLD] e sobrevida livre de recorrência locorregional [SLRLR]) foram selecionados para a avaliação dos desfechos oncológicos. Todos os intervalos de tempo até a ocorrência dos eventos foram medidos a partir da data de início da modalidade de tratamento. Sobrevida global foi definida como o tempo desde o diagnóstico até o último seguimento ou morte por qualquer causa. SLD foi definida como o tempo desde o diagnóstico até o aparecimento de qualquer sinal de doença, recorrência locorregional (RLR) e/ou MD, último acompanhamento ou morte por qualquer causa. SLRLR foi definida como o tempo desde o tratamento até o aparecimento de qualquer sinal de RLR ou até o último seguimento. A análise de sobrevida foi feita pelo método de Kaplan‐Meier e as variáveis foram comparadas com o teste de log‐rank. Um modelo de regressão de risco proporcional de Cox foi criado a fim de determinar o efeito das variáveis nos resultados oncológicos para análise uni‐ e multivariada. As variáveis com um valor de probabilidade<0,1 na análise univariada foram selecionadas para análise multivariada através da regressão de risco proporcional de Cox. Posteriormente, apenas as variáveis com significância permaneceram no modelo com o uso de eliminação regressiva (stepwise backward); assim, os fatores prognósticos independentes foram determinados. Os resultados foram expressos como hazard ratios (HRs) com intervalo de confiança (IC) de 95%. Um valor de p <0,05 foi considerado estatisticamente significativo.
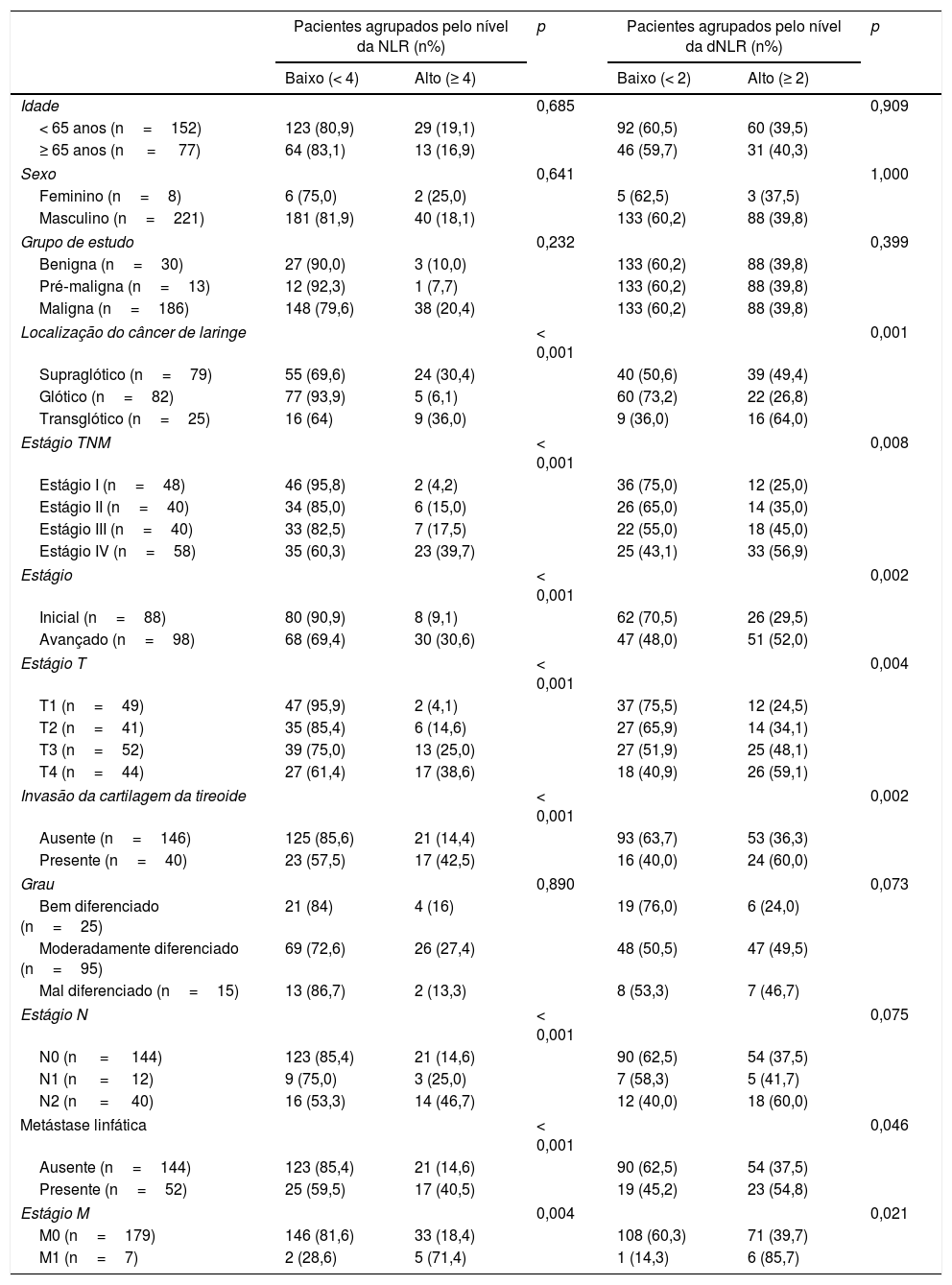
ResultadosCaracterísticas sociodemográficas e clinicopatológicas da população estudadaA população do estudo incluiu 229 pacientes com neoplasias laríngeas. As estatísticas descritivas sobre os pacientes, as características clínicas, histopatológicas e de tratamento são apresentadas na tabela 1. O número de pacientes com neoplasias benignas, pré‐malignas e malignas foi: 30 (17 com pólipos de prega vocal e 13 com nódulos de prega vocal) (13,1%), 13 (nove com displasia leve e quatro com displasia moderada) (5,7%) e 186 (81,2%), respectivamente. A maioria dos casos era do sexo masculino (221 casos, 96,5%). A mediana da idade dos pacientes no momento do tratamento era 59 anos (variação de 31‐88) (< 65 anos, 152 casos, 66,4%). A grande maioria das neoplasias malignas da laringe era glótica (82 casos; 44,1%) e supraglótica (79 casos, 42,5%). O câncer transglótico de laringe foi encontrado em 24 casos (13,4%). O CL foi bem diferenciado em 25 pacientes (13,4%), moderadamente em 95 (51,1%), mal diferenciado em 15 (8,1%) e não identificado em 51 (27,4%). Noventa e oito pacientes (52,7%) estavam em estágio avançado de CL, estágio III: 40 casos (21,5%); estágio IV: 58 casos (31,2%) e 88 pacientes (47,3%) estavam no estágio inicial de CL, estágio I: 48 casos (25,8%); Estágio II: 40 casos (21,5%). A invasão da cartilagem tireoide (TCI, do inglês Thyroid Cartilage Invasion) foi detectada em 40 casos (21,5%). A distribuição dos estágios T I, II, III e IV foi de 26,3% (49 casos), 22% (41 casos), 28% (52 casos), 23,7% (44 casos), respectivamente. Metástase em linfonodos (ML) foi encontrada em 42 casos (22,6%), N1: 12 casos (28,5%); N2: 30 casos (71,5%) e a disseminação nodal extracapsular foi detectada em 26 pacientes (61,9%). Sete pacientes (3,8%) com CL apresentaram MD no momento do diagnóstico. Pacientes com CL no estágio inicial foram tratados principalmente com radioterapia (57 casos, 64,8%). Por outro lado, a maioria dos pacientes com CL em estágio avançado recebeu tratamento cirúrgico e radioterapia ± quimioterapia adjuvante (67 casos, 68,4%). Noventa e oito casos (52,7%) foram tratados com cirurgia ± terapia adjuvante e 88 casos (47,3%) por modalidades não cirúrgicas. O valor médio do seguimento foi de 39,5 (1‐107) meses. Durante o seguimento, a RLR e a MD foram detectadas em 33 casos (18,4%) e 19 casos (10,6%), respectivamente. Sessenta e cinco indivíduos (34,9%) foram a óbito durante o período de acompanhamento.
Características dos pacientes e da doença, análise preditiva da NLR e dNLR com características demográficas e clinicopatológicas
| Pacientes agrupados pelo nível da NLR (n%) | p | Pacientes agrupados pelo nível da dNLR (n%) | p | |||
|---|---|---|---|---|---|---|
| Baixo (< 4) | Alto (≥ 4) | Baixo (< 2) | Alto (≥ 2) | |||
| Idade | 0,685 | 0,909 | ||||
| < 65 anos (n=152) | 123 (80,9) | 29 (19,1) | 92 (60,5) | 60 (39,5) | ||
| ≥ 65 anos (n = 77) | 64 (83,1) | 13 (16,9) | 46 (59,7) | 31 (40,3) | ||
| Sexo | 0,641 | 1,000 | ||||
| Feminino (n=8) | 6 (75,0) | 2 (25,0) | 5 (62,5) | 3 (37,5) | ||
| Masculino (n=221) | 181 (81,9) | 40 (18,1) | 133 (60,2) | 88 (39,8) | ||
| Grupo de estudo | 0,232 | 0,399 | ||||
| Benigna (n=30) | 27 (90,0) | 3 (10,0) | 133 (60,2) | 88 (39,8) | ||
| Pré‐maligna (n=13) | 12 (92,3) | 1 (7,7) | 133 (60,2) | 88 (39,8) | ||
| Maligna (n=186) | 148 (79,6) | 38 (20,4) | 133 (60,2) | 88 (39,8) | ||
| Localização do câncer de laringe | < 0,001 | 0,001 | ||||
| Supraglótico (n=79) | 55 (69,6) | 24 (30,4) | 40 (50,6) | 39 (49,4) | ||
| Glótico (n=82) | 77 (93,9) | 5 (6,1) | 60 (73,2) | 22 (26,8) | ||
| Transglótico (n=25) | 16 (64) | 9 (36,0) | 9 (36,0) | 16 (64,0) | ||
| Estágio TNM | < 0,001 | 0,008 | ||||
| Estágio I (n=48) | 46 (95,8) | 2 (4,2) | 36 (75,0) | 12 (25,0) | ||
| Estágio II (n=40) | 34 (85,0) | 6 (15,0) | 26 (65,0) | 14 (35,0) | ||
| Estágio III (n=40) | 33 (82,5) | 7 (17,5) | 22 (55,0) | 18 (45,0) | ||
| Estágio IV (n=58) | 35 (60,3) | 23 (39,7) | 25 (43,1) | 33 (56,9) | ||
| Estágio | < 0,001 | 0,002 | ||||
| Inicial (n=88) | 80 (90,9) | 8 (9,1) | 62 (70,5) | 26 (29,5) | ||
| Avançado (n=98) | 68 (69,4) | 30 (30,6) | 47 (48,0) | 51 (52,0) | ||
| Estágio T | < 0,001 | 0,004 | ||||
| T1 (n=49) | 47 (95,9) | 2 (4,1) | 37 (75,5) | 12 (24,5) | ||
| T2 (n=41) | 35 (85,4) | 6 (14,6) | 27 (65,9) | 14 (34,1) | ||
| T3 (n=52) | 39 (75,0) | 13 (25,0) | 27 (51,9) | 25 (48,1) | ||
| T4 (n=44) | 27 (61,4) | 17 (38,6) | 18 (40,9) | 26 (59,1) | ||
| Invasão da cartilagem da tireoide | < 0,001 | 0,002 | ||||
| Ausente (n=146) | 125 (85,6) | 21 (14,4) | 93 (63,7) | 53 (36,3) | ||
| Presente (n=40) | 23 (57,5) | 17 (42,5) | 16 (40,0) | 24 (60,0) | ||
| Grau | 0,890 | 0,073 | ||||
| Bem diferenciado (n=25) | 21 (84) | 4 (16) | 19 (76,0) | 6 (24,0) | ||
| Moderadamente diferenciado (n=95) | 69 (72,6) | 26 (27,4) | 48 (50,5) | 47 (49,5) | ||
| Mal diferenciado (n=15) | 13 (86,7) | 2 (13,3) | 8 (53,3) | 7 (46,7) | ||
| Estágio N | < 0,001 | 0,075 | ||||
| N0 (n = 144) | 123 (85,4) | 21 (14,6) | 90 (62,5) | 54 (37,5) | ||
| N1 (n = 12) | 9 (75,0) | 3 (25,0) | 7 (58,3) | 5 (41,7) | ||
| N2 (n = 40) | 16 (53,3) | 14 (46,7) | 12 (40,0) | 18 (60,0) | ||
| Metástase linfática | < 0,001 | 0,046 | ||||
| Ausente (n=144) | 123 (85,4) | 21 (14,6) | 90 (62,5) | 54 (37,5) | ||
| Presente (n=52) | 25 (59,5) | 17 (40,5) | 19 (45,2) | 23 (54,8) | ||
| Estágio M | 0,004 | 0,021 | ||||
| M0 (n=179) | 146 (81,6) | 33 (18,4) | 108 (60,3) | 71 (39,7) | ||
| M1 (n=7) | 2 (28,6) | 5 (71,4) | 1 (14,3) | 6 (85,7) | ||
A distribuição, os valores médios e os desvios‐padrão de NLR e dNLR são apresentados na figura 1. Os valores médios de NLR e dNLR foram relativamente altos em pacientes com CL; entretanto, a diferença não foi estatisticamente significante quando os pacientes com neoplasias laríngeas benignas, pré‐malignas e malignas foram comparados (p=0,068 e p=0,087) (fig. 1). Da mesma forma, nenhuma diferença estatisticamente significativa foi estabelecida entre os pacientes com CL e outros grupos quando os grupos do estudo foram comparados em relação aos valores baixos e altos da NLR e dNLR (p=0,232 e p=0,399) (tabela 1). Por outro lado, valores elevados da NLR e dNLR mostraram alta correlação com o CL supraglótico/transglótico de estágio avançado e presença de TCI, ML e MD (tabela 1) (fig. 1).
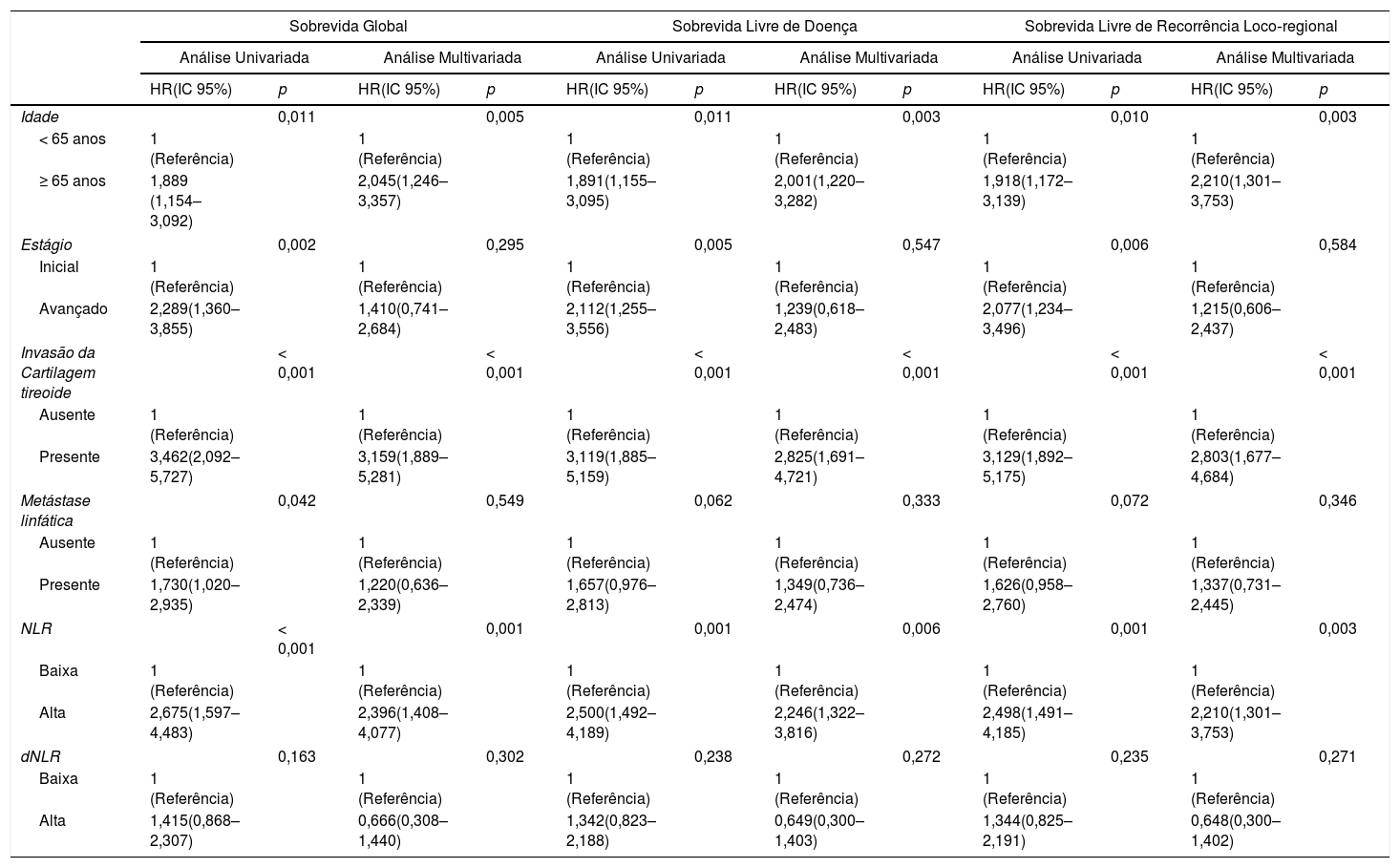
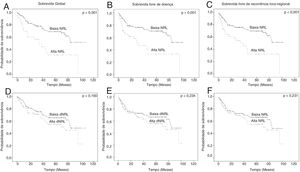
Associação entre NLR, dNLR e desfechos oncológicos: análise uni‐ e multivariadaSG de cinco anos, SLD e SLRLR de pacientes com CL foram 61,3%, 62,3% e 61,8%, respectivamente. Pacientes com NLR ≥ 4 apresentaram desfechos oncológicos significativamente ruins quando comparados com aqueles com NLR <4; sobrevida de 5 anos (SG: 69,0% vs. 31,1%, p <0,001; SLD: 70,0% vs. 32,7%, p <0,001; SLRLR: 69,7% vs. 32,0%, p <0,001) (figs. 2A–C). No entanto, nenhuma diferença estatisticamente significativa entre os valores baixos e altos da dNLR foi determinada para cinco anos: SG (65,4% vs. 54,8%, p=0,160); SLD (66,6% vs. 55,5%, p=0,234) e SLRLR (66,3% vs. 54,8%, p=0,231) (figs. 2D‐F). Além disso, a análise multivariada com o uso da eliminação stepwise‐backward demonstrou que a NLR foi um fator prognóstico independente para sobrevida de cinco anos: SG (HR=2.396, IC 95%: 1.408‐4.077; p=0,001); SLD (HR=2.246, IC 95%: 1.322‐3.816; p=0,006) e SLRLR (HR=2,210, IC 95%: 1,301‐3,753; p=0,003) (tabela 2).
Análise uni‐ e multivariada para sobrevida global de 5 anos, sobrevida doença‐específica, sobrevida livre de doença, sobrevida livre de recorrência locorregional e sobrevida livre de metástase a distância
| Sobrevida Global | Sobrevida Livre de Doença | Sobrevida Livre de Recorrência Loco‐regional | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Análise Univariada | Análise Multivariada | Análise Univariada | Análise Multivariada | Análise Univariada | Análise Multivariada | |||||||
| HR(IC 95%) | p | HR(IC 95%) | p | HR(IC 95%) | p | HR(IC 95%) | p | HR(IC 95%) | p | HR(IC 95%) | p | |
| Idade | 0,011 | 0,005 | 0,011 | 0,003 | 0,010 | 0,003 | ||||||
| < 65 anos | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| ≥ 65 anos | 1,889 (1,154–3,092) | 2,045(1,246–3,357) | 1,891(1,155–3,095) | 2,001(1,220–3,282) | 1,918(1,172–3,139) | 2,210(1,301–3,753) | ||||||
| Estágio | 0,002 | 0,295 | 0,005 | 0,547 | 0,006 | 0,584 | ||||||
| Inicial | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| Avançado | 2,289(1,360–3,855) | 1,410(0,741–2,684) | 2,112(1,255–3,556) | 1,239(0,618–2,483) | 2,077(1,234–3,496) | 1,215(0,606–2,437) | ||||||
| Invasão da Cartilagem tireoide | < 0,001 | < 0,001 | < 0,001 | < 0,001 | < 0,001 | < 0,001 | ||||||
| Ausente | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| Presente | 3,462(2,092–5,727) | 3,159(1,889–5,281) | 3,119(1,885–5,159) | 2,825(1,691–4,721) | 3,129(1,892–5,175) | 2,803(1,677–4,684) | ||||||
| Metástase linfática | 0,042 | 0,549 | 0,062 | 0,333 | 0,072 | 0,346 | ||||||
| Ausente | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| Presente | 1,730(1,020–2,935) | 1,220(0,636–2,339) | 1,657(0,976–2,813) | 1,349(0,736–2,474) | 1,626(0,958–2,760) | 1,337(0,731–2,445) | ||||||
| NLR | < 0,001 | 0,001 | 0,001 | 0,006 | 0,001 | 0,003 | ||||||
| Baixa | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| Alta | 2,675(1,597–4,483) | 2,396(1,408–4,077) | 2,500(1,492–4,189) | 2,246(1,322–3,816) | 2,498(1,491–4,185) | 2,210(1,301–3,753) | ||||||
| dNLR | 0,163 | 0,302 | 0,238 | 0,272 | 0,235 | 0,271 | ||||||
| Baixa | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | 1 (Referência) | ||||||
| Alta | 1,415(0,868–2,307) | 0,666(0,308–1,440) | 1,342(0,823–2,188) | 0,649(0,300–1,403) | 1,344(0,825–2,191) | 0,648(0,300–1,402) | ||||||
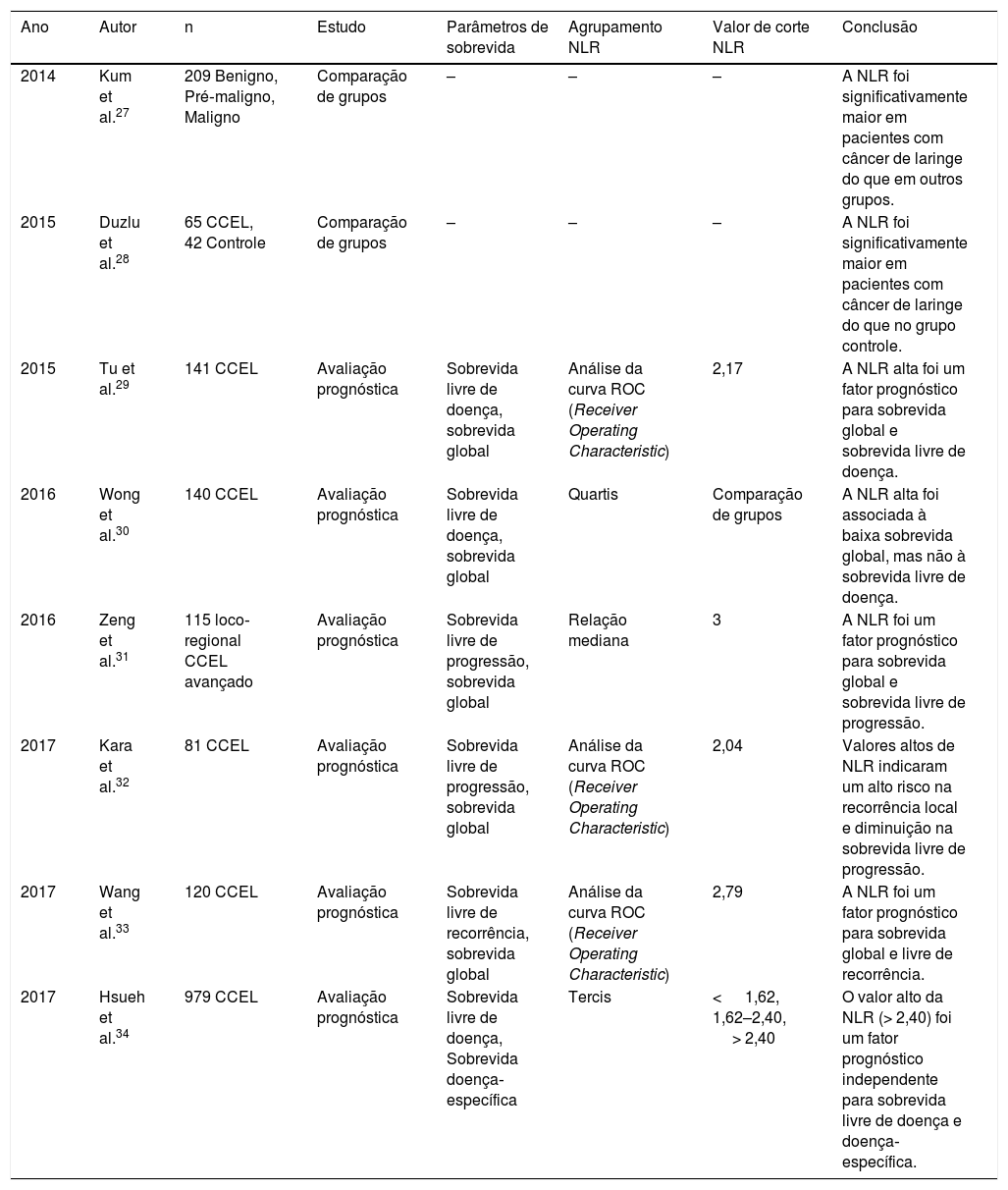
Que seja de nosso conhecimento, este é o primeiro estudo em que o papel diagnóstico, preditivo e prognóstico da NLR e dNLR foi analisado de forma abrangente em pacientes com neoplasias laríngeas. A população do estudo e a duração do seguimento são específicas para determinar a relação entre esses biomarcadores sistêmicos da resposta inflamatória e de neoplasias laríngeas. Nossa pesquisa na literatura mostrou que a relação entre a dNLR e as neoplasias laríngeas ainda não foi avaliada e poucos estudos clínicos avaliaram a correlação entre a NLR e neoplasias laríngeas (tabela 3).27–34 Neste estudo, não houve diferença estatisticamente significante quando comparados pacientes com <65 anos e pacientes com ≥ 65 anos (tabela 1) (fig. 1). Além disso, os valores de NLR e dNLR não foram estatisticamente diferentes entre pacientes do sexo masculino e do sexo feminino (tabela 1) (fig. 1). Portanto, nossos resultados indicaram que tanto a NLR quanto a dNLR não foram afetadas pela idade e sexo, o que é um pré‐requisito para um biomarcador de câncer.
Revisão de estudos clínicos nos quais o papel preditivo e prognóstico da NLR foi avaliado em pacientes com LSCC
| Ano | Autor | n | Estudo | Parâmetros de sobrevida | Agrupamento NLR | Valor de corte NLR | Conclusão |
|---|---|---|---|---|---|---|---|
| 2014 | Kum et al.27 | 209 Benigno, Pré‐maligno, Maligno | Comparação de grupos | – | – | – | A NLR foi significativamente maior em pacientes com câncer de laringe do que em outros grupos. |
| 2015 | Duzlu et al.28 | 65 CCEL, 42 Controle | Comparação de grupos | – | – | – | A NLR foi significativamente maior em pacientes com câncer de laringe do que no grupo controle. |
| 2015 | Tu et al.29 | 141 CCEL | Avaliação prognóstica | Sobrevida livre de doença, sobrevida global | Análise da curva ROC (Receiver Operating Characteristic) | 2,17 | A NLR alta foi um fator prognóstico para sobrevida global e sobrevida livre de doença. |
| 2016 | Wong et al.30 | 140 CCEL | Avaliação prognóstica | Sobrevida livre de doença, sobrevida global | Quartis | Comparação de grupos | A NLR alta foi associada à baixa sobrevida global, mas não à sobrevida livre de doença. |
| 2016 | Zeng et al.31 | 115 loco‐regional CCEL avançado | Avaliação prognóstica | Sobrevida livre de progressão, sobrevida global | Relação mediana | 3 | A NLR foi um fator prognóstico para sobrevida global e sobrevida livre de progressão. |
| 2017 | Kara et al.32 | 81 CCEL | Avaliação prognóstica | Sobrevida livre de progressão, sobrevida global | Análise da curva ROC (Receiver Operating Characteristic) | 2,04 | Valores altos de NLR indicaram um alto risco na recorrência local e diminuição na sobrevida livre de progressão. |
| 2017 | Wang et al.33 | 120 CCEL | Avaliação prognóstica | Sobrevida livre de recorrência, sobrevida global | Análise da curva ROC (Receiver Operating Characteristic) | 2,79 | A NLR foi um fator prognóstico para sobrevida global e livre de recorrência. |
| 2017 | Hsueh et al.34 | 979 CCEL | Avaliação prognóstica | Sobrevida livre de doença, Sobrevida doença‐específica | Tercis | < 1,62, 1,62–2,40, > 2,40 | O valor alto da NLR (> 2,40) foi um fator prognóstico independente para sobrevida livre de doença e doença‐específica. |
Análise da curva ROC (Receiver Operating Characteristic).
Este estudo demonstrou que os valores de NLR e dNLR não foram estatisticamente diferentes entre os pacientes com neoplasias benignas, pré‐malignas e malignas, apesar de terem sido detectados valores altos em pacientes com CL (fig. 1). Em contraste, Kum et al. e Duzlu et al.27,28 relataram uma diferença estatisticamente significativa entre os pacientes com CL e os outros grupos quando comparados os valores de NLR. As populações do estudo podem ser a principal razão para essa diferença. É óbvio que pacientes com CL em estágio avançado apresentavam valores notavelmente altos de NLR e dNLR quando comparados com pacientes com CL em estágio inicial (fig. 1). Ao contrário dos nossos dados, Wong et al.30 relataram valores significantemente maiores de NLR em pacientes com CL em estágio avançado. De fato, pode‐se verificar uma diferença estatisticamente significante quando a população do estudo é composta predominantemente por pacientes com CL em estágio avançado.
Neste estudo, também preferimos valores de corte padronizados a fim de estratificar a população do estudo e aumentar a qualidade da avaliação. Os valores de corte de 4 para NLR e 2 para dNLR foram especificamente selecionados considerando a literatura recente.5,6 Uma revisão sistemática e metanálise, em que o valor de corte 4 foi selecionado, relatou que pacientes com NLR ≥ 4 apresentaram SG ruim em diversos tumores sólidos.5 Além disso, Proctor et al.6 avaliaram o papel prognóstico da NLR e dNLR em vários tipos de câncer, inclusive câncer de cabeça e pescoço, e enfatizaram como limiares ótimos para a NLR e a dNLR os valores 4 e 2, respectivamente. É importante ressaltar que não foi possível demonstrar uma diferença estatisticamente significante entre pacientes com neoplasias benignas, pré‐malignas e malignas, mesmo após a estratificação da população estudada, de acordo com os valores de corte acima mencionados (tabela 1).
Relação neutrófilo‐linfócito e a dNLR foram biomarcadores preditivos para a TCI, ML, estágio N e estágio MEm pacientes com CL, a avaliação dos parâmetros TCI, ML e MD é de extrema importância para a acurácia do estadiamento clínico e seleção de tratamento. Nosso estudo demonstrou que tanto a NLR quanto a dNLR estavam altamente correlacionadas com a TCI, ML, estágio T, estágio N e estágio M (tabela 1) (fig. 1). Da mesma forma, Liu et al.35 determinaram uma relação estatisticamente significante entre o valor da NLR e o tamanho do tumor em pacientes com câncer de tireoide. Em nosso estudo, valores altos da NLR e dNLR também foram detectados em pacientes com CL transglótico e supraglótico quando comparados com CL glótico. De fato, pacientes com tumores transglóticos/supraglóticos geralmente apresentam CL loco‐regionalmente avançado e sobrevida ruim quando comparados aos pacientes com tumores glóticos.36 Portanto, todos os resultados acima mencionados demonstraram que tanto a NLR quanto a dNLR estão provavelmente associadas à extensão do tumor local, da doença regional e a distância e podem indicar a gravidade do câncer de laringe.
A NLR, e não a dNLR, foi um fator prognóstico para a SG de 5 anos, SLD e SLRLRNeste estudo, pacientes com valores altos de NLR (≥ 4) apresentaram um prognóstico ruim (fig. 2A‐C). A análise multivariada também determinou a NLR como um fator prognóstico independente, foi verificado um aumento de mais de duas vezes no risco de mortalidade em pacientes com um valor alto de NLR. Na literatura, apenas alguns poucos estudos clínicos avaliaram o papel prognóstico da NLR em pacientes com CL e todos usaram diferentes valores de corte para estratificação de risco (tabela 3). Neste estudo, os valores de corte de 4 para NLR e 2 para dNLR foram especificamente selecionados devido às razões científicas acima mencionadas. Ao contrário dos nossos dados, Tu et al.29 verificaram que a NLR era um fator prognóstico tanto para a SG quanto para a SLD. Além disso, Zeng et al. detectaram uma relação estatisticamente significante entre um valor alto da NLR e a SLP em pacientes tratados com quimiorradioterapia para carcinoma locorregional de células escamosas de laringe (CCEL) em estágio avançado.31 Curiosamente, Wong et al.30 relataram que um valor alto da NLR estava correlacionado apenas com SG ruim, não com a SLD. Recentemente, Kara et al. relataram que a NLR havia predito recorrência local e diminuição da SLP.31 Além disso, Wang et al.33 e Hsueh et al.34 demonstraram o papel prognóstico da NLR no CL (tabela 3).
Na literatura, o papel prognóstico da dNLR não foi avaliado em pacientes com CL. Em nosso estudo, não foi estabelecida diferença estatisticamente significante nos desfechos oncológicos ao se fazer uma comparação considerando valores altos e baixos da dNLR (fig. 1). Além disso, a análise uni‐ e multivariada demonstrou que o valor alto da dNLR não levou a um aumento no risco de mortalidade (tabela 2). Da mesma forma, Dirican et al.37 determinaram que a NLR, e não a dNLR, foi um fator prognóstico para pacientes com câncer de mama. Além disso, Proctor et al.6 enfatizou que a NLR foi um biomarcador melhor para demonstrar o prognóstico em pacientes com câncer quando comparado com a dNLR.
ConclusõesA relação neutrófilo‐linfócito prevê os resultados oncológicos, em pacientes com CL raras ou pouco comuns, SLD e SG. Como a NLR é facilmente obtida e medida, tem bom custo‐benefício e é estável em relação a idade e sexo, ela pode ser usada rotineiramente como biomarcador prognóstico no CL. Futuros estudos prospectivos com valores de corte padronizados são necessários para a estratificação de risco e determinação do prognóstico e sobrevida no CL.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Eskiizmir G, Uz U, Onur E, Ozyurt B, Karaca Cikrikci G, Sahin N, et al. The evaluation of pretreatment neutrophil–lymphocyte ratio and derived neutrophil–lymphocyte ratio in patients with laryngeal neoplasms. Braz J Otorhinolaryngol. 2019;85:578–87.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.