Endogenous thyroid‐stimulating hormone‐stimulated thyroglobulin collected after total thyroidectomy is a useful predictor of better prognosis in patients with differentiated thyroid carcinomas in general, but studies with microcarcinomas are scarce.
ObjectiveTo assess whether the first postoperative stimulated thyroglobulin measurement is a prognostic factor in patients with microcarcinoma.
MethodsThe medical data of 150 differentiated thyroid carcinoma patients were studied retrospectively, and 54 (36%) cases with microcarcinoma were selected. The first postoperative stimulated thyroglobulin (1st stimulated thyroglobulin), measured after thyroidectomy, initial presentation data, and microcarcinomas treatment were assessed regarding outcome. Worse prognosis was defined as neoplasm persistence/recurrence.
ResultsPersistence/recurrence occurred in 27.8% of the cases. These patients were identified according to the following parameters: receiving more than one 131iodine dose (100% vs. 0%; p<0.0001); accumulated 131iodine dose (232.14±99.09 vs. 144±33.61mCi; p<0.0001); presented active disease in the last assessment (53.3% vs. 0%; p<0.0001); follow‐up time (103.07±61.27 vs. 66.85±70.14 months; p=0.019); and 1st stimulated thyroglobulin (19.01±44.18 vs. 2.19±2.54ng/dL; p<0.0001). After multivariate logistic regression, only the 1stSTg [odds ratio=1.242; 95% confidence interval: 1.022–1.509; p=0.029] and follow‐up time (odds ratio=1.027; 95% confidence interval: 1.007–1.048; p=0.007) were independent predictors of risk of persistence/recurrence. The cutoff point of 1.6ng/dL for the 1st stimulated thyroglobulin was significantly associated with disease persistence/recurrence [area under the curve=0.713 (p=0.019)].
ConclusionThe first stimulated thyroglobulin predicted disease persistence/recurrence in patients with microcarcinoma.
A tireoglobulina estimulada pelo hormônio tireoestimulante endógeno coletada após tireoidectomia total é um preditor útil de melhor prognóstico em pacientes com carcinomas diferenciados de tireoide em geral, mas os estudos com microcarcinomas são escassos.
ObjetivoAvaliar se a primeira medida pós‐operatória de tireoglobulina estimulada é um fator prognóstico em pacientes com microcarcinoma.
MétodoOs dados clínicos de 150 pacientes com carcinoma diferenciado de tireoide foram estudados retrospectivamente e 54 (36%) casos com microcarcinoma foram selecionados. A primeira dosagem de tireoglobulina estimulada (1a TgE) pós‐operatória, medida após a tireoidectomia, os dados da apresentação inicial e tratamento do microcarcinoma foram avaliados quanto ao resultado. O pior prognóstico foi definido como a persistência/recorrência da neoplasia.
ResultadosA persistência/recorrência ocorreu em 27,8% dos casos. Esses pacientes foram identificados de acordo com os seguintes parâmetros: receberam mais de uma dose de iodo131 (100% vs. 0%; p<0,0001); dose acumulada de iodo131 (232,14±99,09 vs. 144±33,61 mCi; p<0,0001); apresentou doença ativa na última avaliação (53,3% vs. 0%; p<0,0001); tempo de seguimento (103,07±61,27 vs. 66,85±70,14 meses; p=0,019); e 1ªTgE (19,01±44,18 vs. 2,19±2,54ng/dL; p<0,0001). Após a regressão logística multivariada, apenas a 1ª TgE [odds ratio=1.242; intervalo de confiança de 95%: 1,022‐1,509; p=0,029] e tempo de seguimento (odds ratio=1,027; intervalo de confiança de 95%: 1,007‐1,048; p=0,007) foram preditores independentes de risco de persistência/recorrência. O ponto de corte de 1,6ng/dL para a 1a TgE foi significativamente associado à persistência/recidiva da doença [área abaixo da curva=0,713 (p=0,019)].
ConclusãoA 1ª dosagem sérica de tireoglobulina estimulada previu a persistência/recorrência da doença em pacientes com microcarcinoma.
A incidência de carcinomas diferenciados de tireoide (CDT) tem crescido significativamente,1 especialmente devido a maior frequência de microcarcinoma de tireoide (MCT).2,3 Embora o MCT esteja geralmente associado a um excelente prognóstico,4 alguns pacientes apresentam tumores mais agressivos, resultando em maiores taxas de persistência/recorrência e doença ativa no seguimento em longo prazo.5 Assim, muitos parâmetros clínicos, histopatológicos e moleculares relacionados a MCT, com complexidades e custos variáveis, foram avaliados na busca de marcadores que possam prever maior agressividade e pior prognóstico.6 No entanto, esses parâmetros variam de um estudo para outro e os fatores associados a pior prognóstico ainda não foram completamente estabelecidos, o que impede o consenso sobre a melhor abordagem de tratamento para o MCT. Tumores maiores, multifocalidade e invasão capsular têm sido associados a metástases linfonodais,7 enquanto a idade mais baixa, multifocalidade, localização subcapsular, extensão extratireoide, fibrose tumoral intraglandular e mutação do gene BRAF foram associadas a maior recorrência.8,9
Nesse contexto, em geral, uma única dosagem sérica de tireoglobulina estimulada (TgE) pelo hormônio tireoestimulante (TSH) após a tireoidectomia total tem sido útil para prever um melhor prognóstico em pacientes com CDT.10 Ainda assim, estudos que avaliam esse parâmetro especificamente em pacientes com MCT são escassos. Este estudo avaliou se a primeira dosagem pós‐operatória de TgE (1a TgE) é um fator prognóstico em pacientes com MCT.
MétodoEste estudo retrospectivo avaliou o curso clínico de pacientes com MCT e comparou a 1a TgE e muitos outros parâmetros clínicos, laboratoriais e terapêuticos de pacientes com e sem persistência/recorrência do tumor após o tratamento inicial. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição na qual foi feito (protocolo n° 4288‐2012).
PacientesOs dados médicos pós‐operatórios tardios de 150 pacientes foram avaliados. Os pacientes eram acompanhados no ambulatório de neoplasias da tireoide de um hospital terciário no Brasil. Cinquenta e quatro (36%) pacientes com MCT submetidos à tireoidectomia total (TT) entre 1994 e 2010 foram selecionados. Esses pacientes não apresentavam outras neoplasias da tireoide, não foram positivos para os anticorpos antitireoglobulina (TgAb), tinham tempo pós‐operatório de pelo menos 24 meses e tomavam levotiroxina.
O protocolo de tratamento/seguimento do serviço em pacientes com CDT no momento em que os casos foram incluídos no estudo consistiu em TT, seguido de pesquisa de corpo inteiro (PCI) e dosagem de tireoglobulina (1aTgE) endógena estimulada por TSH três meses após a TT. Os pacientes receberam então uma dose ablativa/terapêutica de iodo radioativo (DTI) seguida de PCI confirmatória cinco dias depois. Um ano após a DTI, TgE e TSH foram medidos e um ultrassom (USG) de pescoço foi feito. As avaliações clínicas e laboratoriais foram feitas a cada quatro ou seis meses, inclusive a dosagem de TSH sérico, tiroxina livre (FT4), TgAb e tireoglobulina (Tg). A radiografia e USG do pescoço e tórax foram feitas anualmente e outros exames de imagem, [tomografia computadorizada (TC) do tórax, USG abdominal, ressonância magnética (RM) do pescoço e mediastino, nova PCI e tomografia por emissão de pósitrons (PET‐CT)] ou testes cito‐histológicos foram solicitados quando havia suspeita de doença ativa.
Os MCT foram definidos como tumores observados na análise histopatológica com maior diâmetro ≤ 1,0cm e diagnóstico histológico de carcinoma papilífero (CP), carcinoma folicular (CF) ou carcinoma de células de Hürthle.11
Parâmetros do estudoA principal variável de interesse foi a 1a TgE. No entanto, as características gerais dos pacientes, a apresentação inicial da neoplasia, o tratamento e o desfecho da doença também foram avaliados. Os casos com e sem persistência/recorrência de doença foram comparados em relação a esses parâmetros para determinar possíveis preditores do desfecho persistência/recorrência. Os pacientes foram inicialmente caracterizados por sexo, idade no momento da cirurgia, etnia autorrelatada e apresentação inicial da doença, que considerou o seguinte: características e estágio tumorais [risco de recorrência (LATS) e mortalidade (TNM)],12,13 primeira PCI pós‐operatória (a PCI foi considerada positiva se qualquer captação em qualquer segmento foi detectada por cintilografia) e porcentagem de captação de iodo131 (I131). Os aspectos relacionados ao tratamento como esvaziamento cervical durante a TT, número de doses de I131 e dose total acumulada (em mCi) também foram avaliados.
O desfecho da doença foi avaliado principalmente de acordo com a persistência ou recorrência do tumor. Os seguintes itens também foram avaliados: condição do paciente na última avaliação, com ou sem doença ativa; tempo de sobrevida sem doença (em meses); e tempo de acompanhamento (em meses). A persistência ou recorrência da doença foi definida como TgE ≥ 2 ng/mL, ou doença ativa evidenciada por testes de imagem ou biópsia um ano após o tratamento inicial (TT e PCI).14,15 O tumor ativo na última avaliação foi definido como morte causada pelo tumor ou a presença do mesmo critério usado para a definição de persistência ou recorrência.
FT4, TSH e Tg foram determinados por quimiluminescência (DPC, Los Angeles, CA, EUA) no laboratório clínico do Hospital das Clínicas da Faculdade de Medicina de Botucatu. Os valores de referência para FT4 e TSH foram 0,80‐1,90 ng/dL e 0,40‐4,0μUI/mL, respectivamente, enquanto que para Tg foram 0,83‐68,0 ng/mL. As sensibilidades analítica e funcional de Tg foram 0,2 ng/mL e 0,9 ng/mL (para valores superiores a 2 ng/mL), respectivamente.
Análises estatísticasAs variáveis foram submetidas à análise univariada em relação à persistência ou recorrência do tumor. Apenas a idade apresentou distribuição simétrica, por isso foi avaliada pelo teste t de Student. As outras variáveis numéricas (médias ± desvios‐padrão, DP) foram ajustadas pelo modelo linear generalizado com uma distribuição gama (assimétrica). As variáveis qualitativas (porcentagens) foram avaliadas pelo teste exato de Fisher. Posteriormente, a regressão logística multivariada foi feita com as variáveis de análise univariada com p ≤ 0,15. A variável de resposta foi persistência ou recorrência do tumor. As variáveis foram selecionadas pelo método stepwise.
Foi construída uma curva ROC (Receiver‐Operating Characteristics) para a 1a TgE para estabelecer o ponto de corte e determinar a sensibilidade e especificidade do marcador para predizer a persistência ou recorrência do tumor. O nível de significância foi estabelecido em 5% (p < 0,05).
ResultadosA tabela 1 mostra os dados gerais dos pacientes. Cinco pacientes (9,3%) tiveram recorrência e 15 (27,8%) tiveram persistência/recorrência, dos quais oito (53,3%) ainda apresentavam doença ativa na última avaliação clínica. Não ocorreram metástases distantes ou óbitos durante o período de acompanhamento.
Dados clínicos e histopatológicos dos pacientes
| Dados gerais | |
|---|---|
| Sexo feminino, n (%)a | 48 (88,9) |
| Etnia branca autorrelatada, n (%)a | 53 (98,2) |
| Idade (anos)b | 46,30 ± 13,58 |
| Seguimento (meses)b | 76,91 ± 69,19 |
| Tireoidectomia total, n (%)a | |
| Um estágio | 33 (61,1) |
| Dois estágios | 21 (38,9) |
| Esvaziamento linfonodal, n (%)a | 16 (29,6) |
| Subtipos histológicos, n (%)a | |
| Carcinoma papilar | |
| Clássico | 41 (75,9) |
| Variante folicular | 8 (14,8) |
| Esclerosante | 1 (1,8) |
| Mucinoso | 1 (1,8) |
| De células colunares | 1 (1,8) |
| De células oncocíticas | 1 (1,8) |
| Folicular | 1 (1,8) |
| Tamanho do tumor (cm)b | 0,61 ± 0,30 |
| Multifocalidade, n (%)a | 20 (37,0) |
| Bilateralidade, n (%)b | 15 (27,8) |
| Cápsula do tumor, n (%)a | |
| Completa | 13 (24,1) |
| Incompleta | 8 (14,8) |
| Ausente | 33 (61,1) |
| Metástases de linfonodos, n (%)a | 7 (13) |
| Estadiamento TNM, n (%)a | |
| I | 44 (81,5) |
| III | 1 (1,8) |
| IV | 9 (16,7) |
| 1avarredura corporal total positiva, n (%)a | 51 (94,4) |
| 1adosagem de tireoglobulina estimulada (ng/dL)b | 6,72 ± 23,6 |
| Número de doses de iodo131, n (%)a | |
| 0 | 1 (1,9) |
| 1 | 44 (81,5) |
| 2 | 8 (14,8) |
| 3 | 1 (1,9) |
| Captação de iodo131(%)b | 1,51 ± 1,65 |
| Dose cumulativa de iodo131(mCi)b | 167,79 ± 69,84 |
| Recorrência, n (%)a | 5 (9,3) |
| Persistência/recorrência n (%)a | 15 (27,8) |
| Doença ativa na última avaliação médica, n (%)a | 8 (14,8) |
| Sobrevida livre de doença (meses)b | 42,06 ± 65,03 |
%, porcentagem; cm, centímetros; mCi, milicuries; N, número; ng/dL, nanogramas por decilitro; TNM, tumor‐nódulo‐metástases, sistema de estadiamento da American Joint Commission on Cancer (AJCC).13
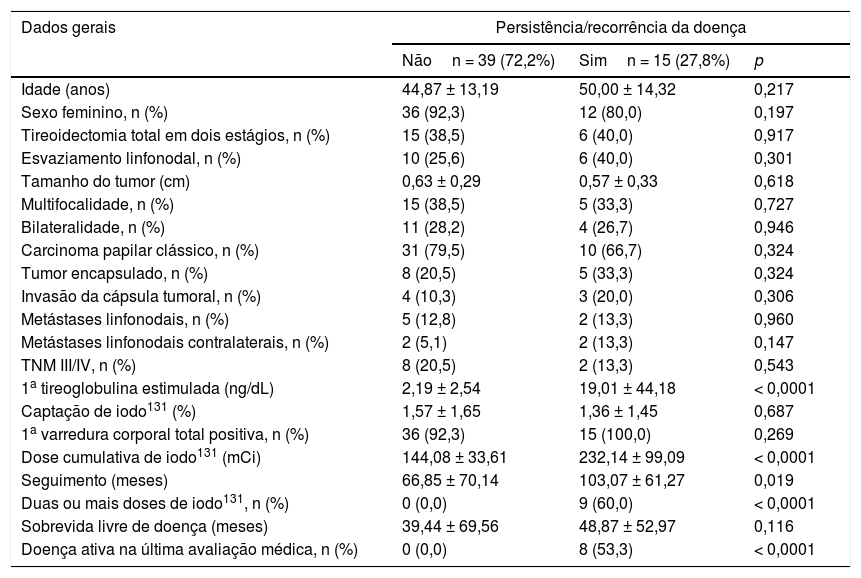
O grupo com persistência/recorrência da doença apresentou maior nível de 1a TgE (p < 0,0001), dose acumulada de I131 (p < 0,0001), tempo de seguimento (p = 0,019), porcentagem de pacientes que receberam duas ou mais doses de I131 (p < 0,0001) e porcentagem de pacientes com doença ativa na última avaliação (p < 0,0001) (tabela 2).
Análise comparativaa dos dados clínicos e histopatológicos entre pacientes com e sem persistência/recorrência de câncer
| Dados gerais | Persistência/recorrência da doença | ||
|---|---|---|---|
| Nãon = 39 (72,2%) | Simn = 15 (27,8%) | p | |
| Idade (anos) | 44,87 ± 13,19 | 50,00 ± 14,32 | 0,217 |
| Sexo feminino, n (%) | 36 (92,3) | 12 (80,0) | 0,197 |
| Tireoidectomia total em dois estágios, n (%) | 15 (38,5) | 6 (40,0) | 0,917 |
| Esvaziamento linfonodal, n (%) | 10 (25,6) | 6 (40,0) | 0,301 |
| Tamanho do tumor (cm) | 0,63 ± 0,29 | 0,57 ± 0,33 | 0,618 |
| Multifocalidade, n (%) | 15 (38,5) | 5 (33,3) | 0,727 |
| Bilateralidade, n (%) | 11 (28,2) | 4 (26,7) | 0,946 |
| Carcinoma papilar clássico, n (%) | 31 (79,5) | 10 (66,7) | 0,324 |
| Tumor encapsulado, n (%) | 8 (20,5) | 5 (33,3) | 0,324 |
| Invasão da cápsula tumoral, n (%) | 4 (10,3) | 3 (20,0) | 0,306 |
| Metástases linfonodais, n (%) | 5 (12,8) | 2 (13,3) | 0,960 |
| Metástases linfonodais contralaterais, n (%) | 2 (5,1) | 2 (13,3) | 0,147 |
| TNM III/IV, n (%) | 8 (20,5) | 2 (13,3) | 0,543 |
| 1a tireoglobulina estimulada (ng/dL) | 2,19 ± 2,54 | 19,01 ± 44,18 | < 0,0001 |
| Captação de iodo131 (%) | 1,57 ± 1,65 | 1,36 ± 1,45 | 0,687 |
| 1a varredura corporal total positiva, n (%) | 36 (92,3) | 15 (100,0) | 0,269 |
| Dose cumulativa de iodo131 (mCi) | 144,08 ± 33,61 | 232,14 ± 99,09 | < 0,0001 |
| Seguimento (meses) | 66,85 ± 70,14 | 103,07 ± 61,27 | 0,019 |
| Duas ou mais doses de iodo131, n (%) | 0 (0,0) | 9 (60,0) | < 0,0001 |
| Sobrevida livre de doença (meses) | 39,44 ± 69,56 | 48,87 ± 52,97 | 0,116 |
| Doença ativa na última avaliação médica, n (%) | 0 (0,0) | 8 (53,3) | < 0,0001 |
%, porcentagem; cm, centímetros; mCi, milicuries; n, número; ng/dL, nanogramas por decilitro.
Análise univariada de variáveis categóricas (n e %; teste exato de Fisher) e numéricas [média ± desvio‐padrão; teste t de Student para idade e ajuste para modelo linear generalizado com distribuição gama (assimetricamente), para as demais variáveis] para a presença de persistência e/ou recorrência de câncer. Significância: p < 0,05. As variáveis com p ≤ 0,15 na análise univariada foram avaliadas posteriormente pela análise multivariada.
Na regressão logística multivariada, a 1aTgE [odds ratio (OR) = 1.242; intervalo de confiança de 95% (IC95%): 1,022‐1,509; p = 0,029] e tempo de seguimento (OR = 1,027; IC 95%: 1,007‐1,048; p = 0,007) foram preditores independentes de risco de persistência/recorrência de CDT.
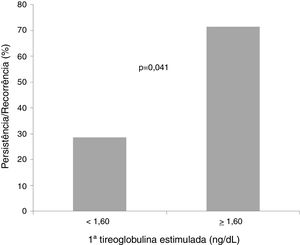
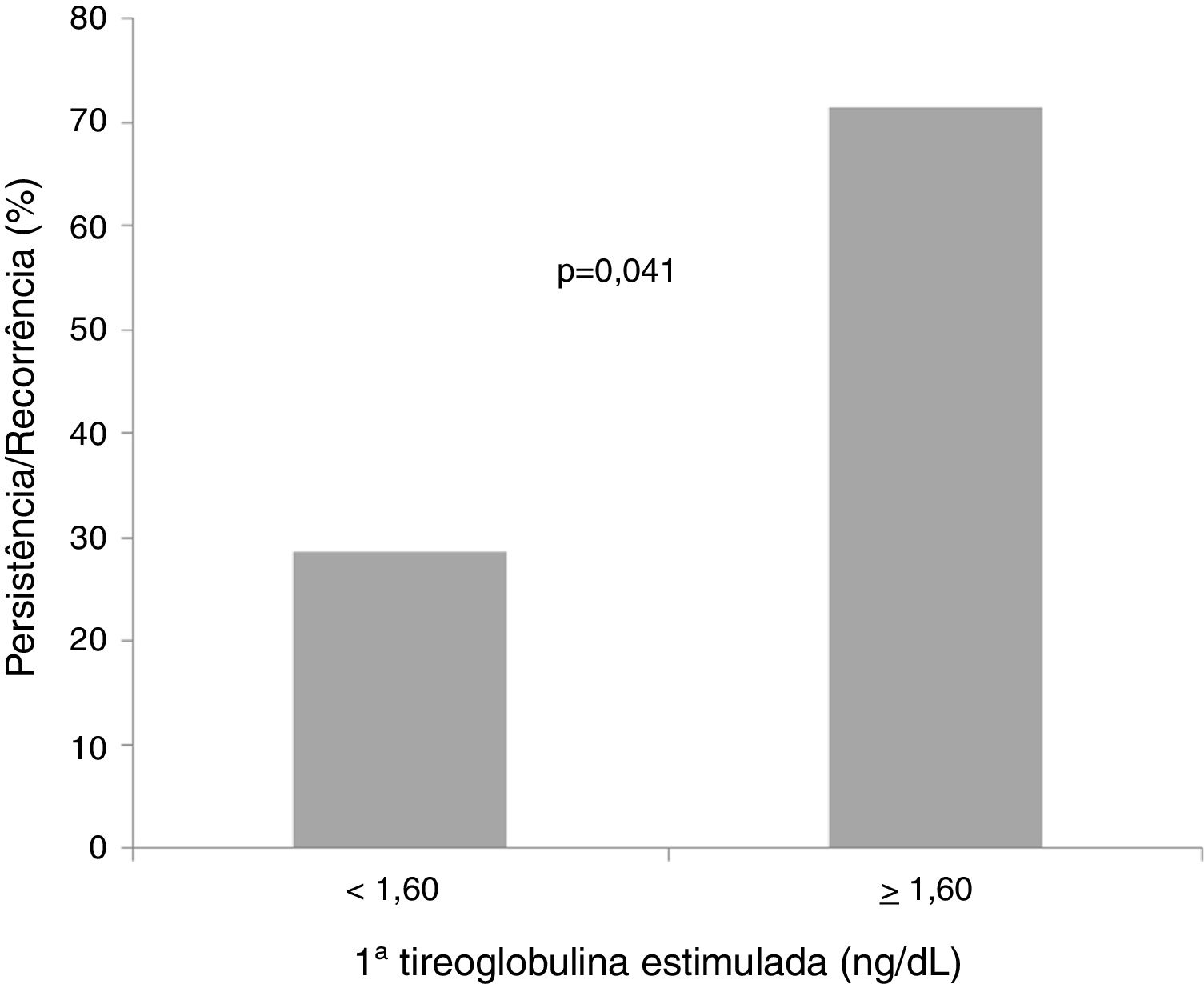
Com base na curva ROC, ponto de corte da 1a TgE de 1,6 ng/dL foi associado a uma sensibilidade de 70% e uma especificidade de 60% (área sob a curva = 0,713; p = 0,019) para a persistência/recorrência do tumor (fig. 1). A maioria dos pacientes (71,4%) com nível de 1ªTgE igual ou superior a 1,6 ng/dL apresentou persistência/recorrência tumoral e a maioria dos casos (60,5%) com nível de TgE abaixo de 1,6 ng/dL não apresentou (fig. 2).
A determinação de TgE no soro após TT e antes da ablação com I131, aqui chamada 1ª TgE, pode ajudar a prever a resposta inicial à terapia e o prognóstico do CDT.10,16,17 No entanto, a maioria dos estudos avalia o CDT em geral e não investiga a 1ª TgE especificamente em pacientes com MCT. Neste estudo observou‐se que 1ª TgE pode ser um preditor independente de persistência/recorrência de carcinoma também para esses tumores. Esse marcador permaneceu significativo mesmo quando avaliado em conjunto com outros parâmetros frequentemente associados com o prognóstico de MCT.8,9,18–20
Um tópico importante a ser discutido é o ponto de corte ideal da 1ª TgE para o prognóstico. Para os CDT em geral, os níveis entre 20 e 30 ng/mL foram associados com maior sensibilidade e especificidade para prever a persistência/recorrência da doença, enquanto os níveis < 1‐2 ng/mL seriam fortes preditores de remissão.4 Em uma metanálise recente com quase 4.000 pacientes, Webb et al. encontraram um alto valor preditivo negativo para o estado livre de doença quando a Tg sérica pré‐ablação foi inferior a 10 ng/mL.10 No entanto, os níveis exatos de Tg necessários para estabelecer o prognóstico de CDT em geral ou MCT não foram estabelecidos, pois dependem de muitos fatores, como o nível de TSH,16 sensibilidade do ensaio e quantidade de tecido residual, entre outros.4 O ponto de corte encontrado pelo presente estudo para MCT (1,6 ng/dL) foi muito menor do que os pontos de corte mencionados anteriormente, com 70% de sensibilidade e 60% de especificidade para prever persistência/recorrência da doença. Esse achado pode ser explicado de muitas maneiras. Primeiro, considerando que todos os pacientes do estudo foram submetidos à TT e a captação de I131 após a cirurgia e antes da ablação foi relativamente baixa, inferimos que o tecido cervical remanescente deve ter sido pouco, o que poderia, pelo menos parcialmente, explicar os pontos de corte mais baixos. Além disso, apesar da Tg atingir seu ponto mais baixo cerca de três a quatro semanas após a TT,4 ela poderia ter continuado a diminuir após este período inicial.15 Assim, uma vez que avaliamos a TgE cerca de três meses após a cirurgia, esse intervalo mais longo poderia ter contribuído para os pontos de corte mais baixos.
Embora a taxa de recorrência do MCT não seja alta, especialmente em pacientes submetidos a TT,21 ela não é insignificante. Neste estudo, as taxas de persistência/recorrência da doença e doença ativa na última avaliação foram quase 30% e 15%, respectivamente. Portanto, acreditamos que a abordagem terapêutica deve ser individualizada e que a TgE pode ser um dos parâmetros incluídos nessa individualização. Com base nos resultados deste estudo, em pacientes com TgAb negativo, o nível de TgE abaixo de 2 ng/dL, medido nos três primeiros meses após a TT e antes da eventual dose terapêutica de I131, indica um bom prognóstico em pacientes com MCT.
As limitações deste estudo poderiam ter influenciado os resultados e incluem: seu caráter retrospectivo, o tamanho amostral modesto, os vários subtipos histológicos incluídos (alguns com pior prognóstico), a incapacidade de classificar os casos de acordo com a apresentação inicial da doença (MCT incidental ou não incidental)22,23 e o tratamento inicial dos pacientes (tireoidectomia total e dose terapêutica de I131), que atualmente não tem sido indicado para MCT.4 No entanto, o mérito deste estudo é revelar a importância de medir a TgE após tireoidectomia para estabelecer o prognóstico do MCT.
ConclusãoA primeira medida pós‐operatória da TgE foi capaz de prever persistência/recorrência de MCT. Outros estudos com amostras maiores e diferentes desenhos são necessários para confirmar esses resultados.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Amui IO, Tagliarini JV, Castilho EC, Marques MA, Kiy Y, Corrente JE, et al. The first postoperative‐stimulated serum thyroglobulin is a prognostic factor for thyroid microcarcinomas. Braz J Otorhinolaryngol. 2019;85:37–42.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.



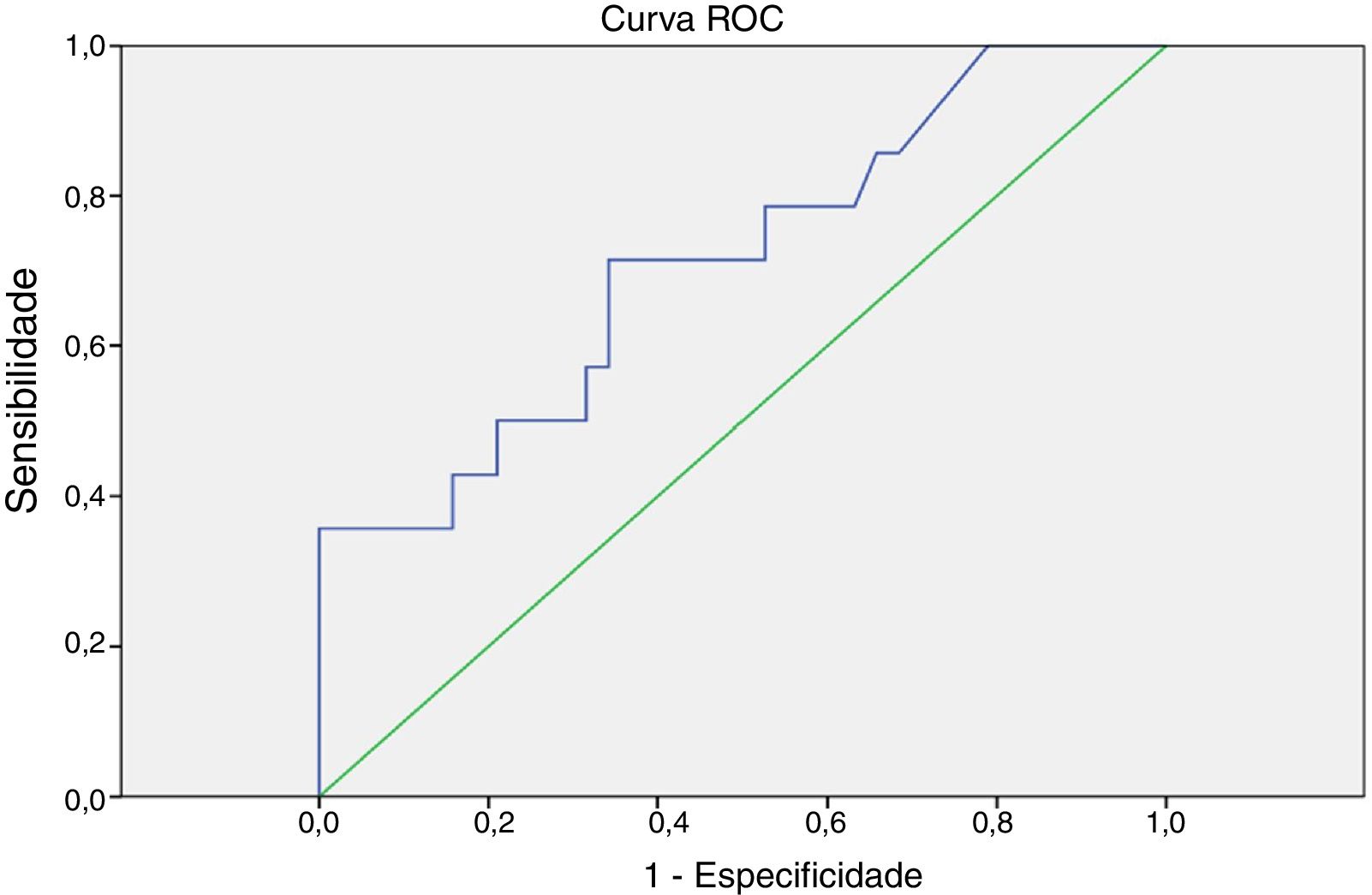

![Curva ROC (Receiver Operating Characteristic curve) da primeira tireoglobulina estimulada [ponto de corte = 1,6 ng/dL (área sob a curva: 0,713; p = 0,019)] como preditor de persistência/recorrência do câncer. Curva ROC (Receiver Operating Characteristic curve) da primeira tireoglobulina estimulada [ponto de corte = 1,6 ng/dL (área sob a curva: 0,713; p = 0,019)] como preditor de persistência/recorrência do câncer.](https://static.elsevier.es/multimedia/25300539/0000008500000001/v1_201901020612/S2530053918300075/v1_201901020612/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/7hLX2FbBoxC1192i158SI=)