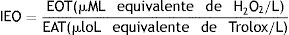Cisplatin is one of the main chemotherapeutic agents used for the treatment of many types of cancer. However, ototoxicity, one of the most serious side effects of cisplatin, restricts its usage.
ObjectiveWe aimed to investigate the protective effects of whortleberry extract against cisplatin‐induced ototoxicity by evaluating hearing and histopathological cochlear damage and by measuring the biochemical parameters affected byoxidative stress.
MethodsForty‐eight male rats were included in the study after performing Distortion Product Otoacoustic Emission test to confirm that their hearing levels were normal. The rats were randomly divided into six groups: the control group, the sham group, and, which received only whortleberry extract, only cisplatin, cisplatin+100mg whortleberry extract, cisplatin+200mg whortleberry extract, respectively. Audiologic investigation was performed by performing the Distortion Product Otoacoustic Emission test at the beginning and at the eighth day of the study. Cardiac blood samples were collected for biochemical analysis, and the rats were sacrificed to obtain cochlear histopathological specimens on the eighth day.
ResultsThe results revealed that whortleberry protects hearing against cisplatin‐induced ototoxicity independent of the dose. However, high doses of whortleberry extract are needed to prevent histopathological degeneration and oxidative stress.
ConclusionThe results obtained in this study show that whortleberry extract has a protective effect against cisplatin‐induced ototoxicity.
A cisplatina é um dos principais agentes quimioterápicos utilizados para o tratamento de muitos tipos de câncer. No entanto, a ototoxicidade, um dos efeitos colaterais mais graves da cisplatina, restringe seu uso.
ObjetivoNosso objetivo foi investigar os efeitos protetores do extrato de uva‐do‐monte contra a ototoxicidade induzida por cisplatina, avaliar o dano auditivo e histopatológico coclear e medir os parâmetros bioquímicos afetados pelo estresse oxidativo.
MétodoForam incluídos no estudo 48 ratos machos após teste de emissão otoacústica evocada por produto de distorção para confirmar que seus níveis de audição eram normais. Os ratos foram divididos aleatoriamente em seis grupos: o grupo controle, o grupo simulado, o que recebeu apenas extrato de uva‐do‐monte, o que recebeu apenas cisplatina, o que recebeu cisplatina+100mg de extrato de uva‐do‐monte e o que recebeu cisplatina+200mg de extrato de uva‐do‐monte, respectivamente. A investigação audiológica foi feita através do teste de emissão otoacústica de produto de distorção no início e no oitavo dia do estudo. As amostras de sangue cardíaco foram coletadas para análise bioquímica e os ratos foram sacrificados para obtenção de espécimes histopatológicos cocleares no oitavo dia.
ResultadosOs resultados revelaram que o extrato de uva‐do‐monte protege a audição contra a ototoxicidade induzida por cisplatina, independentemente da dose. No entanto, são necessárias doses elevadas do extrato para evitar a degeneração histopatológica e o estresse oxidativo.
ConclusãoOs resultados obtidos neste estudo mostram que o extrato de uva‐do‐monte tem um efeito protetor contra a ototoxicidade induzida por cisplatina.
A cisplatina é um agente quimioterápico frequentemente usado no tratamento de vários tipos de câncer. Os efeitos colaterais, como ototoxicidade, neurotoxicidade e nefrotoxicidade, são os efeitos colaterais limitantes da dose de cisplatina. Embora a nefrotoxicidade possa ser evitada através do aumento da hidratação e diurese, ainda não existe tratamento preventivo ou curativo para a ototoxicidade. Estudos anteriores mostraram uma pioria dos limiares auditivos em 75%‐100% dos pacientes que receberam cisplatina. Esse efeito colateral foi mais comum na faixa etária pediátrica.1,2
Os mecanismos celulares e moleculares da ototoxicidade induzida por cisplatina ainda não foram totalmente elucidados. Presume‐se que a cisplatina tenha efeitos destrutivos, especialmente nas células ciliadas externas, que resultam da produção excessiva de radicais livres de oxigênio na cóclea.3,4 Acredita‐se que o principal efeito citotóxico da cisplatina ocorre através do complexo cisplatina mono‐hidratada, que reage com o DNA nuclear. Devido à estreita associação da citotoxicidade com radicais de oxigênio, há muitos anos a pesquisa de tratamento tem se concentrado em antioxidantes.5,6
Embora o extrato de mirtilo tenha demonstrado um amplo espectro de efeitos fisiológicos, como melhoria visual, efeitos antineoplásicos, efeitos neuroprotetivos e efeitos anti‐inflamatórios, seus efeitos contra ototoxicidade são desconhecidos em experimentos em ratos. Acredita‐se que esses efeitos tenham ocorrido devido aos altos níveis de antocianinas em mirtilos.7,8 A uva‐do‐monte (Vaccinium myrtillus), que é uma espécie de mirtilo, pertence a um grupo de substâncias potencialmente promissoras.9
O objetivo deste estudo foi investigar os efeitos protetores do extrato de uva‐do‐monte contra a ototoxicidade induzida por cisplatina, avaliar a audição e o dano coclear histopatológico e medir os parâmetros bioquímicos afetados pelo estresse oxidativo.
MétodoO estudo foi aprovado pelo Comitê de Ética Institucional para Experimentos em Animais (n° 2015/19). Os ratos usados no estudo foram obtidos a partir da unidade de prática experimental de nossa instituição e o estudo foi feito nessa unidade. Este trabalho foi financiado pela nossa Unidade de Projeto de Pesquisa Científica da Universidade sob o número 2.015/9.
Protocolo do estudoForam incluídos no estudo 48 ratos machos Wistar albinos adultos com peso de 250g a 280g após teste de emissão otoacústica evocada por produto de distorção (EOAPD) para confirmar a normalidade de sua audição. Todos os procedimentos de intervenção foram feitos sob anestesia, que foi induzida com 50mg/kg de cloridrato de cetamina aplicado intraperitonealmente (Ketalar®, Eczacıbaşı Parke‐Davis, Istambul, Turquia) e 10 mg/kg de cloridrato de xilazina (Alfazyne®, Alfasan International B.V., Woerden, Holanda). As temperaturas retais dos ratos foram medidas regularmente enquanto os ratos estavam sob anestesia e cobertas aquecidas que mantinham as temperaturas corporais dos ratos a cerca de 35°C foram colocadas sobre eles. Os ratos com valores de razão sinal‐ruído (RSR) de 3dB ou mais em três das cinco frequências avaliadas no teste de EOAPD foram considerados com um nível auditivo normal. Durante o estudo, os ratos foram mantidos na unidade experimental animal, com 12h de luz e 12h de escuridão a cada dia, a uma temperatura ambiente de 22° ± 3°C e umidade de 55% a 60%. Permitiu‐se aos animais consumir alimentos e água da torneira ad libitum. Em todas as etapas do estudo, o meato acústico externo e as membranas timpânicas dos ratos foram examinados otoscopicamente para excluir outros fatores que poderiam influenciar os resultados do teste, como cerume, sinais de infecção ou perfuração da membrana timpânica.
Os ratos foram divididos aleatoriamente em seis grupos de oito animais. As investigações auditivas foram feitas através de um teste EOAPD no início e no oitavo dia do estudo. Os grupos de estudo foram tratados da seguinte forma: o primeiro grupo (grupo controle, n = 8) não foi exposto a intervenção, exceto ao teste de EOAPD. O segundo grupo (grupo simulado, n = 8) recebeu solvente intraperitoneal (i.p.) (água destilada + metanol) durante oito dias. O terceiro grupo (grupo controle de uva‐do‐monte, n = 8) recebeu extrato de uva‐do‐monte i.p. (100mg/kg) por oito dias. O quarto grupo (grupo cisplatina, n = 8) recebeu uma dose única de cisplatina i.p. 16mg/kg (cisplatina DBL 100mg/flaconete de 100mL, Orna İlaç, Istambul) no quinto dia. O quinto grupo (grupo cisplatina + 100mg/kg de uva‐do‐monte, n = 8) recebeu extrato de uva‐do‐monte i.p. (100mg/kg) durante oito dias e uma dose única de 16mg/kg de cisplatina i.p. no quinto dia. O sexto grupo (grupo cisplatina + 200mg/kg de uva‐do‐monte, n = 8) recebeu i.p. extrato de uva‐do‐monte (200mg/kg) durante oito dias e uma dose única de 16mg/kg de cisplatina i.p. no quinto dia.
Preparação do extrato de uva‐do‐monteO extrato de uva‐do‐monte (Vaccinium myrtillus Herbal Liquids, Health Aid, Inglaterra) com uma mistura de 50% de água semidestilada e 50% de etanol com 330mg/mL de extrato de uva‐do‐monte foi usado como um produto de apoio nutricional. O produto foi extradiluído em condições estéreis com uma mistura de água semidestilada e etanol para atingir uma concentração de uva‐do‐monte de 50mg/mL.
Medida da EOAPDO registro do EOAPD foi feito com ‐se um conjunto Echoport ILO292‐II (Otodynamics, Hatfield, Inglaterra) configurado para o modo EOAPD em uma sala silenciosa. Depois de manter a cabeça de cada rato na posição horizontal, uma sonda pediátrica foi anexada ao meato acústico externo dos animais. As medições foram obtidas depois de confirmar que o dispositivo estava na posição de medição adequada com a configuração apropriada do indicador da sonda e da forma de onda do estímulo. A razão entre as frequências f2 e f1 (f2/f1) foi mantida em 1,22. A intensidade do estímulo foi tomada como L1 para a frequência f1 e como L2 para a frequência f2. A diferença entre os níveis de L1 e L2 foi mantida em 10 Db NPS (nível de pressão sonora) (L1 = 65dB NPS, L2 = 55dB NPS). Os resultados foram mostrados na média geométrica dos tons primários (f1 e f2). As emissões otoacústicas foram criadas com dois alto‐falantes diferentes para os dois estímulos (f1 e f2) no meato acústico externo. Os EOAPDs foram medidos na frequência 2f1‐f2 com um microfone no meato acústico externo. As emissões otoacústicas resultantes foram registradas com a média geométrica de f1 e f2 em 2000, 3000, 4000, 6000 e 8000Hz. A duração do teste foi de cerca de 60 segundos. Os valores das amplitudes de EOAPD que estavam 3dB acima do limiar de ruído foram considerados significativos. As curvas de frequência SNR foram obtidas. Os valores da razão sinal‐ruído (RSR) de todos os grupos obtidos durante o teste EOAPD foram comparados intra e entre grupos.
Avaliação bioquímicaForam coletadas amostras de sangue cardíaco de todos os grupos enquanto os animais estavam sob anestesia no fim do estudo. Após a centrifugação dessas amostras a 3.500rpm durante cinco minutos, os níveis do estado antioxidante total (EAT) e do estresse oxidativo total (EOT) das amostras foram medidos com um autoanalisador (Abbott C16000, Abbott Diagnostics, Abbott Park, IL, EUA) com o uso dos kits Rel Assay Total Antioxidant Status e Total Oxidant Stress Test (Mega Tıp, Gaziantep, Turquia) no laboratório de bioquímica de nossa instituição.
O método de medição do EAT baseou‐se no princípio de que a cor do radical catiônico colorido ácido 2,2’‐azino‐bis (3‐etilbenzotiazolina‐6‐sulfônico) (ABTS) é perdida como resultado da redução de ABTS em proporção à concentração total de moléculas antioxidantes. Os resultados das medições foram expressos como mmol equivalente de Trolox/L.10
Na medida do nível de oxidante total, usou‐se o método colorimétrico, que se baseou no princípio da oxidação cumulativa do íon ferroso para o íon férrico pelas moléculas oxidantes.11
O índice de estresse oxidativo (IEO) foi calculado com a fórmula:
Avaliação histopatológicaTodos os animais foram sacrificados para avaliação histopatológica após o último teste de EOAPD e coleta de amostras de sangue. O osso temporal foi dissecado e a bula foi aberta. A parede lateral da cóclea foi removida e a cóclea foi fixada com uma solução de 2,5% de glutaraldeído após uma injeção lenta. Os ossos temporais foram mantidos na mesma solução a +4°C durante a noite. Após a fixação, os ossos temporais foram colocados em uma solução de 10% de EDTA a + 4°C durante dez dias para descalcificação. Após esse procedimento, os espécimes cocleares foram desidratados com etanol e embebidos em blocos de parafina. Em seguida, foram preparados cortes com uma espessura de 5μm e corados com hematoxilina‐eosina. Pelo menos 15 amostras de cada cóclea foram examinadas de cada rato. Sinais de degeneração, como dilatação, células apoptóticas, degeneração celular, degeneração nervosa e vacuolização citoplasmática, foram analisados separadamente por um histopatologista cegado para as informações dos grupos. Cada rato foi classificado em uma escala de cinco pontos que variou de 0 a 4 para sinais de degeneração (0: normal, 1: leve, 2: moderado, 3: moderado a grave e 4: grave).
Análise estatísticaOs dados foram analisados com o software SPSS, versão 15.0 para Windows (SPSS Inc., Chicago, IL, EUA). Os resultados foram apresentados como médias ± erro‐padrão de medida. Todos os dados foram analisados por teste de análise de variância (Anova) com um fator e teste de Bonferroni (post‐hoc). Um valor de p < 0,05 foi considerado como indicativo de uma diferença significante.
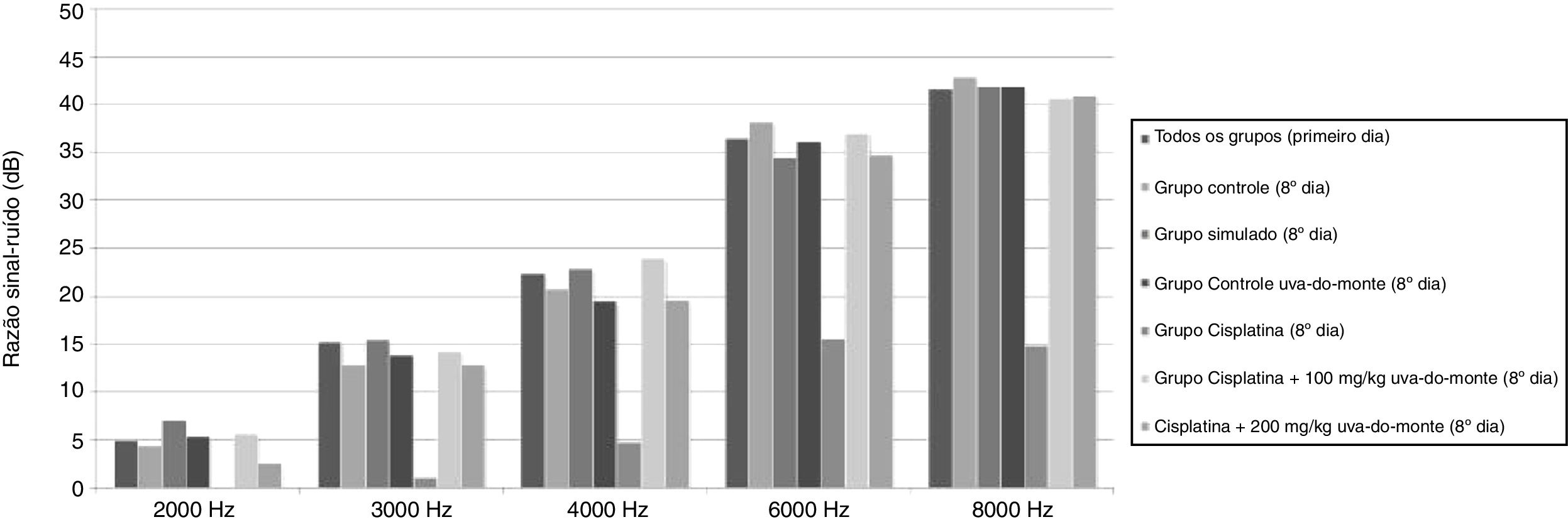
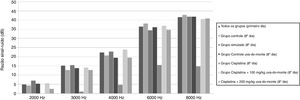
ResultadosResultados do teste de EOAPDO teste de EOAPD foi feito nos animais de todos os grupos antes do início do estudo e os valores basais da RSR foram obtidos em cada frequência. No oitavo dia do estudo, um teste de EOAPD foi feito novamente e os valores da RSR foram registrados. Os valores da RSR obtidos para 2000, 3000, 4000, 6000 e 8000Hz no início e no fim do estudo foram comparados intra e entre grupos. Não houve diferença significante entre os grupos nas medidas do teste de EOAPD feitas no primeiro dia (p > 0,05). No entanto, em comparação com o primeiro teste, os valores da RSR do grupo cisplatina foram significantemente menores em todas as frequências no oitavo dia (p < 0,01). Da mesma forma, os valores da RSR do grupo cisplatina foram inferiores aos dos outros grupos em todas as frequências no oitavo dia (p < 0,015 para 2000, 3000 e 4000Hz, p < 0,001 para 6000 e 8000Hz).
Não houve diminuição significante nos valores de RSR no oitavo dia nos grupos que receberam cisplatina com extrato de uva‐do‐monte (p > 0,05). Esses resultados mostram que o extrato de uva‐do‐monte tem um efeito protetor contra a ototoxicidade induzida por cisplatina. No entanto, não houve diferença significante entre os grupos tratados com cisplatina + 100mg/kg de extrato de uva‐do‐monte e cisplatina + 200mg/kg de extrato de uva‐do‐monte em termos de proteção auditiva (p > 0,05).
Os valores médios da RSR em todos os grupos no primeiro dia e os valores da RSR médios de acordo com cada grupo no oitavo dia são apresentados na figura 1.
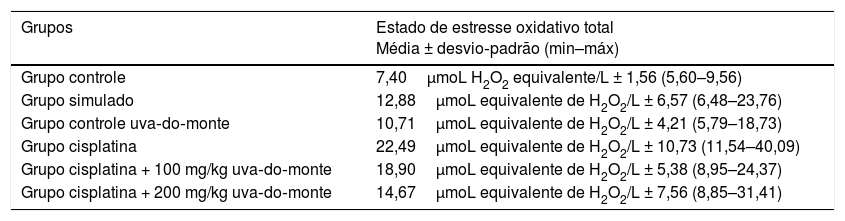
Resultados da análise bioquímicaOs valores de EAT obtidos a partir da avaliação bioquímica estão resumidos na tabela 1. De acordo com os dados obtidos, os valores de EAT no grupo de controle com uva‐do‐monte (p < 0,001) e no grupo cisplatina + 200mg de uva‐do‐monte (p = 0,002) foram significantemente maiores do que os do grupo controle. Não houve diferença significante entre os outros grupos e o grupo controle.
Valores de estado antioxidante total de acordo com os grupos
| Grupos | Estado antioxidante total Média ± desvio‐padrão (min–máx) |
|---|---|
| Grupo controle | 1,12 mmol equivalente de Trolox/L ± 0,10 (0,96–1,60) |
| Grupo simulado | 1,11 mmol equivalente de Trolox/L ± 0,11 (0,98–1,27) |
| Grupo controle uva‐do‐monte | 1,45 mmol equivalente de Trolox/L ± 0,16 (1,12–1,60) |
| Grupo cisplatina | 1,04 mmol equivalente de Trolox/L ± 0,05 (0,97–1,11) |
| Grupo cisplatina + 100 mg/kg uva‐do‐monte | 1,21 mmol equivalente de Trolox/L ± 0,12 (1,01–1,36) |
| Grupo cisplatina + 200 mg/kg uva‐do‐monte | 1,34 mmol equivalente de Trolox/L ± 0,03 (1,27–1,38) |
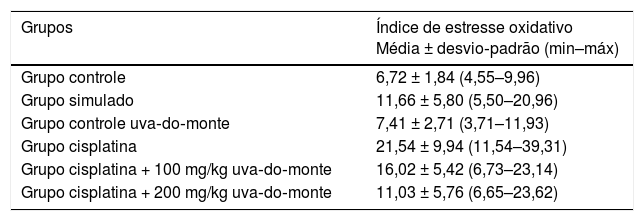
Os dados do EOT dos grupos estão resumidos na tabela 2. Os valores de EOT do grupo cisplatina (p = 0,001) e o grupo cisplatina + 100mg de uva‐do‐monte (p = 0,015) foram significantemente maiores do que os do grupo controle (p < 0,05). Não houve diferença significante entre os demais grupos e o grupo controle (p > 0,05).
Valores de estresse oxidativo total de acordo com os grupos
| Grupos | Estado de estresse oxidativo total Média ± desvio‐padrão (min–máx) |
|---|---|
| Grupo controle | 7,40μmoL H2O2 equivalente/L ± 1,56 (5,60–9,56) |
| Grupo simulado | 12,88μmoL equivalente de H2O2/L ± 6,57 (6,48–23,76) |
| Grupo controle uva‐do‐monte | 10,71μmoL equivalente de H2O2/L ± 4,21 (5,79–18,73) |
| Grupo cisplatina | 22,49μmoL equivalente de H2O2/L ± 10,73 (11,54–40,09) |
| Grupo cisplatina + 100 mg/kg uva‐do‐monte | 18,90μmoL equivalente de H2O2/L ± 5,38 (8,95–24,37) |
| Grupo cisplatina + 200 mg/kg uva‐do‐monte | 14,67μmoL equivalente de H2O2/L ± 7,56 (8,85–31,41) |
Os valores calculados do IEO dos grupos estão resumidos na tabela 3. O valor do IEO do grupo cisplatina (p < 0,001) e do grupo cisplatina + 100mg de uva‐do‐monte (p = 0,031) foram significantemente maiores do que os do grupo controle. Não houve diferença significante entre os demais grupos e o grupo controle (p > 0,05).
Valores do índice de estresse oxidativo de acordo com os grupos
| Grupos | Índice de estresse oxidativo Média ± desvio‐padrão (min–máx) |
|---|---|
| Grupo controle | 6,72 ± 1,84 (4,55–9,96) |
| Grupo simulado | 11,66 ± 5,80 (5,50–20,96) |
| Grupo controle uva‐do‐monte | 7,41 ± 2,71 (3,71–11,93) |
| Grupo cisplatina | 21,54 ± 9,94 (11,54–39,31) |
| Grupo cisplatina + 100 mg/kg uva‐do‐monte | 16,02 ± 5,42 (6,73–23,14) |
| Grupo cisplatina + 200 mg/kg uva‐do‐monte | 11,03 ± 5,76 (6,65–23,62) |
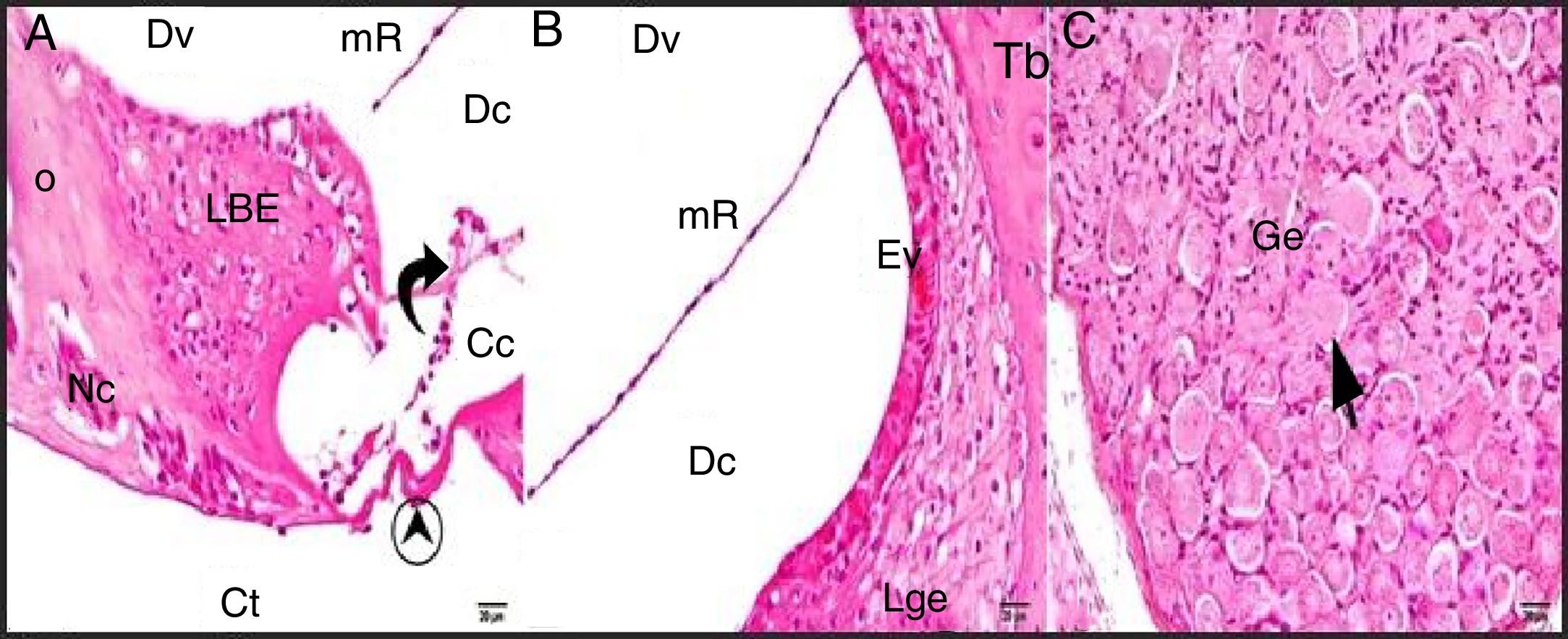
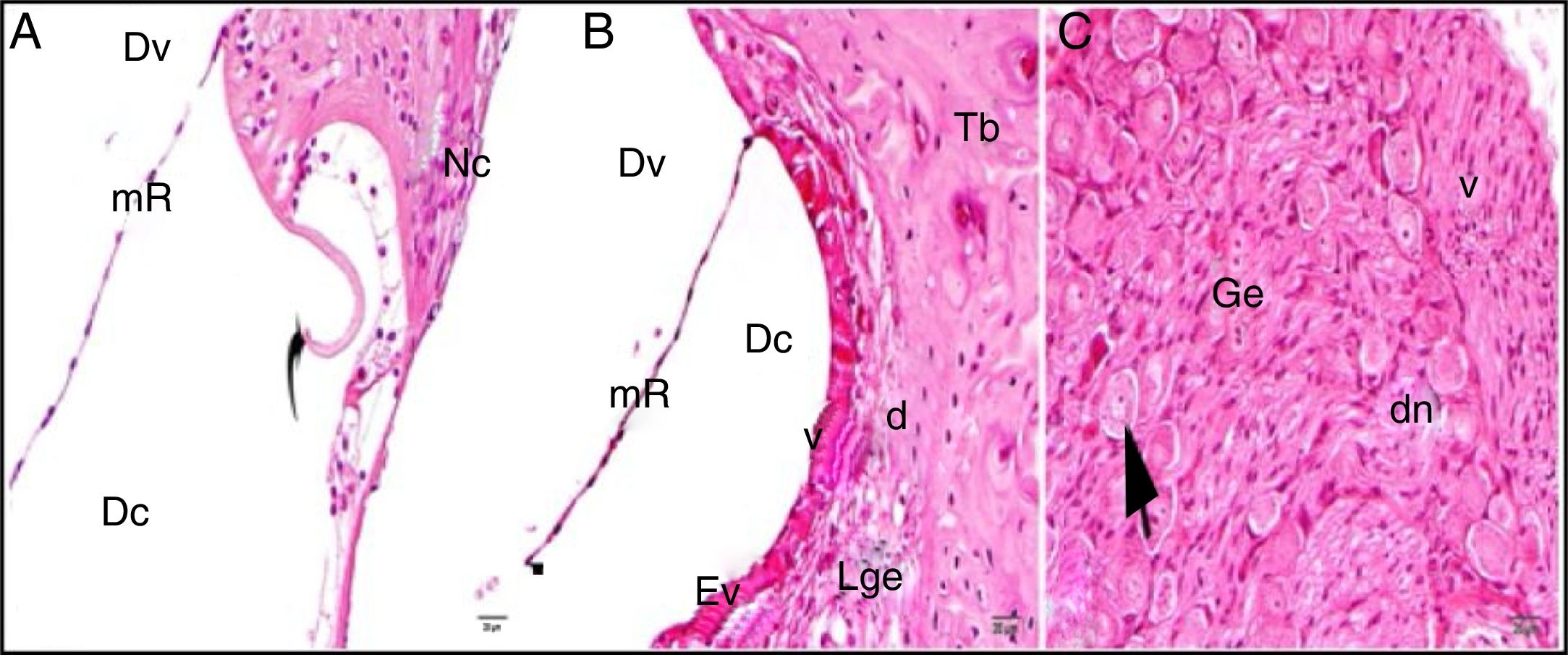
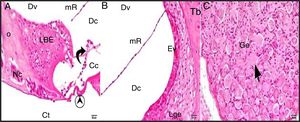
A estrutura geral do grupo controle mostrou achados histológicos normais na avaliação em microscópio ótico (fig. 2A‐C).
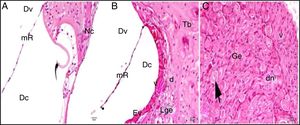
Grupo de controle: LBE, limbus espiral; o, osso; mR, membrana de Reissner; Dv, duto vestibular; Dc, duto coclear; Ct, canal timpânico; ponta de flecha redonda, membrana basilar; flecha curva, membrana tectorial; Cc, célula ciliada interna; Nc, nervo coclear; Ev, estria vascular; Lge, ligamento espiral; Ge, gânglio espiral; seta preta, células ganglionares espirais (coloração hematoxilina eosina, × 40).
Os grupos controle simulado e uva‐do‐monte também mostraram estruturas histológicas normais ao exame com microscópico ótico. Não foram identificados efeitos positivos ou negativos nas estruturas celulares e na morfologia.
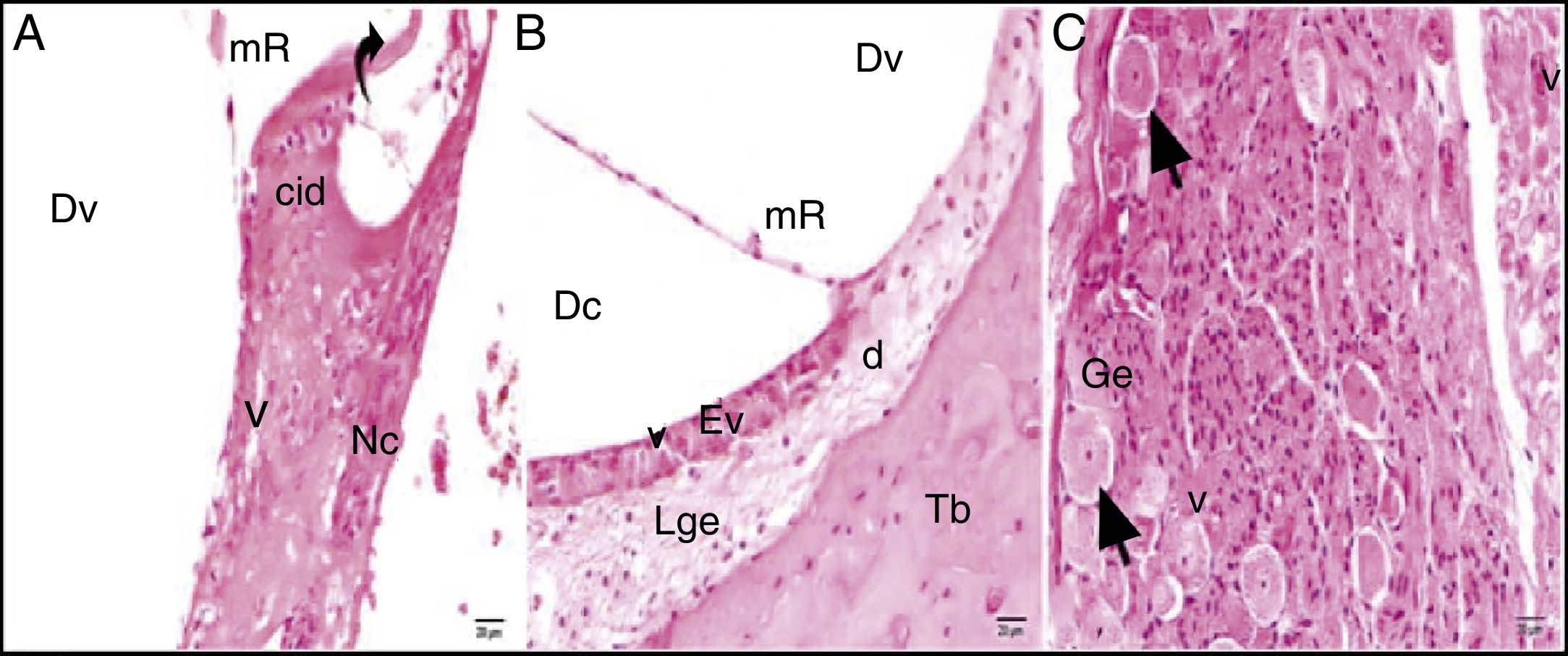
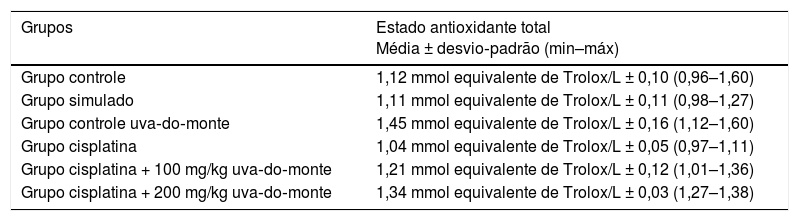
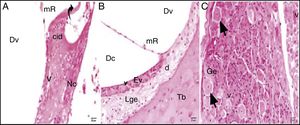
A avaliação por microscopia ótica do grupo cisplatina revelou que a estrutura geral do tecido se deteriorou. Foram observados aumento da vacuolização citoplasmática e separação celular degenerativa. Embora o órgão de Corti tenha mantido sua integridade, a extensão e o corpo celular das células ciliadas internas e externas mostraram edema local e separação degenerativa.
Os núcleos das células mostraram‐se ligeiramente acidófilos e seu citoplasma mostrou vacuolização. A membrana tectorial estava engrossada, com morfologia normal, enquanto a membrana de Reissner mostrou células com edema e separação celular. Embora os núcleos das células de suporte fossem ligeiramente basofílicos, uma pequena quantidade de vacuolização foi observada em seu citoplasma. A vacuolização na região do limbo espiral mostrou as separações como dilatação (fig. 3A). As células que formam a estria vascular e o ligamento espiral eram patológicas em comparação com o grupo controle em termos de matriz e aparência do núcleo. Foram detectadas dilatações e perda de núcleo devido à degeneração celular. O aumento da vacuolização e algum grau de degeneração das células foram observados na estria vascular e no ligamento espiral. Havia células dilatadas no limbo espiral e elas eram intensamente acidófilas (fig. 3B). O gânglio espiral e as fibras nervosas cocleares estavam um pouco degenerados. Foram identificados um aumento da vacuolização e degeneração axonal. A deformação dos corpos celulares foi observada em neurônios pseudounipolares com uma pequena quantidade de vacuolização (fig. 3C).
Grupo cisplatina: mR, membrana de Reissner; Dv, duto vestibular; Dc, duto coclear; ponta da flecha curva, membrana basilar; d, degeneração e dilatação; v, vacuolização; seta curva, membrana tectorial; Nc, nervo coclear; Ev, estria vascular; Lge, ligamento espiral; Ge, gânglio espiral; seta preta, células ganglionares espirais (coloração hematoxilina eosina, × 40).
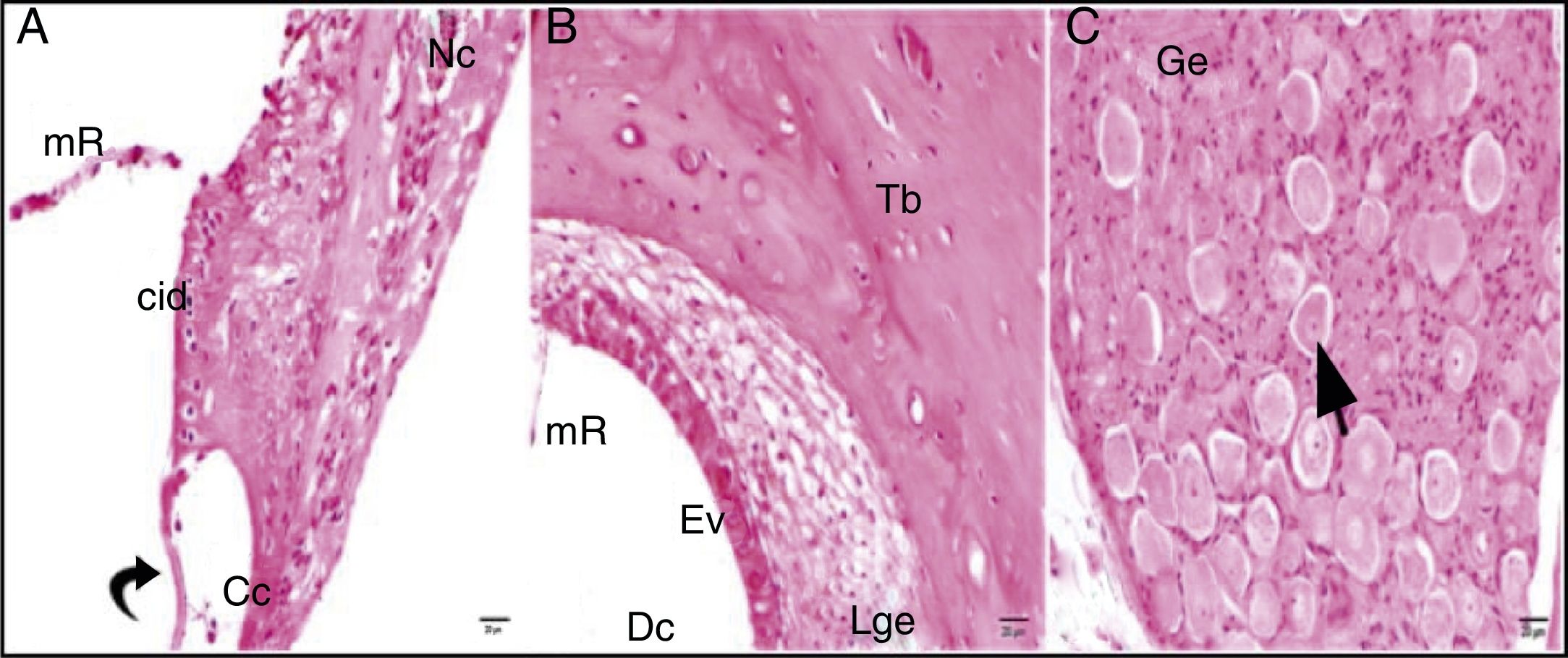
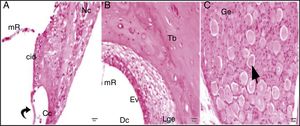
Embora as comparações dos grupos cisplatina + 100mg/kg de uva‐do‐monte e cisplatina + 200mg/kg de uva‐do‐monte com o grupo controle apresentassem achados de degeneração, esses não foram graves como os do grupo cisplatina (figuras 4‐5).
Grupo cisplatina + 100mg/kg uva‐do‐monte; mR, membrana de Reissner; Dc, duto coclear; ponta da flecha curva, membrana basilar; cid, célula interdental; Cc, célula ciliada interna d, degeneração e dilatação; seta curva, membrana tectorial; Nc, nervo coclear; Ev, estria vascular; Lge, ligamento espiral; Ge, gânglio espiral; seta preta, células ganglionares espirais (coloração hematoxilina eosina, × 40).
Grupo cisplatina + 200mg/kg uva‐do‐monte; mR, membrana de Reissner; Dv, duto vestibular; Dc, duto coclear; ponta da flecha curva, membrana basilar; d, degeneração e dilatação; v, vacuolização; seta curva, membrana tectorial; Nc, nervo coclear; Ev, estria vascular; Lge, ligamento espiral; Ge, gânglio espiral; seta preta, células ganglionares espirais (coloração hematoxilina eosina, × 40).
Os resultados da classificação histopatológica cegada para as informações dos grupos, de acordo com os achados de dilatação, células apoptóticas, degeneração nervosa, degeneração celular e vacuolização citoplasmática, estão resumidos na tabela 4. De acordo com os resultados da classificação histopatológica cegada, não foi observada diferença significante entre o controle grupo e os grupos controle simulado e uva‐do‐monte em termos de achados de degeneração (p > 0,05). Quando o grupo controle foi comparado com os grupos cisplatina e cisplatina + 100mg/kg, houve diferenças significantes em relação a todos os critérios de avaliação (p < 0,001).
Classificação cega de achados histopatológicos de cada grupo
| Grupos | Classificação cega histopatológica Média ± desvio‐padrão (min–máx) | ||||
|---|---|---|---|---|---|
| Vacuolização citoplásmica | Degeneração celular | Dilatação | Célula apoptótica | Degeneração nervosa | |
| Grupo controle | 0,25 ± 0,46 (0–1) | 0,13 ± 0,36 (0–1) | 0,13 ± 0,36 (0–1) | 0,63 ± 0,52 (0–1) | 0,25 ± 0,46 (0–1) |
| Grupo simulado | 0,38 ± 0,52 (0–1) | 0 | 0,25 ± 0,46 (0–1) | 0,50 ± 0,53 (0–1) | 0,25 ± 0,46 (0–1) |
| Grupo controle uva‐do‐monte | 0,75 ± 0,71 (0–2) | 0,88 ± 0,99 (0–2) | 0,75 ± 0,89 (0–2) | 0,50 ± 0,53 (0–1) | 0,38 ± 0,52 (0–1) |
| Grupo cisplatina | 3,63 ± 0,52 (3–4) | 3,13 ± 0,35 (3–4) | 2,63 ± 0,74 (2–4) | 3,00 ± 0,00 (3–3) | 2,50 ± 0,53 (2‐3) |
| Grupo cisplatina + 100 mg/kg uva‐do‐monte | 1,75 ± 0,46 (1–2) | 1,63 ± 0,52 (1–2) | 1,75 ± 0,46 (1–2) | 2,75 ± 0,46 (2–3) | 2,13 ± 0,83 (1–3) |
| Grupo cisplatina + 200 mg/kg uva‐do‐monte | 0,88 ± 0,64 (0–2) | 0,88 ± 0,83 (0–2) | 0,50 ± 0,53 (0–1) | 1,00 ± 0,76 (0–2) | 1,50 ± 0,76 (0–2) |
A cisplatina é um agente antineoplásico altamente eficaz, o qual é amplamente usado no tratamento de tumores de cabeça e pescoço. No entanto, os efeitos colaterais graves, tais como ototoxicidade, mielotoxicidade, nefrotoxicidade, neuropatia periférica e toxicidade gastrointestinal, limitam o uso clínico da cisplatina. Estudos promissores foram feitos com o objetivo de reduzir os efeitos ototóxicos da cisplatina, mas ainda não há um tratamento que impeça completamente a ototoxicidade dela.12,13 Os resultados obtidos neste estudo mostraram que o extrato de uva‐do‐monte, conhecido por ser um potente antioxidante, demonstrou um efeito protetor contra a ototoxicidade induzida por cisplatina nos achados audiológicos e histopatológicos de ratos. Este estudo também mostrou evidências bioquímicas de que o extrato de uva‐do‐monte tem um efeito protetor contra o estresse oxidativo, considerado um dos mecanismos de formação da ototoxicidade da cisplatina.
Diferentes doses e aplicações com a intenção de produzir ototoxicidade por cisplatina foram avaliadas em estudos documentados anteriores.14,15 Para induzir a ototoxicidade em ratos em nosso estudo, preferimos usar uma dose única de 16mg/kg de cisplatina, que, como foi detectado em nosso estudo anterior, foi a dose ideal para criar ototoxicidade sem perturbar o estado geral dos ratos. A diminuição da resposta à emissão ao usar‐se um teste de EOAPD no oitavo dia do estudo mostrou que a administração de cisplatina foi suficiente para a indução experimental de ototoxicidade. Além disso, não houve anormalidades causadas pela administração de cisplatina ou as outras substâncias que exigiram a exclusão dos ratos do estudo.
Várias substâncias antioxidantes, como o licopeno, a cúrcuma e ginkgo biloba, foram estudadas quanto ao seu potencial para prevenir a ototoxicidade causada pela cisplatina e essas substâncias demonstraram ter efeitos protetores contra a ototoxicidade.14,16,17 As espécies de mirtilos, conhecidos como potentes antioxidantes, mostraram efeitos fisiológicos, tais como efeitos anticancerígenos, efeitos neuroprotetores, efeitos anti‐inflamatórios e aumento da visão em ratos. Além disso, essas espécies podem reduzir o estresse oxidativo.9,18 Um estudo anterior mostrou que o extrato de mirtilo administrado por via oral teve um efeito protetor contra a ototoxicidade.19
Em nosso estudo, o extrato de uva‐do‐monte, que é uma espécie de mirtilo, foi diluído e aplicado intraperitonealmente. Além disso, os efeitos de diferentes doses foram comparados. Estudos sobre o uso i.p. do extrato de mirtilo são muito limitados. Não encontramos complicações durante o uso i.p. de extrato de uva‐do‐monte. De acordo com as respostas do teste de EOAPD em nosso estudo, o extrato de uva‐do‐monte teve efeito protetor contra a ototoxicidade induzida por cisplatina após o uso de doses baixas e altas. Os efeitos ototóxicos da cisplatina foram identificados em nível celular durante a avaliação histopatológica e baixas doses de extrato de uva‐do‐monte não foram capazes de prevenir a degeneração histopatológica. No entanto, doses elevadas do extrato impediram a degeneração. A preservação da audição no grupo que recebeu doses baixas do extrato de uva‐do‐monte sugere que mesmo que o extrato não forneça uma proteção completa contra a degeneração histopatológica, pode evitar degeneração suficiente para prevenir a deficiência auditiva.
Estudos sobre os efeitos do extrato de mirtilo sobre o estresse oxidativo mostraram que o mirtilo reduz o estresse oxidativo.20,21 Os parâmetros de estresse oxidativo, considerados uma das causas da ototoxicidade da cisplatina, também foram avaliados através de análises bioquímicas em nosso estudo. De acordo com os dados obtidos, a cisplatina aumenta o EOT e o IEO. Embora baixas doses de extrato de uva‐do‐monte não sejam capazes de reduzir o estresse oxidativo que a cisplatina desencadeia, a uva‐do‐monte em doses altas demonstra um efeito antioxidante e reduz o IEO de maneira consonante.
ConclusãoOs dados que obtivemos demonstraram que a uva‐do‐monte em doses elevadas protege a audição contra a ototoxicidade induzida por cisplatina e evita a degeneração celular. Além disso, em doses elevadas, a uva‐do‐monte pode reduzir significantemente o estresse oxidativo, considerado um dos mecanismos da ototoxicidade. À luz dos dados obtidos, é necessário fazer novos e extensos estudos clínicos para determinar a eficácia da uva‐do‐monte em maiores detalhes.
FinanciamentoEste trabalho foi financiado pela Unidade de Projeto de Pesquisa Científica da Universidade sob o número do projeto 2015/9. Conformidade com padrões éticos; o estudo foi feito de acordo com o Guia 2011 para o Cuidado e Uso de Animais de Laboratório.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Özdemir D, Özgür A, Kalkan Y, Terzi S, Tümkaya L, Yılmaz A, et al. The protective effects of whortleberry extract against cisplatin‐induced ototoxicity in rats. J Pediatr (Rio J). 2019;85:55–62.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.