The use of electron microscopy in the study of the inner ear has allowed us to observe minute details of the hair cells, especially in ototoxicity studies; however, the preparation of this material is a difficult and delicate task. In an attempt to simplify the handling of these materials, two agents, toluidine blue and ethylenediamine tetra‐acetic acid were tested, in addition to the elimination of osmium tetroxide during the preparation of albino guinea pig cochleae. We also tested the applicability of these methodologies in an ototoxicity protocol.
ObjectiveTo verify the quality of the images obtained with and without the use of ethylenediamine tetra‐acetic acid, toluidine blue and osmium tetroxide in the preparation of cochleae of albino guinea pigs for the scanning electron microscopy.
MethodsThree groups of cochleae were used. In Group 1, 10 cochleae were prepared with the usual methodology, dissecting the optical capsule without decalcification and using osmium tetroxide as a post‐fixative agent. In Group 2, we prepared 10 cochleae decalcified with ethylenediamine tetra‐acetic acid, injecting toluidine blue in the endolymphatic space to facilitate the identification of the organ of Corti. In Group 3, we used 4 cochleae of guinea pigs that received 3 doses of cisplatin (7.5mg/kg, D1–D5–D6), two prepared according to the methodology used in Group 1 and two with that used in Group 2. Scanning electron microscopy images were obtained from the organ of Corti region of the basal turn of each cochlea.
ResultsThe organ of Corti was more easily identified with the use of toluidine blue. The dissection of the cochlea was more accurate in the decalcified cochleae. The quality of the images and the preservation of the organ of Corti obtained with the two methodologies were similar.
ConclusionThe proposed modifications resulted in images of similar quality as those observed using the traditional methodology.
O emprego da microscopia eletrônica no estudo da orelha interna permitiu observar detalhes minuciosos das células ciliadas especialmente em estudos de ototoxicidade. Entretanto, o preparo desse material é trabalhoso e delicado. Para simplificar a manipulação desses materiais, testou‐se o uso de dois agentes, azul de toluidina e ácido etilenodiamino tetra‐acético, além da retirada do tetróxido de ósmio na preparação de cócleas de cobaias albinas. Testamos também a aplicabilidade dessas metodologias em um protocolo de ototoxicidade.
ObjetivoVerificar a qualidade das imagens obtidas com e sem o uso de ácido etilenodiamino tetra‐acético, azul de toluidina e tetróxido de ósmio na preparação de cócleas de cobaias albinas para a microscopia eletrônica de varredura.
MétodoForam utilizados três grupos de cócleas. No Grupo 1 preparou‐se 10 cócleas com a metodologia usual, dissecando a cápsula ótica sem descalcificac¸ão e utilizando tetróxido de ósmio como pós‐fixador. No Grupo 2 preparamos 10 cócleas descalcificadas com ácido etilenodiamino tetra‐acético, injetando azul de toluidina no espac¸o endolinfático para facilitar a identificação do órgão de Corti. No Grupo 3 utilizamos 4 cócleas de cobaias que receberam 3 doses de cisplatina (7,5 mg/kg, D1-D5-D6), duas preparadas com a metodologia do Grupo 1 e duas com a do Grupo 2. Foram obtidas imagens da microscopia eletrônica de varredura da região do órgão de Corti do giro basal de cada cóclea.
ResultadosO órgão de Corti foi mais facilmente identificado com o azul de touidina. A dissecção da cóclea foi mais precisa nas cócleas descalcificadas A qualidade das imagens e a preservac¸ão do órgão de Corti obtidas com as duas metodologias foi similar.
ConclusãoAs modificações propostas resultaram em imagens de qualidade similar as observadas com o uso da metodologia tradicional.
O uso da microscopia de luz para estudo de tecidos biológicos é de importância imensurável. Foi usado por Alfonso Corti para fazer as primeiras observações histológicas detalhadas dos órgãos labirínticos, descrever o gânglio espiral, a membrana basilar, as células ciliadas internas e externas e a membrana tectória.1 Mas nosso conhecimento sobre a orelha interna ganhou ainda mais profundidade quando começamos a avaliar as estruturas cocleares através da microscopia eletrônica.
O microscópio eletrônico foi inventado em 1931 por Ernst Ruska e usa um feixe de elétrons para geração das imagens. Como o comprimento de onda desse feixe é cerca de 100.000 vezes menor do que do espectro de luz visível, a microscopia eletrônica tem um poder de resolução muito maior do que a microscopia de luz, permite observar ainda mais minuciosamente a microestrutura coclear.2
Uma das modalidades de microscopia eletrônica é a microscopia eletrônica de varredura (MEV), na qual o feixe de elétrons percorre a superfície do material estudado, gera uma imagem tridimensional. Essa característica torna a MEV particularmente interessante na avaliação da integridade das células ciliadas em situações de agressão à orelha interna como nos estudos de ototoxicidade.
A ototoxicidade é a capacidade de uma substância causar dano à orelha interna e pode gerar alteração funcional.3 Os protocolos experimentais de ototoxicidade mais estudados são os mediados por antibióticos aminoglicosídeos e pela cisplatina.4–8 Neles as cócleas passam por um processamento que inclui fixação com glutaraldeído, remoção da cápsula ótica, pós‐fixação com tetróxido de ósmio, desidratação em etanol e ponto crítico de CO2 e finalmente recebem uma fina cobertura de metal (normalmente ouro ou platina). Entretanto, em estudos feitos anteriormente em nosso serviço9,10 observamos que a preservação do órgão de Corti nem sempre era a ideal, ocasionalmente eram encontrados focos de lesão mecânica na região das células ciliadas decorrentes do procedimento de remoção da cápsula ótica.
Com vistas a uma melhor preservação do órgão de Corti e também a simplificar a dissecção e o processamento desse material, desenhamos um modelo no qual modificamos a preparação de cócleas de cobaias albinas para MEV com o uso de ácido etilenodiamino tetra‐acético (EDTA) e azul de toluidina (AT) para descalcificar a cápsula ótica, facilitar a identificação da região das células ciliadas e promover uma dissecção mais delicada da cápsula, além de comparar a qualidade das imagens obtidas com um grupo de cócleas processadas da maneira usual. Nesse novo modelo testamos também a retirada do tetróxido de ósmio para simplificar o processo e evitar a necessidade de uso de fluxo laminar na manipulação do material. Em um segundo momento, aplicamos as duas metodologias (a usual e nova técnica) em cócleas de cobaias submetidas a um protocolo de ototoxicidade para verificar a qualidade de imagem e aplicabilidade desse novo método em protocolos experimentais dessa natureza.
O objetivo deste trabalho é verificar a qualidade das imagens obtidas com e sem o uso de EDTA, azul de toluidina e tetróxido de ósmio na preparação de cócleas de cobaias albinas para a microscopia eletrônica de varredura.
Material e métodosForam usadas doze cobaias albinas fêmeas (cavia porcellus) saudáveis, com reflexo de Preyer presente, entre 350?450g e com cerca de três meses de idade. Os animais permaneceram em gaiolas com temperatura estável entre 21?22°C, ciclos de período diurno/noturno de 12 horas e acesso livre a ração e água. Projeto e todos seus procedimentos foram aprovados pelo Comitê de Ética em Pesquisa de nossa instituição sob o número CEP1625/04.
Os espécimes foram divididos em três grupos.
Grupo 1 – Preparação usualCinco cobaias (10 cócleas) sem uso prévio de medicações ototóxicas e com reflexo de Preyer presente foram anestesiadas com injeções intramusculares de xilazina (10 mg/kg) e cloridrato de cetamina (40 mg/kg), posteriormente sacrificadas com injeção intracardíacas de cloreto de potássio. Rapidamente os animais foram decapitados e uma craniotomia sagital mediana foi feita para separar os hemicrânios direito e esquerdo. Posteriormente seus ossos temporais foram individualizados e retiraram‐se as demais porções ósseas da estrutura craniana.
A bula mastóidea foi aberta, expôs desse modo a cóclea. Sob visão microscópica uma fenestração no ápice da cóclea foi confeccionada com um microestilete e serviu como contra‐abertura para uma infiltração com solução fixadora de glutaraldeído 2,5% em tampão cacodilato 0,1 M Ph 7,2 através da janela redonda e posteriormente o material fica imerso na mesma solução fixadora por 24 horas armazenadas em uma geladeira a 4°C. Após esse período foram feitas duas lavagens de uma hora e descanso durante a noite na solução tampão para remoção completa do fixador.
Na etapa seguinte removemos cuidadosamente o restante da cápsula ótica com extração do modíolo conjuntamente com o órgão de Corti, material submetido à desidratação em soluções de concentração crescente de etanol (50%, 70% e 90%) durante 30 minutos cada e três imersões de 30 minutos em etanol 100% e posteriormente submerso em tetróxido de ósmio a 2%, esperaram‐se 15 minutos para completar a pós‐fixação. Passamos então para a secagem em equipamento de ponto crítico (Balzers‐CPD 030), no qual as amostras foram submetidas a diversos banhos em CO2 líquido que retira toda a água e todo o etanol ainda presentes.
Esse espécime final foi fixado e montado em suporte adequado com o uso de pasta condutiva, recoberto com uma camada de ouro de 25 a 50 mm de espessura (Balzers SCD 050 - Sputter Coater) e visualizado no microscópio de varredura JEOL modelo 5300.
Foi analisado um campo fotográfico da espira coclear basal em busca de verificar a nitidez da imagem obtida para comparação com os outros grupos, bem como a preservação do órgão de Corti.
Grupo 2 – Modificação da técnicaCinco cobaias (10 cócleas) foram submetidas à mesma preparação do Grupo 1. Entretanto, após 12 horas em solução‐tampão para remoção do fixador, o material fica submerso em solução de EDTA 10% também por novo período de 12 horas, não é feita a etapa de pós‐fixação com o tetróxido de ósmio. Para melhor identificação e preservação do órgão de Corti usamos o agente corante azul de toluidina em uma solução de 0,1%, injetada no espaço endolinfático do giro basal da cóclea através da cápsula ótica descalcificada com o uso de um kit de seringa e agulha (8,0×0,3 mm) de aplicação de insulina.
Com uma lâmina de bisturi número 11 e uma microtesoura de cirurgia otológica a cápsula ótica foi removida, foi então removido o modíolo em conjunto com o órgão de Corti.
Após esse material passar pelas etapas de desidratação em álcool e ponto crítico, montagem em suporte adequado e ser recoberto com uma camada de ouro, fotografamos um campo da espira coclear mais inferior.
Grupo 3 – Aplicação das duas técnicas em um protocolo de ototoxicidade mediada por cisplatinaDuas cobaias foram submetidas à aplicação de três doses de 7,5 mg/kg de cisplatina de acordo com o esquema D1?D5?D6 (aplicações no primeiro dia e no quarto e quinto dias subsequentes), protocolo padronizado em nosso serviço que apresenta alteração comprovada em testes auditivos funcionais e lesão das células ciliadas externas. No dia seguinte à última aplicação de cisplatina as cobaias foram sacrificadas, uma das cócleas foi submetida ao protocolo de preparação do Grupo 1 (Subgrupo 3a) e a outra cóclea ao protocolo do Grupo 2 (Subgrupo 3b). Durante todo o período de acompanhamento foram feitos exames otoscópicos para afastar quadros inflamatórios de orelha média e externa.
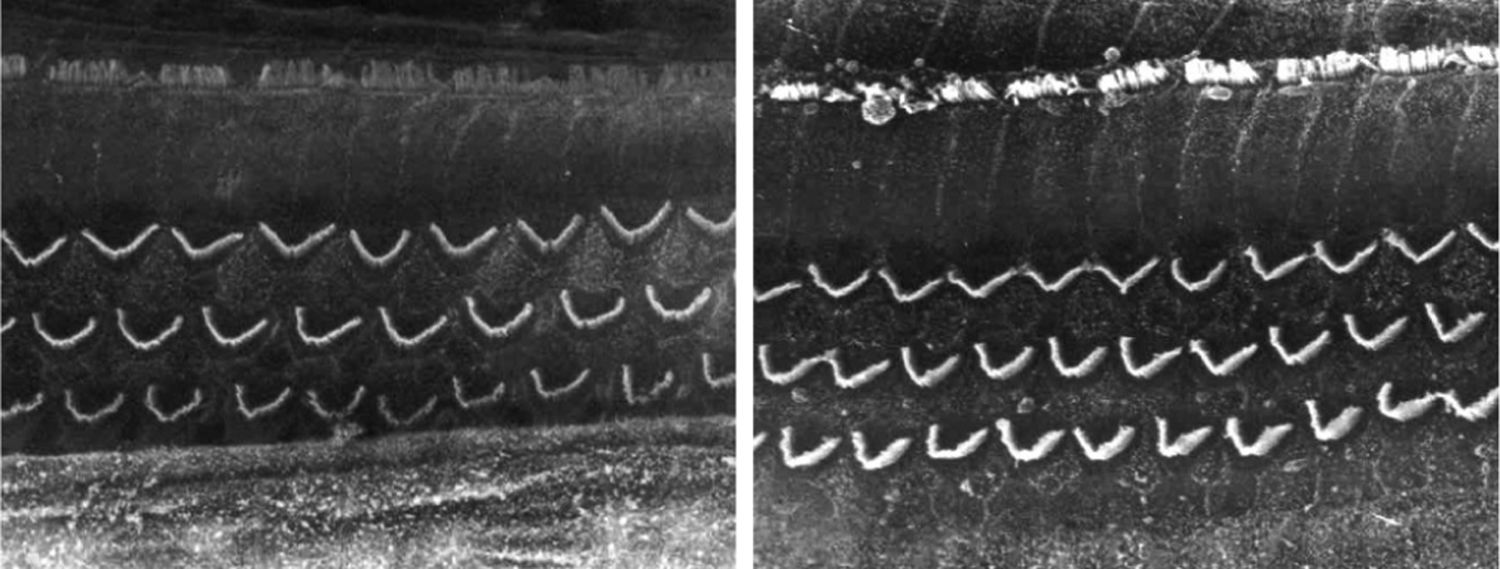
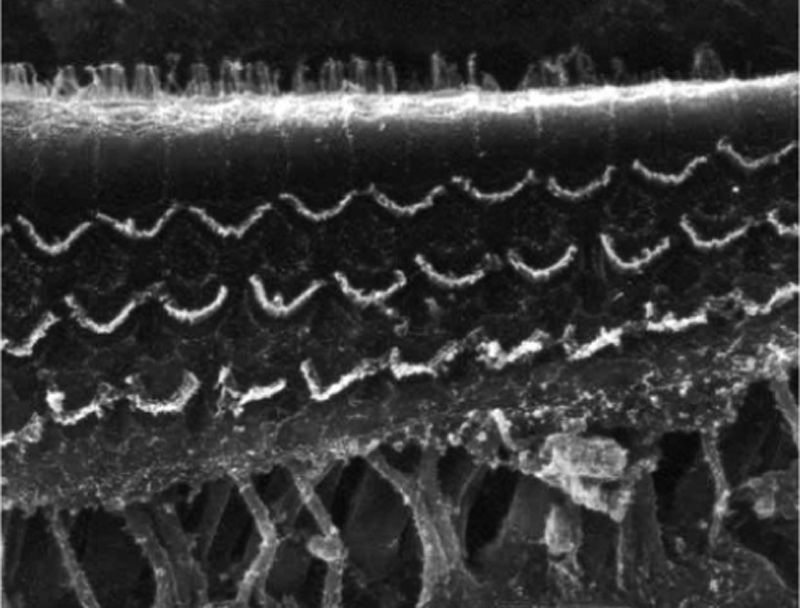
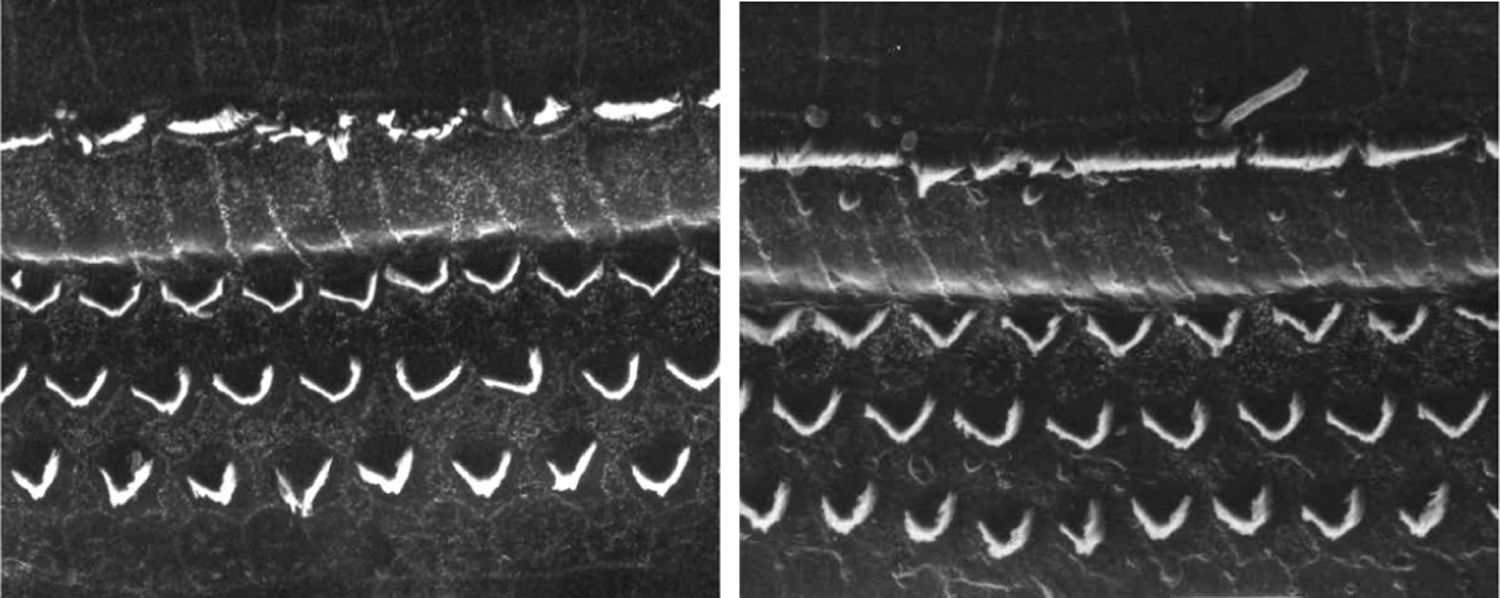
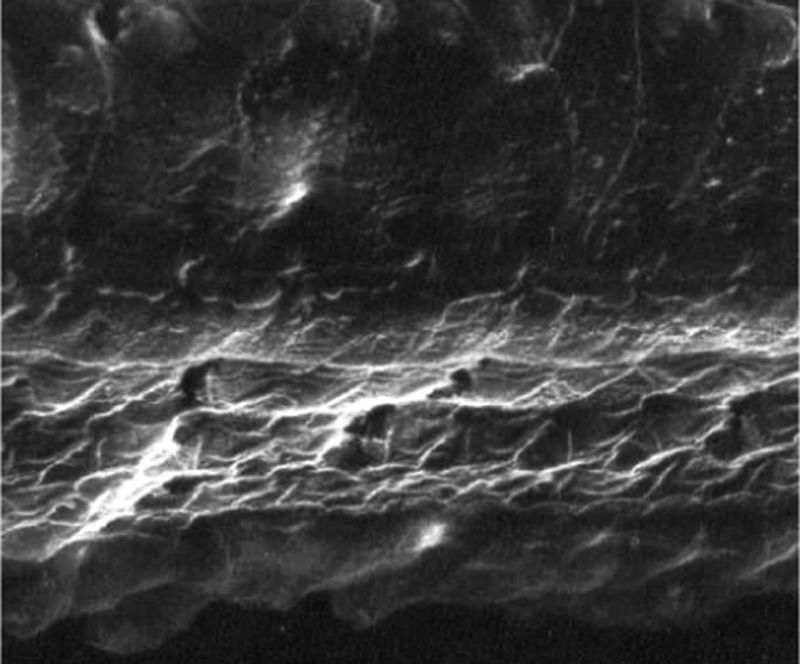
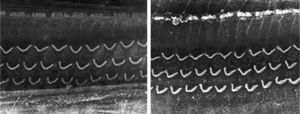
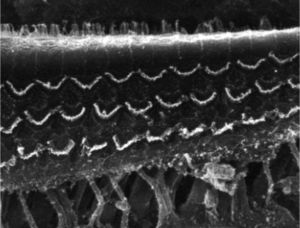
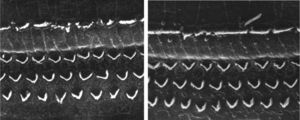
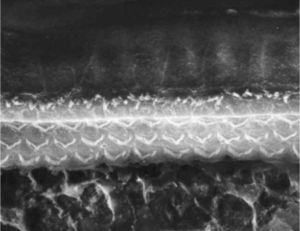
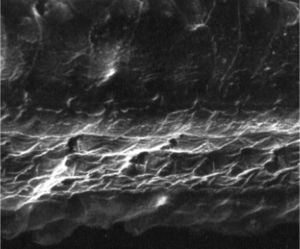
ResultadosGrupo 1As imagens obtidas nas fotos das cócleas desse grupo apresentaram uma qualidade excelente, nos permitiram verificar com grande facilidade tanto a presença das células ciliadas internas como as externas, como pode ser observado na fig. 1. O nível de detalhamento foi adequado não somente para verificar a presença das células ciliadas, mas também a integridade e posição de seus estereocílios. Em algumas cócleas observamos lesão de região próxima à zona das células ciliadas (fig. 2). Não encontramos evidência de lesão das células ciliadas por conta dos procedimentos de preparação desse material para MEV.
Não houve diferença perceptível na qualidade de imagem das fotos obtidas nesse grupo em relação àquelas encontradas no Grupo 1, foi possível observar com nitidez a presença e integridade das células ciliadas e de seus estereocílios (fig. 3). Também de forma similar ao grupo anterior, observamos algumas áreas de lesão em região próxima às células ciliadas (fig. 4). Nesse grupo também não observamos lesão de células ciliadas que pudesse indicar que essa metodologia interfira na preservação das células ciliadas.
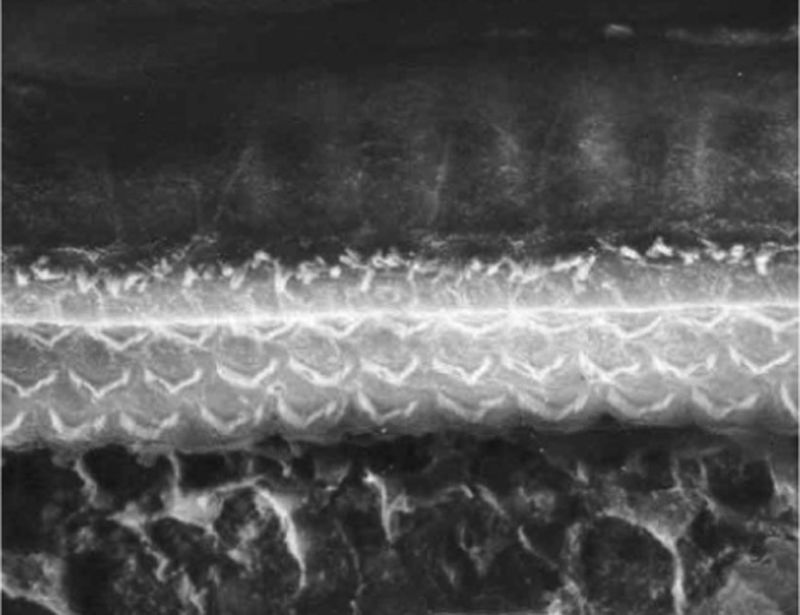
Os dois grupos apresentaram imagens de qualidade de resolução semelhantes que permitiram avaliar o órgão de Corti de maneira adequada para comprovar a lesão das células ciliadas (fig. 5).
DiscussãoNosso conhecimento anatômico ganhou um refinamento maior com o advento da microscopia de luz e da microscopia eletrônica.
A microscopia de luz ainda é a mais usada para estudo de materiais biológicos devido a seu menor custo e ao uso de equipamentos mais simples. Apesar disso, é inegável que a ME obtém um nível de detalhamento que a torna ideal para o estudo de alguns materiais.
Um dos pontos críticos do estudo em ME é a preparação dos espécimes para análise.
O preparo dos materiais biológicos a serem avaliados pela ME inicia‐se com a fixação (com formaldeído, glutaraldeído ou ambos11,12), pós‐fixação e desidratação. A etapa de pós‐fixação com tetróxido de ósmio é rotineira em um laboratório de ME, pois o feixe de elétrons usado para obtenção de imagens apresenta um pequeno poder de penetração e são necessários elementos pós‐fixadores que contenham átomos de metais pesados como urânio (acetato de uranila), chumbo (citrato de chumbo) e ósmio (tetróxido de ósmio) para criar contraste, fator extremamente relevante para a microscopia eletrônica de transmissão, na qual o feixe de elétrons atravessa o material para obtenção de imagem.
Porém, no preparo do material para a MEV, os espécimes devem ser desidratados e sua superfície deve ser tratada com uma cobertura de metal, procedimento também conhecido como sputtering, normalmente usa‐se ouro ou uma liga de ouro/paládio. A captação de imagens no MEV baseia‐se principalmente na propriedade de deflexão eletrônica dessa superfície metálica, que permite ainda analisar a estrutura externa de insetos que têm exoesqueleto rígido sem outra preparação que não a pulverização catódica.13,14 Esse fato nos levou a acreditar que o uso do tetróxido de ósmio seria desnecessário para obtenção de imagens na MEV, o que realmente ocorreu nas cócleas preparadas com nossa nova metodologia.
O objetivo de abdicar do uso do ósmio foi evitar a alta toxicidade dos metais pesados. O tetróxido de ósmio é altamente tóxico e extremamente volátil, é necessário o uso de capela de fluxo laminar, óculos protetores, avental e luvas para sua manipulação, pois a exposição a essa substância pode causar tosse, cefaleia, queimaduras de pele, edema conjuntival e destruição de córnea e edema pulmonar, tem também potencial cancerígeno. Durante o manuseio do tetróxido de ósmio na preparação das cócleas do Grupo 1 e 3 de nosso estudo, tivemos de usar fluxo laminar e luvas de proteção o tempo inteiro e mesmo assim observamos a rápida impregnação do tetróxido de ósmio na luva usada ao abrirmos o frasco de sua solução.
Já o uso do EDTA e do azul de toluidina visava a deixar a dissecção mais delicada e precisa, além de facilitar a identificação e preservação do órgão de Corti.
O azul de toluidina foi injetado no labirinto endolinfático das cócleas do Grupo 2 e em seus similares no Grupo 3b. O que observamos foi uma imediata impregnação do corante nas estruturas do labirinto membranoso endolinfático. Com essas estruturas bem identificadas foi possível tomar um cuidado redobrado ao se fazer a dissecção da área das células ciliadas externas.
O uso de EDTA é comum na preparação de materiais ósseos, nos quais cortes extremamente finos são fundamentais. Entretanto, na MEV não encontramos seu uso difundido.15–17 O uso do EDTA no nosso trabalho buscava averiguar se isso facilitaria a preparação desse material também na MEV e o que encontramos foram pontos positivos e negativos.
O que se observa é que se por um lado a rigidez natural da cápsula facilita a feitura de pequenas linhas de fratura que agilizam a sua remoção, a força necessária para fazer essas fraturas tem o potencial de danificar a estrutura a ser estudada.
A cápsula ótica descalcificada dos Grupos 2 e 3b apresentou uma grande flacidez e maleabilidade, necessitou de uso de microtesouras para sua total remoção. O uso de instrumental de corte trouxe uma maior precisão na retirada das partes indesejadas do material, mas tornou a dissecção um pouco mais demorada.
Macroscopicamente, os grupos em que se usou o EDTA aparentavam melhor aspecto de preservação estrutural, mas no nível microscópico observamos fissuras semelhantes às encontradas nas cócleas sem descalcificação. Esse fato nos leva a concluir que a etapa de descalcificação deve ser incluída a critério do responsável pela dissecção das cócleas a depender de sua preferência ou necessidade de fazer uma dissecção mais delicada.
Mas o objetivo deste trabalho era verificar se a qualidade de imagens obtidas com as modificações de metodologia se equiparava com o processamento usual, além de observar sua aplicabilidade em modelos experimentais de ototoxicidade.
Nos grupos de cócleas normais (Grupos 1 e 2) as imagens apresentavam definição idêntica. E com um protocolo padronizado de nossa instituição de três doses de 7,5 mg/kg de cisplatina, conseguimos gerar lesões de células ciliadas externas facilmente identificadas pela MEV, foi possível encontrar desarranjo ou ausência total dos estereocílios nos giros cocleares mais inferiores. A observação dessas alterações foi feita sem quaisquer dificuldades em todos nossos grupos de cócleas, nos levou à conclusão de que modificações na metodologia de preparo dessas amostras para MEV são aplicáveis nesse modelo de ototoxicidade por cisplatina.
ConclusõesA qualidade das imagens obtidas com as modificações propostas foi similar à observada com a técnica tradicional.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Iha LC, Cruz OL. Use of scanning electron microscopy in the cochlea of guinea pigs. Braz J Otorhinolaryngol. 2020;86:222–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.