O carcinoma espinocelular do meato acústico externo é uma doença rara. Estudos anteriores sugeriram preditores de recorrência do tumor. Entretanto, a maioria dos fatores prognósticos se originou do aspecto clínico‐patológico.
ObjetivoAnalisar a correlação entre marcadores inflamatórios periféricos pré‐operatórios e os desfechos de sobrevida e identificar biomarcadores prognósticos para pacientes com carcinoma espinocelular do meato acústico externo.
MétodoAnalisamos retrospectivamente pacientes com diagnóstico de carcinoma espinocelular do meato acústico externo submetidos à cirurgia em nosso instituto. Os marcadores inflamatórios circulantes pré‐operatórios, como as contagens de neutrófilos, linfócitos, plaquetas e monócitos, foram medidos e as suas relações calculadas, inclusive as relações neutrófilos/linfócitos, plaquetas/linfócitos e linfócitos/monócitos. O valor prognóstico dos parâmetros hematológicos medidos em relação aos desfechos de sobrevida também foi avaliado.
ResultadosForam incluídos 83 pacientes, entre os quais 26 apresentaram recorrência tumoral e 57 não apresentaram. A contagem de neutrófilos e a relação neutrófilo/linfócito estavam intimamente associadas ao estágio do tumor. Nos pacientes com recorrência, a contagem de neutrófilos, a relação neutrófilos/linfócitos e a relação plaquetas/linfócitos eram elevadas (p <0,0001, p ˃ 0,0001 e p=0,001), enquanto a contagem de linfócitos e a relação linfócitos/monócitos estavam diminuídas (p=0,012 e p=0,016, respectivamente). A análise da curva, Receiver Operating Characteristic, indicou que a relação neutrófilos/linfócitos pré‐operatória era um potencial marcador prognóstico para a recorrência de carcinoma espinocelular do meato acústico externo (Área sob a curva=0,816) e o ponto de corte foi de 2,325.
ConclusõesA contagem pré‐operatória de neutrófilos e linfócitos, as relações neutrófilos/linfócitos, plaquetas/linfócitos e linfócitos/monócitos estão significativamente correlacionadas com a recorrência do tumor em pacientes com carcinoma espinocelular do meato acústico externo. Além disso, a relação neutrófilos/linfócitos pode ser um fator prognóstico desfavorável dessa doença.
O carcinoma espinocelular (CEC) do meato acústico externo é uma malignidade rara. Portanto, dados limitados estão disponíveis para esse tipo de câncer. A atual estratégia de tratamento para dessa condição clínica é baseada em cirurgia, radioterapia, quimioterapia ou uma combinação desses tratamentos. No momento, não existe um sistema de estadiamento aprovado pela Union for International Cancer Control ou pelo American Joint Committee on Cancer para esse tipo de lesão maligna. O sistema de estadiamento de Pittsburgh proposto pela primeira vez em 1996 e modificado em 2000 é comumente usado na prática clínica para selecionar a abordagem cirúrgica e avaliar o resultado da sobrevida.1,2 A maioria dos estudos sobre carcinoma espinocelular do meato acústico externo analisou apenas fatores prognósticos estabelecidos, inclusive o estágio do tumor, estruturas envolvidas e terapia adjuvante combinada. No entanto, ao concentrar‐se apenas na invasão local, outras informações, como imunologia do tumor e biologia celular, podem ser negligenciadas. Portanto, novos fatores prognósticos precisam ser identificados.
Desde que Virchow descreveu pela primeira vez a presença de leucócitos nos tecidos neoplásicos e a correlação da inflamação com o câncer em 1863, numerosos estudos tentaram elucidar a conexão entre a inflamação e a progressão da malignidade.3–5 Nos últimos anos, evidências crescentes sugerem que as contagens de diferentes tipos de células circulantes no sangue estão associados a taxas de sobrevida em várias neoplasias, inclusive câncer gástrico, carcinoma oral e carcinoma nasofaríngeo. Além disso, foi observado que as relações hematológicas, como a relação neutrófilos/linfócitos (RNL), plaquetas/linfócitos (RPL) e a relação linfócitos/monócitos (RLM), podiam predizer o prognóstico de pacientes afetados por vários tipos de câncer. O papel das células inflamatórias no microambiente e nas metástases do câncer também tem aparecido em pesquisas de laboratório. Lartigue et al.6 observaram que as células tumorais circulantes podem ficar presas nas redes de DNA derivadas de neutrófilos após a infecção sistêmica, sugeriram que os neutrófilos estão envolvidos na metástase do tumor. Labelle et al.7 demonstraram que, após a liberação do TGF‐β e contato direto com as células tumorais, as plaquetas podem ativar as vias tumorais TGFβ/Smad e NF‐κB, aprimoram a transição do tumor para um fenótipo mais invasivo e metástase. Reichert et al.8 mostraram que a morte mediada por tumor de células T circulantes através da via Fas/Fas L suprimia a função imune antitumoral no carcinoma oral. Esses achados fornecem uma compreensão aprofundada do envolvimento de marcadores inflamatórios na carcinogênese, o que poderia fornecer uma base de evidências para o desenvolvimento de novas estratégias para o manejo de pacientes com câncer. No entanto, que seja de nosso conhecimento, o valor prognóstico dos marcadores inflamatórios pré‐operatórios no CEC do meato acústico externo ainda não foi avaliado.
Portanto, neste estudo, avaliamos a correlação entre marcadores inflamatórios pré‐operatórios e o prognóstico de pacientes com CEC do meato acústico externo a fim de identificar novos fatores prognósticos independentes para essa rara doença.
MétodoPopulação do estudoEste estudo foi aprovado pelo comitê de ética médica do Eye, Ear, Nose and Throat Hospital da Fudan University (2014007) e todos os pacientes assinaram o termo de consentimento informado.
Fizemos uma revisão retrospectiva de todos os pacientes diagnosticados com CEC do meato acústico externo submetidos à cirurgia em nossa instituição entre janeiro de 2005 e dezembro de 2018. Os critérios de inclusão foram os seguintes: 1) Diagnóstico primário do CEC de meato acústico externo confirmado por exame histopatológico em nossa instituição; 2) Ressecção óssea temporal curativa com parotidectomia; 3) Consentimento para participação no estudo; 4) Disponibilidade de prontuários médicos abrangentes, inclusive imagens, exames laboratoriais e seguimento. Foram excluídos os seguintes pacientes: 1) Pacientes submetidos a radioterapia ou quimioterapia pré‐operatória; 2) Pacientes com doença hematológica, doença inflamatória sistêmica ou infecção concomitante; 3) Pacientes diagnosticados com doença autoimune ou tratados com agentes imunossupressores; 4) Pacientes com suspeita de metástase distante após tomografia computadorizada e ressonância magnética. Noventa e oito pacientes preencheram os critérios de inclusão, dos quais 15 foram excluídos da análise da sobrevida devido à perda de seguimento.
Coleta de dadosColetamos os prontuários médicos para todos os pacientes envolvidos no estudo, inclusive resultados de exames laboratoriais e achados radiológicos e histológicos. Os pacientes foram estadiados de acordo com o sistema de estadiamento de Pittsburgh. As amostras de sangue dos pacientes foram coletadas em tubos que continham ácido etilenodiaminotetracético 2 semanas antes da cirurgia. As contagens pré‐operatórias de neutrófilos, monócitos, linfócitos e plaquetas foram feitas com o analisador automático de hematologia Mindray BC‐5500 (Shenzhen, China). A RNL, RPL e RLM foram calculadas dividindo‐se os valores absolutos das contagens de células correspondentes.
Seguimento do pacienteTodos os pacientes foram acompanhados por exames de ressonância magnética (RM) feitos entre intervalos e tomografia computadorizada de tórax após a cirurgia para detectar recorrência local ou metástase à distância. O último seguimento para todos os pacientes foi em outubro de 2019. A duração do seguimento variou de 8 a 138 meses, com mediana de 27 meses.
Análise estatísticaO teste U de Mann‐Whitney e o teste de Kruskal‐Wallis foram usados para comparar os parâmetros hematológicos pré‐operatórios médios e as relações calculadas estratificadas por dados demográficos e características clínicas. O teste U de Mann‐Whitney foi aplicado para comparar os parâmetros hematológicos pré‐operatórios e as razões foram calculadas entre pacientes recorrentes e não recorrentes. Os dados são apresentados como média ±DP. A análise da curva ROC (receiver operating characteristic) foi feita para obtenção do índice de Youden (sensibilidade+especificidade‐1), foram calculados os pontos de corte ideais de neutrófilos, monócitos, linfócitos, contagem de plaquetas e RNL, RPL, e RLM. Os resultados foram considerados significantes se os valores dos 2 lados fossem p <0,05. Todas as análises estatísticas foram feitas no software IBM SPSS 20.0 (IBM, Armonk, NY, EUA).
ResultadosDados demográficos e características clínicasOs dados demográficos e as características clínicas dos pacientes são mostradas na tabela 1. A coorte de pacientes foi composta por 59 homens e 24 mulheres (proporção homem:mulher=2,46: 1) com média de 60,78±9,24 anos (variação de 35 a 79 anos). O tempo médio de seguimento foi de 27 meses (variação de 8 a 138 meses). De acordo com o sistema de estadiamento de Pittsburgh, 24 pacientes (28,9%) estavam no estágio inicial (T1‐T2), enquanto 59 pacientes (71,1%) estavam em estágio avançado (T3‐T4). Além disso, 4 pacientes (4,8%) apresentaram metástase linfonodal. Em 42 pacientes (50,6%), os tumores eram bem ou moderadamente diferenciados; em 7 (8,4%), eram pouco diferenciados; e em 34 pacientes (41,0%), esse fator era desconhecido.
Características dos pacientes
| Características clínicas | N (%) |
|---|---|
| Idade (< 60 anos/≥ 60 anos) | 33 (39,8%) / 50 (60,2%) |
| Sexo (masculino/feminino) | 59 (71,1%) / 24 (28,9%) |
| Estágio | |
| T1 | 3 (3,6%) |
| T2 | 21 (25,3%) |
| T3 | 22 (26,5%) |
| T4 | 37 (44,6%) |
| Status dos linfonodos | |
| N0 | 79 (95,2%) |
| N1 | 4 (4,8%) |
| Padrões de diferenciação | |
| Bem e moderadamente diferenciado | 42 (50,6%) |
| Pouco diferenciado | 7 (8,4%) |
| Desconhecido | 34 (41,0%) |
A comparação dos parâmetros hematológicos e clínico‐patológicos é mostrada na tabelas 2 e 3. Como a metástase linfonodal ocorreu em apenas 4 pacientes, não analisamos mais a correlação entre a metástase linfonodal e os parâmetros hematológicos, pois não foi possível estabelecer correlação significante nessa coorte.
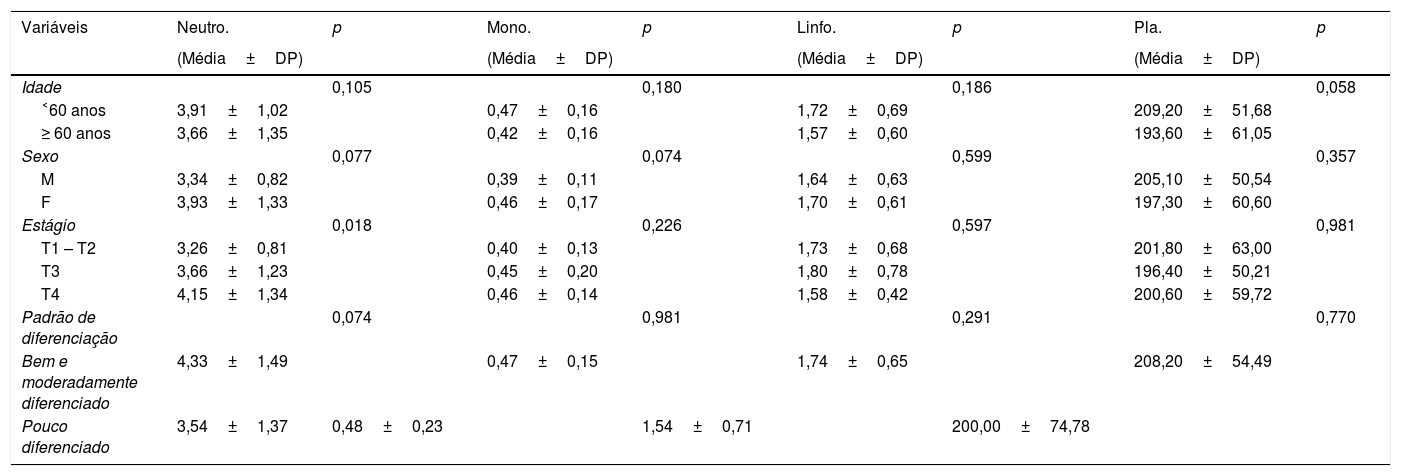
Médias dos parâmetros hematológicos pré‐operatórios (×109), estratificados por características demográficas e clínico‐patológicas
| Variáveis | Neutro. | p | Mono. | p | Linfo. | p | Pla. | p |
|---|---|---|---|---|---|---|---|---|
| (Média±DP) | (Média±DP) | (Média±DP) | (Média±DP) | |||||
| Idade | 0,105 | 0,180 | 0,186 | 0,058 | ||||
| ˂60 anos | 3,91±1,02 | 0,47±0,16 | 1,72±0,69 | 209,20±51,68 | ||||
| ≥ 60 anos | 3,66±1,35 | 0,42±0,16 | 1,57±0,60 | 193,60±61,05 | ||||
| Sexo | 0,077 | 0,074 | 0,599 | 0,357 | ||||
| M | 3,34±0,82 | 0,39±0,11 | 1,64±0,63 | 205,10±50,54 | ||||
| F | 3,93±1,33 | 0,46±0,17 | 1,70±0,61 | 197,30±60,60 | ||||
| Estágio | 0,018 | 0,226 | 0,597 | 0,981 | ||||
| T1 – T2 | 3,26±0,81 | 0,40±0,13 | 1,73±0,68 | 201,80±63,00 | ||||
| T3 | 3,66±1,23 | 0,45±0,20 | 1,80±0,78 | 196,40±50,21 | ||||
| T4 | 4,15±1,34 | 0,46±0,14 | 1,58±0,42 | 200,60±59,72 | ||||
| Padrão de diferenciação | 0,074 | 0,981 | 0,291 | 0,770 | ||||
| Bem e moderadamente diferenciado | 4,33±1,49 | 0,47±0,15 | 1,74±0,65 | 208,20±54,49 | ||||
| Pouco diferenciado | 3,54±1,37 | 0,48±0,23 | 1,54±0,71 | 200,00±74,78 |
Neutro, neutrófilos; Mono, monócitos; Linfo, linfócitos; Pla, plaquetas.
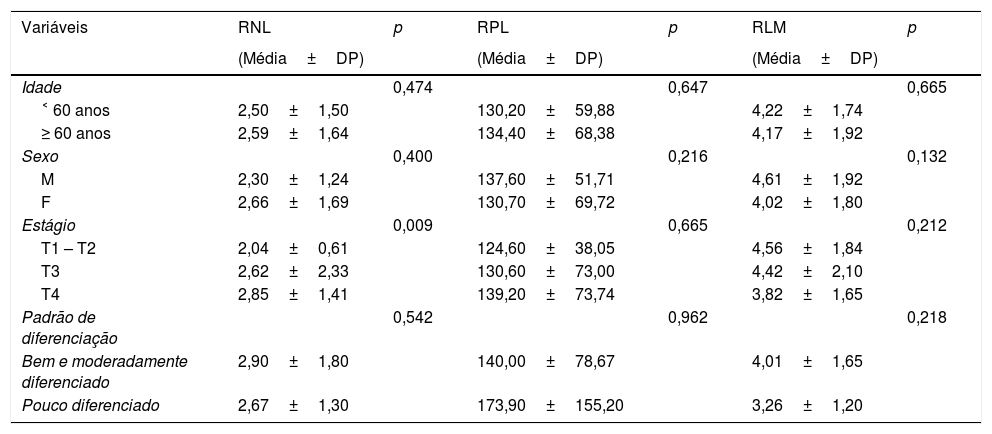
Médias das RNL, RPL e RLM pré‐operatórias, estratificadas por características demográficas e clínico‐patológicas
| Variáveis | RNL | p | RPL | p | RLM | p |
|---|---|---|---|---|---|---|
| (Média±DP) | (Média±DP) | (Média±DP) | ||||
| Idade | 0,474 | 0,647 | 0,665 | |||
| ˂ 60 anos | 2,50±1,50 | 130,20±59,88 | 4,22±1,74 | |||
| ≥ 60 anos | 2,59±1,64 | 134,40±68,38 | 4,17±1,92 | |||
| Sexo | 0,400 | 0,216 | 0,132 | |||
| M | 2,30±1,24 | 137,60±51,71 | 4,61±1,92 | |||
| F | 2,66±1,69 | 130,70±69,72 | 4,02±1,80 | |||
| Estágio | 0,009 | 0,665 | 0,212 | |||
| T1 – T2 | 2,04±0,61 | 124,60±38,05 | 4,56±1,84 | |||
| T3 | 2,62±2,33 | 130,60±73,00 | 4,42±2,10 | |||
| T4 | 2,85±1,41 | 139,20±73,74 | 3,82±1,65 | |||
| Padrão de diferenciação | 0,542 | 0,962 | 0,218 | |||
| Bem e moderadamente diferenciado | 2,90±1,80 | 140,00±78,67 | 4,01±1,65 | |||
| Pouco diferenciado | 2,67±1,30 | 173,90±155,20 | 3,26±1,20 |
M, Masculino; F, feminino; RNL, relação neutrófilos/linfócitos; RPL, relação plaquetas/linfócitos; RLM, relação linfócitos/monócitos.
Não foram encontradas diferenças significantes entre os parâmetros hematológicos e características demográficas, como idade e sexo. No entanto, verificamos que a contagem de neutrófilos e a RNL estão significantemente associadas ao estágio do tumor. Pacientes com câncer em estágio avançado (T3‐4) apresentaram maior contagem de neutrófilos e RNL do que aqueles em estágio inicial (T1‐2). Além disso, não encontramos correlação significante entre os padrões de diferenciação e quaisquer parâmetros hematológicos.
Correlação de parâmetros hematológicos com resultados de seguimentoDurante o seguimento, observamos 26 recorrências. Dos pacientes que apresentaram recorrência, 18 foram a óbito devido ao CEC do meato acústico externo, enquanto 8 permaneceram vivos com recorrência local no último seguimento. Cinquenta e sete pacientes não apresentaram recorrência, entre os quais 55 permaneceram vivos sem evidência da doença, enquanto dois morreram de doença cardíaca e câncer de cólon, respectivamente. Nenhum dos 83 pacientes desenvolveu metástase a distância.
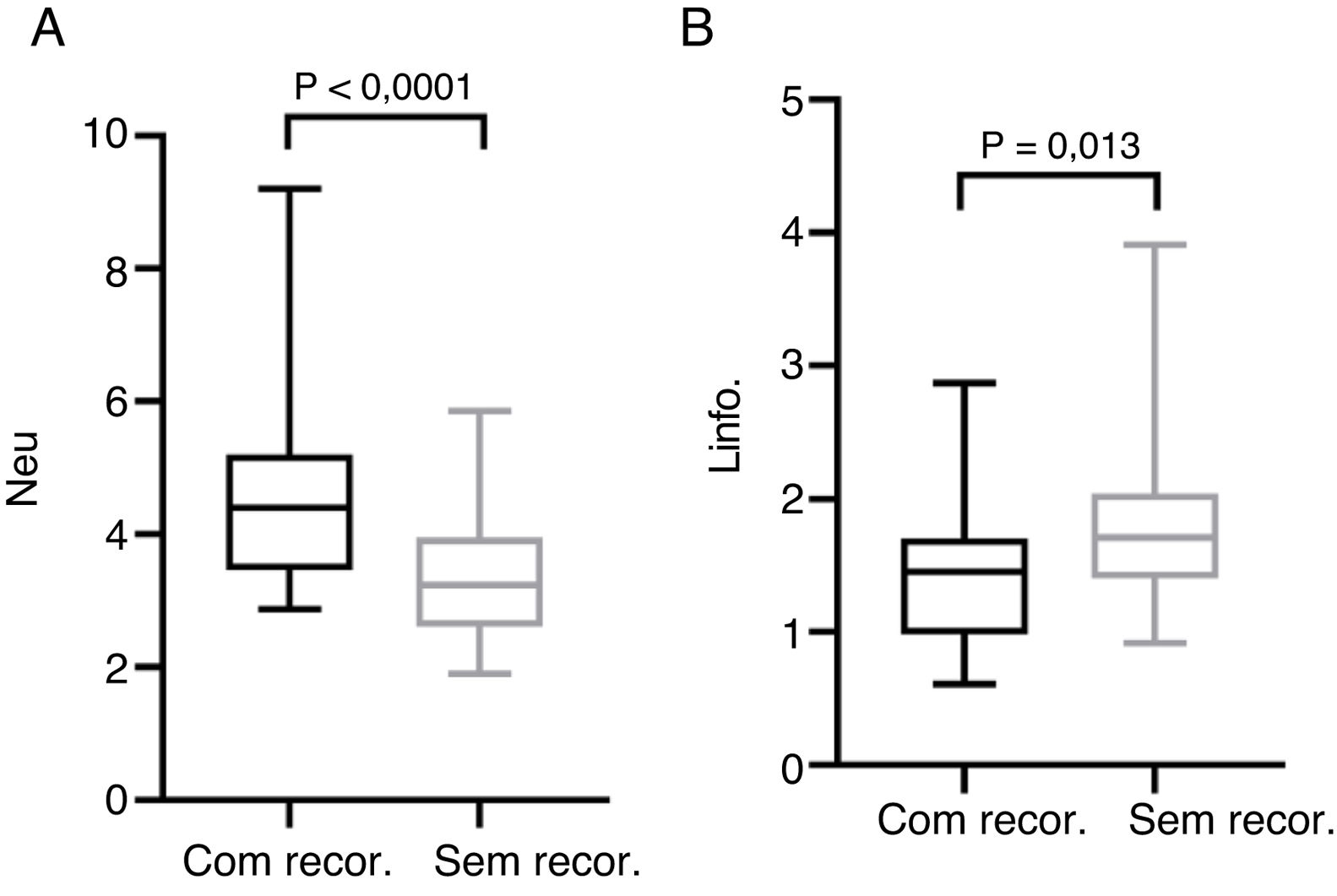
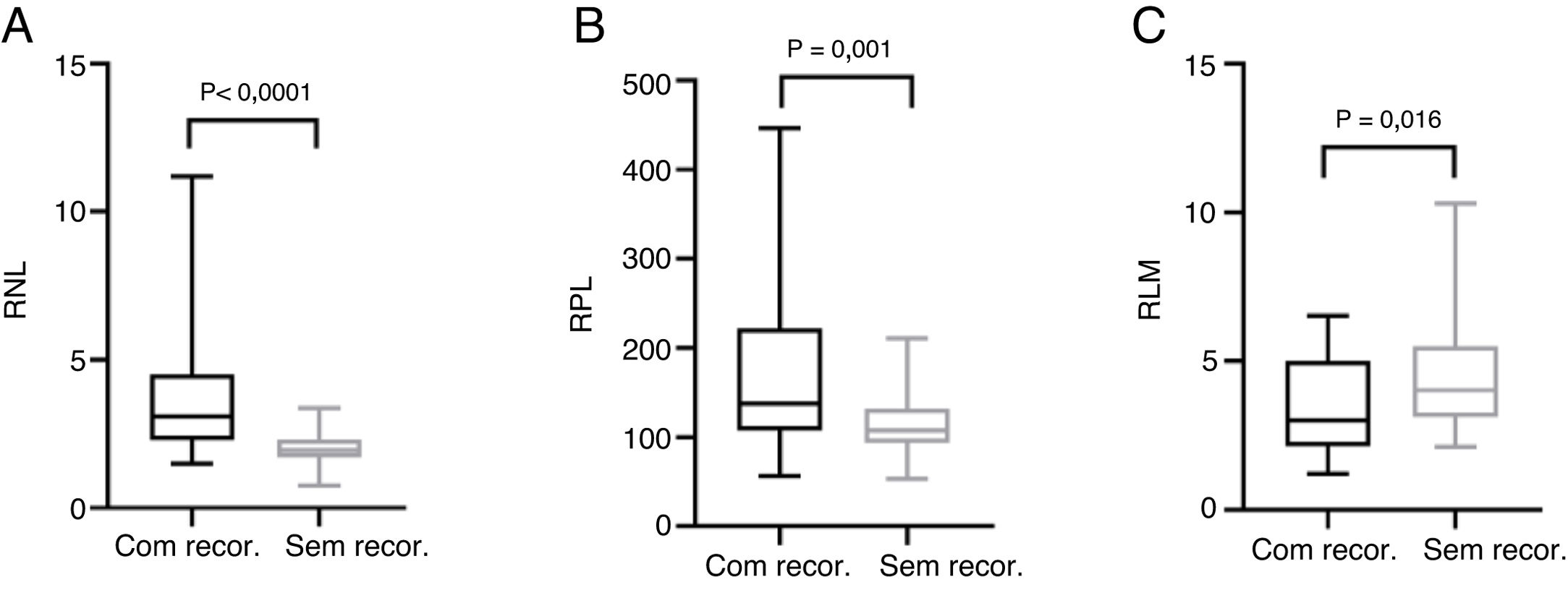
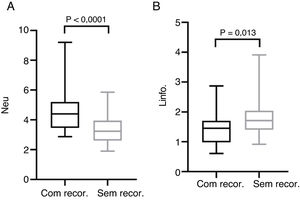
A contagem pré‐operatória média de neutrófilos, monócitos, linfócitos e plaquetas foi de 4,56±1,47, 0,46±0,15, 1,44±0,57 e 212,50±62,10 nos pacientes com recorrência e 3,40±0,91, 0,43±0,16, 1,79±0,60, 194,0±55,18 nos pacientes sem recorrência, respectivamente. As médias pré‐operatórias da RNL RPL e RLM foram de 3,76±2,70, 174,20±93,92, 3,50±1,69 em pacientes com recorrência e 2,00±0,55, 113,80±32,31, 4,50±1,84 em pacientes sem recorrência, respectivamente. O teste de Mann‐Whitney revelou que a contagem de neutrófilos, a RNL e a RPL aumentaram significantemente em pacientes com recorrência (p <0,0001, p <0,0001 e p=0,001, respectivamente), enquanto a contagem de linfócitos e a RLM diminuíram em pacientes com recorrência (p=0,012 e p=0,016, respectivamente) (figs. 1 e 2).
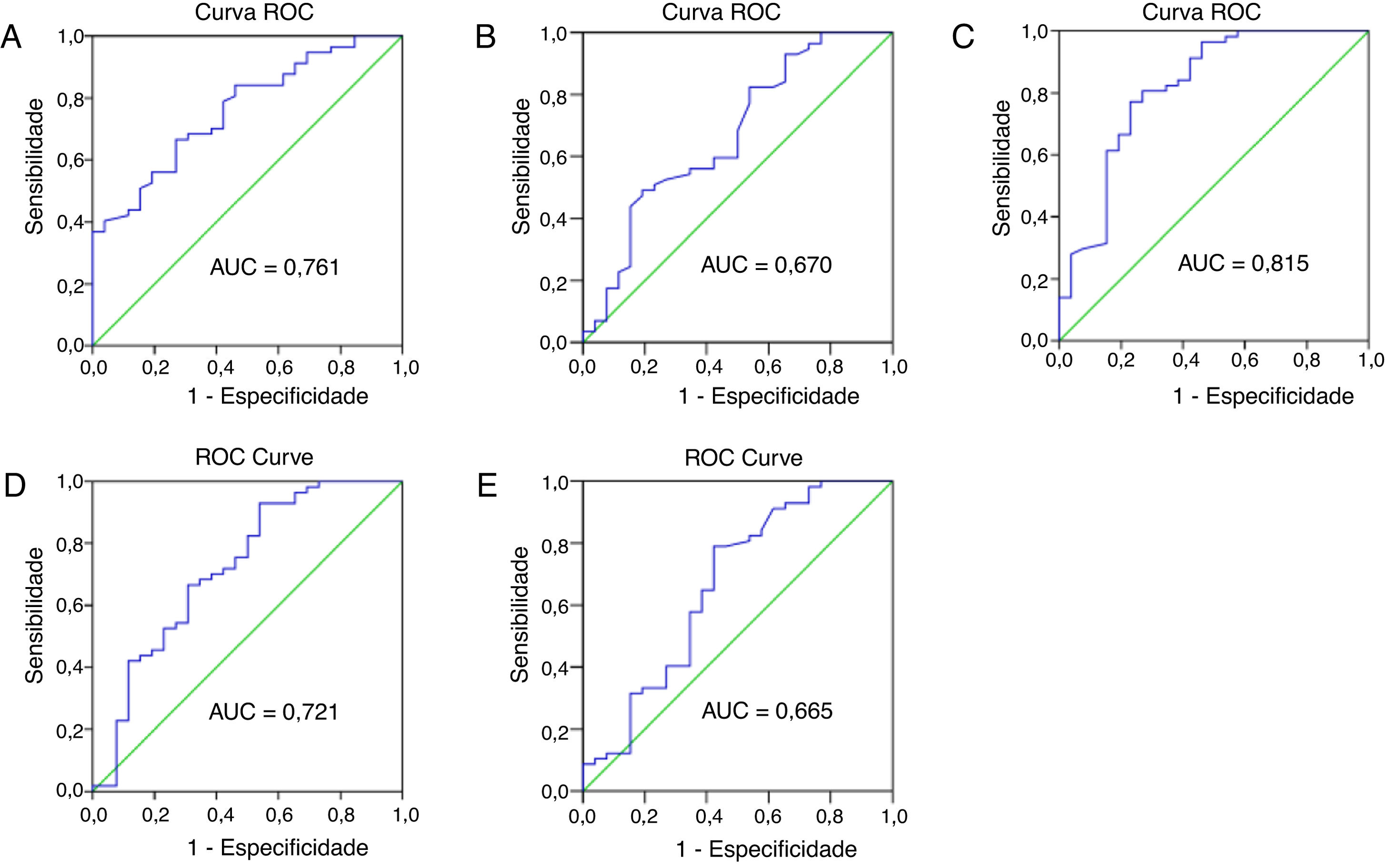
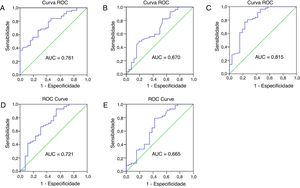
A capacidade prognóstica dos parâmetros hematológicos e relações para pacientes com CEC do meato acústico externo foram analisadas pela curva ROC. Os resultados são mostrados na figura 3. A área sob curva (AUC) das contagens de neutrófilos, linfócitos, plaquetas e monócitos foi de 0,761, 0,670, 0,618 e 0,552, com o intervalo de confiança de 95%, variação de 0,657 a 0,866, 0,539–,801, 0,495‐0,741 e 0,422‐0,482 e p <0,001, <0,05, >0,05 e >0,05, respectivamente. A AUC da RNL, RPL e RLM foi de 0,815, 0,721, 0,665, com o intervalo de confiança de 95%, variação de 0,707 a 0,924, 0,593‐ 0,848, 0,528‐ 0,803 e p <0,0001, <0,01, <0,05, respectivamente. Os pontos de corte foram calculados entre pacientes com recorrência e sem recorrência. Os pontos de corte ideais foram 3,75×109/L para contagem de neutrófilos, 1,77×109/L para contagem de linfócitos, 2,325 para RNL, 157,9 para RPL e 3,065 para RLM.
Curva ROC (Receiver Operating Characteristic) e Área sob a Curva (AUC) para analisar os pontos de corte ideais para contagens de neutrófilos (A) e linfócitos (B), RNL (C), RPL (D) e RLM (E). RNL, relação neutrófilos/linfócitos; RPL, relação plaquetas/linfócitos; RLM, relação linfócitos/monócitos.
Nosso estudo revelou que em pacientes com CEC do meato acústico externo, a contagem pré‐operatória de neutrófilos e linfócitos, a RNL, RPL e RLM estavam associadas à recorrência do tumor. A RNL pode ser um fator prognóstico desfavorável para o desfecho da sobrevida nesses pacientes.
DiscussãoEste estudo avaliou o valor prognóstico de parâmetros hematológicos inflamatórios pré‐operatórios abrangentes (contagem de neutrófilos, plaquetas, linfócitos e monócitos) e relações calculadas (RNL, RPL e RLM) para pacientes com CEC do meato acústico externo. Nossos resultados mostram que a contagem elevada pré‐operatória de neutrófilos, RNL, RPL e a contagem diminuída de linfócitos e RLM estavam significantemente correlacionadas com a recorrência de CEC do meato acústico externo. Em termos de progressão tumoral, nossos resultados mostraram que a contagem de neutrófilos e a RNL estavam correlacionadas com o estágio do tumor. Embora o valor prognóstico dos parâmetros hematológicos pré‐operatórios já tenha sido validado para vários tumores, inclusive câncer de cabeça e pescoço, nosso estudo foi o primeiro a avaliar seu valor prognóstico para pacientes com CEC do meato acústico externo.
Estudos anteriores relataram que os homens têm um número maior de neutrófilos, linfócitos e plaquetas do que as mulheres.9,10 No entanto, neste estudo, não observamos diferença estatística nas contagens e proporções de células sanguíneas entre os sexos e idades. Nosso estudo mostrou que um aumento na contagem de neutrófilos e na RNL está correlacionado com o estágio do tumor. Os neutrófilos são células mieloides derivadas da medula óssea que podem ser recrutadas por tumores, onde promovem a progressão tumoral, facilitam a angiogênese, inibem a atividade das células T e participam de outros eventos biológicos.11,12 Isso pode explicar a correlação entre o estágio do tumor e a contagem de neutrófilos e RNL.
Além disso, os neutrófilos têm um papel duplo estabelecido na defesa do hospedeiro contra infecções, secretam citocinas e enzimas que estimulam o crescimento tumoral e promovem a angiogênese e metástase do tumor.13 Além disso, os neutrófilos podem se comportar como células imunossupressoras, inibem a atividade das células T através da produção de nitrogênio e espécies reativas de oxigênio.14 Essa observação pode explicar por que a RNL é um fator prognóstico útil em pacientes com câncer. Balermpas et al.15 relataram que uma taxa de sobrevida favorável em pacientes com câncer de cabeça e pescoço estava associada a níveis mais elevados no pré‐tratamento dos infiltrados de linfócitos CD3+e CD8+. Zhang et al.,16 mostraram que a ausência de células T intratumorais no carcinoma ovariano está associada a uma expressão aumentada do fator de crescimento endotelial vascular (VEGF, Vascular Endothelial Growth Factor), que promove a angiogênese do tumor. A presença de células T intratumorais está correlacionada com uma recorrência tardia e uma taxa de sobrevida melhorada. As plaquetas podem estimular a metástase tumoral e promover a agregação celular para proteger as células tumorais da vigilância imunológica. Níveis aumentados de plaquetas podem estimular a atividade dos osteoclastos e facilitar a metástase óssea.17 Os monócitos circulantes são recrutados para o local do tumor, onde se diferenciam em macrófagos associados ao tumor (TAMs, Tumor‐Associated Macrophages) através de quimiocinas produzidas pelo tumor. Os TAMs produzem uma variedade de moléculas que promovem a angiogênese tumoral e estimulam o crescimento de células tumorais, como VEGF, IL‐1, fator induzível por hipóxia‐2α, fator de crescimento de fibroblastos e fator de crescimento de hepatócitos. Os TAMs também contribuem para a metástase do tumor ao produzir proteases da membrana basal.18 Em resumo, extensos estudos demonstraram interações entre parâmetros hematológicos periféricos e tumores.
Estudos anteriores relataram que a RNL prediz significantemente um pior resultado em vários tipos de câncer.19,20 Adicionalmente, altos níveis de neutrófilos e monócitos e baixos níveis de linfócitos circulantes foram correlacionados com mau prognóstico.21,22 Além disso, Rachidi et al.23 confirmaram independentemente que uma contagem mais baixa de plaquetas previa um melhor prognóstico e que a administração de agentes antiplaquetários melhorava a sobrevida de pacientes com CEC de cabeça e pescoço. Xie et al.24 mostraram que a RPL pré‐operatória se correlacionava inversamente com a sobrevivência específica por câncer (CSS, Cancer Specific Survival) em pacientes com CEC esofágico. Vários estudos relataram que a RLM está associada ao prognóstico em pacientes com câncer. Esses resultados validam o uso de marcadores de inflamação periférica para prever resultados pós‐operatórios em pacientes com câncer. Neste estudo, observamos que as contagens pré‐operatórias de neutrófilos, RNL e RPL eram maiores, enquanto as contagens de linfócitos e RLM eram menores nos pacientes com recorrência em comparação aos pacientes sem recorrência. Como mostrado na figura 3, os pontos de corte foram 3,75×109/L para contagens de neutrófilos, 1,77×109/L para contagens de linfócitos, 2,325 para RNL, 157,9 para RPL e 3,065 para RLM. A RNL pode servir como um potencial marcador prognóstico na prática clínica, com um valor ideal da AUC de 0,816.
Entretanto, este estudo apresentou algumas limitações, inclusive seu desenho retrospectivo e o tamanho da amostra relativamente pequeno, o que pode levar a vieses de referência. Portanto, são necessários mais estudos para validar o papel e a utilidade prognóstica dos marcadores inflamatórios sistêmicos nesses pacientes.
ConclusãoTomados em conjunto, nossos resultados sugeriram que a contagem pré‐operatória de neutrófilos e linfócitos, RNL, RPL e RLM está significantemente relacionada à recorrência do CEC do meato acústico externo. Além disso, a RNL pode servir como potencial marcador prognóstico para prever piores desfechos nestes pacientes.
FinanciamentoNational Natural Science Foundation of China (n° 81771009).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Li F, Shi X, Dai C. Prognostic value of pre‐operative peripheral inflammation markers in patients with squamous cell carcinoma of the external auditory canal. Braz J Otorhinolaryngol. 2022;88:161–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.