Diferentes teorias já foram propostas sobre a etiologia do zumbido, inclusive causas metabólicas e audiológicas. Acreditamos que os níveis do volume plaquetário médio e da relação neutrófilos/linfócitos se alteram no zumbido, sugerem distúrbio microcirculatório e processo inflamatório na etiopatogenia do zumbido.
ObjetivoAvaliar o volume plaquetário médio e a relação neutrófilos/linfócitos em pacientes com zumbido em comparação com controles saudáveis.
MétodoEstudo de caso‐controle retrospectivo, com 287 pacientes entre 18 e 59 anos e diagnosticados com zumbido na Clínica de Otorrinolaringologia entre dezembro de 2014 e maio de 2017 (grupo pacientes) e 275 indivíduos saudáveis que solicitaram uma triagem auditiva no mesmo período (grupo controle). Foram registrados dados demográficos, doenças concomitantes, resultados laboratoriais e dados audiométricos. O volume plaquetário médio e a relação neutrófilos/linfócitos foram as medidas de desfecho. Pacientes com perda auditiva por presbiacusia ou por outros motivos e pacientes com distúrbios anatômicos na orelha externa e média foram excluídos do estudo por meio de exame físico, resultados de audiometria tonal pura e imagens radiológicas. O limite de idade superior foi fixado em 59 anos para excluir pacientes com presbiacusia.
ResultadosA proporção de pacientes do sexo feminino foi maior no grupo de pacientes do que no grupo controle (58,5%, n=168 vs. 49,4%, n=127; respectivamente; p=0,033). A média de idade do grupo de pacientes era significantemente maior do que a do grupo controle (44,89±10,96 anos e 38,37±10,65 anos, respectivamente; p=0,001). A porcentagem de indivíduos com nível alto de volume plaquetário médio foi significantemente maior no grupo de pacientes do que no grupo controle (9,4%, n=27 e 3,1%, n=8, respectivamente; p=0,008). A relação neutrófilos/linfócitos média foi maior nos pacientes com zumbido do que no grupo controle (1,95±1,02 e 1,67±0,57, p=0,012). Um nível de relação neutrófilos/linfócitos de 2,17 e acima está associado a um risco 1,991 vez maior de zumbido (odds ratio=1,99, Intervalo de Confiança de 95% 1,31 a 3,02).
ConclusãoAltos valores de volume plaquetário médio e relação neutrófilos/linfócitos estão associados ao zumbido idiopático, sugerem o papel de doenças vasculares na etiologia do zumbido. O zumbido pode ser um sinal de distúrbios sistêmicos ou locais subjacentes. Portanto, pacientes com zumbido devem ser submetidos a uma avaliação detalhada, inclusive índices hematológicos.
O zumbido é a percepção de sons anormais, como um fluxo rápido sonoro de um zunido, assobio, vibração e sussurro nas orelhas. É uma condição comum que afeta cerca de um quinto da população em geral, portanto constitui‐se numa razão significativa para consultas em clínicas otorrinolaringológicas.1–3 Como seu tratamento é direcionado à causa subjacente, a etiologia do zumbido deve ser bem compreendida.
Diferentes teorias foram propostas sobre a etiologia do zumbido, inclusive causas metabólicas e audiológicas. Uma das teorias sugere que um dano nas sinapses patológicas em fibras nervosas adjacentes possa ser a causa subjacente do zumbido.4,5 Outra teoria propõe que qualquer dano às células ciliadas internas ou externas possa causar zumbido, ao aumentar sua atividade espontânea.4,5 Como a orelha interna possui suprimento sanguíneo sem colaterais, também foi sugerido que os distúrbios microcirculatórios possam desempenhar um papel nos fatores produtores dezumbido. Nos últimos anos, o volume plaquetário médio (VPM) e a relação neutrófilos/linfócitos (RNL) têm sido rotineiramente estudados para investigar a etiopatogenia e o prognóstico de doenças microvasculares.6–8 Foi sugerido que o risco de trombose possa aumentar à medida que o tamanho dos trombócitos cresce em doenças microvasculares.6–8 Portanto, o VPM alto tem sido associado a alta incidência de complicações microvasculares na diabetes mellitus e aumento da mortalidade na doença arterial coronariana.9,10 A RNL tem sido considerada como um indicador de estresse inflamatório e usada como um marcador do status inflamatório sistêmico.11 Foi relatado que valores aumentados da RNL estão correlacionados à alta mortalidade em pacientes com doença arterial coronariana.12 Com base nessas informações, acreditamos que os níveis de VPM e RNL possam estar alterados no zumbido, indicam distúrbio microcirculatório e processo inflamatório na etiopatogenia do zumbido.
Portanto, neste estudo objetivamos avaliar os níveis de VPM e RNL em pacientes com zumbido em comparação com controles saudáveis.
MétodoDesenho e população do estudoForam incluídos neste estudo de caso‐controle retrospectivo 287 pacientes entre 18 e 59 anos e diagnosticados com zumbido na Clínica de Otorrinolaringologia entre dezembro de 2014 e maio de 2017 (grupo de pacientes) e 257 indivíduos saudáveis que solicitaram triagem auditiva no mesmo período (grupo controle). Foram excluídos do estudo pacientes que apresentavam distúrbios anatômicos da orelha externa e média, determinados pelos achados ao exame físico e tomografia computadorizada, histórico de cirurgia na orelha e audiometria, e aqueles com média de tom puro superior a 20dB no audiograma. O limite de idade superior foi fixado em 59 anos para excluir pacientes com presbiacusia.
O estudo foi aprovado pelo comitê de ética em pesquisa clínica institucional e conduzido de acordo com os princípios éticos para pesquisas médicas que envolvem seres humanos descritos na Declaração de Helsinque (número de aprovação do comitê de ética: 2017/67). A necessidade do consentimento informado foi dispensada devido ao desenho retrospectivo do estudo.
Dados demográficos, histórico médico, doenças concomitantes, achados do exame físico, resultados laboratoriais e dados audiométricos foram registrados e comparados estatisticamente entre os grupos de pacientes e controle.
A faixa normal de VPM no hemograma completo foi aceita como 4,5–8,5 fentolitros (fL).13 As medidas de neutrófilos e linfócitos foram usadas para calcular a RNL.
Os dados audiométricos foram analisados com médias de tons puros de sete frequências (250Hz, 500Hz, 1000Hz, 2000Hz, 4000Hz, 6000Hz e 8000Hz) de condução aérea e óssea para ambas as orelhas.
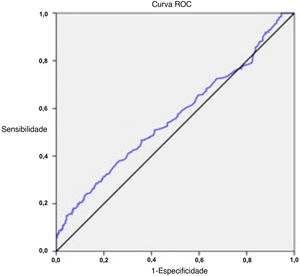
Análise estatísticaOs dados do estudo foram resumidos com estatística descritiva (por exemplo, média, desvio‐padrão, mediana, intervalo, frequência, porcentagem). O software Number Cruncher Statistical System (NCSS, 2007; Kaysville, Utah, EUA) foi usado para a análise estatística. Para testar a significância da diferença nas variáveis contínuas entre os grupos de estudo, o teste t de Student ou o teste U de Mann‐Whitney foram usados para dados distribuídos normalmente ou não normalmente, respectivamente. O teste do qui‐quadrado foi usado para comparação dos dados qualitativos entre os grupos de estudo. O valor preditivo da RNL para o zumbido foi avaliado com a análise ROC (Receiver Operating Characteristic) e o ponto de corte ideal da RNL foi determinado com alta sensibilidade ou alta especificidade. O odds ratio foi calculado como uma estimativa do risco relativo da RNL de corte no zumbido como desfecho. A significância estatística foi definida como p <0,05.
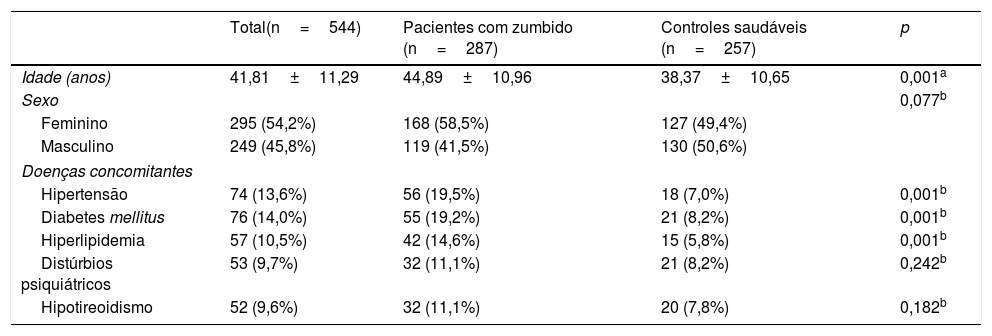
ResultadosDos 544 pacientes incluídos no estudo, 54,2% eram do sexo feminino e 45,8% do masculino. A proporção de pacientes do sexo feminino foi maior no grupo zumbido do que no grupo controle (58,5% vs. 41,5%, respectivamente; p=0,077) (tabela 1). A idade da população estudada variou de 18 a 59 anos, com média de 41,81±11,29. A média de idade dos pacientes com zumbido foi significantemente maior do que a do grupo controle (44,89±10,96 anos e 38,37±10,65 anos, respectivamente; p=0,001) (tabela 1).
Dados demográficos e doenças concomitantes dos grupos de estudo
| Total(n=544) | Pacientes com zumbido (n=287) | Controles saudáveis (n=257) | p | |
|---|---|---|---|---|
| Idade (anos) | 41,81±11,29 | 44,89±10,96 | 38,37±10,65 | 0,001a |
| Sexo | 0,077b | |||
| Feminino | 295 (54,2%) | 168 (58,5%) | 127 (49,4%) | |
| Masculino | 249 (45,8%) | 119 (41,5%) | 130 (50,6%) | |
| Doenças concomitantes | ||||
| Hipertensão | 74 (13,6%) | 56 (19,5%) | 18 (7,0%) | 0,001b |
| Diabetes mellitus | 76 (14,0%) | 55 (19,2%) | 21 (8,2%) | 0,001b |
| Hiperlipidemia | 57 (10,5%) | 42 (14,6%) | 15 (5,8%) | 0,001b |
| Distúrbios psiquiátricos | 53 (9,7%) | 32 (11,1%) | 21 (8,2%) | 0,242b |
| Hipotireoidismo | 52 (9,6%) | 32 (11,1%) | 20 (7,8%) | 0,182b |
As doenças concomitantes registradas em toda a população estudada foram hipertensão (13,6%), diabetes mellitus (14,0%), hiperlipidemia (10,5%), distúrbios psiquiátricos (9,7%) e hipotireoidismo (9,6%) (tabela 1). A hipertensão, diabetes mellitus e hiperlipidemia foram significantemente mais comuns em pacientes com zumbido do que no grupo controle (p=0,001 para todos) (tabela 1).
Não houve diferença estatisticamente significante entre os grupos em termos de médias de tons puros em todas as frequências (p >0,05).
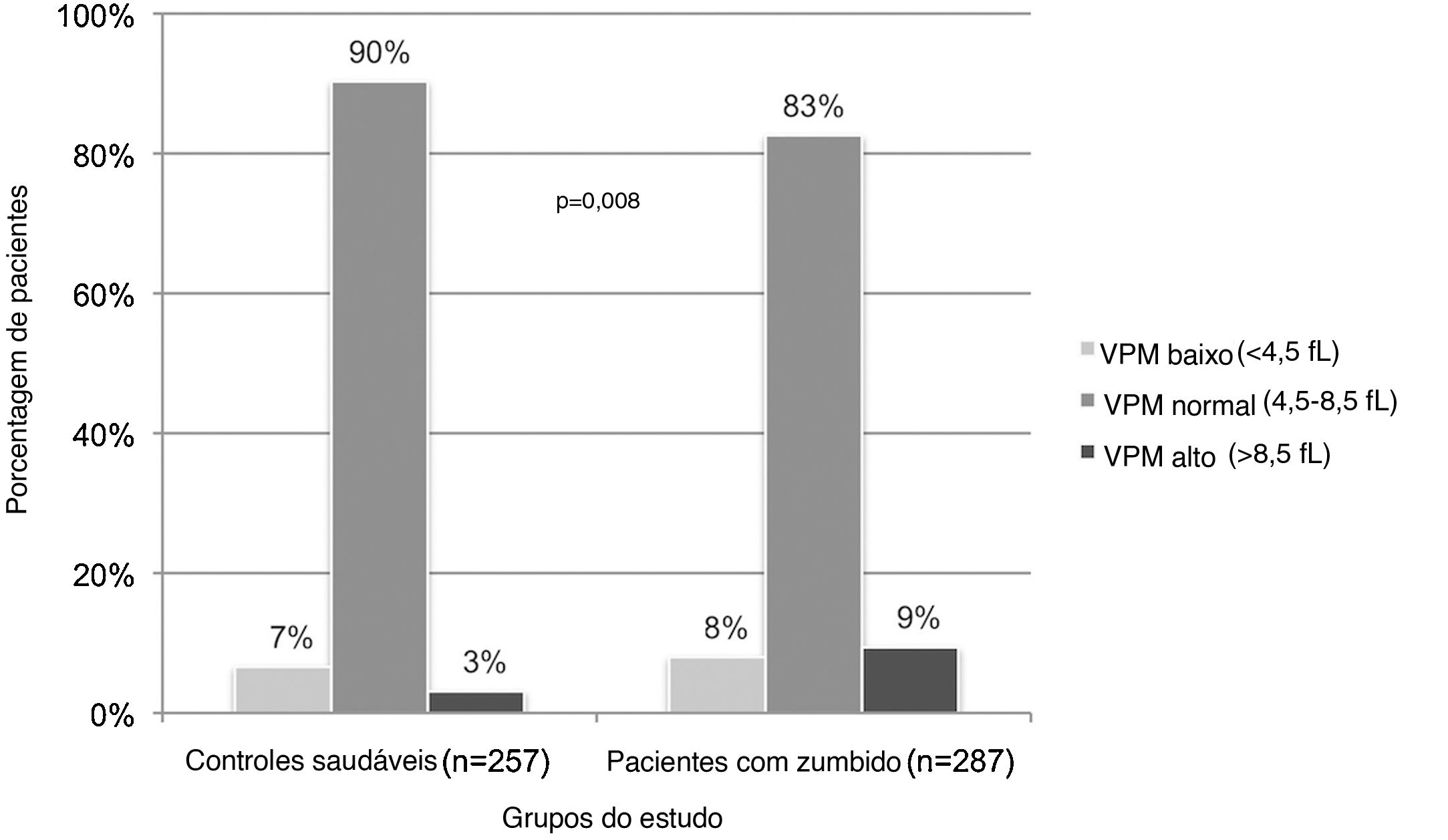
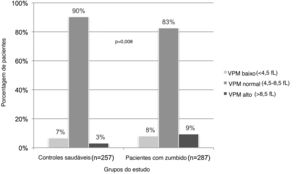
Os níveis de VPM estavam dentro dos limites normais em 86,2% de toda a população do estudo. A porcentagem de indivíduos com alto nível de VPM foi significantemente maior no grupo com zumbido do que no grupo controle (9,4% e 3,1%, respectivamente; p=0,008) (tabela 2, fig. 1).
Volume plaquetário médio e relação neutrófilos/linfócitos dos grupos estudados
| Total(n=544) | Pacientes com zumbido(n=287) | Controles saudáveis(n=257) | p | |
|---|---|---|---|---|
| VPM | 0,008a | |||
| Baixo (<4,5 fL) | 40 (7,4%) | 23 (8,0%) | 17 (6,6%) | |
| Normal (4,5–8,5 fL) | 469 (86,2%) | 237 (82,6%) | 232 (90,3%) | |
| Alto (> 8,5 fL) | 35 (6,4%) | 27 (9,4%) | 8 (3,1%) | |
| RNL | 1,82±0,85 | 1,95±1,02 | 1,67±0,57 | 0,012b |
| 1,6 (0,6–9,9) | 1,7 (0,9–9,9) | 1,6 (0,6–3,7) |
VPM, volume médio plaquetário; RNL, relação neutrófilos/linfócitos; Fl, fentolitro.
Volume plaquetário médio (VPM) de controles saudáveis e pacientes com zumbido. Como a porcentagem de indivíduos com nível normal de VPM foi menor no grupo com zumbido do que no grupo controle, aqueles com nível baixo ou alto de VPM foram significantemente maiores (p=0,008); (fL, fentolitro).
A RNL média da população estudada foi de 1,82±0,85, foi maior nos pacientes com zumbido do que no grupo controle (1,95±1,02 e 1,67±0,57, p=0,012) (tabela 2).
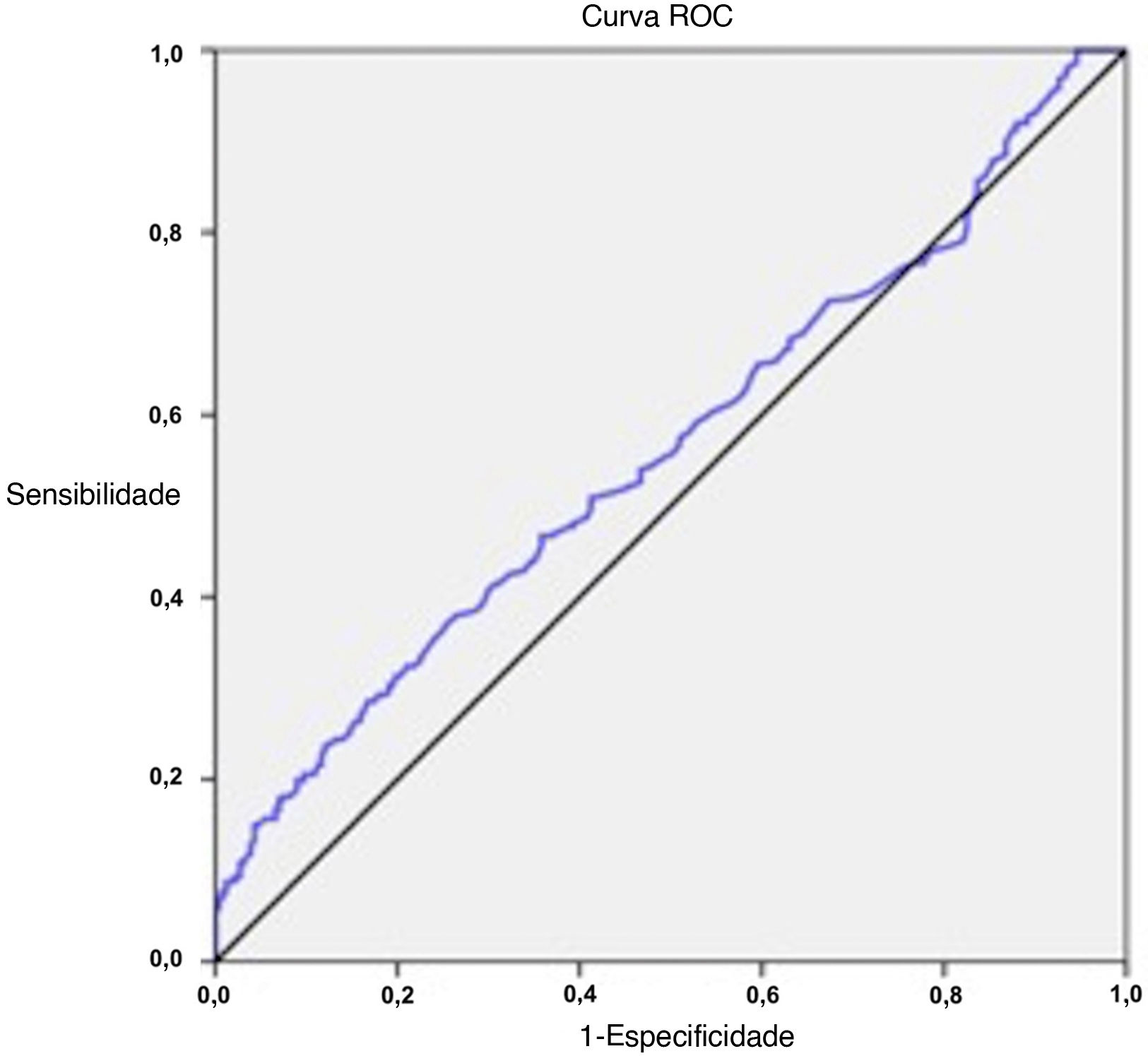
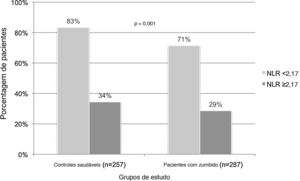
O valor de corte ideal da RNL para o zumbido foi calculado como 2,17 (sensibilidade 28,6%, especificidade 83,3%) na análise ROC (tabela 3, fig. 2). A porcentagem de pacientes com RNL de 2,17 e acima foi de 65,6% no grupo com zumbido e 34,4% no grupo controle (p=0,001) (fig. 3). Um nível de RNL de 2,17 e acima pode estar associado a um risco 1,99 vezes maior de zumbido (OR=1,99, IC 95% 1,31–3,02) (tabela 3).
Valor preditivo da relação neutrófilos/linfócitos para o zumbido na análise ROC
| Valor preditivo da RNL | Curva ROC | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Valor de corte | Sensibilidade | Especificidade | VPP | VPN | OR | IC95% | AUC | IC95% | p |
| ≥2,17 | 28,6% | 83,3% | 65,60 | 51,07 | 1,99 | 1,31–3,02 | 0,563 | 0,515–0.611 | 0,011 |
RNL, relação neutrófilos/linfócitos; ROC, Receiver Operating Characteristic; VPP, valor preditivo positivo; VPN, valor preditivo negativo; OR, odds ratio; IC, intervalo de confiança, AUC, área sob a curva.
Neste estudo de caso‐controle, observamos principalmente que os níveis de VPM e RNL são significantemente mais altos em pacientes com zumbido do que em indivíduos saudáveis. Também calculamos um valor de corte de RNL de 2,17, associado ao risco 1,991 maior de zumbido. Além disso, registramos que hipertensão, diabetes mellitus e hiperlipidemia eram significantemente mais comuns em pacientes com zumbido.
O zumbido é mais comum na população acima de 50 anos.14–16 A incidência de zumbido tem aumentado com o aumento da perda auditiva progressiva relacionada à idade no envelhecimento da população.17–19 Em nosso estudo, definimos o limite superior de 59 anos para excluir pacientes com presbiacusia. Além disso, foram excluídos os pacientes com perda auditiva neurossensorial bilateral de início precoce, de acordo com os dados audiométricos. Na maioria dos estudos anteriores sobre zumbido, os indivíduos com presbiacusia foram incluídos sem limite superior de idade.17–19 A média de idade significantemente mais alta dos pacientes com zumbido do que a dos indivíduos saudáveis em nosso estudo foi interpretada como o aumento da incidência de zumbido em idades mais avançadas. Cremos que, embora a perda auditiva relacionada à idade ainda não tivesse se desenvolvido, o zumbido é uma queixa crescente em idades mais avançadas. Portanto, é necessário avaliar outros fatores etiológicos responsáveis pelo aumento da incidência de zumbido com a idade.
Em estudos anteriores, foram obtidos resultados conflitantes sobre a distribuição do zumbido por gênero. Schulman et al.14 relataram que não houve diferença entre pacientes do sexo masculino e feminino em termos de frequência de zumbido. Em outro estudo, o zumbido era mais comum em pacientes jovens do sexo masculino do que em mulheres jovens, mas à medida que a idade aumentava as taxas eram similares entre os sexos.20 Martines et al.15 verificaram que a frequência do zumbido aumentou significantemente em indivíduos do sexo masculino com 50 anos ou mais. Vernon et al.21 relataram que o zumbido é mais comum em homens do que mulheres em todas as faixas etárias. De forma contrária, Kim et al.16 relataram que a taxa de indivíduos do sexo feminino era maior no grupo do zumbido do que no grupo controle, indicou que o zumbido é mais comum entre as mulheres do que os homens.
Estudos recentes mostraram que a hipertensão aumenta o risco de zumbido.15,22,23 Em apoio a essa associação, verificamos que a hipertensão era significantemente mais comum no grupo com zumbido do que no grupo controle. Figueiredo et al.23 relataram que alterações na pressão arterial podem induzir o zumbido, ao afetar a microcirculação coclear ou que o zumbido pode resultar do uso de anti‐hipertensivos como verapamil e enalapril nesses pacientes. Em nosso estudo, o uso de anti‐hipertensivos na população estudada não foi questionado. Se os pacientes em uso de anti‐hipertensivos fossem excluídos do estudo, a relação entre hipertensão e zumbido poderia ser mais claramente demonstrada e a hipótese de que a hipertensão pode interromper a microcirculação coclear seria testada.
Somogyi et al.24 sugeriram que o diabetes tipo 2 aumenta a frequência do zumbido e que o zumbido ocorre mais cedo em pacientes com diabetes tipo 2. Em nosso estudo, a diabetes mellitus foi significantemente mais prevalente no grupo zumbido do que no grupo controle, apoiou uma associação entre diabetes mellitus e zumbido. Embora os pacientes com perda auditiva relacionada à idade tenham sido excluídos do estudo ao estabelecer um limite superior de idade, os indivíduos com zumbido ainda tinham uma idade significantemente maior. Acreditamos que a diabetes mellitus seja uma causa de zumbido ao afetar a microcirculação coclear e pode ser uma das razões pelas quais o zumbido é mais comum em idade avançada em nossa população.
Martines et al.15 verificaram que a frequência do zumbido aumentou significantemente nos casos com hipercolesterolemia. Da mesma forma, Kim et al.16 relataram que a hiperlipidemia constitui um fator de risco para o zumbido. Paralelamente a esses relatos, a taxa de hiperlipidemia foi significantemente maior em pacientes com zumbido do que nos controles saudáveis em nosso estudo.
Kim et al.16 sugeriram que a presença de estresse e depressão constituía um fator de risco para o zumbido. Fetoni et al.25 observaram que o escore no Tinnitus Disability Questionnaire era maior à medida que o nível de depressão‐ansiedade aumentava. Ziai et al. 26 encontraram uma associação significante entre zumbido e distúrbios psiquiátricos. Diferentemente da maioria dos estudos na literatura, a prevalência de distúrbios psiquiátricos em nosso estudo não diferiu significantemente entre os pacientes e os grupos controle.
Kim et al.16 também observaram que a doença da tireoide era um fator de risco para o zumbido. No entanto, o hipotireoidismo não foi associado ao zumbido em nosso estudo.
Nos estudos anteriores, os valores de VPM em indivíduos com zumbido subjetivo foram maiores.27,28 Em acordo com esses estudos, verificamos que, em comparação com controles saudáveis, altos valores de VPM foram significantemente mais prevalentes no grupo de zumbido. Macrotrombócitos podem causar distúrbio na circulação coclear devido ao seu alto potencial trombótico.6 O dano neuronal às células ciliadas aumenta sua atividade espontânea, estabelece sinapses anormais e envia informações falsas ao córtex auditivo, o que faz com que o paciente ouça um som.6
Özbay et al.29 compararam os valores de RNL de indivíduos com e sem zumbido e relataram que aqueles com zumbido apresentaram RNL significantemente maior. Da mesma forma, em nosso estudo, o grupo com zumbido apresentou valores de RNL significantemente mais altos do que o grupo controle. Na análise ROC, o valor de corte da RNL para predizer o zumbido com alta especificidade foi de 2,17. A RNL é um fator etiológico e prognóstico para doenças caracterizadas por falha na microcirculação e dano ao órgão final.30 O aumento da RNL no zumbido sugere que a falha na microcirculação coclear possa ser a doença subjacente ao zumbido.
A principal limitação do presente estudo foi seu desenho retrospectivo, o que limita o controle de fatores de confusão que afetam o VPM e a RNL, e nos impede de chegar a uma conclusão definitiva sobre doenças vasculares na etiologia do zumbido. Novos estudos prospectivos, randomizados e em larga escala são necessários para definir claramente sua etiopatogenia.
ConclusãoAltos valores de VPM e RNL podem estar associados ao zumbido idiopático, sugerem um papel das doenças vasculares na etiologia do zumbido. Embora o zumbido seja apenas um sintoma, pode indicar distúrbios sistêmicos subjacentes. Portanto, pacientes com zumbido devem ser submetidos a exame sistêmico detalhado, histórico médico e exames laboratoriais, incluindo índices hematológicos.
FinanciamentoEsta pesquisa não recebeu nenhuma bolsa específica de agências de financiamento nos setores público, comercial ou sem fins lucrativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Yildiz S, Karaca H, Toros SZ. Mean platelet volume and neutrophil to lymphocyte ratio in patients with tinnitus: a case‐control study. Braz J Otorhinolaryngol. 2022;88:155–60.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.