A rinossinusite crônica, atualmente, é classificada em dois tipos: Rinossinusite Crônica sem Pólipos Nasais (RSCsPN) e Rinossinusite Crônica com Pólipos Nasais (RSCcPN). No Ocidente, cerca de 80% dos casos de RSCcPN caracterizam‐se por um infiltrado celular predominantemente eosinofílico e um padrão de citocinas Th2.
ObjetivoAvaliar o efeito do Interferon‐alpha nos níveis de citocinas do sobrenadante de culturas celulares de pólipos nasais eosinofílicos.
MétodoForam feitas culturas celulares a partir de amostras de tecido polipoide nasal coletadas de 13 pacientes com RSCcPN eosinofílica. Os pólipos eram considerados eosinofílicos segundo exame histopatológico. As culturas celulares foram estimuladas com 3000 UI de IFN‐α. Antes e após tal estímulo, foram avaliadas, no sobrenadante das culturas celulares, as concentrações do Interferon‐γ (IFN‐γ), do Fator de Necrose Tumoral alfa (TNF‐α) e das Interleucinas (IL) 2, 4, 6 e 10, usou‐se o Cytometric Bead Array.
ResultadosForam incluídas no estudo amostras celulares dos pólipos nasais eosinofílicos de 13 pacientes. Vinte e quatro horas após o estímulo com IFN‐α, os sobrenadantes das culturas dos pólipos nasais eosinofílicos apresentaram, de forma significante, diminuição da concentração de IL‐4 e aumento das concentrações de IFN‐γ, IL‐10 e IL‐6, em relação ao controle. Não houve diferença significante nas concentrações de TNF‐α e IL‐2.
ConclusãoDemonstramos que o IFN‐α, in vitro, altera o padrão de citocinas nas culturas celulares de pólipos nasais eosinofílicos. A análise do conjunto dessas alterações sugere que o IFN‐α promove, nas culturas celulares, um rebalanceamento dos perfis inflamatórios, favorece a expressão de citocinas Th1 e regulatórias, em detrimento de citocinas do padrão Th2.
A rinossinusite crônica (RSC) é uma doença multifatorial complexa, caracterizada por inflamação da mucosa nasossinusal por mais de 12 semanas. Habitualmente, distinguem‐se duas apresentações fenotípicas da RSC, segundo a presença de pólipos nasais (PN): RSC sem PN (RSCsPN) e RSC com PN (RSCcPN).1 Aspectos relacionados ao infiltrado celular, padrão de citocinas e remodelação tecidual revelam‐se distintos entre a RSCsPN e a RSCcPN. A RSCsPN, frequentemente, associa‐se a um padrão de resposta Th1, com predomínio de IFN‐γ e TGF‐β1, permeado por um infiltrado celular predominantemente mononuclear. Do ponto de vista estrutural, destaca‐se, na RSCsPN, predomínio de fibrose, hiperplasia de goblet cell, espessamento da membrana basal e edema subepitelial.2 Por outro lado, a RSCcPN relaciona‐se, comumente, a um padrão de resposta Th2, com predomínio de IL‐4, IL‐5 e IL‐13, somado a um infiltrado celular predominantemente granulocítico, com destaque aos eosinófilos. Com relação à remodelação tecidual, há, na RSCcPN, intenso edema estromal com depósito de albumina, formação de pseudocistos, espessamento da membrana basal, hiperplasia epitelial e escassez glandular.3 De fato, pesquisas, em pacientes ocidentais com RSCcPN demonstram que cerca de 80% dos pólipos nasais apresentam infiltrado celular essencialmente eosinofílico.4,5 Entretanto, estudos que envolveram a população asiática, em especial China, Coreia e Japão, revelam que mais de 50% dos casos de RSCcPN não apresentam predominância eosinofílica e, em alguns casos, os neutrófilos são as células dominantes.6–8 Desse modo, fica evidente que a RSCcPN não representa um grupo homogêneo no que diz respeito às suas características imunológicas e histológicas. Uma vez que o fenótipo de RSCcPN não pressupõe um completo esclarecimento a respeito da fisiopatogenia celular e molecular subjacente, os estudos atuais têm caminhado na direção de que a RSCcPN seria constituída de subtipos biológicos, ou endótipos, os quais poderiam ser identificados através de biomarcadores.9,10
A RSCcPN eosinofílica apresenta, geralmente, quadro clínico mais severo, maior comprometimento tomográfico (com especial acometimento da região etmoidal),11‐14 maior associação com asma comórbida e pior desfecho clínico quando submetida a tratamento cirúrgico.15,16 Além disso, os casos de RSCcPN eosinofílica, comumente, respondem melhor à corticoterapia quando comparados aos não eosinofílico.17,18 Do ponto de vista inflamatório, a RSCcPN eosinofílica é fortemente influenciada pelas citocinas do Tipo 2, tais como IL‐4,IL‐5 e IL‐13. Essas citocinas são produzidas por várias células, especialmente as do tipo Th2, mastócitos e células linfóides inatas do Tipo 2 (ILC2).3,10
A abordagem terapêutica da RSCcPN eosinofílica se apoia nos tratamentos clínico e cirúrgico. No que diz respeito ao tratamento clínico, os corticosteroides tópicos e orais encontram, na literatura, grau de evidência elevado e forte recomendação. O tratamento cirúrgico da RSCcPN eosinofílica pode ser considerado quando não há melhoria da sintomatologia, a despeito do máximo tratamento clínico.1
Os Interferons (IFNs) compreendem um conjunto de glicoproteínas que, devido às suas ações imunomoduladora, antiviral e antiproliferativa, são amplamente usadas no tratamento de uma variedade de doenças crônicas, inclusive esclerose múltipla, infecção pelo HCV e certos tipos de câncer. Participam também do arsenal terapêutico de doenças eosinofílicas, como a síndrome hipereosinofílica idiopática (SHI), tornando‐se uma opção nos casos refratários à corticoterapia ou, conjuntamente, a fim de reduzir a dosagem dessa.19,20
Diante do contexto exposto, este estudo propõe‐se a avaliar a ação imunológica do Interferon‐α, in vitro, frente a uma doença essencialmente eosinofílica.
MétodoSeleção da amostraForam selecionados, de 2015 a 2017, 13 pacientes portadores de RSCcPN eosinofílica acompanhados no ambulatório de otorrinolaringologia da Universidade Federal do Triângulo Mineiro (UFTM), 8 do sexo masculino e 5 do feminino, com faixa etária entre 19 e 73 anos.
Durante o processo de seleção, foram incluídos pacientes maiores de 18 anos com RSCcPN, segundo o European Position Paper on Rhinosinusitis and Nasal Polyps 2012,1 e eosinofilia tecidual, verificada no estudo histológico dos pólipos nasais (mais do que 20 eosinófilos por campo de maior aumento). Foram excluídos os pacientes com RSCsPN e os pacientes com RSCcPN que apresentavam fibrose cística, rinossinusite fúngica alérgica ou doença exacerbada pela aspirina. Também foram exclusos os pacientes com pólipos do tipo antrocoanal, esfenocoanal ou etmoidocoanal, assim como aqueles com qualquer pólipo unilateral. Nenhum dos pacientes selecionados para o estudo havia usado corticosteroides tópicos ou sistêmicos nos 30 dias que antecediam a avaliação.
O estudo foi submetido à avaliação do Comitê de Ética em Pesquisa da UFTM, com aprovação número 2672.
Formatação geral do estudoTrata‐se de estudo prospectivo, experimental, autopareado, com 13 amostras de pólipos nasais eosinofílicos. O grupo de estudo foi composto por culturas de células derivadas de pólipos nasais eosinofílicos, com aplicação de interferon‐α in vitro. Para o grupo controle, seguiu‐se o mesmo roteiro do grupo experimental, porém sem a aplicação de interferon‐α.
Todos os pacientes com RSCcPN, que se dispuseram a participar do estudo, após esclarecimento e assinatura do termo de consentimento, foram agendados para comparecimento no ambulatório de Otorrinolaringologia da UFTM, em dia específico. Em tal data, após tomografia computadorizada dos seios paranasais (TCSP) no setor de imagem da UFTM, o paciente foi encaminhado ao ambulatório de Otorrinolaringologia a fim de ali fazer história clínica, exame otorrinolaringológico, endoscopia nasal e biópsia dos pólipos nasais. Terminada a avaliação otorrinolaringológica, os pacientes foram orientados a procurar o ambulatório de Pneumologia da UFTM para avaliação clínica e espirometria.
Durante a biópsia incisional dos pólipos nasais, foram coletados dois fragmentos de cada paciente. Um fragmento foi acondicionado em tubo plástico cônico, com formol, e levado ao laboratório de Anatomopatologia da UFTM para estudo histopatológico e determinação do infiltrado celular. O segundo fragmento foi acondicionado em tubo plástico cônico, estéril, com solução fisiológica a 0,9%, e levado imediatamente ao laboratório do Ipon da UFTM para cultura celular.
Escores para tomografia computadorizada dos seios paranasais e endoscopia nasal (TCSP)Os pacientes foram submetidos à TCSP, sem uso de contraste. Usou‐se, para tal, tomógrafo da marca Toshiba Aquilion 64 canais. As imagens, em cortes coronal e axial de 0,5 milímetros (mm) de volume e reconstrução de 5 mm de espessura, foram analisadas pelo pesquisador e classificadas segundo o sistema proposto por Lund‐Mackay.21 Nesse sistema, os seios paranasais (frontal, maxilar, etmoidal anterior, etmoidal posterior e esfenoide) são pontuados com a nota 0 (sem opacificacão), 1 (opacificacão parcial) e 2 (opacificacão total). O complexo osteomeatal também recebe pontuações: nota 0 (não obstruído) e nota 2 (obstruído). Assim, considerando‐se os lados direito e esquerdo das imagens analisadas, os pacientes receberam, na totalidade, um escore que variou de 0 a 24 pontos.
A endoscopia foi feita em ambas as fossas nasais, com fibra ótica rígida de 4 milímetros de diâmetro e zero grau de angulação, da marca Storz. A quantificação da endoscopia baseou‐se na proposta de Lund‐Kennedy.22 Nessa classificação, a endoscopia é quantificada em 0 (ausência de pólipos), 1 (pólipos confinados no meato médio) e 2 (pólipos além do meato médio). Portanto, considerando as fossas nasais direita e esquerda, a pontuação dos pacientes variou de 0 a 4 pontos.
Caracterização da asmaTodos os pacientes foram avaliados pela disciplina de Pneumologia da UFTM, a qual definiu a presença ou ausência de asma, segundo as Diretrizes da Sociedade Brasileira de Pneumologia e Tisiologia para o Manejo da Asma – 2012.23
Foram considerados os seguintes critérios: história clínica (dispneia, tosse crônica, sibilância, opressão ou desconforto torácico, sobretudo à noite ou nas primeiras horas da manhã) e prova de função pulmonar (espirometria que mostrasse VEF1/CVF < 75% com reversibilidade de pelo menos 7% após salbutamol).
Caracterização da eosinofiliaOs fragmentos destinados à análise histopatológica foram fixados em formaldeído diluído a 4% tamponado, processados, incluídos em parafina e corados segundo a técnica de hematoxilina‐eosina (HE). A presença e a quantidade de eosinófilos, nas biópsias, foram avaliadas simultaneamente por dois observadores (um médico patologista do setor de Patologia da UFTM e o pesquisador). Os cortes histológicos, que mediam cerca de 4 μm de espessura e corados com HE, foram estudados em microscópio de luz comum (OLYMPUS BX41®) e, primeiramente, sob um aumento de 100 vezes, a fim de uma avaliação geral. Os eosinófilos, presentes no tecido conjuntivo subepitelial, foram contados segundo uma modificação do método proposto por Ruffoli et al.24 Quantificaram‐se os eosinófilos, sob um aumento de 400 vezes, em 5 campos, calculou‐se a média do número de eosinófilos por campo. Os pólipos que apresentaram média maior do que 20 eosinófilos por campo de grande aumento (CGA) foram considerados eosinofílicos.
Cultura de células e estímulo com Interferon‐alphaAs células derivadas dos pólipos nasais foram cultivadas, a 37°C, em 2000 microlitros de meio RPMI 1640 com 5% de CO2, 10% de soro bovino fetal, bicabornato de sódio, piruvato de sódio, 200 mμ de L‐glutamina, 10.000 UI de penicilina, beta‐2‐mercaptoetanol e 10mg/mL de estreptomicina (meio completo vendido por Sigma).
O fragmento do pólipo destinado à cultura foi depositado em placa de Petri e divulsionado com pinças anatômicas e lâminas de bisturi número 21. O produto da divulsão foi lavado, na placa de Petri, com meio Roswell Park Memorial Institute (RPMI) incompleto e transferido para tubo plástico cônico de 50 mL. A esse foi, então, adicionado meio RPMI incompleto até o volume de 15 mL. Em seguida, o tubo foi levado à centrifugação, a 4°C, velocidade de 2100 rpm, por 10 minutos, sob refrigeração. Fizeram‐se dois ciclos de centrifugação. Entre eles, o precipitado foi lavado com meio RPMI incompleto. No fim da última centrifugação, o excesso de solução foi cuidadosamente removido e o precipitado foi ressuspenso em 8 mL da solução. Em seguida, usou‐se a câmara de Newbauer para contagem celular por mililitro (mL) de solução. Uma vez conhecida a quantidade de células/ml da solução, foram semeadas 106 células, juntamente com meio RPMI completo, em uma placa de cultura com seis poços. Cada poço totalizava 2 mL. As culturas foram, então, preservadas na incubadora. Todos os procedimentos foram executados em condições estéreis, usou‐se capela de fluxo laminar, com exceção da contagem de células.
Vinte e quatro horas após a incubação das culturas, foram aplicadas, em 4 poços considerados como o grupo experimental, 3000 UI de interferon‐α. Aos 2 poços restantes não foi adicionado o interferon‐α, passaram esses a constituir o grupo controle. Todas as amostras foram analisadas em duplicata.
Após a aplicação da citocina citada, as culturas retornaram à estufa, considerou‐se esse momento como tempo zero. Doze horas decorridas da aplicação do interferon‐α, coletou‐se o sobrenadante da cultura de 2 poços do grupo experimental, denominados, então, de experimento 12 horas. As culturas retornaram novamente para a estufa. Vinte quatro horas após a introdução do interferon‐α, recolheu‐se o sobrenadante dos outros 2 poços do grupo experimental, os quais foram classificados como experimento 24 horas. Nesse momento, foi coletado também o sobrenadante dos dois poços que não sofreram a ação do interferon‐α (grupo controle). Todo sobrenadante coletado foi armazenado em eppendorfs e mantido, no freezer, a ‐80°C.
Posteriormente, ele, na sua totalidade, foi analisado por Cytometric Bead Array (CBA), através do que se verificou a concentração das interleucinas IL‐2, IL‐4, IL‐6, IL‐10, TGF‐β e IFN‐γ.
Dosagem das citocinas por Cytometric Bead Array (CBA)Os sobrenadantes coletados das culturas celulares dos pólipos nasais eosinofílicos foram submetidos à dosagem de algumas citocinas, usou‐se para tal Cytometric Bead Array (CBA) (BDTM Biosciences, San Diego, CA). O CBA Th1/Th2 Cytokine Human Kit II efetuou a dosagem de seis citocinas representantes de um amplo espectro de mediadores, eram elas as interleucinas 2, 4, 6 e 10, o Fator de Necrose Tumoral (TNF) e o Interferon‐γ (IFN‐γ). Todo o processamento das amostras analisadas seguiu as instruções do fabricante. As leituras foram feitas em citômetro de fluxo BDTM FACSCalibur®, junto à curva‐padrão, a fim de determinar as concentrações de referência, assim como o controle de qualidade. O software usado para essas análises foi o FCAP Array Cytometric Bead Array versão 1.4 (BD Biosciences, San Jose, CA), o qual trabalha sob sistema de análises automatizadas. Segundo recomendações do fabricante, todas as curvas‐padrão obtidas obedeceram ao limiar para as dosagens das citocinas com precisão de 99%, condição impreterivelmente requerida para o início das análises.
Análise estatísticaNão houve cálculo estatístico para definição do tamanho da amostra. Essa foi definida por acessibilidade. Os resultados, referentes à dosagem das citocinas, uma vez obtidos foram lançados em um banco de dados, empregou‐se o Microsoft Access 2000®, e avaliados através do programa GraphPad Prism 5 para estudo estatístico. A comparação estatística foi feita por meio de análise não paramétrica, com o teste de Wilcoxon. Os testes foram considerados significantes quando a probabilidade de rejeição da hipótese foi menor do que 5% (p < 0,05).
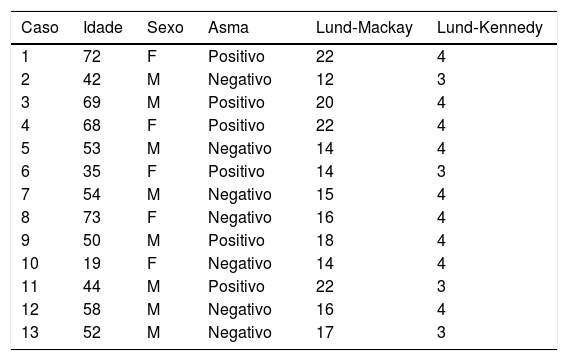
ResultadosParticiparam da pesquisa 13 pacientes por atenderem aos critérios de inclusão determinados para o estudo. A faixa etária dos pacientes variou de 19 a 73 anos, com média de 53. Entre esses, 8 pacientes eram do sexo masculino (61%) e 5 do feminino (39%), 46% asmáticos. O escore de Lund‐Mackay da avaliação tomográfica variou entre 12 e 22 pontos (média = 17) para um total de 24 pontos. A endoscopia das fossas nasais revelou um escore de Lund‐Kennedy variável de 3 a 4 pontos (média = 3,69) para um total de 4 pontos (tabela 1).
Características da amostra de acordo com idade, sexo, presença de asma, Lund‐Mackay e Lund‐Kennedy
| Caso | Idade | Sexo | Asma | Lund‐Mackay | Lund‐Kennedy |
|---|---|---|---|---|---|
| 1 | 72 | F | Positivo | 22 | 4 |
| 2 | 42 | M | Negativo | 12 | 3 |
| 3 | 69 | M | Positivo | 20 | 4 |
| 4 | 68 | F | Positivo | 22 | 4 |
| 5 | 53 | M | Negativo | 14 | 4 |
| 6 | 35 | F | Positivo | 14 | 3 |
| 7 | 54 | M | Negativo | 15 | 4 |
| 8 | 73 | F | Negativo | 16 | 4 |
| 9 | 50 | M | Positivo | 18 | 4 |
| 10 | 19 | F | Negativo | 14 | 4 |
| 11 | 44 | M | Positivo | 22 | 3 |
| 12 | 58 | M | Negativo | 16 | 4 |
| 13 | 52 | M | Negativo | 17 | 3 |
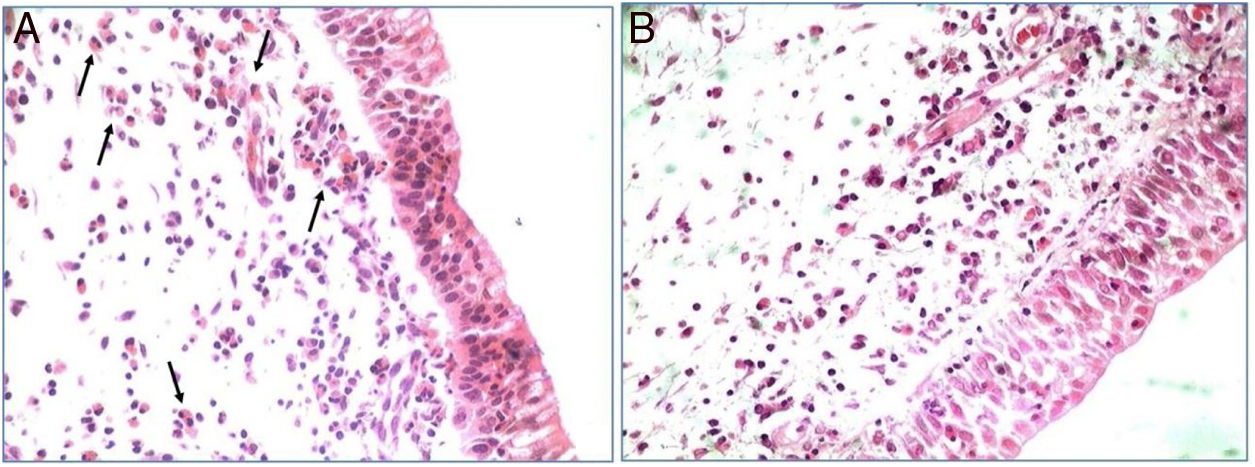
Todas as amostras de tecido polipoide usadas na pesquisa exibiram intenso infiltrado eosinofílico na análise histopatológica (mais de 20 eosinófilos/CGA). Tal achado serviu de critério para classificar esses pólipos nasais como eosinofílicos (fig. 1).
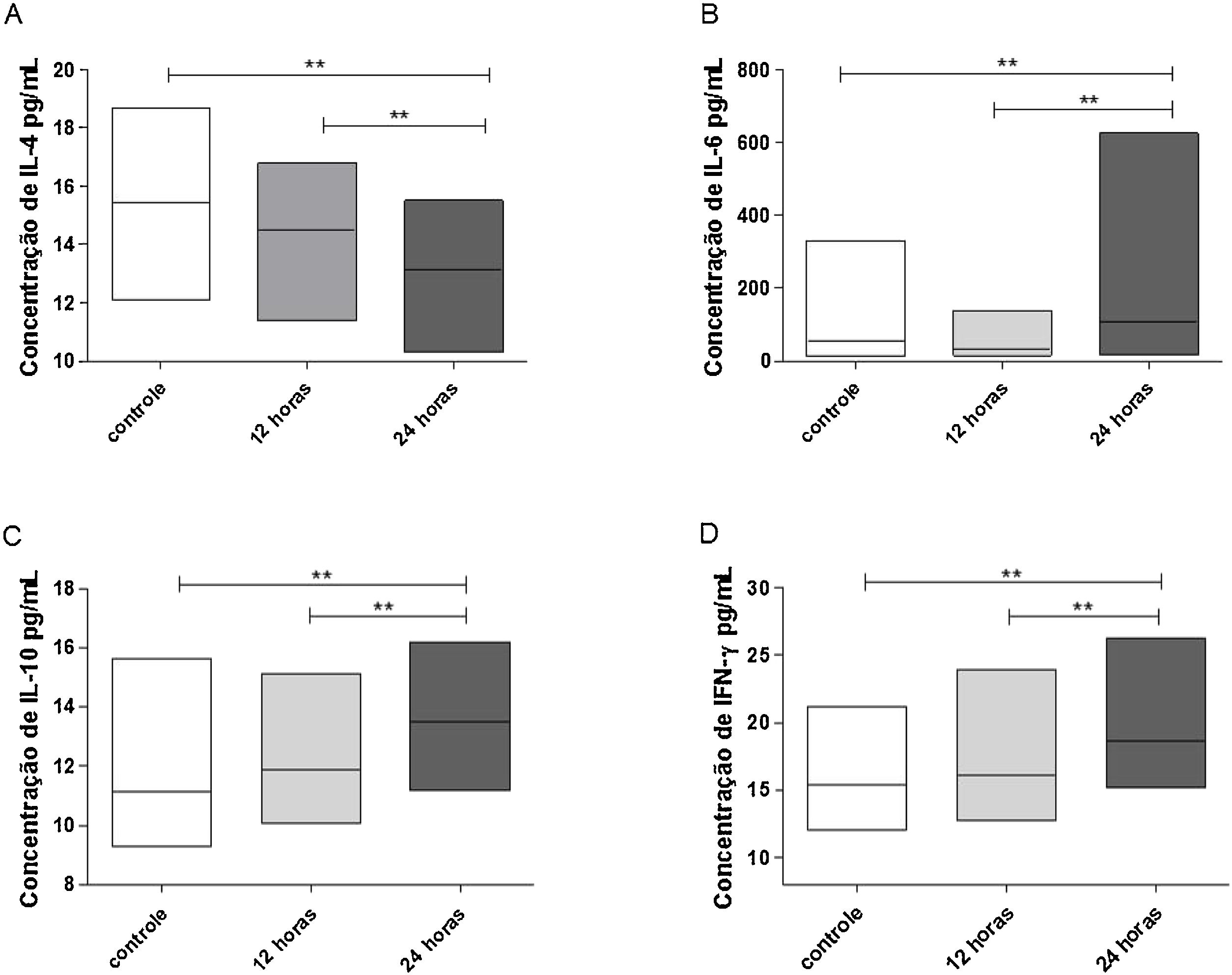
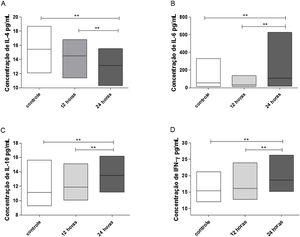
Avaliando‐se a concentração das interleucinas no sobrenadante das culturas celulares dos pólipos nasais eosinofílicos, encontramos diminuição significante da concentração de IL‐4 (p = 0,0078), em relação aos controles, 24 horas após a exposição das culturas à ação do IFN‐α. Observou‐se também que a redução da concentração de IL‐4 foi significantemente mais intensa nas culturas avaliadas 24 horas após o estímulo do IFN‐α, comparativamente às culturas avaliadas 12 horas após (p = 0,0039) (fig. 2A).
Concentração de citocinas em sobrenadantes de culturas celulares de pólipos nasais eosinofílicos, após 12 e 24 horas de estimulação com IFN‐a. Os resultados foram expressos em mediana, valores máximo e mínimo de concentração (pg/mL) das citocinas IL‐4 (A), IL‐6 (B), IL‐10 (C) e IFN‐g (D). Os resultados foram analisados com o teste não paramétrico de Wilcoxon. As diferenças observadas foram consideradas significativas quando p < 0,05 (5%).
Com relação à IL‐6 (p = 0,0186), à IL‐10 (p = 0,0039) e ao IFN‐γ (p = 0,0039), as culturas celulares dos pólipos nasais eosinofílicos apresentaram, relativamente aos controles, aumento significante das suas concentrações, 24 horas após à ação do IFN‐α. Notou‐se também que a elevação da concentração dessas citocinas foi significantemente mais relevante nas culturas avaliadas 24 horas após o estímulo do IFN‐α, comparativamente às culturas avaliadas 12 horas após (p = 0,0039 para IL‐6, p = 0,0091 para IL‐10 e p = 0,0269 para IFN‐γ) (fig. 2B, C e D).
Ao que se refere às interleucinas IL‐2 e TNF‐α, não houve diferença significante nas suas concentrações, em relação aos controles, após a estimulação das culturas com o IFN‐α (dados não apresentados nos gráficos). Na tabela 2, observam‐se os dados referentes à mediana, valores máximo e mínimo das interleucinas avaliadas.
Valores das medianas, máximo e mínimo das concentrações das interleucinas dosadas nos sobrenadantes das culturas celulares dos pólipos nasais eosinofílicos
| Controle | 12 horas | 24 horas | |
|---|---|---|---|
| IL‐4 | 15,80 (12,10–18,70)a | 15,30 (11,40–16,80)b | 13,20 (10,30–15,50)a,b |
| IL‐6 | 29,20 (12,20–331,50)a | 20,90 (14,50–138,30)b | 32,90 (17,90 – 625,90)a,b |
| IL‐10 | 10,70 (9,30–15,60)a | 11,50 (10,10–15,10)b | 13,80 (11,20–16,20)a,b |
| IFN‐γ | 14,70 (12,10–21,20)a | 15,60 (12,80–23,90)b | 17,90 (15,20–26,30)a,b |
| IL‐2 | 13,80 (10,90–128,50) | 13,10 (10,60–61,10) | 12,95 (10,60–15,30) |
| TNF‐α | 12,00 (9,10–104,80) | 12,20 (9,00–61,70) | 11,30 (9,50–14,70) |
O conhecimento atual a respeito da RSCcPN permite afirmar que representa uma doença essencialmente inflamatória e de etiologia desconhecida. Com o avanço da compreensão sobre a arquitetura da biologia molecular e celular que envolve a RSCcPN, tornou‐se evidente que o diagnóstico fenotípico de RSCcPN abrange uma variedade de vias inflamatórias distintas. A tendência, no momento, é individualizar essas vias através de biomarcadores, a fim de se conhecerem os vários endótipos da RSCcPN.25
Os estudos têm demonstrado que, no Ocidente, a maioria dos pacientes com RSCcPN apresenta endótipo caracterizado por infiltrado celular predominantemente eosinofílico e perfil imunológico com destaque para citocinas Th2. Essas exercem relevante papel na individualização dos endótipos da RSCcPN, uma vez que participam da resposta imune adaptativa a fatores exógenos, influenciam o ambiente tecidual local e recrutam vários tipos celulares.26
A intensidade da infiltração eosinofílica, no tecido polipoide dos pacientes com RSCcPN, caracteriza tal doença como eosinofílica ou não eosinofílica, além de acarretar implicações prognósticas. A RSCcPN eosinofílica associa‐se, geralmente, à maior severidade clínica e radiológica e a maior risco de ocorrência de asma e de recidiva da polipose após tratamento cirúrgico.27 Aslam et al. avaliaram a severidade da doença em 53 pacientes com RSCcPN. Nos pacientes com pólipos eosinofílicos (eosinófilos > 10/CGA), os autores encontraram pontuação média de 13,5/24 para o índice de Lund‐Mackay (comprometimento radiológico) e 2,8/4 para o Lund‐Kennedy (comprometimento da endoscopia nasal).17 Em outro estudo, Wang et al. também perceberam elevados índices de comprometimento radiológico (Lund‐Mackay de 14,42/24) e da endoscopia nasal (Lund‐Kennedy de 3,59/4) em pacientes com pólipos eosinofílicos (eosinófilos > 5/CGA).28 Em conformidade com a literatura, os pacientes do estudo em questão também apresentaram relevância nos índices de Lund‐Mackay (média de 17/24) e Lund‐Kennedy (média de 3,69/4). Outro dado de importância clínica foi a constatação de que, aproximadamente, metade dos pacientes da amostra (46%) era asmática. De fato, a associação entre asma e RSCcPN já é conhecida e, do ponto de vista histopatológico, ambas compartilham algumas alterações, tais como inflamação eosinofílica, dano epitelial e espessamento da membrana basal da mucosa respiratória.29 Na pesquisa feita por Hopkins et al.,dentre 2.176 pacientes com RSCcPN submetidos a tratamento cirúrgico, 37,5% foram detectados com asma.30 A análise desses dados permite inferir que os pacientes do estudo apresentado revelaram clara concordância com os relatos de literatura sobre os demais pacientes com RSCcPN eosinofílica, do ponto de vista clínico, radiológico e histopatológico.
O tratamento da RSCcPN eosinofílica ainda é um desafio. Muitos pacientes demonstram controle insatisfatório da doença, a despeito do máximo tratamento clinico‐cirúrgico. Os estudos têm demonstrado que pacientes com RSCcPN eosinofílica apresentam piores desfechos clínicos e maior tendência à recidiva da polipose após tratamento cirúrgico, quando comparados aos não eosinofílicos.31 Até o momento, os corticosteroides, nas suas apresentações tópica ou sistêmica, representam as opções com maiores níveis de evidência no tratamento da RSCcPN eosinofílica.1 Entretanto, por se tratar de uma doença de evolução crônica, o uso frequente de corticosteroides, principalmente na sua forma sistêmica, não raramente produz efeitos colaterais indesejáveis.32
Assim, diante das limitações dos tratamentos disponíveis para RSCcPN eosinofílica e do maior conhecimento atual a respeito da fisiopatogenia da doença, têm‐se buscado, recentemente, opções terapêuticas atreladas às bases moleculares dessa doença. Sob essa perspectiva, terapias biológicas, com anticorpos monoclonais endereçados contra os biomarcadores da resposta inflamatória Th2, têm ganhado relevância. Destacam‐se as pesquisas com omalizumab (anti‐IgE), reslizumab (anti‐IL‐5), mepolizumab (anti‐IL‐5) e dupilumab (antirreceptor de IL‐4α).33
O Interferon α (IFN‐α) é uma opção terapêutica nas síndromes eosinofílicas, tais como a síndrome hipereosinofílica idiopática e a síndrome de Churg‐Straus. Os benefícios clínicos do IFN‐α sobre essas doenças são sustentados por estudos in vitro, os quais demonstram a ação dessa citocina sobre a eosinofilia. A Incubação de eosinófilos com IFN‐α inibe a liberação da neurotoxina derivada do eosinófilo e da proteína catiônica eosinofílica quando esses são estimulados com IgA e IgE.34 Por promover o desenvolvimento de linfócitos Th1, o IFN‐α pode inibir a diferenciação e migração dos eosinófilos através dos efeitos do IFN‐γ.35 Finalmente, tem sido demonstrado que o IFN‐α inibe a expressão gênica de IL‐5, GM‐CSF e IL‐13, citocinas importantes na migração, proliferação, ativação e sobrevida dos eosinófilos.36
Mais recentemente, o uso do IFN‐α no tratamento de doenças atópicas com perfil Th2 tem sido relatado. No caso da asma, doença que do ponto de vista imunopatológico compartilha semelhanças com a RSCcPN eosinofílica, tem sido documentado que o uso clínico do IFN‐α melhora a função pulmonar, reduz a dose diária de corticosteroide para controle dos sintomas e diminui as visitas dos pacientes às unidades hospitalares de emergência.37
No campo da otorrinolaringologia, o IFN‐α é muito pouco citado como opção terapêutica. Não se encontra, na literatura, relato de tratamento da RSCcPN eosinofílica com IFN‐α. Recentemente, Neff et al. relataram o uso de IFN‐α peguilado em 8 pacientes com otite média eosinofílica. Os autores observaram resposta clínica satisfatória, com resolução completa da otorreia, normalização da mucosa da orelha média e descontinuação da corticoterapia em 50% dos casos.38 Diante do exposto, a proposta do estudo aqui apresentado foi pesquisar, in vitro, se o IFN‐α altera o perfil de citocinas da RSCcPN eosinofílica, que sabidamente se caracteriza por um padrão predominantemente Th2.
Neste estudo, constatou‐se que a exposição das culturas celulares dos pólipos eosinofílicos ao IFN‐α diminuiu significantemente a concentração da IL‐4. Essa é uma importante citocina Th2 produzida por eosinófilos, basófilos, mastócitos, células NK e células Th2. Algumas de suas funções são estimular a diferenciação de linfócitos T virgens em linfócitos Th2 e ser importante cofator na prevenção da apoptose das células T ativadas. Ainda, a IL‐4 é a principal citocina responsável pela mudança de classe de imunoglobulina dos linfócitos B para o fenótipo IgE. A IL‐4 também participa do recrutamento de eosinófilos ao aumentar a expressão de VCAM‐1 nas células endoteliais.39 Sabendo‐se, pois, da importância da IL‐4 na construção de um ambiente inflamatório Th2, sua redução, frente ao estímulo com IFN‐α, sugere que esse apresenta o potencial de modular negativamente a inflamação do tipo Th2 na RSCcPN eosinofílica. Essa proposição encontra respaldo na literatura, uma vez que tem sido demonstrado que o IFN‐α, de fato, pode regular negativamente a expressão de citocinas Th2 a partir da inibição do seu fator de transcrição GATA‐3.40
Com relação a IL‐10, IFN‐γ e IL‐6, este estudo detectou que estas citocinas aumentaram significantemente após a exposição das culturas dos pólipos nasais eosinofílicos ao IFN‐α. A IL‐10 é considerada importante citocina anti‐inflamatória fundamental na prevenção de danos teciduais provocados pela inflamação. É produzida por uma variedade de células, especialmente Treg e Th2, regula tanto a resposta imune inata quanto a adaptativa.41 O papel da IL‐10 na fisiopatogenia da RSCcPN eosinofílica ainda é controverso, uma vez que os autores divergem quanto ao aumento da expressão da IL‐10 no tecido polipoide em relação à mucosa nasossinusal.42,43 Entretanto, recentemente, alguns autores têm sugerido que o endótipo dos pacientes com RSCcPN, caracterizado pela presença da IL‐10, apresenta doença menos severa e mais facilmente tratável.44
De fato, já foi demonstrado que o IFN‐α é capaz de aumentar a expressão da IL‐10 em células T CD4+ periféricas ativadas e em cultura de sangue total.45 Assim, é possível que o IFN‐α, ao aumentar a concentração da IL‐10 nas culturas celulares dos pólipos nasais eosinofílicos, module uma ação regulatória sobre o processo inflamatório eosinofílico. O IFN‐γ é a principal citocina Th1 secretada por linfócitos CD8+, células NK, células B e outras células apresentadoras de antígenos. Os níveis dessa interleucina estão aumentados na RSCsPN e diminuídos na RSCcPN.46 Entretanto, observamos um aumento significante dessa citocina após estimulação das culturas celulares dos pólipos nasais eosinofílicos com IFN‐α. Segundo Zhu et al., uma das maneiras pela qual o fator de transcrição GATA‐3 potencializa o desenvolvimento do perfil Th2 é através da inibição da resposta Th1. Ainda, de acordo com os autores, esse mecanismo inibitório ocorreria, possivelmente, pelo bloqueio da expressão de Tbet, principal fator de transcrição Th1.47 Assim, uma vez que o IFN‐α bloqueia o fator de transcrição GATA‐3,40 pode‐se inferir que ele diminua a negatividade sobre o desenvolvimento Th1, aumenta a concentração do IFN‐γ nas culturas celulares. A IL‐6 é uma citocina multifuncional produzida por várias células, inclusive as epiteliais, linfócitos B e T, macrófagos, eosinófilos, mastócitos e fibroblastos. As pesquisas têm revelado que essa interleucina está presente no tecido polipoide, embora sua participação na fisiopatogenia da polipose nasal não esteja bem definida. No estudo de Danielsen et al., esses avaliaram 13 pacientes com polipose nasal e encontraram aumento significante da concentração da IL‐6 no tecido polipoide, comparativamente à mucosa do corneto inferior dos próprios pacientes.48 Em outra pesquisa, Peters et al. avaliaram a via da trans‐sinalização da IL‐6 na mucosa sinusal de pacientes com RSCsPN, no tecido polipoide de pacientes com RSCcPN e na mucosa do corneto inferior de pacientes controle. Para tal, foram mensuradas as concentrações da IL‐6, do seu receptor solúvel (sIL‐6R), da glicoproteína solúvel 130 (sgp130) e do fator de transcrição STAT3. Houve aumento significante da IL‐6, do sIL‐6R e da sgp130 no tecido polipoide em relação aos extratos de mucosa dos pacientes com RSCsPN e do controle. Entretanto, a concentração de STAT3 foi significantemente menor no tecido polipoide. O aumento da IL‐6 e do sIL‐6R no tecido polipoide favorecem a via da trans‐sinalização, diferentemente do que ocorre frente à baixa concentração do STAT3 e ao aumento da sgp130. Segundo os autores, esses achados sugerem que essa via de sinalização da IL‐6 esteja reprimida no tecido polipoide.49 No estudo aqui apresentado, observou‐se também, nas culturas celulares dos pólipos nasais eosinofílicos, aumento significante da concentração da IL‐6 após o estímulo com IFN‐α. Desse modo, é razoável supor que o IFN‐α potencializa a via de sinalização da IL‐6, provavelmente modulando positivamente o fator de transcrição STAT3. Além disso, se a via da trans‐sinalização da IL‐6 (responsável por suas ações pró‐inflamatórias) estiver inibida no tecido polipoide, é possível que essa sinalize através da sua via clássica, determinando ações anti‐inflamatórias.50
ConclusãoEste estudo demonstrou que o IFN‐α alterou o padrão de citocinas nos sobrenadantes das culturas celulares dos pólipos nasais eosinofílicos. A estimulação dessas com IFN‐α ocasionou diminuição significante da concentração da IL‐4 (perfil Th2) e aumento significante da IL‐10 (perfil regulatório), do IFN‐γ (perfil Th1) e da IL‐6. Essas observações, em conjunto, sugerem que a ação do IFN‐α, in vitro, suscita um rebalanceamento dos perfis inflamatórios em tais culturas e favorece a expressão de citocinas Th1 e regulatórias, em detrimento das citocinas do padrão Th2.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sousa JC, Etchbehere RM, Alves EA, Stark LM, Murta EF, Michelin MA. Interferon‐α action in cytokine profile in eosinophilic nasal polyp cultures. Braz J Otorhinolaryngol. 2021;87:260–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.