Peritonsillar abscess is the most common deep neck infection. The infectious microorganism may be different according to clinical factors.
ObjectiveTo identify the major causative pathogen of peritonsillar abscess and investigate the relationship between the causative pathogen, host clinical factors, and hospitalization duration.
MethodsThis retrospective study included 415 hospitalized patients diagnosed with peritonsillar abscess who were admitted to a tertiary medical center from June 1990 to June 2013. We collected data by chart review and analyzed variables such as demographic characteristics, underlying systemic disease, smoking, alcoholism, betel nut chewing, bacteriology, and hospitalization duration.
ResultsA total of 168 patients had positive results for pathogen isolation. Streptococcus viridans (28.57%) and Klebsiella pneumoniae (23.21%) were the most common microorganisms identified through pus culturing. The isolation rate of anaerobes increased to 49.35% in the recent 6 years (p=0.048). Common anaerobes were Prevotella and Fusobacterium spp. The identification of K. pneumoniae increased among elderly patients (age>65 years) with an odds ratio (OR) of 2.76 (p=0.03), and decreased in the hot season (mean temperature>26°C) (OR=0.49, p=0.04). No specific microorganism was associated with prolonged hospital stay.
ConclusionThe most common pathogen identified through pus culturing was S. viridans, followed by K. pneumoniae. The identification of anaerobes was shown to increase in recent years. The antibiotics initially selected should be effective against both aerobes and anaerobes. Bacterial identification may be associated with host clinical factors and environmental factors.
O Abscesso Peritonsilar é a infecção cervical profunda mais comum. O microrganismo infeccioso pode ser diferente de acordo com os fatores clínicos.
ObjetivoIdentificar o principal agente causador do abscesso peritonsilar e investigar a relação entre o patógeno causador, os fatores clínicos do hospedeiro e a duração da hospitalização.
MétodoEste estudo retrospectivo incluiu 415 pacientes hospitalizados diagnosticados com abscesso peritonsilar que foram internados em um centro médico terciário de junho de 1990 a junho de 2013. Coletamos dados através da análise dos arquivos médicos dos pacientes e analisamos variáveis como características demográficas, doença sistêmica subjacente, tabagismo, alcoolismo, hábito de mascar noz de betel, bacteriologia e duração da hospitalização.
ResultadosUm total de 168 pacientes apresentaram resultados positivos para isolamento de patógenos. Streptococcus viridans (28,57%) e Klebsiella pneumoniae (23,21%) foram os microrganismos mais comuns identificados pela cultura da secreção. A taxa de isolamento de anaeróbios aumentou para 49,35% nos últimos 6 anos (p=0,048). Os anaeróbios comuns foram Prevotella e Fusobacterium spp. A identificação de K. pneumoniae aumentou em pacientes idosos (idade>65 anos) com razão de chances (Odds Ratio ‐ OR) de 2,76 (p=0,03) e diminuiu na estação do calor (temperatura média>26°C) (OR=0,49, p=0,04). Nenhum microrganismo específico foi associado à hospitalização prolongada.
ConclusãoO patógeno mais comumente identificado através da cultura de secreção foi S. viridans, seguido por K. pneumoniae. A identificação de anaeróbios mostrou ter aumentado nos últimos anos. Os antibióticos selecionados inicialmente devem ser efetivos contra aeróbios e anaeróbios. A identificação bacteriana pode estar associada a fatores clínicos e fatores ambientais do hospedeiro.
O abscesso peritonsilar (APT), ou periamigdaliano, é a infecção cervical profunda mais comum.1 O abscesso pode se espalhar para o espaço parafaríngeo de outros espaços cervicais profundos, para a estrutura adjacente e para a corrente sanguínea. Isso raramente ocorre, mas o APT é potencialmente fatal. O diagnóstico precoce é extremamente crucial e são necessários antibióticos adequados e intervenção cirúrgica para o tratamento do abscesso.2 Os antibióticos resultam em uma redução substancial na progressão da doença. O antibiótico empírico utilizado deve ser eficaz contra o possível agente causador do APT.
Nossos objetivos foram investigar a microbiologia do APT e identificar sua relação com variáveis clínicas, incluindo a doença sistêmica subjacente dos pacientes; hábitos como tabagismo, alcoolismo e o hábito de mascar noz de betel; e duração da hospitalização.
MétodoDesenho do estudo e amostra da populaçãoEste estudo retrospectivo incluiu 415 pacientes com APT que foram admitidos em um centro médico terciário localizado no sul de Taiwan de junho de 1990 a junho de 2013. Os critérios de inclusão foram pacientes hospitalizados, clinicamente diagnosticados com APT (código CID‐9 475) por aspiração de secreção purulenta ou imagem de tomografia computadorizada (TC). Revisamos os arquivos médicos de cada paciente para coletar os seguintes dados: data de admissão, idade, sexo, altura, peso, fatores clínicos do hospedeiro (Diabetes Melito [DM], hipertensão, tabagismo, alcoolismo, e hábito de mascar noz de betel), resultado da cultura de pus, antibioticoterapia, cirurgia, e duração da hospitalização. O estudo foi aprovado pelo conselho de ética institucional.
Classificamos as bactérias em diferentes categorias de acordo com as características da coloração de Gram e propriedades anaeróbias. Hospitalização prolongada foi definida como aquela com duração maior que 6 dias. Obesidade foi definida como um índice de massa corporal superior a 27, e paciente idoso foi definido como pacientes com idade superior a 65 anos. A estação do calor foi definida como os meses de maio a outubro, quando a temperatura média no sul de Taiwan foi superior a 26°C de acordo com o registro do Central Weather Bureau de R.O.C., em Taiwan.
Análise estatísticaTodos os dados foram analisados utilizando‐se o software estatístico SPSS (IBM Corp., Armonk, NY, EUA), exceto pelo teste de Cochran‐Armitage, que foi realizado utilizando‐se o software SAS (SAS Institute, Cary, NC, EUA). A associação com cada variável independente foi analisada estatisticamente entre os diferentes grupos. As variáveis categóricas foram comparadas usando o teste Qui‐quadrado de Pearson ou o teste exato de Fisher, conforme apropriado. A razões de chances (odds ratio) e seus Intervalos de Confiança de 95% (IC 95%) foram calculados. As tendências dos patógenos isolados foram analisadas utilizando‐se o teste de Cochran‐Armitage. Um valor de p < 0,05 foi considerado estatisticamente significante.
Declaração de éticaEste estudo foi aprovado pelo Conselho de Ética institucional; o número do protocolo de aprovação é VGHKS14‐CT7‐01.
ResultadosCaracterísticas demográficasEste estudo incluiu 415 pacientes. Os resultados das culturas obtidas da secreção purulenta de amostras cirúrgicas ou aspiração com agulha estavam disponíveis para 266 pacientes. Ajustes para a amostra submetida à cirurgia de amígdalas ou drenagem do APT foram realizados, como mostrado na tabela 1. Não havia nenhum paciente com histórico de AIDS ou infecção por HIV neste estudo.
Características demográficas de pacientes com abscesso peritonsilar
| Idade | Geral, (n=266) | Diabetes melito | Tabagismo | Alcoolismo | Hábito de mascar noz de betel |
|---|---|---|---|---|---|
| <18 anos | 22 (8,27) | 0 | 6 (27,27) | 5 (22,73) | 2 (9,09) |
| 18‐64 anos | 215 (80,83) | 19 (8,84) | 111 (51,63) | 76 (35,35) | 37 (17,21) |
| ≥65 anos | 29 (10,90) | 4 (13,79) | 5 (17,24) | 7 (24,14) | 3 (10,34) |
| Total | 266 (100) | 23 (8,65) | 122 (45,86) | 88 (33,08) | 42 (15,79) |
Os dados são apresentados como n(%).
Dos pacientes com amostra de secreção purulenta, 230 (230 de 266, 86,47%) mostraram crescimento bacteriano na cultura. A cultura dos 36 pacientes restantes não apresentou crescimento bacteriano. Dos 230 pacientes, 132 (132‐230, 57,39%) apresentaram vários agentes isolados (polimicrobiano), incluindo 62 casos relatados como “flora normal” apenas ou “flora mista” (62 de 230, 26,96%). As culturas de 168 pacientes (168 de 266, 63,15%) mostraram resultados positivos para isolamento de patógenos. Mais de um patógeno foi isolado em 64 pacientes (64 de 168, 38,10%). Bactérias aeróbias foram isoladas de 85,7% (144/168) das culturas positivas, enquanto bactérias anaeróbias ou aeróbias facultativas foram isoladas em 44,0% (74 de 168) e bactérias aeróbias e anaeróbias misturadas em 29,8% (50 de 168).
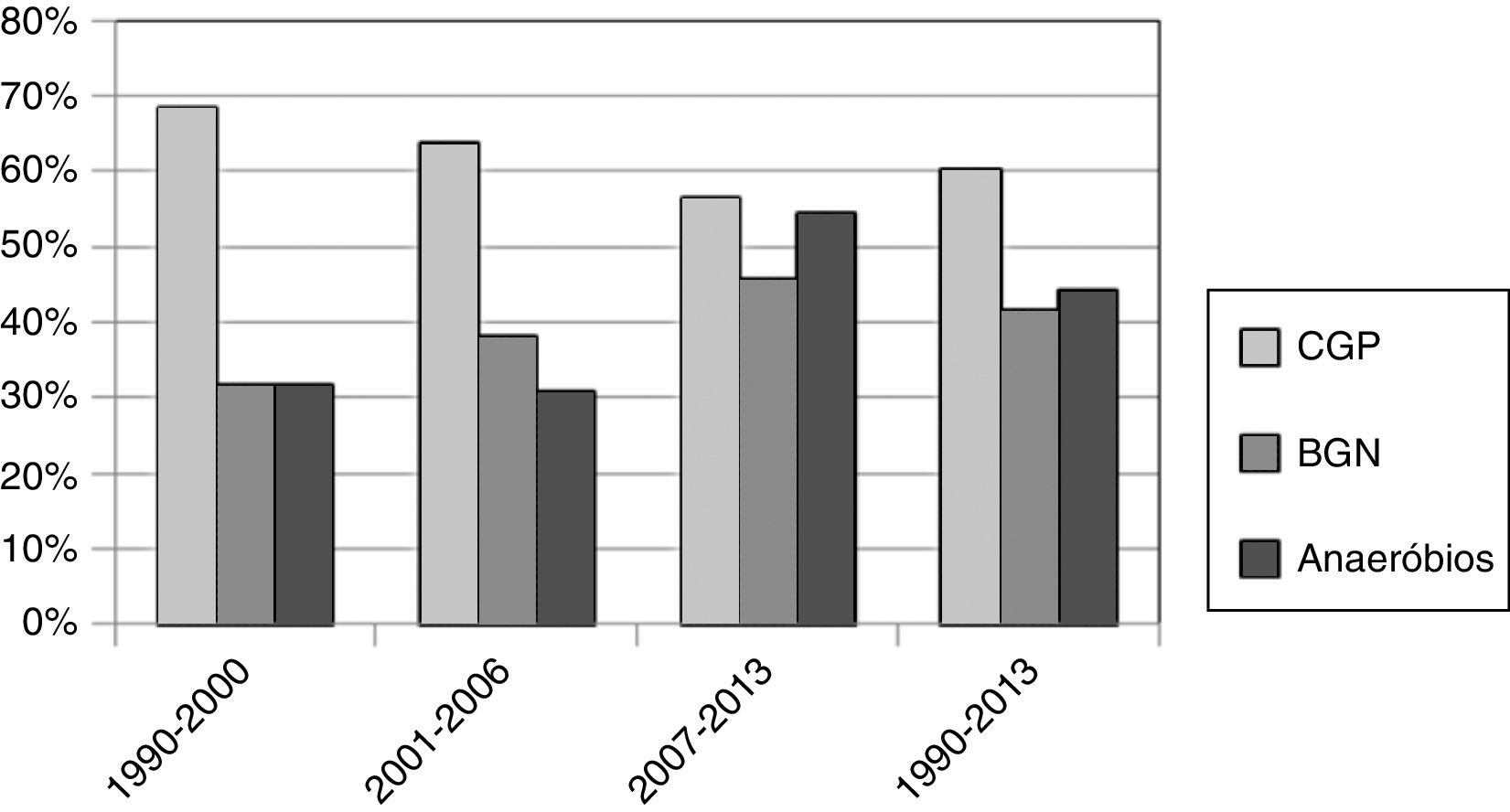
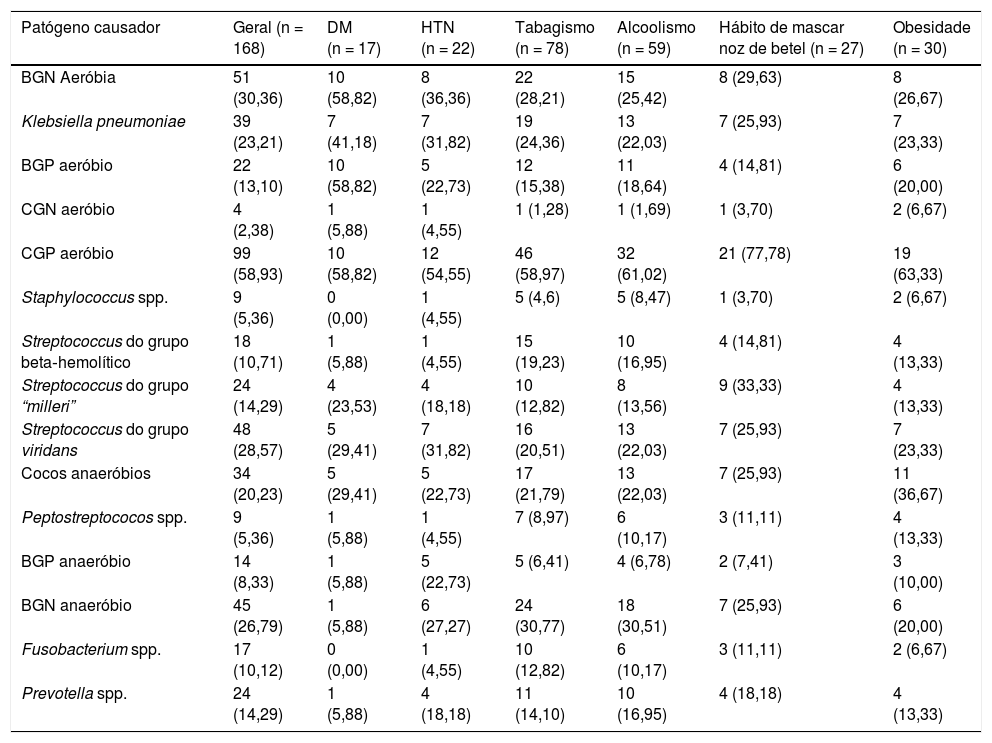
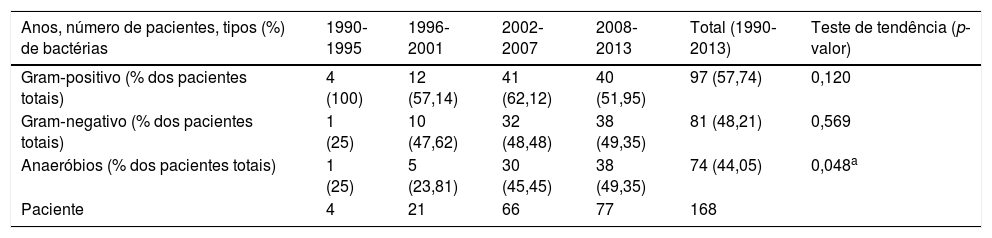
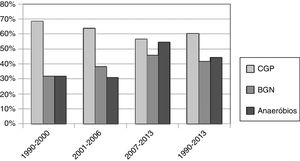
O patógeno mais comum identificado através da cultura foi o Streptococcus viridans (48 de 168, 28,57%), seguido por Klebsiella pneumoniae (39 de 168, 23,21%) e o Streptococcus beta hemolítico (17 de 168, 10,12%), como mostrado na tabela 2. Os pacientes foram divididos em 4 períodos de 1990 a 1995, 1996 a 2001, 2002 a 2007 e 2008 a 2013; e a taxa de isolamento dos anaeróbios foi de 25%, 23,81%, 45,45% e 49,35%, respectivamente. A taxa de isolamento de patógenos anaeróbios aumentou significativamente entre 1990 e 2013 (teste de Cochran‐Armitage, p = 0,048), como mostrado na tabela 3 e figura 1. As taxas de isolamento de bactérias gram‐positivas e gram‐negativas nesses 4 períodos foram 100% e 25%, 57,14% e 47,62%, 62,12% e 48,48%, e 51,95% e 49,35%, respectivamente. A maioria dos patógenos anaeróbios era Prevotella spp. (24 de 168, 14,29%) e Fusobacterium spp. (16 de 168, 9,52%), como mostrado na tabela 2.
Bacteriologia de 168 pacientes com abscesso peritonsilar
| Patógeno causador | Geral (n = 168) | DM (n = 17) | HTN (n = 22) | Tabagismo (n = 78) | Alcoolismo (n = 59) | Hábito de mascar noz de betel (n = 27) | Obesidade (n = 30) |
|---|---|---|---|---|---|---|---|
| BGN Aeróbia | 51 (30,36) | 10 (58,82) | 8 (36,36) | 22 (28,21) | 15 (25,42) | 8 (29,63) | 8 (26,67) |
| Klebsiella pneumoniae | 39 (23,21) | 7 (41,18) | 7 (31,82) | 19 (24,36) | 13 (22,03) | 7 (25,93) | 7 (23,33) |
| BGP aeróbio | 22 (13,10) | 10 (58,82) | 5 (22,73) | 12 (15,38) | 11 (18,64) | 4 (14,81) | 6 (20,00) |
| CGN aeróbio | 4 (2,38) | 1 (5,88) | 1 (4,55) | 1 (1,28) | 1 (1,69) | 1 (3,70) | 2 (6,67) |
| CGP aeróbio | 99 (58,93) | 10 (58,82) | 12 (54,55) | 46 (58,97) | 32 (61,02) | 21 (77,78) | 19 (63,33) |
| Staphylococcus spp. | 9 (5,36) | 0 (0,00) | 1 (4,55) | 5 (4,6) | 5 (8,47) | 1 (3,70) | 2 (6,67) |
| Streptococcus do grupo beta‐hemolítico | 18 (10,71) | 1 (5,88) | 1 (4,55) | 15 (19,23) | 10 (16,95) | 4 (14,81) | 4 (13,33) |
| Streptococcus do grupo “milleri” | 24 (14,29) | 4 (23,53) | 4 (18,18) | 10 (12,82) | 8 (13,56) | 9 (33,33) | 4 (13,33) |
| Streptococcus do grupo viridans | 48 (28,57) | 5 (29,41) | 7 (31,82) | 16 (20,51) | 13 (22,03) | 7 (25,93) | 7 (23,33) |
| Cocos anaeróbios | 34 (20,23) | 5 (29,41) | 5 (22,73) | 17 (21,79) | 13 (22,03) | 7 (25,93) | 11 (36,67) |
| Peptostreptococos spp. | 9 (5,36) | 1 (5,88) | 1 (4,55) | 7 (8,97) | 6 (10,17) | 3 (11,11) | 4 (13,33) |
| BGP anaeróbio | 14 (8,33) | 1 (5,88) | 5 (22,73) | 5 (6,41) | 4 (6,78) | 2 (7,41) | 3 (10,00) |
| BGN anaeróbio | 45 (26,79) | 1 (5,88) | 6 (27,27) | 24 (30,77) | 18 (30,51) | 7 (25,93) | 6 (20,00) |
| Fusobacterium spp. | 17 (10,12) | 0 (0,00) | 1 (4,55) | 10 (12,82) | 6 (10,17) | 3 (11,11) | 2 (6,67) |
| Prevotella spp. | 24 (14,29) | 1 (5,88) | 4 (18,18) | 11 (14,10) | 10 (16,95) | 4 (18,18) | 4 (13,33) |
Dados são apresentados como n (%).
Os isolados aeróbios incluíram isolados aeróbios e anaeróbios facultativos
DM, Diabetes Melito; BGN, Bacilos Gram‐Negativos; CGN, Cocos Gram‐Negativo; BGP, Bacilos Gram‐Positivos; CGP, Cocos Gram‐Positivos; HTN, Hipertensão.
Taxa de isolamento de diferentes tipos de bactérias durante intervalos de 6 anos, 1990‐2013
| Anos, número de pacientes, tipos (%) de bactérias | 1990‐1995 | 1996‐2001 | 2002‐2007 | 2008‐2013 | Total (1990‐2013) | Teste de tendência (p‐valor) |
|---|---|---|---|---|---|---|
| Gram‐positivo (% dos pacientes totais) | 4 (100) | 12 (57,14) | 41 (62,12) | 40 (51,95) | 97 (57,74) | 0,120 |
| Gram‐negativo (% dos pacientes totais) | 1 (25) | 10 (47,62) | 32 (48,48) | 38 (49,35) | 81 (48,21) | 0,569 |
| Anaeróbios (% dos pacientes totais) | 1 (25) | 5 (23,81) | 30 (45,45) | 38 (49,35) | 74 (44,05) | 0,048a |
| Paciente | 4 | 21 | 66 | 77 | 168 |
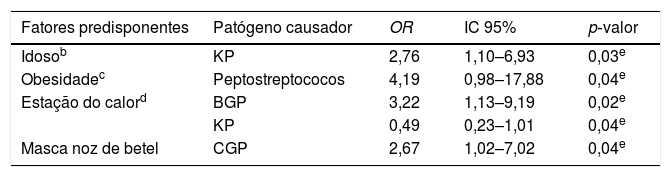
Os fatores clínicos do hospedeiro foram associados a vários patógenos isolados. O habito de mascar noz de betel foi associada ao isolamento de Cocos Gram‐Positivos (CGP) (OR = 2,67, p = 0,04). A associação do isolamento bacteriano com o hábito de fumar e alcoolismo não foi estatisticamente significante. Pacientes idosos (idade > 65 anos) apresentaram menor taxa de isolamento de K. pneumoniae (OR = 2,76, p = 0,03). A obesidade (IMC > 27) foi associada a um maior isolamento de Peptostreptococcus (OR = 4,19, p = 0,04), como mostrado na tabela 4.
Associação entre os fatores predisponentes e o patógenoa
| Fatores predisponentes | Patógeno causador | OR | IC 95% | p‐valor |
|---|---|---|---|---|
| Idosob | KP | 2,76 | 1,10–6,93 | 0,03e |
| Obesidadec | Peptostreptococos | 4,19 | 0,98–17,88 | 0,04e |
| Estação do calord | BGP | 3,22 | 1,13–9,19 | 0,02e |
| KP | 0,49 | 0,23–1,01 | 0,04e | |
| Masca noz de betel | CGP | 2,67 | 1,02–7,02 | 0,04e |
Além disso, na estação do calor, observamos que o risco de isolamento de Bacilos Gram‐Positivos (GPB) aumentou (OR = 3,22, p = 0,02), mas que o isolamento de K. pneumoniae diminuiu (OR = 0,49, p = 0,04), conforme demonstrado na tabela 4. Não houve microrganismo específico associado à internação prolongada.
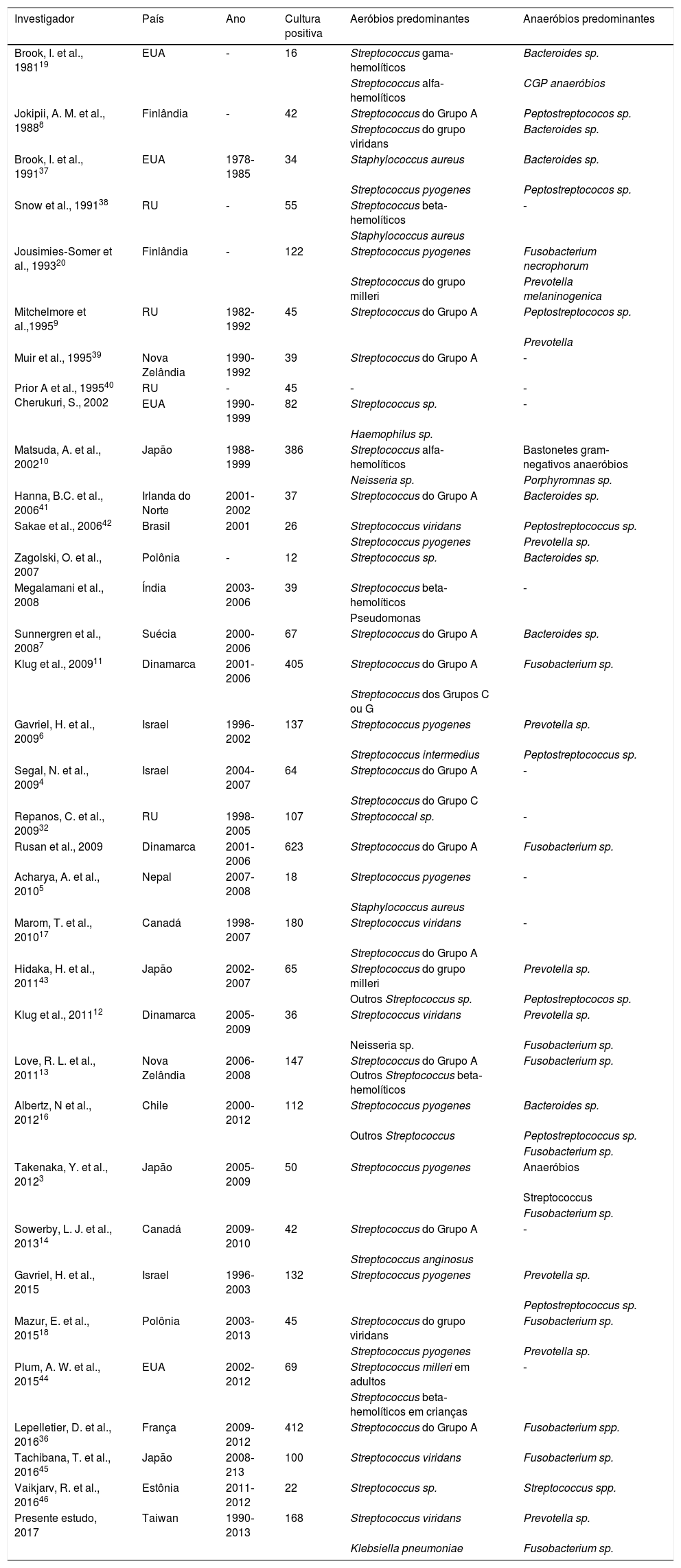
Pesquisando a partir do banco de dados PubMed, identificamos 30 estudos envolvidos na bacteriologia do APT entre 1980 e 2016. As datas, as localizações geográficas e as espécies bacterianas predominantes identificadas nestes estudos foram listadas na tabela 5.
Estudos envolvidos na bacteriologia do APT durante o período de 1980‐2016
| Investigador | País | Ano | Cultura positiva | Aeróbios predominantes | Anaeróbios predominantes |
|---|---|---|---|---|---|
| Brook, I. et al., 198119 | EUA | ‐ | 16 | Streptococcus gama‐hemolíticos | Bacteroides sp. |
| Streptococcus alfa‐hemolíticos | CGP anaeróbios | ||||
| Jokipii, A. M. et al., 19888 | Finlândia | ‐ | 42 | Streptococcus do Grupo A | Peptostreptococos sp. |
| Streptococcus do grupo viridans | Bacteroides sp. | ||||
| Brook, I. et al., 199137 | EUA | 1978‐1985 | 34 | Staphylococcus aureus | Bacteroides sp. |
| Streptococcus pyogenes | Peptostreptococos sp. | ||||
| Snow et al., 199138 | RU | ‐ | 55 | Streptococcus beta‐hemolíticos | ‐ |
| Staphylococcus aureus | |||||
| Jousimies‐Somer et al., 199320 | Finlândia | ‐ | 122 | Streptococcus pyogenes | Fusobacterium necrophorum |
| Streptococcus do grupo milleri | Prevotella melaninogenica | ||||
| Mitchelmore et al.,19959 | RU | 1982‐1992 | 45 | Streptococcus do Grupo A | Peptostreptococos sp. |
| Prevotella | |||||
| Muir et al., 199539 | Nova Zelândia | 1990‐1992 | 39 | Streptococcus do Grupo A | ‐ |
| Prior A et al., 199540 Cherukuri, S., 2002 | RU | ‐ | 45 | ‐ | ‐ |
| EUA | 1990‐1999 | 82 | Streptococcus sp. | ‐ | |
| Haemophilus sp. | |||||
| Matsuda, A. et al., 200210 | Japão | 1988‐1999 | 386 | Streptococcus alfa‐hemolíticos | Bastonetes gram‐negativos anaeróbios |
| Neisseria sp. | Porphyromnas sp. | ||||
| Hanna, B.C. et al., 200641 | Irlanda do Norte | 2001‐2002 | 37 | Streptococcus do Grupo A | Bacteroides sp. |
| Sakae et al., 200642 | Brasil | 2001 | 26 | Streptococcus viridans | Peptostreptococcus sp. |
| Streptococcus pyogenes | Prevotella sp. | ||||
| Zagolski, O. et al., 2007 | Polônia | ‐ | 12 | Streptococcus sp. | Bacteroides sp. |
| Megalamani et al., 2008 | Índia | 2003‐2006 | 39 | Streptococcus beta‐hemolíticos | ‐ |
| Pseudomonas | |||||
| Sunnergren et al., 20087 | Suécia | 2000‐2006 | 67 | Streptococcus do Grupo A | Bacteroides sp. |
| Klug et al., 200911 | Dinamarca | 2001‐2006 | 405 | Streptococcus do Grupo A | Fusobacterium sp. |
| Streptococcus dos Grupos C ou G | |||||
| Gavriel, H. et al., 20096 | Israel | 1996‐2002 | 137 | Streptococcus pyogenes | Prevotella sp. |
| Streptococcus intermedius | Peptostreptococcus sp. | ||||
| Segal, N. et al., 20094 | Israel | 2004‐2007 | 64 | Streptococcus do Grupo A | ‐ |
| Streptococcus do Grupo C | |||||
| Repanos, C. et al., 200932 | RU | 1998‐2005 | 107 | Streptococcal sp. | ‐ |
| Rusan et al., 2009 | Dinamarca | 2001‐2006 | 623 | Streptococcus do Grupo A | Fusobacterium sp. |
| Acharya, A. et al., 20105 | Nepal | 2007‐2008 | 18 | Streptococcus pyogenes | ‐ |
| Staphylococcus aureus | |||||
| Marom, T. et al., 201017 | Canadá | 1998‐2007 | 180 | Streptococcus viridans | ‐ |
| Streptococcus do Grupo A | |||||
| Hidaka, H. et al., 201143 | Japão | 2002‐2007 | 65 | Streptococcus do grupo milleri | Prevotella sp. |
| Outros Streptococcus sp. | Peptostreptococos sp. | ||||
| Klug et al., 201112 | Dinamarca | 2005‐2009 | 36 | Streptococcus viridans | Prevotella sp. |
| Neisseria sp. | Fusobacterium sp. | ||||
| Love, R. L. et al., 201113 | Nova Zelândia | 2006‐2008 | 147 | Streptococcus do Grupo A Outros Streptococcus beta‐hemolíticos | Fusobacterium sp. |
| Albertz, N et al., 201216 | Chile | 2000‐2012 | 112 | Streptococcus pyogenes | Bacteroides sp. |
| Outros Streptococcus | Peptostreptococcus sp. | ||||
| Fusobacterium sp. | |||||
| Takenaka, Y. et al., 20123 | Japão | 2005‐2009 | 50 | Streptococcus pyogenes | Anaeróbios |
| Streptococcus | |||||
| Fusobacterium sp. | |||||
| Sowerby, L. J. et al., 201314 | Canadá | 2009‐2010 | 42 | Streptococcus do Grupo A | ‐ |
| Streptococcus anginosus | |||||
| Gavriel, H. et al., 2015 | Israel | 1996‐2003 | 132 | Streptococcus pyogenes | Prevotella sp. |
| Peptostreptococcus sp. | |||||
| Mazur, E. et al., 201518 | Polônia | 2003‐2013 | 45 | Streptococcus do grupo viridans | Fusobacterium sp. |
| Streptococcus pyogenes | Prevotella sp. | ||||
| Plum, A. W. et al., 201544 | EUA | 2002‐2012 | 69 | Streptococcus milleri em adultos | ‐ |
| Streptococcus beta‐hemolíticos em crianças | |||||
| Lepelletier, D. et al., 201636 | França | 2009‐2012 | 412 | Streptococcus do Grupo A | Fusobacterium spp. |
| Tachibana, T. et al., 201645 | Japão | 2008‐213 | 100 | Streptococcus viridans | Fusobacterium sp. |
| Vaikjarv, R. et al., 201646 | Estônia | 2011‐2012 | 22 | Streptococcus sp. | Streptococcus spp. |
| Presente estudo, 2017 | Taiwan | 1990‐2013 | 168 | Streptococcus viridans | Prevotella sp. |
| Klebsiella pneumoniae | Fusobacterium sp. |
–, Indica “não relatado”.
Vários antibióticos de amplo espectro, como penicilina ou cefazolina combinados com Gentamicina (GM) e metronidazol, clindamicina com GM ou amoxicilina‐clavulanato, foram utilizados em nossa série. Todos esses antibióticos foram efetivos sem diferença significativa.
DiscussãoEm nosso estudo, o patógeno mais comum identificado através da cultura de secreção em pacientes com APT foi S. viridans, seguido de K. pneumoniae; os anaeróbios comumente isolados em nosso estudo foram Prevotella e Fusobacterium spp. Revisamos os dados de bacteriologia de estudos anteriores, como mostra a tabela 5. A maioria dos estudos3–16 relataram Streptococcus do grupo A como o patógeno aeróbio mais comum no APT; alguns estudos12,17,18 relataram que os patógenos aeróbios mais comuns foram S. viridans, seguido por Streptococcus beta hemolítico do grupo A. A prevalência de K. pneumoniae foi raramente relatada em estudos anteriores. Em estudos anteriores, Fusobacterium nucleatum,3,8,11,12,15,19,20Prevotella,3,12,19–21Bacteroides,7,8,19Peptostreptococos,8,9,20 e Streptococcus anaeróbios12 foram os agentes patogênicos anaeróbios mais comuns. As divergências das culturas bacterianas podem ser devidas à diferentes localizações geográficas. Com as diferenças em dietas e estilo de vida, a flora bacteriana de cada pessoa também pode ser diferente.
K. pneumoniae e Streptococcus spp. são parte da flora oral normalmente encontrada na boca e são patógenos odontogênicos de infecção cervical profunda.22–24 O grupo S. viridans é o agente etiológico de cáries dentárias, pericoronarite ou, se introduzido na circulação sanguínea, endocardite. Em Taiwan, K. pneumoniae tem sido associado à infecção pulmonar em pacientes com aspiração ou abscesso hepático,25 em pacientes imunocomprometidos ou com diabetes.26
Pacientes idosos27 ou com diabetes melito28 são considerados imunocomprometidos e têm mais chance de desenvolver infecções. Pacientes com DM e idosos também estão associados à maior número de complicações e taxa de mortalidade em infecções cervicais profundas.29,30 Assim, os pacientes com APT com as características acima necessitam hospitalização mais prolongada.30 Relatamos a microbiologia do APT nestes pacientes imunocomprometidos. Pacientes com DM não apresentaram risco aumentado de isolamento de K. pneumoniae como agente causador do APT. Em contraste, pacientes idosos com APT na série atual apresentaram maior risco de isolamento de K. pneumoniae.
A tendência para uma maior taxa de isolamento de anaeróbios foi observada durante o período de 2002 a 2013 (p=0.048). Garvriel6 relatou um aumento significativo no crescimento anaeróbio durante o período de 1996 a 1999 e, em seguida, um declínio lento e não significativo até 2002. Takenaka3 não relatou nenhuma alteração na porcentagem de casos com crescimento anaeróbio entre 2 períodos (2005 a 2007 e 2008 a 2009). Tal fenômeno pode resultar de uma mudança real nos patógenos; da alteração de antibióticos utilizados ou métodos de cultura melhorados para patógenos anaeróbios. Em nossa série, não foi observada nenhuma alteração importante dos antibióticos utilizados ou melhoria dos métodos de cultura. Os médicos devem prescrever antibióticos empíricos para incluir anaeróbios.
O APT é frequentemente uma infecção polimicrobiana. O crescimento de agentes polimicrobianos foi observado nas culturas de 57,39% dos pacientes. A razão para o uso de antibióticos empíricos seria para incluir CGP, BGN e anaeróbios respiratórios. Se necessário, os antibióticos adequados devem ser escolhidos com base nos resultados da cultura. No entanto, o manejo da maioria dos pacientes não‐complicados não necessariamente é afetado pelo resultado da cultura.31 Repanos et al.32 sugeriram que o uso de antibióticos de amplo espectro, como cefalosporina ou penicilina combinada com metronidazol, é efetivo. Em nosso estudo, nenhuma diferença significativa foi encontrada entre várias combinações de antibióticos de amplo espectro.
O tabagismo tem sido comumente observado em pacientes com APT em vários estudos,17,18,33,34 os quais relataram o tabagismo como fator de risco para APT. Marom et al.17 relataram uma incidência significativamente maior para S. viridans, outros cocos gram‐positivos e anaeróbios. Em nosso estudo, não houve significância estatística no patógeno causador entre fumantes e não fumantes com APT, semelhante aos achados do estudo de Klug.34
Mascar noz de betel é um hábito popular no Sudeste Asiático. Que seja de nosso conhecimento, nenhum estudo encontrou uma associação entre a bacteriologia do APT e o hábito de mascar noz de betel. Em nossa série, esse hábito foi associado a um maior risco de apresentar CGP como patógenos. No estudo de Ling et al.,35 ele foi associado a uma probabilidade de infecção subgengival por Actinobacillus actinomycetemcomitans e Porphyromonas gingivalis.
Em nosso estudo, pacientes idosos (com idade superior a 65 anos) apresentaram alto risco de isolamento de K. pneumoniae. O estudo de Marom17 relatou uma taxa de isolamento significativamente maior para infecção por CGP (espécies mistas de Streptococcus) e bastonetes gram‐negativos em pacientes mais velhos (40 anos ou mais) do que em pacientes mais jovens.
A estação do calor aumentou o risco de infecção por BGP e reduziu o risco de infecção por K. pneumoniae em pacientes com APT em nosso estudo atual. Nosso instituto está localizado em uma região tropical que tem aproximadamente seis meses (maio a outubro) de clima quente, com uma temperatura média de 27°C. Em contraste, Klug et al.,15 de outro instituto localizado em uma zona temperada, relataram maior incidência de infecção por F. nucleatum durante o verão do que durante o inverno. Também relataram que Streptococcus do Grupo A foram significativamente mais frequentemente identificados no inverno e na primavera. Um estudo francês36 relatou que APT causado por S. pyogenes ou anaeróbios foi mais prevalente no inverno e na primavera do que no verão. Essa flutuação na microbiologia do APT pode estar relacionada ao clima.
Em nossa série, nenhum microrganismo específico foi associado a prognóstico ruim do APT. Essa descoberta é consideravelmente semelhante aos relatos de Marom17 e Mazur.18
Nosso estudo tem várias limitações. Como coletamos dados retrospectivamente através de análise de arquivos médicos, os dados do registro médico podem ter sido perdidos durante os primeiros anos. Como utilizamos populações pequenas de patógenos isolados, é necessário um tamanho amostral maior para determinar a relação entre o patógeno isolado e os fatores predisponentes.
ConclusõesO patógeno causativo mais comum do APT foi S. viridans, seguido por K. pneumoniae. O isolamento de anaeróbios aumentou significativamente nos últimos anos. Os mais comuns foram Prevotella e Fusobacterium spp. Os antibióticos empíricos que têm como alvo aeróbios e anaeróbios provavelmente são adequados como tratamento. O isolamento bacteriano pode estar associado a fatores clínicos do hospedeiro, fatores ambientais e duração da hospitalização.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem ao Professor Hsueh‐Wen Chang (Departamento de Ciências Biológicas, National Sun Yat‐sen University, Kaohsiung, Taiwan) por sua ajuda na análise estatística.
Como citar este artigo: Tsai Y‐W, Liu Y‐H, Su H‐H. Bacteriology of peritonsillar abscess: the changing trend and predisposing factors. Braz J Otorhinolaryngol. 2018;84:532–39.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.