High‐frequency audiometry may contribute to the early detection of hearing loss caused by ototoxic medications. Many ototoxic drugs are widely used in the treatment of patients with cystic fibrosis. Early detection of hearing loss should allow known harmful drugs to be identified before the damage affects speech frequencies. The damage caused by ototoxicity is irreversible, resulting in important social and psychological consequences. In children, hearing loss, even when restricted to high frequencies, can affect the development of language.
ObjectiveTo investigate the efficacy and effectiveness of hearing monitoring through high‐frequency audiometry in pediatric patients with cystic fibrosis.
MethodsElectronic databases PubMed, MedLine, Web of Science and LILACS were searched, from January to November 2015. The selected studies included those in which high‐frequency audiometry was performed in patients with cystic fibrosis, undergoing treatment with ototoxic drugs and published in Portuguese, English and Spanish. The GRADE system was chosen for the evaluation of the methodological quality of the articles.
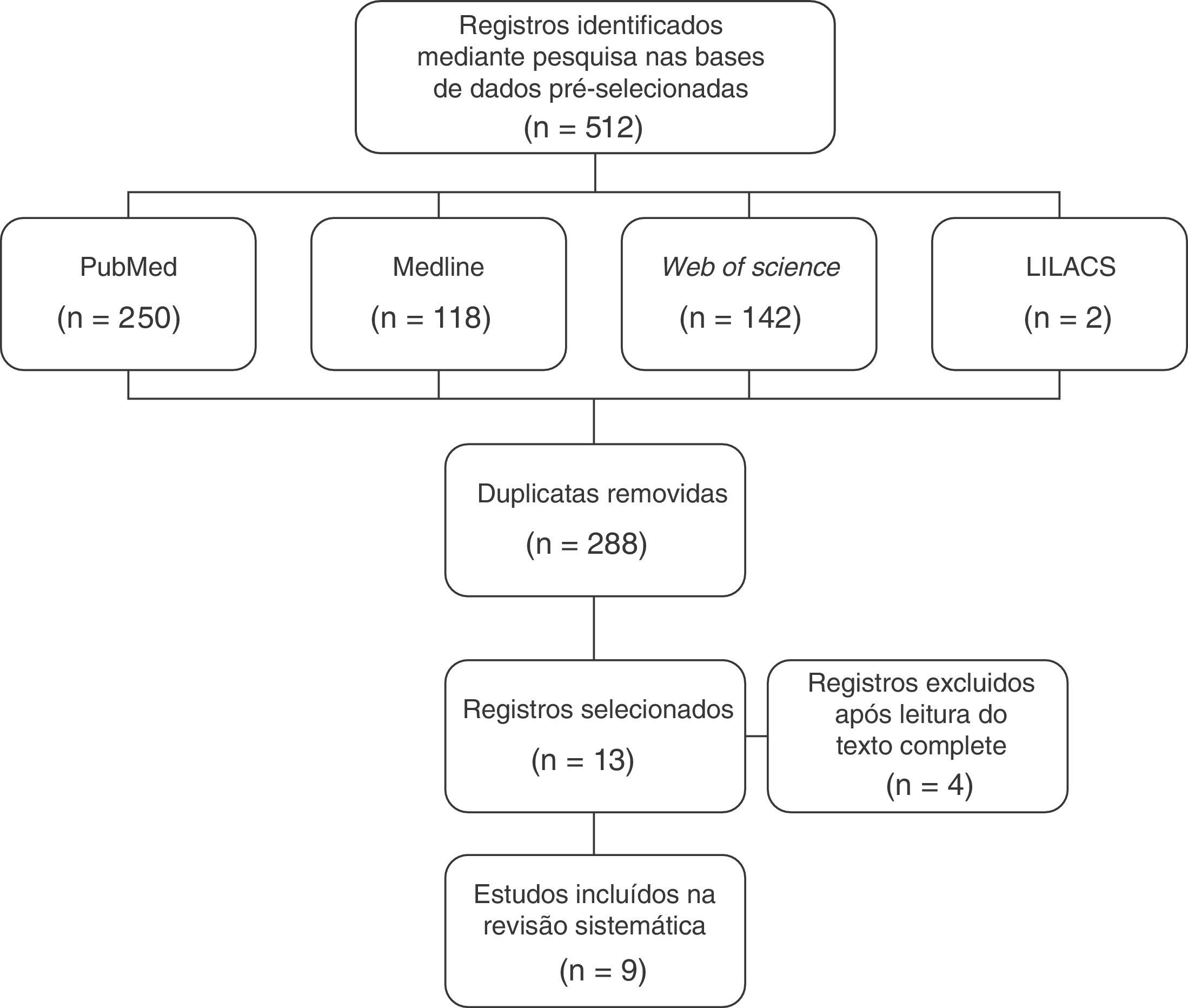
ResultsDuring the search process carried out from January 2015 to November 2015, 512 publications were identified, of which 250 were found in PubMed, 118 in MedLine, 142 in Web of Science and 2 in LILACS. Of these, nine articles were selected.
ConclusionThe incidence of hearing loss was identified at high frequencies in cystic fibrosis patients without hearing complaints. It is assumed that high‐frequency audiometry can be an early diagnostic method to be recommended for hearing investigation of patients at risk of ototoxicity.
A audiometria de altas frequências pode contribuir para a detecção precoce de alterações auditivas causadas por medicações ototóxicas. No tratamento dos pacientes com fibrose cística, existem muitos fármacos ototóxicos amplamente utilizados. A detecção precoce de alterações auditivas deve permitir que sejam identificadas antes que o dano atinja as frequências da fala. A lesão causada pela ototoxicidade é irreversível, traz importantes consequências sociais e psicológicas. Nas crianças, a perda auditiva, mesmo restrita às altas frequências, pode afetar o desenvolvimento da linguagem.
ObjetivoInvestigar a eficácia e a efetividade do monitoramento da audição por meio da audiometria de altas frequências em pacientes pediátricos com fibrose cística.
MétodoForam consultadas as bases de dados eletrônicas PubMed, Medline, Web of Science e Lilacs, de janeiro a novembro de 2015. Foram selecionados os estudos em que foi feita audiometria de altas frequências em pacientes com fibrose cística em tratamento com medicamentos ototóxicos e publicados em português, inglês e espanhol. Para a avaliação da qualidade metodológica dos artigos optou‐se pelo uso do sistema Grade.
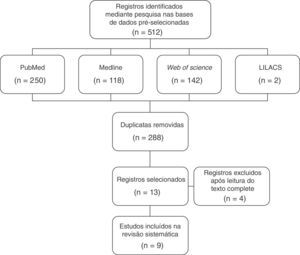
ResultadosNo processo de busca feito de janeiro de 2015 a novembro de 2015 foram encontradas 512 publicações, 250 na PubMed, 118 na Medline, 142 na Web of Science e dois na Lilacs. Desses, foram selecionados nove artigos.
ConclusãoIdentificou‐se a ocorrência de perda auditiva em altas frequências em pacientes com fibrose cística sem queixas auditivas. Admite‐se que audiometria em altas frequências possa ser um método de diagnóstico precoce a ser recomendado para investigação auditiva de pacientes em risco de ototoxicidade.
A fibrose cística (FC), também chamada de mucoviscidose, é causada por mutações de um gene localizado no braço longo do cromossomo 7 (7q31). Esse gene faz a codificação da proteína reguladora de condução transmembrana da FC (cystic fibrosis transmembrane conductance regulator – CFTR), que funciona como um canal de cloro, faz e regula o transporte de íons através da membrana celular.1
Nos indivíduos com FC há falha na secreção de cloro no epitélio respiratório, o que acarreta uma absorção excessiva de sódio, resulta em maior influxo de água para as células e, portanto, aumenta a viscosidade do muco. O muco torna‐se cerca de 30 a 60 vezes mais espesso do que o normal. Não afeta de forma direta o batimento mucociliar, porém torna‐se ineficaz no clearance de substância tão viscosa, gera estase, que predispõe à obstrução dos óstios e ao aumento de colonização bacteriana.2,3 Isso pode ocasionar infecções pulmonares recorrentes, doença pulmonar obstrutiva crônica, rinossinusites, polipose nasossinusal, má absorção gastrointestinal secundária à insuficiência pancreática, íleo meconial, prolapso retal e infertilidade por obstrução dos ductos deferentes.2
A incidência da FC varia de acordo com a etnia, é mais comum na branca. Por ser uma doença autossômica recessiva, quando cada um dos progenitores tem o gene para a FC, a probabilidade de nascimento de um filho com a doença é de 25%. De acordo com as etnias, a incidência da FC pode variar de 1/2.000 a 1/5.000 brancos nascidos vivos na Europa, nos Estados Unidos e no Canadá, 1/15.000 negros americanos e 1/40.000 na Finlândia.4,5
No Brasil, a incidência estimada para a Região Sul é mais próxima da população caucasiana centro‐europeia, enquanto que, para outras regiões, diminui para cerca de 1/10.000 nascidos vivo.4 A prevalência da mutação no gene CFTR (ΔF508) na população infantil dos pacientes com FC nascidos em Porto Alegre é de 60%, estima‐se uma incidência de 10 casos por ano na cidade.6
O diagnóstico da FC é essencialmente clínico, embora a triagem neonatal tenha permitido diagnosticar casos mesmo antes do início dos sintomas. O diagnóstico pode ser feito pelo achado de duas mutações no gene FC, dois resultados alterados do teste do suor ou pela presença de ao menos um dos seguintes sintomas: doença pulmonar obstrutiva/supurativa ou sinusal crônica, insuficiência pancreática exócrina crônica ou histórico familiar de FC.2,4 Para os pacientes nos quais a concentração de cloro no suor é normal ou limítrofe e nos quais as mutações de dois genes FC não são identificadas o exame da diferença de potencial nasal (DPN) pode ser usado como evidência de disfunção da CFTR. O julgamento clínico continuará a ser essencial para pacientes que têm sintomas atípicos ou típicos, mas que não têm provas conclusivas de disfunção CFTR.7
No tratamento de pacientes com FC, muitos fármacos ototóxicos são amplamente usados, entre eles os aminoglicosídeos (AGs), que podem causar perda de audição. Alguns AGs são classificados como mais vestibulotóxicos (afetam o sistema vestibular), outros como mais cocleotóxicos (afetam a cóclea). Assim, é recomendável o controle da audição desses pacientes na busca da detecção precoce de sinais, mesmo assintomáticos, de deterioração e lesão do sistema auditivo.8
As drogas ototóxicas têm a capacidade de danificar diretamente o órgão de Corti, degeneram primeiro as células ciliadas externas, com início nas espiras da base da cóclea, e se propagam em direção ao seu ápice. A degeneração celular pode se estender às células ciliadas internas, com início no ápice da cóclea se a exposição ao agente ototóxico persistir.9
A ototoxicidade tem assumido um papel importante, especialmente em crianças mais jovens, visto que geralmente é considerada irreversível e acarreta um sério prejuízo futuro.10 Exames audiométricos que avaliam altas frequências são especialmente usados com o propósito de detectar perdas auditivas neurossensoriais relacionadas à ototoxicidade.11
A audiometria de altas frequências (AAF) é mencionada na literatura internacional como um procedimento sensível na detecção precoce de alterações auditivas causadas por medicações ototóxicas. Embora não exista um critério para a interpretação dos resultados, muitos investigadores têm declarado que o monitoramento auditivo é fundamental para evitar que ocorra um processo de degeneração na espira basal da cóclea.12–15
A AAF é considerada um exame subjetivo da audição feito em cabine acústica, com fones especialmente calibrados para emitir sons agudos de 8.000 a 16.000 Hz.15 Esse exame contribui para a melhor compreensão da lesão coclear em frequências mais agudas, o que não se obtém com a audiometria convencional, cuja faixa de frequência compreende somente até 8.000 Hz.
O monitoramento da audição deve permitir que a lesão seja identificada antes que o dano atinja as frequências da fala e, consequentemente, prejudique a sua compreensão. De acordo com estudos prévios, está bem definido que as alterações auditivas provocadas por drogas ototóxicas iniciam na base da cóclea e atingem primariamente as frequências mais agudas.16
A AAF parece identificar danos auditivos assintomáticos nos pacientes com FC, pode contribuir para a detecção precoce de perdas auditivas.17,18 Buscar evidências científicas nesse contexto torna‐se necessário, uma vez que esses pacientes normalmente têm acesso à audiometria convencional, mas poderiam se beneficiar ainda mais com a avaliação auditiva em frequências mais agudas. O objetivo desta pesquisa foi avaliar a acurácia da AAF na identificação de perdas auditivas em pacientes pediátricos com FC.
MétodoA revisão sistemática foi feita nas bases de dados PubMed, Medline, Web of Science e Lilacs. Não houve restrição quanto ao ano de publicação. Foram usados os seguintes descritores provenientes dos DeCS (Descritores em Ciências da Saúde): audiometria (Audiometry), perda auditiva (Hearing Loss), fibrose cística (Cystic Fibrosis), aminoglicosídeos (Aminoglycosides) e anormalidades induzidas por medicamentos (Abnormalities, Drug‐Induced).
A avaliação dos títulos e dos resumos identificados na busca inicial foi feita por dois pesquisadores de forma independente, obedeceu rigorosamente aos critérios de inclusão e exclusão previamente definidos no protocolo de pesquisa. Os estudos eram incluídos quando apresentavam o título, o tema e/ou a palavra‐chave condizente com a proposta deste estudo feito com crianças e adolescentes com fibrose cística em tratamento com medicação ototóxica. Entre as intervenções deveria estar incluída a AAF, que é a mensuração do desfecho de interesse (limiares auditivos em altas frequências). Foram considerados artigos com idiomas em português, espanhol e inglês.
Para avaliação da qualidade metodológica dos artigos optou‐se pelo uso do sistema Grade (grades of recommendation, assessment, development, and evaluation). Esse sistema fornece, além de critérios para os graus de evidências, uma definição para a qualidade das evidências. Esse sistema procurou ser claro e explícito, levou em consideração o delineamento do estudo, sua execução, consistência e direção linear e direta no julgamento da qualidade da evidência para cada resultado/consequência importante.19,20 Segue a qualidade das evidências conforme o sistema Grade:21
Alta (A): Consistente, com evidência em ensaios controlados randomizados ou metanálises, sem limitações importantes ou com evidências excepcionalmente fortes de estudos observacionais. É muito improvável que pesquisas adicionais possam mudar a confiança nos efeitos estimados;
Moderada (B): Evidência de ensaios controlados randomizados com limitações importantes (resultados inconsistentes, falhas metodológicas, imprecisão, resultados indiretos). Pesquisas adicionais provavelmente tenham impacto na confiança da estimativa do efeito e podem mudar essa estimativa;
Baixa (C): Evidência de pelo menos um resultado importante de estudos observacionais, série de casos ou estudos controlados randomizados com falhas graves ou evidência indireta. É muito provável que pesquisas adicionais tenham impacto importante na confiança da estimativa de efeito e que mudem a estimativa.
Muito baixa (C): É incerta qualquer estimativa de efeito.
As evidências que compõem as revisões sistemáticas não são indicadas diretamente como recomendações, mas constituem‐se em instrumentos que apoiam as recomendações finais das diretrizes. O sistema Grade considera como forte a recomendação de um teste diagnóstico quando os benefícios suplantam claramente riscos e “carga da doença”, ou vice‐versa. Quando os benefícios são restritos, apresentem riscos e “carga da doença”, o sistema Grade classifica como fraca a recomendação.22
ResultadosNo processo de busca, feito de janeiro a novembro de 2015, foram encontradas 512 publicações (250 na PubMed, 118 na Medline, 142 na Web of Science e duas na Lilacs). Com a exclusão dos artigos repetidos entre as bases de dados pesquisadas, obtivemos 224 registros. Após a leitura dos títulos e resumos foram excluídos 211 artigos, por não avaliarem o desfecho nem a exposição de interesse. As 13 publicações restantes foram revisadas com leitura e avaliação do texto completo. Nessa etapa foram excluídas quatro publicações, por não avaliarem o desfecho de interesse. Dessa forma, a estratégia de busca identificou nove artigos que atenderam aos critérios de inclusão para esta revisão, conforme fluxograma de seleção dos estudos (fig. 1). As nove publicações selecionadas após a estratégia de busca estão descritas na tabela 1 e a qualificação da evidência conforme o sistema Grade é apresentada na tabela 2.
Principais características dos estudos
| Título/autor/ano | Delineamento | Amostra | Intervenção | Resultados | Conclusão |
|---|---|---|---|---|---|
| Absence of Cochleotoxicity measured by standard and high‐frequency pure tone audiometry in a trial of once‐ vs. three times‐daily tobramycin in cystic fibrosis patients (Mulheran et al., 2006) | Estudo experimental: ensaio clínico randomizado controlado. Web of Science, PubMed – em processo | Foram incluídos 244 pacientes com fibrose cística (FC), dos quais 219 (125 crianças e 94 adultos) realizaram audiometria. Foram obtidos resultados para 168 do total de pacientes que completaram o tratamento. | Audiometria tonal feita em toda a faixa de frequência de 0,25 a 8 KHz. Audiometria de alta frequência de 10‐16 kHz. Audiometrias foram feitas no início do tratamento com tobramicina, no final de um curso de 14 dias de tratamento, e no seguimento de 6‐8 semanas mais tarde. | Não foram detectadas diferenças significativas nos limiares auditivos entre os regimes de tratamento. Verifica‐se queda dos limiares auditivos em altas frequências em ambos os grupos de regimes de tratamento. | Não demonstrou risco cocleotóxico cumulativo em pacientes com FC devido à terapia repetida aminoglicosídeos, exigindo melhor caracterização. |
| Aminoglycoside antibiotics cochleotoxicity in paediatric Cystic Fibrosis (CF) patients (Al‐Malky et al., 2011) | Estudo observacional: coorte. Web of Science, PubMed –indexado para Medline | 45 crianças com fibrose cística (FC). 39/45 dos participantes tinham recebido aminoglicosídeos (AGs) via intravenosa (IV), 23 dos quais receberam repetidas vezes a cada 3 meses. | Foram feitos testes auditivos de audiometria e emissões otoacústicas por produto de distorção (EOAPD) durante as visitas de rotina ao ambulatório de FC ou quando os pacientes eram internados. Os participantes foram agrupados de acordo com sua história de exposição prévia a AG por via IV. | No grupo de alta exposição, 8 (21%) tiveram sinais claros de ototoxicidade; limiares nas frequências 8 a 20 kHz foram elevados por ∼ 50dB. As amplitudes de EOAPD foram > 10 dB mais baixas em f2 3,2 a 6,3 kHz. O restante 31/39 (79%) dos pacientes expostos ao tratamento com AG mantiveram os limiares auditivos normais. | Um número significante de crianças com FC apresentou ototoxicidade por cursos repetidos de tratamento com AGs por via IV. Recomenda‐se a realização dos testes auditivos em todos os pacientes com FC com exposições elevadas AG. A ocorrência de perda auditiva (PA) foi associada com alta exposição, mas, no entanto, a alta exposição só resultou em PA em uma minoria de pacientes. A análise genética pode ajudar a explicar a dicotomia encontrada em resposta a AGs. |
| Aminoglycoside ototoxicity in cystic fibrosis. Evaluation by high‐frequency audiometry (McRorie; Bosso; Randolph, 1989) | Estudo observacional: caso‐controle, pareado. Web of Science, PubMed – indexado para Medline | 22 pacientes com fibrose cística (FC) tratados com aminoglicosídeos (AGs). 13 deles foram pareados e comparados a 38 indivíduos sem FC, os quais nunca tinham recebido tratamento com AGs. | Realizados testes audiométricos para medir limiares auditivos de 250 a 20.000Hz. | Em pacientes com FC que foram tratados com AGs (menores de 20 anos), encontra‐se diferenças estatisticamente significativas em frequências superiores a 16 KHz. Pacientes com FC que foram tratados com AG com idade superior a 20 anos tinham os limiares elevados em todas as frequências testadas. Pacientes com FC que não foram tratados com AG não diferiram estatisticamente. | A audiometria de alta frequência pode servir como uma medida útil da elevação nos limiares auditivos tonais que precedem a perda perceptível de acuidade auditiva em pacientes com FC que estão em tratamento com AGs em longo prazo. |
| Avaliação do uso da audiometria em frequências ultra‐altas em pacientes submetidos ao uso de ototóxicos (Weigert et al., 2013) | Estudo observacional, transversal com grupo controle não pareado. Lilacs | 69 indivíduos de 7 a 20 anos de idade. 35 pacientes regularmente submetidos a terapia com medicação potencialmente ototóxica fazendo parte do grupo de estudo (GE) e 34 indivíduos saudáveis constituíram o grupo controle (GC). | Realizada audiometria convencional (250 a 8.000Hz) e audiometria em frequências ultra‐altas (9.000‐16.000 Hz). | Encontrou‐se um caso alterado na audiometria convencional (2,9%) e 6 casos alterados na audiometria em frequências ultra‐altas (17,1%) (p = 0,063). O GE apresentou limiares auditivos estatisticamente mais elevados em relação ao GC na audiometria convencional nas frequências de 2 KHz e 8 KHz e na audiometria em frequências ultra‐altas em 10 KHz (p = 0,004) e 16 KHz (p < 0,001). | O estudo sugeriu que a audiometria em frequências ultra‐altas é útil no monitoramento da audição em pacientes com risco de ototoxicidade. |
| Cumulative and acute toxicity of repeated high‐ dose tobramycin treatment in cystic fibrosis (Pedersen et al., 1987) | Estudo observacional: transversal. Web of Science, PubMed – indexado para Medline | 46 pacientes com fibrose cística (FC), idade média de 15,7 anos e infecção broncopulmonar crônica por Pseudomonas aeruginosa. | Os pacientes foram estudados antes e no final de um curso de duas semanas de tratamento com tobramicina (10 a 20 mg/kg por dia) para discriminar entre toxicidade aguda e crônica por meio de exames de audiometria e Eletronistagmografia. | Dois pacientes (5%) tiveram perda auditiva em alta frequência (acima de 8 kHz), mas somente um relacionado à tobramicina. Nenhuma toxicidade vestibular crônica foi observada. Após duas semanas de tratamento, 32% tinham um limiar de audição ligeiramente reduzido (15‐30 dB) em duas ou mais frequências altas, e 28% tiveram uma queda na resposta vestibular superior a 25% do valor inicial, mas permaneceram dentro dos limites normais. | A toxicidade aguda e crônica no tratamento com altas doses de tobramicina em pacientes com FC parece ser muito leve. |
| Hearing loss in cystic fibrosis (Martins et al., 2010) | Estudo observacional, transversal, descritivo. Web of Science, PubMed – indexado para Medline | 120 pacientes com fibrose cística (FC) e com idades entre 5 meses e 18 anos. | Feito por meio de questionários, análise de testes audiométricos e das emissões otoacústicas produto de distorção (EOAPD). Avaliação do uso prévio de antibióticos aminoglicosídeos (AGs) foi feita por meio da coleta de dados em prontuários. | Os exames audiométricos mostram uma prevalência 4 a 11% de perda auditiva neurossensorial. Não houve relação estatisticamente significativa entre o uso de AGs e perda de audição (p = 0,48). | A análise dos exames audiométricos e das EOAPD revelou que houve alta prevalência de perda auditiva, o que faz dos pacientes com FC um grupo de alto risco que necessita de avaliação auditiva periódica. A comparação dos grupos com e sem uso de AGs mostrou que não houve diferença estatisticamente significativa, o que sugere que o uso de AGs não é o único fator causal para a perda auditiva na FC. |
| High‐frequency audiometry reveals high prevalence of aminoglycoside ototoxicity in children with cystic fibrosis (Al‐Malky et al., 2015) | Estudo observacional: transversal prospectivo. Web of Science, PubMed – em processo | 70 crianças com fibrose cística (FC). Média de idade de 10,7 anos. | A avaliação auditiva foi feita em crianças com FC usando o padrão de audiometria tonal limiar (ATL) e de alta frequência (AAF), além de emissões otoacústicas por produto de distorção (EOAPD). | Das 63 crianças que receberam AG por via intravenosa (IV), 15 (24%) tiveram ototoxicidade detectada pela AAF e EOAPD. Por meio da ATL foram detectadas ototoxicidade em 5 crianças (somente na frequência de 8 kHz, com perda auditiva > 20 dBNA) e 13 crianças com alguma alteração não significativa. Perda auditiva de 25‐85 dBNA em todas as altas frequências e queda significativa na amplitude das EOAPD nas frequências de 4‐8 kHz foram detectadas. Houve diferença estatisticamente significante (p < 0,05) do limiar auditivo entre os grupos nas altas frequências (de 8‐16 kHz). | Crianças com FC que tinham recebido pelo menos 10 cursos de AG por via IV apresentaram um maior risco de ototoxicidade. AAF identificou 2 crianças com ototoxicidade a mais do que a ATL. Dependendo das instalações disponíveis, a AAF deve ser o teste de escolha para detecção de ototoxicidade em crianças com CF que receberam tratamento com AG. |
| High frequency hearing thresholds and product distortion otoacoustic emissions in cystic fibrosis patients (Geyer; Barreto; Weigert; Teixeira, 2015) | Estudo observacional: transversal, retrospectivo e prospectivo com grupo controle. Medline PubMed – em processo | Crianças e adolescentes dos ambulatórios de fibrose cística (FC), adulto e pediátrico. A amostra foi constituída por 75 indivíduos, 39 do grupo de estudo (GE) e 36 do grupo controle (GC). | Foram utilizados dados preexistentes, contidos em um banco de dados criado anteriormente. A este, foram acrescentados novos exames, por meio da realização de audiometria tonal (ATL), audiometria de altas frequências (AAF) e emissões otoacústicas por produto de distorção (EOAPD), em mais pacientes do ambulatório de fibrose cística (GE) do e de grupo controle (GC). | O GE apresentou limiares significativamente mais elevados nas frequências de 250, 1.000, 8.000, 9.000, 10.000, 12.500 e 16.000 Hz; (p = 0,004). Houve associação significativa entre as alterações dos limiares auditivos na AAF com o número de cursos de aminoglicosídeos (AGs) feitos (p = 0,005). 83% dos pacientes que realizaram mais de 10 cursos de AGs apresentaram perda auditiva na AAF. | Um número significativo de pacientes com FC que receberam repetidos cursos de AGs apresentou alterações na AAF e EOAPD. A realização de 10 ou mais cursos de AGs esteve associada às alterações na AAF. |
| Occurrence and risk of cochleotoxicity in cystic fibrosis patients receiving repeated high‐dose aminoglycoside therapy (Mulheran et al., 2001) | Estudo observacional: transversal, retrospectivo, com grupo controle. Web of Science, PubMed – indexado para Medline | 70 pacientes com FC subdivididos em grupos pediátricos com 27 indivíduos (10 a 18 anos) e 43 adultos (19‐37 anos). Resultados foram comparados com os de 91 indivíduos do grupo controle. | Foi feita audiometria tonal padrão (0,25 a 8 kHz) e de alta frequência (10‐16kHz). | De 70 pacientes com FC, 12 (um pediátrico) apresentavam perda auditiva consideradas como causadas pela exposição repetida aos aminoglicosídeos (AGs). Houve uma relação não linear entre os cursos de terapia recebidos e a incidência de perda auditiva. A gravidade da perda não pareceu estar relacionada com o número de cursos recebidos. As estimativas preliminares de risco de perda auditiva por curso foram inferiores a 2%. | Após a comparação com estudos clínicos prévios e trabalho experimental, estas descobertas sugerem que a incidência de cocleotoxicidade em pacientes com FC é consideravelmente mais baixa do que seria esperado, sugerindo que a condição de FC pode conferir proteção contra cocleotoxicidade. |
Sistema Grade para qualidade da evidência
| Autor/ano/delineamento | Classe A | Classe B | Classe C |
|---|---|---|---|
| Geyer LB, Menna Barreto SS, Weigert LL, Teixeira AR; 2015 (Observacional: transversal, com grupo controle pareado). | X | ||
| Al‐Malky G et al.; 2015 (Observacional: transversal). | X | ||
| Weigert LL et al., 2013 (Observacional: transversal com grupo controle não pareado). | X | ||
| Al‐Malky G et al., 2011 (coorte). | X | ||
| Mulheran M et al.; 2006 (Ensaio clínico randomizado). | X | ||
| Martins LMN et al.; 2010 (Observacional: transversal) | X | ||
| Mulheran M et al.; 2001 (Observacional: transversal, com grupo controle pareado). | X | ||
| McRorie TI, Bosso J, Randolph L; 1989 (Observacional: caso controle pareado). | X | ||
| Pedersen SS, et al.; 1987 (Observacional: transversal). | X |
Qualidade das evidências: Classe A, alta; Classe B, moderada; Classe C, baixa ou muito baixa.
Em todos os estudos incluídos nesta revisão, há o registro de perda auditiva nos grupos de pacientes com FC em tratamento com medicamentos ototóxicos. Entretanto, resultados estatisticamente significativos foram verificados em cinco dos estudos que fizeram AAF em pacientes fibrocísticos tratados com AGs.18,23–26
Nos outros quatro estudos desta revisão, os autores observaram que o risco para cocleotoxicidade na FC é relativamente baixo, não há diferença significativa entre os grupos de pacientes e controles. Tais estudos sugerem mais pesquisas que possam incluir o efeito cumulativo do uso medicamentoso.14,27–29 Esses resultados menos expressivos parecem estar relacionados com o curto tempo de acompanhamento dos pacientes.
Em relação à aplicabilidade da AAF, todos os estudos recomendam seu uso para monitoramento auditivo como uma avaliação complementar à audiometria tonal limiar (ATL) em pacientes com FC. Uma revisão sistemática feita com o objetivo de analisar a produção científica nacional a respeito da aplicação clínica da AAF e seu uso concluiu que a AAF tem sido amplamente usada na prática audiológica para a identificação precoce de alterações auditivas, no monitoramento auditivo de sujeitos expostos a drogas ototóxicas ou a agentes otoagressores e no diagnóstico complementar, quando se avaliam populações especiais, como no caso dos portadores de doenças renais crônicas, diabete e patologias auditivas.17
Em parte dos estudos incluídos nesta investigação foi usada a pesquisa de emissões otoacústicas e produto de distorção (EOAPD) na avaliação auditiva desses pacientes, mostrou‐se que o exame também contribuiu para o diagnóstico de ototoxicidade nas crianças com FC.18,23,25,26,29 A vantagem desse exame é possibilitar a detecção de perdas auditivas em crianças menores de quatro anos, que geralmente não podem ser submetidas a audiometria, por requerer métodos de condicionamento nem sempre viáveis. Já a limitação do uso das EOAPD é que elas geralmente detectam somente perdas inferiores a 45 dBNA.
Em uma pesquisa que monitorou a audição de pacientes expostos à cisplatina, foram avaliados 13 indivíduos por meio da pesquisa dos limiares auditivos nas frequências de 250 Hz a 18 kHz, além do exame de emissões otoacústicas transientes (EOAT) e produto de distorção (EOAPD). Observou‐se que, após a infusão de 120 mg/m2 de cisplatina, os limiares de audibilidade pioraram a partir da frequência de 8 kHz, registrados pela AAF. A resposta global e as amplitudes absolutas nas frequências de 1, 2 e 3 kHz da EOAT tendem a permanecer presentes até o fim do tratamento, porém o mesmo não ocorre com a frequência de 4 kHz. Os autores concluíram que a AAF foi o método mais efetivo na detecção precoce da ototoxidade da cisplatina.30
Em quatro estudos incluídos nesta revisão foram identificados mais indivíduos com sinais de ototoxicidade por meio da AAF em comparação com a audiometria convencional.18,23,24,28 Esses estudos sugerem que a AAF seja feita para a detecção de ototoxicidade em crianças com FC que receberam tratamento com AG.
Já nos estudos de Mulheran et al. (2001)14 e Mulheran et al. (2006)27 a queda nos limiares nas altas frequências é observada tanto no grupo controle quanto nos pacientes com FC. Os autores sugeriram que a FC pode funcionar como um fator de proteção para cocleotoxicidade devido à eliminação renal mais rápida do AGS, relataram que o defeito que causa a permeabilidade diminuída ao cloro pode prejudicar o transporte dos AGS para as células ciliadas externas e internas da cóclea. Outros fatores relacionados à perda auditiva, como prematuridade e história prévia de infecções intrauterinas, além do uso AGs, poderiam contribuir para uma maior prevalência de perda auditiva no grupo que não usou AGs.
Dois estudos desta revisão sugeriram que o uso de AGs não é o único fator causal para a perda auditiva na FC.23,29 Segundo Al‐Malky et al. (2011),23 a ocorrência de perda auditiva foi associada à alta exposição aos AGs; no entanto, a alta exposição resultou em perda auditiva na minoria dos pacientes. De acordo com os autores deste estudo, a análise genética pode ajudar a explicar a dicotomia encontrada em resposta aos AGs.
Conrad et al. (2008)31 verificaram que a predisposição genética por meio de mutação mitocondrial (A15555G) torna pacientes mais suscetíveis à perda auditiva ocasionada pelos AGs, mesmo em doses mais fracas do medicamento. Novos estudos prospectivos poderão contribuir para elucidar a causa da perda auditiva na FC.
Uma revisão sistemática, que buscou avaliar o papel da triagem auditiva de rotina para perda auditiva neurossensorial em crianças com FC em tratamento com AGs, mostrou que o exame mais usado nos estudos foi a AAF (6/12), seguido das EOAPD (4/12), e apenas um estudo incluiu as EOAT (1/12) e audiometria de tronco encefálico (1/12).32 Outros estudos que usaram a AAF para monitoramento auditivo em pacientes durante tratamento com medicamentos ototóxicos (quimioterápicos ou conservadores da função renal) reforçam a importância da aplicabilidade clínica do exame, com vistas a prevenir as alterações auditivas permanentes.30,33,34
No estudo de Martins et al. (2010)29 foi registrada a perda auditiva em 4% da amostra, quando considerada a média tritonal das frequências de 500, 1.000 e 2.000 Hz. Quando usado outro critério para configurar perda auditiva, em que se considerava aumento do limiar auditivo em duas ou mais frequências, inclusive as altas frequências, foi constatada perda auditiva superior a 25 dBNa em 11% dos pacientes da amostra. Uma vez conhecido o fato de que os AGs provocam perda de audição inicialmente nas altas frequências, e que essas são desconsideradas no primeiro critério, reforça‐se a importância do monitoramento auditivo por meio da AAF. Assim, mesmo que o paciente não apresente perda auditiva clinicamente significativa, ele pode ser beneficiado com o monitoramento que inclui as altas frequências, quando inicia um novo tratamento com medicamento ototóxico. A variabilidade dos critérios usados reforça a ideia de que a perda auditiva pode ser subdetectada se usarmos os critérios de perda auditiva convencionais.35
A via de administração dos antibióticos AGs foi observada nos estudos desta revisão, conforme mostrado na tabela 3.
A farmacocinética de todos os AGs é bastante semelhante. Devido à sua natureza polar, são pouco absorvidos pelo trato gastrintestinal, menos de 1% da dose é absorvido após administração oral ou retal. A principal via de administração é, portanto, parenteral, a droga atinge concentração plasmática máxima depois de 30 a 90 minutos da aplicação intramuscular e 30 minutos após sua injeção intravenosa. A antibioticoterapia é indicada para tratamento da exacerbação da doença e para tratamento preventivo na tentativa de suprimir a carga bacteriana.36
As evidências mais recentes têm fundamentado o uso da antibioticoterapia inalatória nos pacientes com infecção crônica por Pseudomonas aeruginosa, sob a forma de tratamento de manutenção ou de supressão crônica, em especial nos pacientes com FC. Embora o uso da tobramicina inalatória esteja fundamentado em ensaios clínicos randomizados,37 em virtude do elevado custo, seu uso tem sido reservado para os pacientes que não toleraram ou não responderam ao uso de outros antibióticos.38,39
Entre os três estudos que avaliaram e compararam a audição de adultos e de crianças com FC em uso de AGs,14,24,27 dois constataram maiores alterações auditivas nos pacientes adultos.14,24McRorie, Bosso e Randolph (1989)24 encontraram diferenças significativas em frequências superiores a 16.000 Hz nos pacientes menores de 20 anos e limiares elevados em todas as frequências testadas em pacientes acima de 20 anos. No estudo de Mulheran (2001),14 em que foram avaliados 70 pacientes com FC em uso de AGs, 27 crianças e 43 adultos, constatou‐se que somente uma das crianças apresentou perda auditiva atribuída ao uso de AGs. Quando analisados os resultados em adultos, verificou‐se que 11 pacientes apresentaram perda auditiva atribuída ao uso de AGs. Esses resultados mais expressivos no grupo de pacientes adultos podem estar associados ao maior tempo de uso do medicamento ototóxico, sugerem um risco cumulativo.
O estudo feito por Mulheran et al. (2006)27 sugere forte evidência científica por se tratar de um ensaio clínico randomizado controlado. Esse estudo foi feito com 125 crianças e 94 adultos com FC, com o objetivo de investigar risco cumulativo do uso de ototóxico. Comparou‐se um grupo de pacientes com tratamento de uma dose diária de tobramicina com um grupo tratado com três doses diárias desse medicamento. A audiometria foi feita no início do tratamento, no fim de um curso de 14 dias de tratamento e de seis a oito semanas após o término do tratamento. Os limiares auditivos em ambos os grupos caíram entre 25 e 75 dB NA nas frequências de 10 a 16 kHz. Assim, o prejuízo no limiar auditivo desses pacientes foi verificado tanto com doses menores quanto com doses maiores do medicamento ototóxico. A perda auditiva foi identificada por meio da AAF nesses pacientes, mas não foi possível verificar diferenças entre as doses de tratamento como o estudo pretendia.
Contudo, há fortes indícios de que por meio da AAF é possível identificar precocemente a ocorrência de perdas auditivas ou quedas progressivas nos limiares, mesmo que não relacionadas somente ao uso de ototóxicos.
ConclusãoA audiometria em altas frequências tem sido pesquisada e empregada como instrumento de diagnóstico e monitoração de alterações auditivas em pacientes com fibrose cística.
Nesta revisão, identificou‐se a ocorrência de perda auditiva em altas frequências em pacientes com fibrose cística ainda sem queixas auditivas.
Admite‐se que audiometria em altas frequências possa ser um método de diagnóstico precoce a ser recomendado para investigação auditiva de pacientes em risco de ototoxicidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Os autores agradecem o apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Como citar este artigo: Caumo DT, Geyer LB, Teixeira AR, Barreto SS. Hearing thresholds at high frequency in patients with cystic fibrosis: a systematic review. Braz J Otorhinolaryngol. 2017;83:464–74.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.