Introdução: O carcinoma espinocelular oral (CECO) trata-se de um importante problema de saúde pública, devido à elevada taxa de mortalidade e incidência crescente em todo o mundo. A susceptibilidade ao CECO é mediada por interações entre fatores genéticos e ambientais. Estudos sugerem que as variantes genéticas que codificam as enzimas envolvidas no metabolismo do folato podem modular o risco de CECO, alterando a síntese/reparação do DNA e o processo de metilação.
Objetivo: Os objetivos deste estudo foram avaliar a associação de três polimorfismos genotípicos (MTHFR C677T, MTHFR A1298C e CBS 844ins68) e o risco de câncer oral em brasileiros da região Sudeste, e avaliar as interações entre polimorfismos e parâmetros clínico-histopatológicos.
Método: Este estudo de caso-controle incluiu 101 casos e 102 controles no estado do Espírito Santo, Brasil. A genotipagem do polimorfismo MTHFR foi realizada por PCR-RFLP (Reação de Polimerase em Cadeia – Polimorfismo no Comprimento de Fragmento de Restrição) e a do CBS por análise da PCR (Reação de Polimerase em Cadeia).
Resultados: O polimorfismo MTHFR C677T foi associado ao envolvimento de gânglios linfáticos. O genótipo CT + TT atuou como um fator protetor. O genótipo MTHFR A1298C AC + CC foi associado à diferenciação do tumor e, possivelmente, a um prognóstico melhor. Na análise de risco, a correlação entre os genótipos e o CECO não foi observada.
Conclusão: Concluímos que os polimorfismos MTHFR C677T, MTHFR A1298C e CBS 844ins68 não estão associados ao risco de CECO nos brasileiros da região Sudeste; no entanto, sugerimos um efeito prognóstico associado aos polimorfismos MTHFR C677T e A1298C em CECO.
Introduction: Oral squamous cell carcinoma (OSCC) is a serious public health problem, due to its high mortality rate and worldwide rising incidence. OSCC susceptibility is mediated by interactions between genetic and environmental factors. Studies suggest that genetic variants encoding enzymes involved in folate metabolism may modulate OSCC risk by altering DNA synthesis/repair and methylation process.
Objective: The goals of this study were to evaluate the association of three genotypic polymorphism (MTHFR C677T, MTHFR A1298C and CBS 844ins68) and oral cancer risk in southeastern Brazilians and evaluate the interactions between polymorphisms and clinical histopathological parameters.
Methods: This case-control study included 101 cases and 102 controls in the state of Espírito Santo, Brazil. MTHFR genotyping was done by PCR-RFLP (polymerase chain reaction – restriction fragment length polymorphism) and CBS genotyping by PCR (polymerase chain reaction) analysis.
Results: MTHFR C677T polymorphism was associated with lymph node involvement. Genotype CT + TT acted as a protective factor. MTHFR A1298C AC + CC genotype was associated with tumor differentiation, and possibly with a better prognosis. In risk analysis, no correlation was observed between genotypes and OSCC.
Conclusion: We concluded that MTHFR C677T, MTHFR A1298C and CBS 844ins68 polymorphisms were not associated with OSCC risk in southeastern Brazilians; however, we suggest a prognosis effect associated with MTHFR C677T and A1298C polymorphisms in OSCC.
Introdução
O carcinoma espinocelular oral (CECO) é o oitavo câncer em humanos mais comum no mundo.1 Em 2014, a expectativa de novos casos de câncer oral foi de cerca de 15.290 novos e, no Sudeste, esse tipo de câncer é o quarto entre os homens e o décimo entre as mulheres.2 O CECO é uma doença multi-fatorial, afetada por fatores ambientais amplamente conhecidos, como álcool e tabaco, bem como por fatores genéticos, dos quais pouco se sabe. Os polimorfismos em determinados genes podem conferir susceptibilidade para o desenvolvimento CECO. Estudos têm demonstrado uma relação entre os polimorfismos dos genes envolvidos no metabolismo do folato e o risco de CECO, devido à sua influência sobre a metilação, a síntese e a reparação do DNA.3-7
O gene da MTHFR codifica a enzima metilenotetrahidrofolato redutase, que é importante para a homeostase intracelular de folato e a conversão irreversível de 5,10-metilenotetrahidrofolato (5,10-MTHF) para 5-metiltetrahidrofolato (5-MTHF). Os polimorfismos C677T e A1298C no gene da MTHFR podem estar associados à susceptibilidade ao câncer oral devido a alterações na atividade catalítica. O polimorfismo C677T resulta em uma enzima com 65% da atividade homozigoto selvagem para heterozigotos e 30% para homozigotos do alelo variante.8,9 O polimorfismo MTHFR A1298C está localizado na região de domínio regulamentar.10 Indivíduos homozigóticos 1298C têm, aproximadamente, a mesma atividade enzimática daqueles heterozigóticos.11 A redução da atividade da enzima MTHFR aumenta a disponibilidade de folato para a produção de timidilato e de purinas para a síntese e reparação do DNA.12
O gene CBS codifica a cistationina beta-sintase (CBS), também envolvida na via de folato, que decorre da conversão de homocisteína em cistationina. O polimorfismo CBS 844ins68 foi associado a menos tempo de sobrevida em pacientes com carcinoma de células escamosas de cabeça e pescoço.13 Portanto, este estudo teve como objetivo investigar a frequência e a associação dos polimorfismos MTHFR e CBS na susceptibilidade ao câncer oral da população do Espírito Santo, Brasil, e seu potencial impacto sobre o resultado do prognóstico.
Método
Amostras
Neste estudo de caso-controle, amostras de sangue foram coletadas de 101 pacientes com diagnóstico histopatológico conclusivo de carcinoma epidermoide oral, obtidas na Divisão de Cabeça e Pescoço do Hospital Santa Rita de Cássia. Desse total, 69 indivíduos foram classificados pela cor da pele e outras características físicas: 22 como brancos (caucasianos, principalmente descendentes portugueses); 32 como pardos (mistura étnica de europeus, africanos e ameríndios); e 15 como negros (afrodescendentes), com base na classificação oficial do Censo Demográfico Brasileiro. Todos os pacientes eram residentes do estado do Espírito Santo (ES, Brasil) e foram recrutados aleatoriamente de 2011 a 2013. Foram incluídos nesse estudo pacientes de ambos os sexos com mais de 35 anos de idade que aceitaram participar da pesquisa. Os critérios de exclusão foram pacientes com CCE em outros locais e aqueles que receberam radioterapia, quimioterapia, cirurgia ou qualquer outro tratamento antes de seu recrutamento.
O grupo controle foi composto por 102 indivíduos residentes no Espírito Santo, Brasil, que foram encaminhados para avaliação clínica e tinham história de câncer familiar negativa, e não apresentavam lesões bucais pré-malignas ou malignas no momento da coleta de amostras. O grupo controle foi equiparado por idade e sexo. Como estavam disponíveis para os controles apenas dados parciais, em relação a hábitos como tabagismo e uso de álcool, estes não foram incluídos para equiparação com os casos. Todos os indivíduos assinaram o termo de consentimento informado, aprovado por conselhos de revisão institucional. Este trabalho foi previamente aprovado pelo Comitê de Ética em Pesquisa da instituição (CEP Protocolo nº 318/2011).
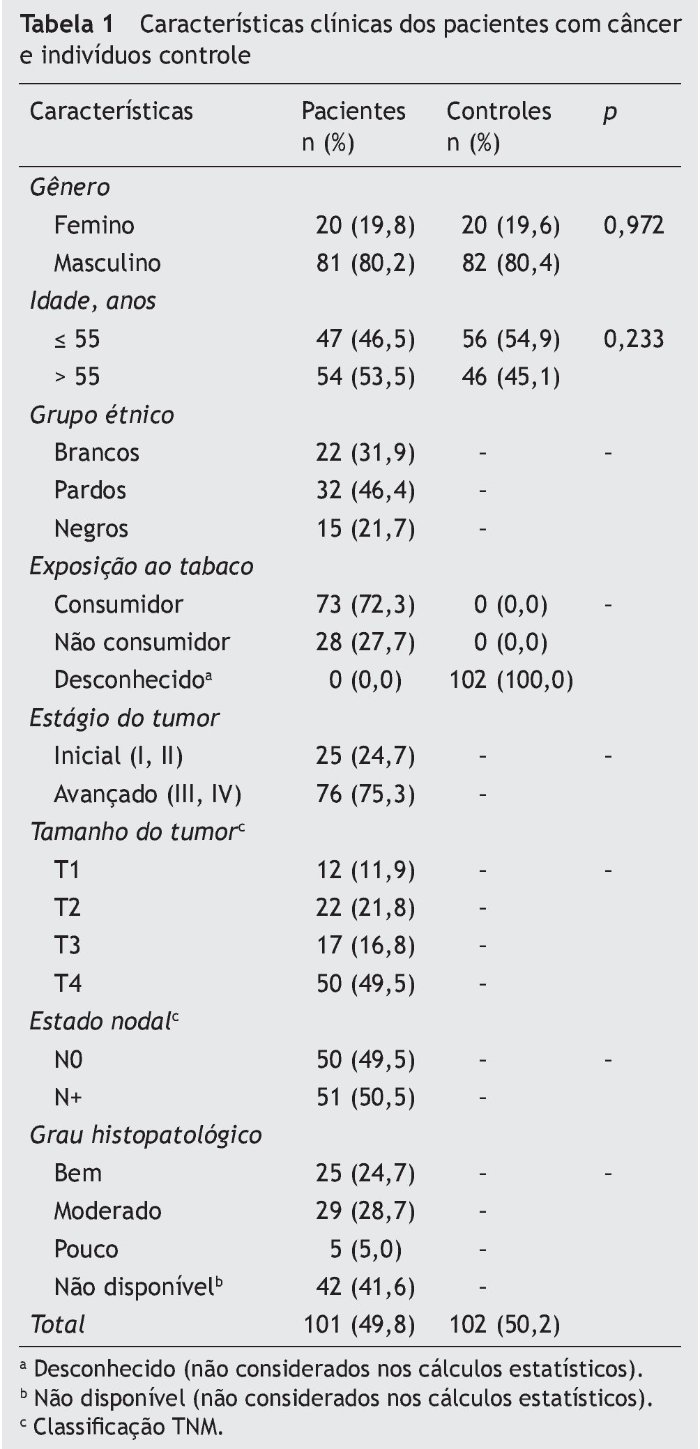
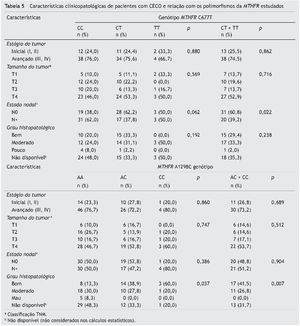
As características clinicopatológicas dos pacientes analisados foram: estágio (estágio inicial I-II e tardio III-IV) e tamanho (T1, T2, T3 e T4) do tumor; estádio nodal (N+, positivo e N0, negativo), de acordo com a classificação TNM14; grau histolopatológico (tumores bem, moderadamente e pouco diferenciados)15; e consumo de cigarros. Todas as informações necessárias a respeito dos parâmetros clínicos e histopatológicos foram obtidas de laudos médicos. Os participantes não foram classificados em grupos étnicos ou pela cor da pele.
Testes de genotipagem
O DNA genômico foi isolado através de extração com fenol/ clorofórmio. Os polimorfismos MTHFR C677T e MTHFR A1298C foram genotipados pelo método PCR-RFLP (Reação em Cadeia da Polimerase – Polimorfismo no Comprimento de Fragmento de Restrição), como descrito anteriormente.8,11 Todas as reações incluíram controles positivos e negativos. Aproximadamente 20% das amostras foram selecionadas aleatoriamente para o procedimento repetido de genotipagem. A reprodutibilidade foi de 100%.
A transição C → T cria um local de restrição para a enzima Hinf I. O produto da PCR (198 bp) foi digerido usando a enzima Hinf1 e visualizado por eletroforese em géis de poliacrilamida a 8% e coloração com nitrato de prata. Os produtos da PCR incluíam um único fragmento 198 bp para homozigóticos de tipo selvagem (CC); 198, 175 e 23 pb para fragmentos heterozigotos (CT); e 175 e 23 pb para homozigoto mutante (TT).
O polimorfismo MTHFR 1298AC elimina o sítio de restrição MboII.
O genótipo selvagem (AA) produziu cinco fragmentos de 56, 31, 30, 28 e 18 pb; enquanto o heterozigoto (AC) produziu seis fragmentos de 84, 56, 31, 30, 28 e 18 pb; e os mutantes homozigotos (CC) produziram quatro fragmentos de 84, 31, 30 e 18 pb.
Os polimorfismos CBS 844ins68 foram caracterizados por separação do tamanho diferencial após PCR, como descrito anteriormente.16 O alelo polimórfico resulta da inserção de 68 pb no exon 8. O alelo major (I) apresentou um fragmento 239 pb, e o alelo normal (N) apresentou um fragmento de 171 pb.
Análise estatística
As frequências genotípicas foram testadas para o equilíbrio Hardy-Weinberg (HWE). Os testes Qui-quadrado e exato de Fisher foram usados para análise de associação, e a confirmação foi obtida pelo teste de Lilliefors (significância considerada quando p < 0,05). A regressão logística multivariada foi usada para obter odds ratio (OR) e intervalos de confiança de 95% (IC 95%). Os cálculos estatísticos foram realizados com o uso do programa Epi InfoH 3.4.3 de 2007. O desequilíbrio de ligação (LD) e a análise dos haplótipos foram conduzidos usando o programa Haploview
Resultados
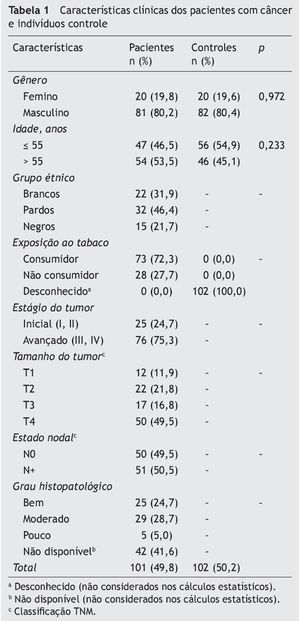
As características de 101 pacientes com câncer oral e 102 controles estão apresentadas na tabela 1. Não foram observadas diferenças significativas entre os grupos (p > 0,05).
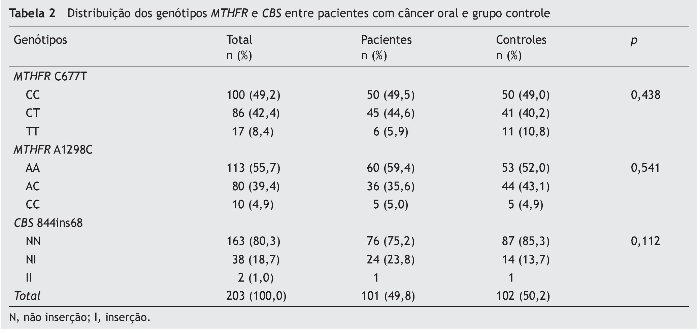
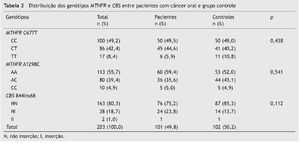
As frequências genotípicas para MTHFR C677T, A1298C e CBS 844ins68 em controles e em pacientes com câncer oral estão apresentadas na tabela 2.
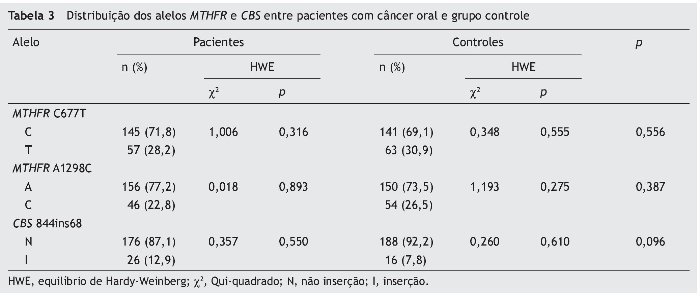
A distribuição dos genótipos dos três polimorfismos genéticos não foi significantemente diferente entre o câncer oral e o grupo controle (p > 0,05) (tabela 2). As frequências dos alelos MTHFR C677T, A1298C e CBS 844ins68 em controles e em pacientes com câncer oral estão apresentadas na tabela 3. Todos os polimorfismos testados estão no equilíbrio de HWE.
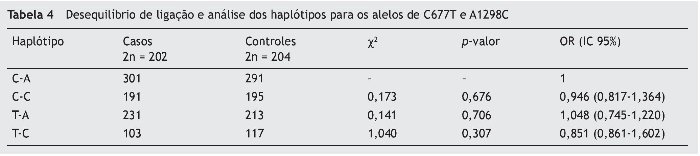
O programa Haploview foi usado para a análise do LD e haplótipo em alelos de MTHFR C677T e A1298C (tabela 4). Verificamos que não houve diferença para os haplótipos nos dois grupos (p > 0,05), o que sugeriu que eles não aumentam o risco de câncer.
Os pacientes foram avaliados de acordo com a etnia, mas não foi observada prevalência do alelo polimórfico em grupos étnicos. A prevalência do alelo C (polimorfismo MTHFR C677T) foi maior nos três grupos étnicos (brancos: 63,6%; negros: 73,3%; pardos: 82,8%). Para o polimorfismo MTHFR A1298C, o alelo A predominou em todos os grupos étnicos (brancos: 72,7%; negros: 83,3% e pardos: 76,6%) e, finalmente, a presença do alelo tipo selvagem para o polimorfismo CBS 844ins68 também foi mais prevalente em todos os grupos étnicos (brancos: 86,4%; negros – 86,7% e pardos – 89,1%). Esses dados demonstram a ampla mistura de raças no grupo caso.
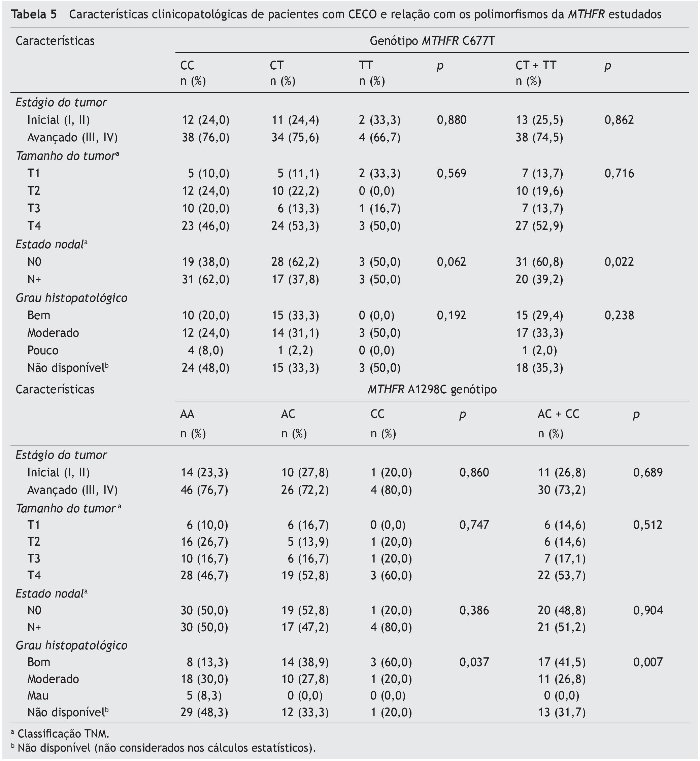
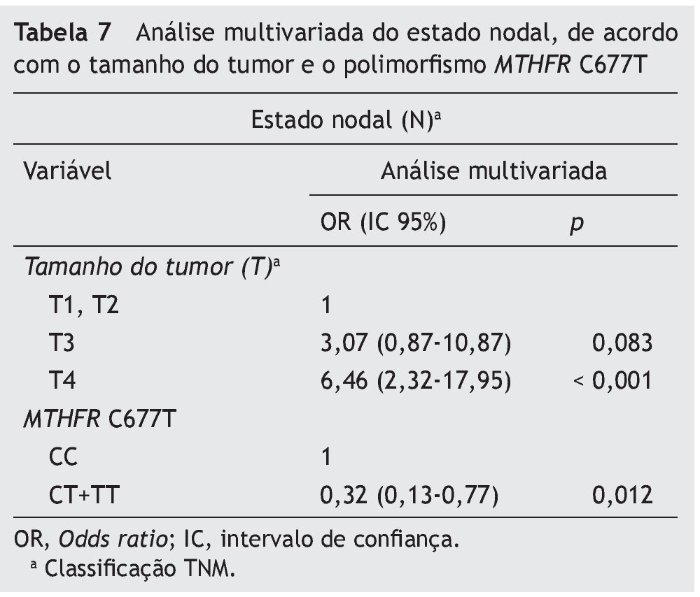
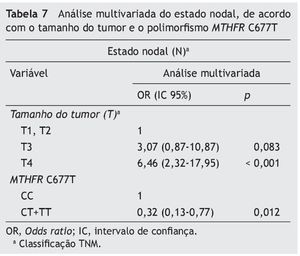
A interação entre os genótipos e as características clinicopatológicas foi adicionalmente analisada (tabelas 5 e 6). O polimorfismo MTHFR C677T está associado aos linfonodos positivos, e a combinação dos genótipos CT + TT atua como um fator de proteção. A análise multivariada (IC 95%) considerando o tamanho do tumor revelou que a combinação dos genótipos CT + TT gera um risco de metástase linfática três vezes menor que o genótipo CC (p = 0,012) (tabela 7).
Observamos que o polimorfismo A1298C está relacionado com a diferenciação do tumor. Os genótipos AC + CC foram mais frequentes em tumores bem diferenciados, enquanto o genótipo AA foi mais frequente em tumores moderadamente ou pouco diferenciados (p = 0,007) (tabela 5).
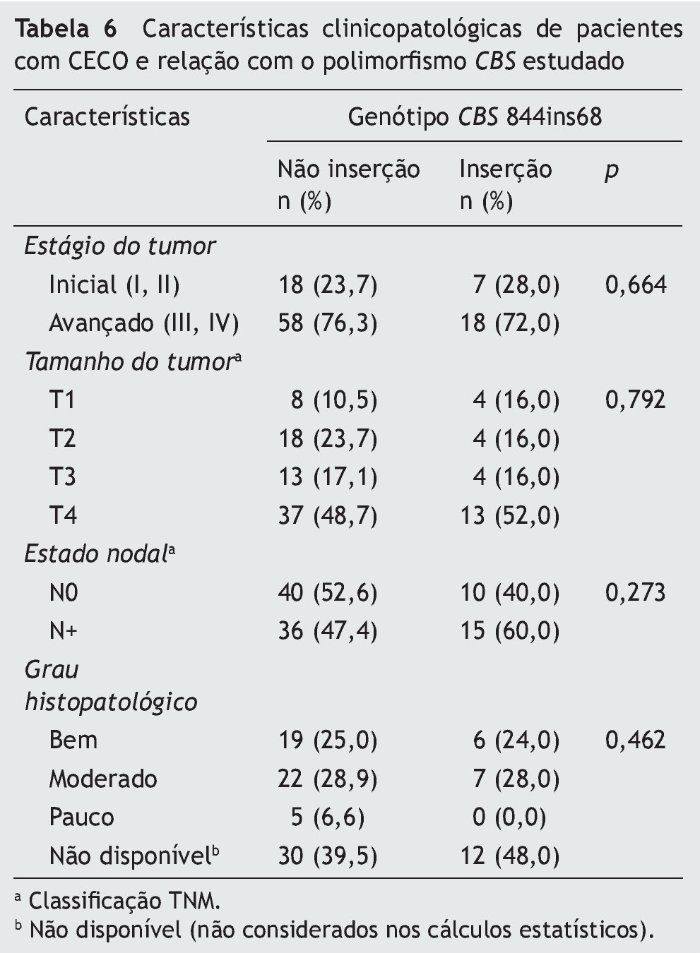
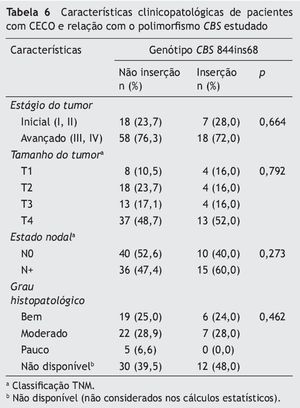
Não houve associação estatisticamente significativa entre o polimorfismo CBS 844ins68 e as variáveis analisadas (tabela 6).
Discussão
A deficiência de folato tem sido associada a doenças como o câncer. Portanto, o papel dos polimorfismos genéticos das enzimas do metabolismo de folato já foi investigado em vários tipos de câncer.17,18 Entre essas enzimas, investigamos MTHFR e CBS em CECO.
O nosso estudo relatou, pela primeira vez, a associação entre as metástases em linfonodos e a combinação de CT + TT no polimorfismo MTHFR C677T atuando como um fator de proteção (p = 0,022). Além disso, outros estudos sugeriram um melhor prognóstico para os pacientes com câncer oral com os genótipos CT ou TT. Tsai et al.19 mostraram que os pacientes com 677CT + TT apresentam um risco menor de metástase em comparação com aqueles com CC, e Sailasree et al.20 mostraram melhora da sobrevida.
O efeito protetor pode ocorrer devido à sua menor eficiência para a metilação do DNA.21MTHFR converte 5,10-MTHF em 5-MTHF; o 5,10-MTHF é usado para a conversão de dUTMP em dTMP; enquanto o 5-MTHF é o doador de metil para a síntese de metionina e S-adenosilmetionina em reações de metilação.22 Indivíduos com os genótipos MTHFR 677TT e MTHFR 677CT apresentam enzimas com atividade diminuída,8 portanto, tendem a acumular 5,10-MTHF, causando uma alteração na via, o que leva à diminuição da metilação do DNA.21 Um nível baixo de metilação do DNA genômico poderia diminuir a chance de hipermetilação em genes relacionados ao câncer, levando a um número menor de mutações por desaminação espontânea de 5-metilcitosina (5mC). A hipermetilação favorece a iniciação e a progressão do câncer ao silenciar genes supressores tumorais ou genes de reparo do DNA.23 A maioria das mutações encontradas em cancros é constituída de transições C ® T em sequências CG:CG, devido às altas frequências de desaminação espontânea de 5mC.24,25 A falta de metilação de citosina poderia evitar as mutações C ® T.
Além disso, o polimorfismo MTHFR A1298C foi associado à diferenciação do tumor. Os genótipos AC + CC foram mais frequentes nos tumores bem diferenciados (p = 0,007), que também podem estar associados a um melhor prognóstico; enquanto o genótipo AA teve uma frequência mais elevada em tumores moderadamente ou pouco diferenciados. Embora o valor prognóstico do grau histológico seja controverso em CECO, alguns estudos sugerem que os carcinomas pouco diferenciados tendem a gerar metástase e estão associados à diminuição da taxa de sobrevida.26 No entanto, não há consenso na literatura sobre se a classificação histológica do tumor é um bom parâmetro isolado de valor prognóstico. O grau histopatológico do tumor, juntamente com fatores prognósticos adicionais e estadiamento TNM, podem proporcionar um melhor suporte para a decisão terapêutica.
No entanto, neste estudo com a população brasileira do Sudeste, não observamos associação entre os polimorfismos MTHFR C677T, MTHFR A1298C e CBS 844ins68 e a susceptibilidade ao câncer oral. Alguns estudos também descobriram um risco reduzido não significativo para o genótipo MTHFR 677TT no câncer oral.27,28 Em contraste, Sailasree et al.20 descobriram que C677T estava associado à predisposição ao câncer oral, com um risco reduzido para indivíduos com genótipo CT + TT. Estudos de meta-análise29,30 mostraram uma associação marginal ou nenhuma associação do polimorfismo MTHFR C677T com o risco de câncer oral. Os resultados conflitantes sobre as associações entre os polimorfismos MTHFR C677T e os riscos para CECO podem ocorrer devido às diferentes etnias, subtipos e exposição a dietas regionais e exposição a cancerígenos locais.
Para o polimorfismo A1298C, alguns estudos concordam com nossos resultados, incluindo um estudo de meta-análise,19,20,31 que mostrou a falta de associação com o risco de câncer oral. No entanto, a meta-análise demonstrou que o alelo C possui um possível papel preventivo para o câncer oral.29
Em nosso estudo, o alelo de inserção CBS 68bp (I) não foi associado ao risco de CECO, nem com o genótipo heterozigoto (I/N) ou genótipo homozigoto polimórfico (I/I), corroborando os resultados de Gabiallti et al.,32 mas diferente dos resultados para outros tipos de tumores, como câncer de próstata e do trato gastrointestinal superior.33,34
A prevalência do genótipo para o polimorfismo MTHFR C677T varia entre as diferentes populações humanas. Em indígenas, a frequência do genótipo TT é inferior a 1%,20 enquanto nos mexicanos a frequência é superior a 30%; já em nossos controles a frequência foi de 10,8%, o que é comparável com relatos anteriores de populações chinesas e porto-riquenhas,27,35-37 e também de regiões do Brasil.38-40 As frequências do genótipo TT demonstradas em estudos com populações do Sudeste do Brasil variaram de 4,4% a 14% no estado de São Paulo.39,41,42 Nos controles, a prevalência dos genótipos variantes (CC) do polimorfismo MTHFR A1298C em nosso estudo foi de 4,9%, semelhante a estudos no Nordeste do Brasil e também em outras populações do mundo, como China, Japão, Polônia, Itália e Estados Unidos.19,43-48 No entanto, os resultados diferiram das frequências observadas no estado de São Paulo, com frequências de 6,1% e 8,8%.41,42
Em nosso estudo, o alelo de inserção (I) de 68bp no gene CBS foi observado em 7,8% da população controle. Uma frequência similar (7%) foi observada na população paquistanesa49; entretanto, as frequências alélicas foram mais altas em outro estudo realizado em São Paulo, Brasil.32 Assim como apontado em outra pesquisa,32 em nosso estudo, o polimorfismo CBS 844ins68 não foi associado a características clínicas ou histopatológicas.
Conclusão
Em conclusão, os genótipos MTHFR C677T CT e TT foram associados ao envolvimento de linfonodos, agindo como um fator de proteção em CECO, e o genótipo MTHFR A1298C AC + CC foi associado à diferenciação do tumor, que pode estar vinculada a um melhor prognóstico. No entanto, os resultados precisam ser confirmados em estudos mais amplos com pacientes e controles pareados por hábito de fumar.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Agradecimentos
ABS foi patrocinada por uma bolsa do CAPES. Agradecemos à Divisão de Cabeça e Pescoço do Hospital Santa Rita de Cássia, ES, Brasil, pela ajuda com a coleta de amostras.
Recebido em 1 de abril de 2015;
aceito em 2 de outubro de 2015
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.10.012
☆ Como citar este artigo: Barbosa A, dos Santos M, de Podestá JR, Gouvêa SA, Von Zeidler SV, Louro ID, et al. Polymorphisms in methylenetetrahydrofolate reductase and cystathionine beta-synthase in oral cancer – a case-control study in southeastern Brazilians. Braz J Otorhinolaryngol. 2016;82:558-66.
* Autor para correspondência.
E-mail:melissafcs@yahoo.com.br (M.F. Cordeiro-Silva).